2. 南方医科大学 国际教育学院,广东 广州 510515;
3. 广州市妇女 儿童医疗中心中心实验室,广东 广州 510623
2. Institute of International Education, Southern Medical University, Guangzhou 510515, China;
3. Central Laboratory, Guangzhou Women and Children's Medical Center, Guangzhou 510623, China
肠道病毒71型(EV71)是一种嗜神经组织病毒,它是引起婴幼儿手足口病和病毒性咽峡炎的主要病原体之一[1]。重症患儿还可出现严重的中枢神经系统疾病,例如无菌性脑膜炎、脑干脑炎和脊髓灰质炎样的麻痹等[2],个别重症患儿因病情进展快而导致死亡。自1974年首次报道以来,EV71感染已在全球范围内引起多次流行和爆发[3]。近年来EV71病毒的流行在亚太地区呈现上升趋势,其中最引人关注的就是其感染所引起的中枢神经系统损伤症状[4],多发生于5岁以下幼儿,1岁以下婴儿发病率最高。
目前,越来越多的研究表明固有免疫识别系统在机体抵御病毒感染和诱导炎症反应的过程中起到重要作用,宿主细胞可通过特异的受体蛋白,激活细胞信号通路而诱发炎症反应[5]。NLRP3炎性小体是由多种蛋白质组成的复合体,能够调节胱冬肽酶-1(caspase-1)的活化进而促进细胞因子前体pro-IL-1β和pro-IL-18的切割成熟[6-8],在固有免疫系统功能发挥过程中具有极其重要的作用。此外,NLRP3炎性小体能调节caspase-1依赖的细胞焦亡-诱导细胞在炎性和应激的病理条件下死亡[9]。同时,有学者发现存在于宿主细胞表面的波形蛋白可作为EV71的吸附受体[10-11],VIM作为一些病原体感染宿主细胞的受体蛋白,在病原体早期的结合和病毒增殖的过程中起到重要的作用[12-14]。而有学者在研究EV71与NLRP3的关系时,发现用EV71的3D聚合酶蛋白可以激活细胞体内炎症小体,释放炎症小体调控的产物,并且发现这一过程对EV71在宿主体内的增殖有促进作用[15]。在最新的小鼠动物模型研究也表明,细菌内毒素(LPS)引起小鼠急性肺损伤过程中,VIM参与了炎症小体的激活[16]。但是,目前对于EV71引起宿主炎症小体的激活过程中VIM是否具有调控作用尚未见报道。本研究首次通过EV71感染野生型小鼠(WT)和VIM基因敲除(VIM-/-)小鼠,比较两种小鼠脑内炎性小体效应蛋白caspase-1活化和IL-1β释放的情况以及神经元受损的程度,发现在EV71感染时,VIM可能介导了炎症小体的激活,从而引起炎症反应和中枢神经系统损伤。
1 材料和方法 1.1 材料 1.1.1 实验动物3~5 d龄VIM敲除型及野生型SV129乳鼠,体质量2.5~3.0 g,共80只(美国南加州大学洛杉矶儿童医院黄胜和教授惠赠)。
1.1.2 EV71病毒株由广州市儿童医院中心实验室经5岁重症手足口病患儿咽拭子临床分离培养,利用人横纹膈肌肉瘤细胞(RD细胞)培育保种。
1.1.3 主要试剂IL-1β ELISA试剂盒(Dldevelop),RIPA裂解液(北京鼎国昌盛生物公司),caspase-1一抗(武汉proteintech),辣根过氧化物酶标记二抗Goat Anti-Mouse IgG (H+L) (北京鼎国昌盛公司),Trizol试剂(日本宝日医生物公司),TransScript One-step逆转录试剂盒(北京全式金公司),sybr premix ex taqⅡ荧光定量试剂盒(日本宝日医生物公司),神经元NeuN抗体(英国Abcam)。
荧光定量RT-PCR相关引物由上海生工公司设计合成,序列如下表:
| 表 1 荧光定量RT-PCR相关引物序列 Table 1 Primer sequences for fluorescence quantitative PCR |
台式高速离心机(美国Thermo),半干转Western blot电泳仪(上海拜力生物公司),BeckmanJ2-MC高速冷冻离心机(美国Beckman),倒置显微镜IMI-Z(日本奥林巴斯光学工业),精密电子天平(德国Satorius),病理切片机(上海徕卡仪器有限公司RM2016),LightCycler96实时荧光定量PCR仪(瑞士罗氏公司)。
1.2 方法 1.2.1 EV71的培养与收集由广州市儿童医院中心实验室工作人员选取3份阳性咽拭子标本进行筛选培养分离EV71株。咽拭子保存液标本经0.45 μm过滤器过滤后取200 μL保存液接种于已长满单层RD细胞的6孔板上,并设置复孔和阴性对照孔,在二氧化碳培养箱内37 ℃,不加胎牛血清的细胞培养液进行培养。每天用倒置显微镜观察有特征性的肠道病毒致细胞病变效应的出现。第1代培养的细胞及其培养液经3次反复冻存后离心,取上清作为1代培养病毒。
1.2.2 小鼠的病毒接种取出生3~5 d的基因敲除型和野生型乳鼠各40只,两种小鼠型分别随机分为EV71实验组和PBS注射的对照组,20只/组。实验组小鼠腹腔注射10 μL含有1×108TCID50的病毒液,对照组腹腔注射10 μL无菌PBS。观察1周时间,有实验组小鼠出现毛发疏松、体质量减少或肢体麻痹等症状时收集所有小鼠脑组织和脑脊液标本待用。
1.2.3 ELISA检测小鼠脑组织和脑脊液中IL-1β的变化将待取标本的小鼠用1%戊巴比妥钠麻醉,打开胸腔,从心脏右心室处用无菌PBS进行灌洗,冲洗血液循环系统内及脑部的血液。无菌打开乳鼠颅腔,摘取脑组织,称重,并浸泡于事先冷浴的无菌PBS中。吸取CSF于无菌EP管中,-80 ℃保存。按ELISA试剂盒(Dldevelop)推荐步骤进行操作,检测IL-1β的表达水平。
1.2.4 Western blot蛋白印迹取小鼠脑组织,按照蛋白提取试剂盒推荐操作步骤提取组织蛋白,BCA法检测蛋白浓度,与5×SDS PAGE上样缓冲液混合,100 ℃加热5 min。取50 μg蛋白样品于12% SDS-PAGE胶电泳。后电转至PVDF膜,用含5%脱脂奶粉的TBST溶液封闭1 h,一抗(1: 2000)孵育,4 ℃过夜。PVDF膜用TBST清洗3遍,二抗(1: 3000)孵育1 h,再次清洗3遍后,使用全自动化学发光成像分析系统检测蛋白条带。
1.2.5 荧光定量PCR按照组织总RNA提取说明书提取全RNA。经过Trans Script One-step逆转录试剂盒说明书逆转录为cDNA,PCR反应式:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 15 s,68 ℃ 20 s 40个循环扩增;95 ℃ 10 s,65 ℃ 1 min,97 ℃ 1 s解链;37 ℃ 30 s冷却。以β-actin为内参,相对表达量=2-ΔΔCt,ΔCt=目的基因平均Ct值-内参照平均Ct值,ΔΔCt=实验组ΔCt-对照组ΔCt。
1.2.6 病理组织切片取待检测的小鼠脑组织放入福尔马林中保存,制作前先漂洗,乙醇梯度脱水后将组织浸泡在二甲苯(xylene)中室温摇动20 min,重复3次。于包埋机器中60 ℃孵育45 min,重复3次。将组织放进切片模型,倒满包埋液,置于冰上使石蜡凝固,常温保存;用石蜡切片机切片,片厚为4 μm。切片漂浮于40 ℃的摊片机温水上,展平。捞起漂浮于载玻片上的组织片,置于60 ℃烘箱内烤干。待水烤干石蜡烤化后取出常温保存备用。经过细胞核、细胞质染色之后封片,在倒置显微镜下观察组织并拍下组织图片。
1.2.7 免疫组化将石蜡切片脱蜡清洗,加热法进行抗原修复。室温冷却后将玻片浸泡于PBS(pH=7.4)洗涤3次,放入3%过氧化氢溶液,避光孵育25 min,将玻片再次PBS洗涤3次。滴加3% BSA,均匀覆盖组织,室温封闭30 min。轻轻甩干,在切片上滴加神经元抗体,4 ℃孵育过夜后PBS溶液洗涤3次。后滴加二抗覆盖组织,室温孵育50 min,再次PBS洗涤3次。滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色时终止显色。脱水封片,最后用显微镜镜检,通过ImageJ软件计数分析。
1.2.8 统计学分析采用SPSS 16.0统计软件,各组方差齐同后采用单因素方差分析(两组之间比较采用SNK-q检验),P < 0.05为差异有统计学意义。
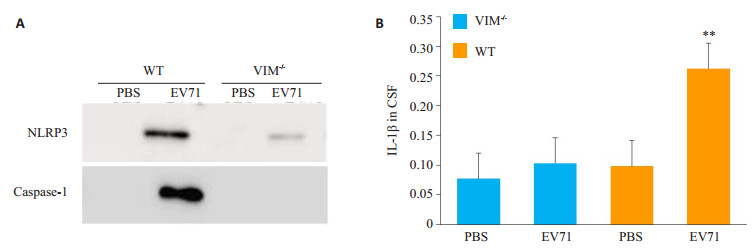
2 结果 2.1 检测EV71感染小鼠脑脊液中炎症小体的活化感染小鼠1周,取小鼠脑脊液,经考马斯亮蓝染色考察蛋白质含量合适之后,用Western blot与ELISA检测小鼠受感染后神经中枢系统中NLRP3及其下游炎性产物caspase-1和IL-1β的生成、释放到CSF中的情况。结果显示:仅在野生小鼠感染组脑脊液内检测到NLRP3和caspase-1,且野生小鼠感染组IL-1β的含量也明显高于基因敲除小鼠感染组(P < 0.05,图 1)。
|
图 1 各组小鼠脑脊液中NLRP3,caspase-1和IL-1β含量变化 Figure 1 Release of NLRP3, caspase-1 and IL-1β in the CSF of VIM-/- and WT mice in each group. A: NLRP3 and caspase-1 levels detected by Western blotting; B: Expression of IL-1β detected by ELISA (**P < 0.05 vs VIM-/- EV71 infection group). |
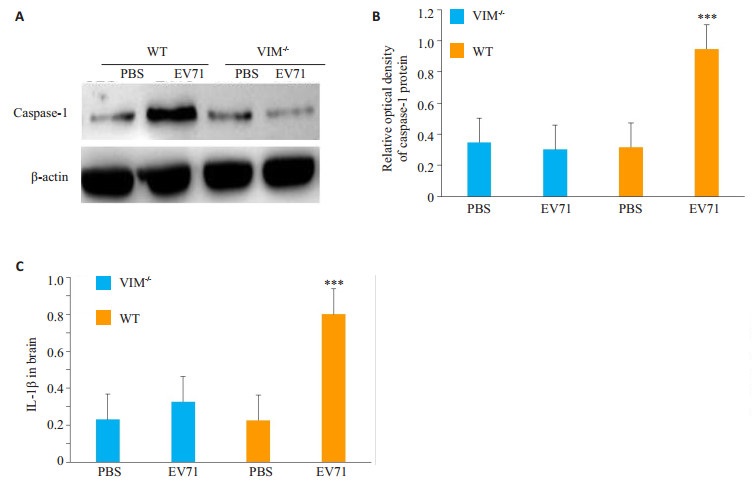
感染小鼠1周之后,取小鼠脑组织,提取组织全蛋白质,用Western blot技术检测caspase-1含量;同时运用ELISA试剂盒检测脑组织内IL-1β的生成,比较VIM基因敲除和野生型小鼠的caspase-1和IL-1β的生成量是否不同。结果显示:VIM基因敲除小鼠EV71感染组和PBS空白组比较差异无统计学意义,野生型小鼠EV71感染组和PBS组比较,脑组织中caspase-1和IL- 1β含量明显升高(P < 0.05,图 2)。
|
图 2 各组小鼠脑组织内caspase-1,IL-1β的表达量 Figure 2 Expression of caspase-1 and IL-1β in VIM-/- and WT mice in each group. A: Relative expression of caspase-1 in the brain tissues detected by Western blotting; B: Relative density of caspase-1 expression (***P < 0.05 vs VIM-/- infected group). C: Expression of IL- 1β in the brain tissues of the mice detected by ELISA (***P < 0.05 vs VIM-/- infected group). |
将病毒感染1周后的小鼠以及PBS注射的对照组小鼠提取的脑组织总RNA经逆转录和RT-PCR测定发现,相对于野生型小鼠,VIM基因敲除组的caspase-1和IL-1β的mRNA含量更低(P < 0.05,表 2)。
| 表 2 小鼠脑组织炎性产物mRNA的表达与VIM有关 Table 2 Association of caspase-1 and IL-1β expressions with VIM in mice |
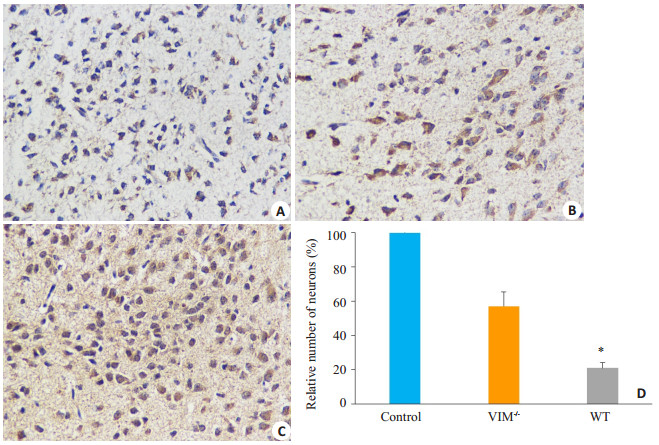
经过对小鼠体内炎症小体衍生物的检测之后,我们发现野生型小鼠经EV71感染后和其它几组小鼠存在差异,于是我们用免疫组化实验进一步考察和对比两组小鼠在感染EV71之后脑组织所受到的损伤情况。在显微镜下可见,经抗体染色后神经元细胞呈棕色,大脑皮质内野生鼠感染后神经元细胞形态皱缩,并出现大量炎性细胞浸润,空白组脑皮质内神经元细胞数量多,细胞圆润,经Image J细胞计数软件分析发现,虽然实验组小鼠均有细胞数量减少,但基因敲除实验组小鼠神经元细胞相对含量高于野生实验组(P < 0.05,图 3)。
|
图 3 感染EV71后各组小鼠大脑皮质神经元的损伤情况图 Figure 3 Vimentin-mediated damages of the brain in mice infected with EV71 evaluated by immunohistochemical staining (Original magnification: ×400). A: WT mice infected with 1×108 TCID50 of EV71; B: VIM-/- mice infected with 1×108 TCID50 of EV71; C: Control mice treated with PBS; D: Neuron counts in the brain tissues by Image J software, showing greater relative number of neurons in VIM-/- mice than in WT mice (*P < 0.05 vs VIM-/- EV71 infection group). |
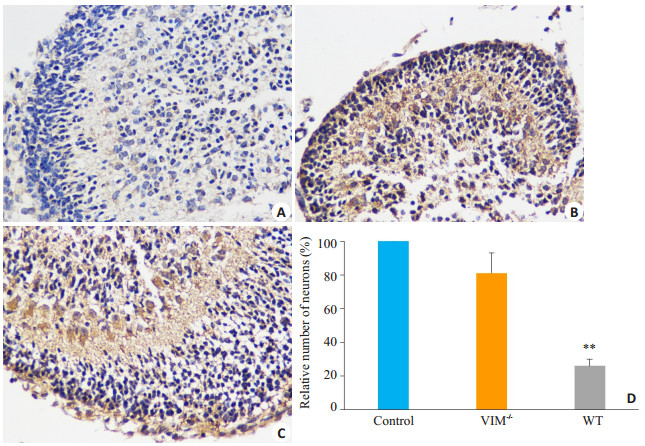
检测小脑皮质发现,VIM基因敲除组小鼠小脑皮质神经元细胞形态较之空白组没有太大的改变,野生组小鼠小脑皮质内有细胞皱缩变形,炎性细胞浸润等现象,而经软件计数分析,VIM基因敲除感染组小鼠神经元细胞数量与空白组差异无统计学意义,明显高于野生小鼠感染组(P < 0.05,图 4)。
|
图 4 感染EV71后各组小鼠小脑神经元的损伤情况图 Figure 4 Vimentin-mediated cerebellar damages in EV71-infected mice evaluated by immunohistochemical staining (×400). A: WT mice infected with 1×108 TCID50 of EV71; B: VIM-/- mice infected with 1×108 TCID50 of EV71; C: Control mice treated with PBS; D: Neuron counts in the cerebellum tissues by ImageJ software, showing greater relative number of neurons in VIM-/- mice than in WT mice (**P < 0.05 vs VIM-/- EV71 infection group). |
研究发现EV71在神经系统的损害当中发挥了大量的作用,无论是病原体、药物、急性创伤还是其他外源物质的刺激作用下引起的中枢神经系统损伤,都伴有炎症小体的激活[17-18],并且其激活程度与机体损伤程度呈正相关,在以往对于CNS与炎症小体的体内体外研究中,也提示了两者之间的关系[19]。
波形蛋白是负责控制从溶酶体传送由低密度脂蛋白(LDL)所衍生的胆固醇至酯化位点,是中间丝的其中一种细胞结构蛋白质[20-22]。有研究表明,EV71感染神经中枢宿主细胞产生28个差异性表达蛋白,其中一个重要差异性表达蛋白即为VIM[11]。同时,在重症细菌性脑炎研究中人们发现,患者感染的早期,人脑血管内皮细胞表面的Vimentin蛋白作为吸附受体与细菌结合[23],激活信号因子通路并诱导信号因子转入细胞核内,刺激细胞产生大量炎性因子,所以,VIM激活细胞信号通路对于中枢神经系统的致病性起到关键作用[24-25]。炎症小体激活导致的细胞程序性焦亡不同于细胞普通凋亡的方式[23],是一项新的机制,由于其对于微生物感染反应的敏感性,并且在各种类型的细胞中都发现炎症小体的激活[24-25],使它已经逐渐成为微生物感染机制研究的热点,为重症病原微生物的机制研究及其防治提供了新的思路[26]。
对于EV71感染引起炎症小体的激活是否经过VIM的调控,并最终造成中枢神经系统的损伤的研究目前仍然未见报道。我们的研究首次利用VIM基因敲除小鼠,比较EV71感染两种小鼠后中枢神经系统的的病理改变和炎症因子的表达水平,来研究VIM蛋白是否介导了炎症小体。其研究目的就是要探明VIM介导EV71的感染与炎症小体激活的关联作用机制,从而为治疗EV71感染所引起中枢神经系统病变提供科学依据。
Caspase-1和IL-1β是炎症小体激活后诱导生成的成熟炎症因子产物[27-29],在本实验中被用来作为炎症小体激活的指示物。在实验中我们发现,经腹腔注射EV71之后,从野生型小鼠的脑组织以及脑脊液内检测到比VIM基因敲除型小鼠和空白组小鼠更高的IL-1β和caspase-1含量,提示在EV71侵染中枢神经系统过程中可能有炎症小体的激活,并且这个过程可能与VIM有关[30]。本研究通过免疫组化分析考察了神经系统的病理改变情况发现,伴随着炎症小体的激活,野生型小鼠神经元细胞受到破坏损伤而大量减少,基因敲除组小鼠的脑组织内神经元细胞损伤较轻微,提示EV71引起的炎症小体的激活与中枢神经系统的损伤有关[31]。这与前文提到的关于炎症小体研究的结果一致。但是,EV71感染过程中VIM如何介导炎症小体的激活还有待进一步研究。
综上所述,EV71在侵染中枢神经系统过程中可能通过VIM介导炎症小体活化,继而促进caspase-1活化和炎症因子IL-1β释放,引起炎症反应,最终导致中枢神经系统损伤和神经元死亡。因此,VIM对炎症小体的调控作用具有较高的研究价值,我们的研究为EV71引起的病毒性脑炎、脑膜炎防治开拓了新的思路并提供了新的理论依据。
| [1] |
Ho M. Enterovirus 71: the virus, its infections and outbreaks[J].
J Microbiol Immunol Infect, 2000, 33(4): 205-16.
|
| [2] |
Mcminn PC. Enterovirus vaccines for an emerging cause of brainstem encephalitis[J].
N Engl J Med, 2014, 370(9): 792-4.
DOI: 10.1056/NEJMp1400601. |
| [3] |
Mcminn P, Stratov I, Nagarajan L, et al. Neurological manifestations of enterovirus 71 infection in children during an outbreak of hand, foot, and mouth disease in Western Australia[J].
Clin Infect Dis, 2001, 32(2): 236-42.
DOI: 10.1086/318454. |
| [4] |
Yan JJ, Su IJ, Chen PF, et al. Complete genome analysis of enterovirus 71 isolated from an outbreak in Taiwan and rapid identification of enterovirus 71 and coxsackievirus A16 by RT-PCR[J].
J Med Virol, 2001, 65(2): 331-9.
DOI: 10.1002/(ISSN)1096-9071. |
| [5] |
Li Q, Zhang X, Wang W, et al. CPT-11 activates NLRP3 inflammasome through JNK and NF-kappa B signaling[J].
Toxicol Appl Pharmacol, 2015, 289(2): 133-41.
DOI: 10.1016/j.taap.2015.09.025. |
| [6] |
Tricarico PM, Epate A, Celsi FA. Alendronate treatment induces IL- 1B expression and apoptosis in glioblastoma cell line[J].
Inflammopharmacology, 2018, 26(1): 285-90.
DOI: 10.1007/s10787-017-0369-5. |
| [7] |
Patel S. Inflammasomes, the cardinal pathology mediators are activated by pathogens, allergens and mutagens: A critical review with focus on NLRP3[J].
Biomed Pharmacother, 2017, 92(8): 819-25.
|
| [8] |
Evavold C, Kagan JC. How inflammasomes inform adaptive immunity[J].
J Mol Biol, 2017(17): 30470-9.
|
| [9] |
Boaru SG, Borkham-Kamphorst E, Van de Leur E, et al. NLRP3 inflammasome expression is driven by NF-kappa B in cultured hepatocytes[J].
Biochem Biophys Res Commun, 2015, 458(3): 700-6.
DOI: 10.1016/j.bbrc.2015.02.029. |
| [10] |
Du N, Cong HL, Tian HC, et al. Cell surface vimentin is an attachment receptor for enterovirus 71[J].
J Virol, 2014, 88(10): 5816-33.
DOI: 10.1128/JVI.03826-13. |
| [11] |
Luo WY, Zhong JY, Zhao W, et al. Proteomic analysis of human brain microvascular endothelial cells reveals differential protein expression in response to enterovirus 71 infection[J].
Biomed Res Int, 2015, 24(7): 864169.
|
| [12] |
Chi F, Bo T, Wu CH, et al. Vimentin and PSF act in concert to regulate IbeA plus e-coli K1 induced activation and nuclear translocation of NF-kappa B in human brain endothelial cells[J].
PLoS One, 2012, 7(4): e35862.
DOI: 10.1371/journal.pone.0035862. |
| [13] |
Peuhu E, Virtakoivu R, Mai A, et al. Epithelial vimentin plays a functional role in mammary gland development[J].
Development, 2017, 144(22): 4103-13.
DOI: 10.1242/dev.154229. |
| [14] |
Mak TN, Brüggemann H. Vimentin in bacterial infections[J].
Cells, 2016, 5(2): 145.
|
| [15] |
Wang WB, Xiao F, Wan P, et al. EV71 3D protein binds with NLRP3 and enhances the assembly of inflammasome complex[J].
PLoS Pathog, 2017, 13(1): e1006123.
DOI: 10.1371/journal.ppat.1006123. |
| [16] |
dos Santos G, Rogel MR, Baker MA, et al. Vimentin regulates activation of the NLRP3 inflammasome[J].
Nat Commun, 2015, 6(3): 6574.
|
| [17] |
Kinzel S, Weber MS. The role of peripheral CNS-Directed antibodies in promoting inflammatory CNS demyelination[J].
Brain Sci, 2017, 7(7): 365.
|
| [18] |
Mamik MK, Power C. Inflammasomes in neurological diseases: emerging pathogenic and therapeutic concepts[J].
Brain, 2017, 140(9): 2273-85.
DOI: 10.1093/brain/awx133. |
| [19] |
Wallisch JS, Simon DW, Bayir H, et al. Cerebrospinal fluid NLRP3 is increased after severe traumatic brain injury in infants and children[J].
Neurocrit Care, 2017, 27(1): 44-50.
DOI: 10.1007/s12028-017-0378-7. |
| [20] |
Yang YY, Ye CX, Wang LX, et al. Repressor activator protein 1- promoted colorectal cell migration is associated with the regulation of Vimentin[J].
Tumour Biol, 2017, 39(4): 1393394630.
|
| [21] |
Keeling MC, Flores LR, Dodhy AH, et al. Actomyosin and vimentin cytoskeletal networks regulate nuclear shape, mechanics and chromatin organization[J].
Sci Rep, 2017, 7(1): 5219.
DOI: 10.1038/s41598-017-05467-x. |
| [22] |
He C, Kong L, Zhou LJ, et al. Host cell vimentin restrains toxoplasma gondii invasion and phosphorylation of vimentin is partially regulated by interaction with TgROP18[J].
Int J Biol Sci, 2017, 13(9): 1126-37.
DOI: 10.7150/ijbs.21247. |
| [23] |
Huang SH, Chi F, Peng L, et al. Vimentin, a novel NF-kappa B regulator, is required for meningitic escherichia coli K1-Induced pathogen invasion and PMN transmigration across the Blood-Brain barrier[J].
PLoS One, 2016, 11(9): e162641.
|
| [24] |
Liu LS, Hess J, Sahu ID, et al. Probing the local secondary structure of human vimentin with electron spin echo envelope modulation (ESEEM) spectroscopy[J].
J Phys Chem B, 2016, 120(48): 12321-6.
DOI: 10.1021/acs.jpcb.6b10054. |
| [25] |
Engdahl C, Bang H, Dietel K, et al. Periarticular bone loss in arthritis is induced by autoantibodies against citrullinated vimentin[J].
J Bone Miner Res, 2016, 68(10): 1681-91.
|
| [26] |
Lee HW, Lee CG, Rhee DK, et al. Sinigrin inhibits production of inflammatory mediators by suppressing NF-kappa B/MAPK pathways or NLRP3 inflammasome activation in macrophages[J].
Int Immunopharmacol, 2017, 45(8): 163-73.
|
| [27] |
Xiao QF, Qu ZH, Zhao Y, et al. Orientin ameliorates LPS-Induced inflammatory responses through the inhibitory of the NF-kappa B pathway and NLRP3 inflammasome[J].
Evid Based Complement Alternat Med, 2017, 25(7): 2495496.
|
| [28] |
Zmora N, Levy M, Pevsner-Fischer M, et al. Inflammasomes and intestinal inflammation[J].
Mucosal Immunol, 2017, 10(4): 865-83.
DOI: 10.1038/mi.2017.19. |
| [29] |
Lee NY, Chung KS, Jin JS, et al. The inhibitory effect of nodakenin on Mast-Cell-Mediated allergic inflammation via downregulation of NF-kappa B and caspase-1 activation[J].
J Cell Biochem, 2017, 118(11): 3993-4001.
DOI: 10.1002/jcb.v118.11. |
| [30] |
Broz P. Inflammasomes in host defense and autoimmunity[J].
Chimia (Aarau), 2016, 70(12): 853-5.
DOI: 10.2533/chimia.2016.853. |
| [31] |
Hedde JR, Hanks AN, Schmidt CJ, et al. The isozyme selective phosphodiesterase-4 inhibitor, ABI-4, attenuates the effects of lipopolysaccharide in human cells and rodent models of peripheral and CNS inflammation[J].
Brain Behav Immun, 2017, 64(8): 285-95.
|
 2018, Vol. 38
2018, Vol. 38

