2. 陕西省肿瘤医院妇瘤外科,陕西 西安 710061;
3. 精准外科与再生医学国家地方联合工程研究中心,陕西 西安 710061
2. Department of Gynecology Oncology Surgery, Shaanxi Provincial Cancer Hospital;
3. National Local Joint Engineering Research Center for Precision Surgery and Regenerative Medicine, Xi'an 710061, China
近年来,基于脱细胞支架构建组织工程肝脏的技术发展为扩大供肝数量带来了希望。前期研究已经成功使用肝脏脱细胞支架(DLM)及种子细胞构建组织工程肝脏(TEL),能够在体外代偿部分肝功能[1-4],进一步研究证实TEL能够改善急性肝衰竭动物肝功能,并且降低其死亡率[5],成为再生医学领域的又一高峰。虽然DLM是一种十分理想的支架材料,但仍需肝脏作为制作材料,来源仍受到很大的限制。为此,本课题组在前期研究中提出使用脾脏脱细胞支架(DSM)作为构建TEL的支架材料。脾脏可源于门脉高压症脾切除、外伤性脾破裂切除以及器官捐献,其来源较肝脏更加广泛,可实现“变废为宝”。课题组前期研究已经证实脾脏脱细胞支架具有与肝脏脱细胞支架类似的细胞外基质成分、三维多孔结构、完整的血管网络以及良好的生物相容性,且实现了联合原代肝细胞[6]、间充质干细胞[7]的肝样组织的构建及体外培养,能够部分表达肝细胞特异性功能[8]。
目前基于脱细胞支架的TEL研究大多停留在体外实验阶段,体内应用研究很少,主要原因之一是缺少理想的植入策略。理想的组织工程肝脏植入策略至少应具有以下特点:操作简单、血供充足、细胞能够长时间存活。本实验利用DSM构建了组织工程肝脏,比较了异位血管吻合移植、肝断面缝合移植、肝内嵌入移植以及肠系膜包裹移植4种移植策略的优缺点,为组织工程肝脏的临床应用奠定了实验基础。
1 材料和方法 1.1 材料 1.1.1 实验动物健康3月龄SD大鼠,体质量250~300 g,由西安交通大学动物实验中心提供。饲养温度保持为18~25℃,标准饲料喂养,实验过程严格遵照国家科学技术部2006年发布的《关于善待实验动物的指导性意见》。
1.1.2 试剂及仪器DMEM培养基、青链霉素(Hyclone)、胎牛血清(Gibco)、台盼蓝染液、胰蛋白酶、红细胞裂解液(碧云天)、WE(William's E)培养基、Ⅳ型胶原酶(Sigma)。主要仪器包括:超净工作台、CO2恒温培养箱、多功能酶标仪(Thermo Scientific)、200目不锈钢滤网(北京索莱宝科技有限公司)、倒置相差显微镜(Olympus)。
1.2 组织工程肝脏制备 1.2.1 脱细胞脾脏支架制备经脾动脉插管获取大鼠脾脏,门静脉侧留置Cuff鞘套管。支架制备方法如本课题组前期研究[3-5]所述,简要概括如下:脾脏离体后继续去离子水灌注30 min,随后浸入PBS中冻存于-80 ℃冰箱备用。反复冻融脾脏2次后置入烧杯中,连接蠕动泵,灌注速度为4 mL/min,序列应用0.2%十二烷基硫酸钠(SDS)溶液、PBS液经由脾动脉持续灌注,直至脱去脾脏实质细胞,应用PBS冲洗后进行支架消毒,保存在含3%双抗PBS溶液中。
1.2.2 原代肝细胞分离提取采用Seglen改良两步胶原酶灌注法获取大鼠原代肝细胞[9]。全身肝素化后门静脉插管,依次灌注37 ℃前灌液、0.05% Ⅳ型胶原酶溶液,灌注速度分别为20 mL/min及10 mL/min,各灌注5 min。加入4 ℃清洗液50 mL,转移至超净台,撕破肝包膜,抖落肝细胞,过200目滤网,WE培养基清洗2次。加入完全培养基重悬,调整细胞密度为5×106/mL。台盼蓝染液测定细胞活性,活力大于90%的用于下一步实验。
1.2.3 组织工程肝脏制备一次性无菌性注射器吸取10 mL含10%胎牛血清的WE培养基,连接DSM门脉内留置针,以2 mL/min的速度灌注入DSM内,支架逐渐呈现均匀淡红色。随后吸取1 mL细胞悬液,细胞密度为5×106/mL,以1 mL/min速度缓慢注入DSM,置于5% CO2饱和湿度的37 ℃培养箱中静置15 min,使细胞与支架充分吸附。再次吸取相同浓度的细胞悬液1 mL以1 mL/min速度注入DSM内,静置15 min。细胞悬液注射过程总共重复3次。再次使用10 mL含10%胎牛血清的WE培养基以2 mL/min速度灌注支架去除未吸附的原代肝细胞。DSM内初始细胞总量约为1.5×107,3次注射结束后支架颜色逐渐变深,透明度明显降低(图 2B)。TEL制备后,静置于5% CO2饱和湿度的37 ℃培养箱中等待移植,使细胞与支架充分吸附,与植入体内间隔约1 h。
|
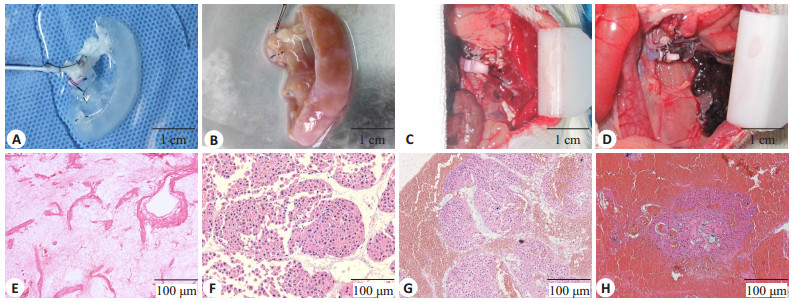
图 2 异位血管吻合移植 Figure 2 Ectopic vascular anastomosis. A-D: General view; E-H: HE staining; A, E: Decellularized spleen matrix: B, F: Tissue engineered liver; C, G: Graft immediately after reperfusion; D, H: Graft 6 h after operation. |
受体选用雄性大鼠,常规麻醉、消毒、铺巾、开腹。暴露左肾及腹主动脉,钝性分离肾脏血管,依次游离并结扎肾上腺动脉、肾动脉、肾静脉及输尿管,切除左肾。动脉夹阻断肾动静脉,袖套法吻合肾动脉及脾动脉,Cuff鞘套管法吻合肾静脉及门静脉,打结固定。移除动脉夹恢复TEL血供,充分止血后关腹。术后6 h处死大鼠取标本。
1.3.2 肝断面缝合移植术前准备及进腹过程如前所述。显露第一肝门,动脉夹阻断肝蒂。眼科剪迅速剪去肝中叶及左内侧叶,棉签压迫止血。使用可吸收缝线将剪开一侧脾包膜的TEL缝合在肝断面之上。移除动脉夹恢复肝脏血供,充分止血后关腹。分别在术后第3天、7天、14天取标本。
1.3.3 肝内嵌入移植术前准备及进腹过程如前所述。于肝叶根部结扎并切除肝中叶及左内侧叶。在剩余肝叶剪开1 cm长切口,棉签压迫止血,将脱细胞肝脏支架小块插入到肝脏切口中间,再次压迫止血后关腹。分别在术后第3天、7天、14天取标本观察。
1.3.4 肠系膜包裹移植术前准备及进腹过程如前所述。暴露肠系膜,随后使用肠系膜包裹组织工程肝脏,还纳肠管后关腹。分别在术后第3天、7天、14天留取标本。
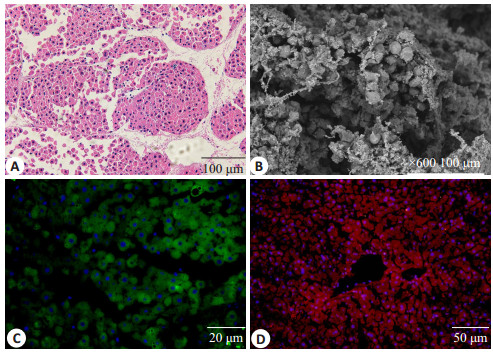
2 结果 2.1 构建了功能良好的组织工程肝脏原代肝细胞在DSM上的细胞种植率(74.5±7.7)%,HE染色与扫描电镜显示肝细胞在支架内生长良好,主要沿着DSM内部血管结构分布,形成白髓与红髓样结构。免疫荧光染色证实支架内肝细胞正常表达ALB、G6Pc。TEL活性良好,并且能够表达部分肝细胞特异性功能(图 1)。
|
图 1 组织工程肝脏微观特征 Figure 1 Microscopic observation of the tissue-engineered liver. A: HE staining; B: Scanning electron microscopy; C: ALB immunofluorescence staining; D: G6pc immunofluorescence. |
本组实验总共进行了12组血管吻合肝移植,其中2只大鼠死于手术操作失误,2只死于术后肺栓塞。重新开放肾动静脉之后,TEL由土黄色变为鲜红色,灌注良好,无明显渗血,血管开放后肝细胞周围可见大量游离红细胞,支架内血管通畅,无明显血栓形成。术后6 h开腹检查,见TEL为紫黑色,支架内无血流通过,门静脉管腔内可见大量血栓形成,部分肝细胞结构消失,细胞与周围血栓、间质等分界不清(图 2)。
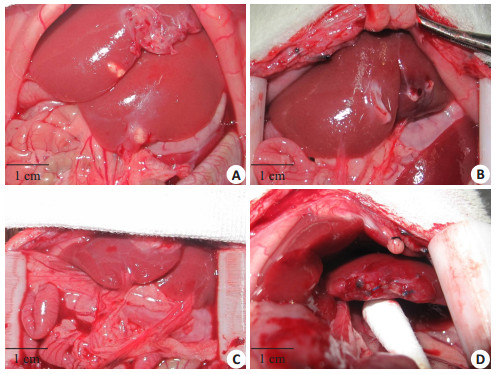
2.3 肝断面缝合与肝内嵌入移植移除肝蒂上动脉夹后可见肝脏颜色由暗红色变为鲜红色,再灌注良好,肝断面与移植肝脏缝合处未见明显渗血,9只大鼠均无死亡。术后第3天可见肝断面愈合良好,仅见残余可吸收缝线,未见成形移植物(图 3)。
|
图 3 肝内嵌入与肝断面缝合移植 Figure 3 Intrahepatic insertion and liver cross- section suture transplantation. A-C: General view on days 3, 7 and 14 after intra-hepatic transplantation; D: General view 3 days after cross-section suture transplantation. |
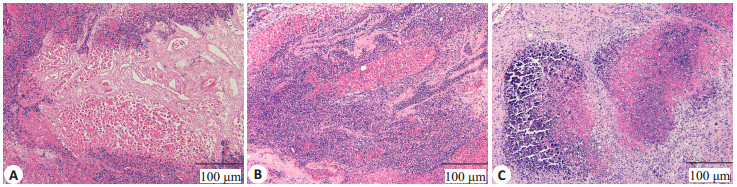
肝内嵌入组大鼠术后同样恢复良好,9只大鼠均未死亡。术后第3天可见嵌有支架的肝脏表面有大网膜覆盖,无红肿、化脓、溃液、钙化等表现,植入支架组织结构完整,支架与肝脏结合较疏松,易于与周围肝组织分离,接触面可见少量点状出血。术后第7天可见支架结构仍完整,体积较前缩小,与肝脏组织粘连紧密,分离后可见接触面较多出血点。术后第14天,支架体积缩小,与周围组织粘连更加紧密,分界不清,分离后出血较多(图 3)。HE结果显示,术后第3~14天支架体积明显缩小,脱细胞支架内的原代肝细胞大量死亡,细胞体积明显缩小,细胞核固缩、溶解,胞质颜色减淡,仅保留细胞轮廓,术后14 d时未见到存活肝细胞。同时大量的中性粒细胞、单核细胞等炎性细胞从植入支架周边向中心浸润(图 4)。
|
图 4 肝内嵌入移植 Figure 4 Intrahepatic insertion. A-C: HE staining on days 3, 7 and 14 after intrahepatic insertion, respectively. |
肠系膜包裹移植组大鼠术后同样恢复良好,未见大鼠死亡。术后第3天可见TEL结构完整,被大网膜及肠系膜包裹,但结合较疏松,分离后可见少量出血。术后第7天支架较前变化不大,与周围组织结合更加紧密,分离后可见到较多出血点。术后2周,打开腹腔可见局部粘连严重,TEL与肠系膜及大网膜结合紧密,难以分离。剥开表面粘连,可见TEL呈现表面光滑的淡黄色实性包块,质地较韧,表面大量出血点。而HE染色结果显示,大量炎性细胞及成纤维细胞从TEL周边向中心部位浸润,大量原代肝细胞坏死、凋亡,细胞体积变小,细胞核固缩、染色变浅以及溶解,胞质染色变淡,许多细胞仅保留细胞轮廓。但是同嵌入模型相比,术后第14天HE结果显示在支架的中心部位仍可见到结构完整的肝细胞,提示TEL内肝细胞植入体内两周后仍未全部死亡,仍有部分细胞存活,细胞存活率(38.3±7.1)%(图 5)。
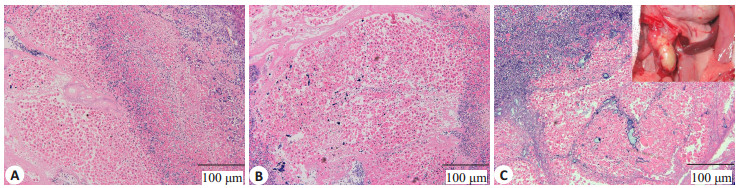
|
图 5 肠系膜包裹移植 Figure 5 Mesenteric transplantation. A-C: HE staining on days 3, 7 and 14 after mesenteric transplantation, respectively. mThe insert in C shows the general view of TEL 14 days after transplantation. |
血管吻合是组织工程器官体内植入最常见的方法之一。但由于脱细胞支架缺乏内皮细胞导致胶原暴露,在同受体血管吻合后极易形成血栓,严重降低了移植物存活率及受体存活率。有研究尝试采用逐层自组装[10-11]对脾脏脱细胞支架进行肝素化修饰,形成肝素的缓释环境,以其实现抗凝目的,尚需进一步探索。此外,肾动脉吻合的辅助移植方式缺少门静脉血供,而后者对肝脏生理功能具有重要作用[12-16]。并且此种移植方式难度较大,对外科手术技术要求很高。综上所述,以现阶段技术水平来说,血管吻合的移植方式并不是一种理想的移植方式。
3.2 肝断面缝合与肝内嵌入移植同血管吻合移植的方式相比,这两种移植方式都无需对支架进行特殊处理,TEL直接接触正常肝脏组织,肝脏的细胞外基质、生长因子以及门静脉血供均利于支架中肝细胞的长期存活和增殖。
对于肝断面缝合移植,TEL不仅可以直接接触肝断面,而且能够促进肝断面的止血,在类似研究中这种移植方式能够促进支架内血管的新生,促进干细胞的迁移[17-18]。但是在本研究被没有观察到这种现象,缝合后组织工程肝脏很快坏死脱落。初步分析TEL坏死脱落主要因为移植物与受体肝脏之间尚未建立有效血管连接,仅靠组织渗透作用维持支架内细胞的营养、氧气供应,无法满足支架内大量细胞的代谢需求,TEL内细胞很快死亡,导致支架的坏死、脱落。
实验进一步将TEL切割成较小体积的组织嵌入到肝脏之中。肝内嵌入的方式植入的TEL体积缩小,细胞数量减少。但是接触面积增大,同正常肝组织之间的代谢交换增加,利于TEL中细胞的存活。我们的实验结果也证实肝内嵌入的TEL降解时间明显延长,可见到新生毛细血管,原代细胞存活时间长达1周。但是,我们发现DSM降解速度仍相对较快,同细胞外基质新生速度不匹配,无法满足组织工程支架的需求。其次,新生血管数量生成较少,新生速度慢,不能满足TEL代谢需要。此外,免疫排斥反应严重,支架内细胞死亡的主要原因为受体对DSM以及原代肝细胞的严重排斥反应。因此,肝断面缝合与肝内嵌入移植也无法满足TEL体内植入的需求。
3.3 肠系膜包裹移植在肠系膜包裹移植实验组中,长达2周之后TEL内仍有部分肝细胞存活,存活时间长于前几种移植方式。我们推测肝细胞能够长期存活主要有以下几种原因:首先,TEL肠系膜包裹移植后可以同时被大网膜包裹,大网膜具有高度血管化的结构,在临床上被广泛用于外科重建手术中对缺损组织的修复,促进组织的再生[4, 19]。在组织工程领域,大网膜被用于体外移植物的“天然生物反应器[20]”,大网膜能够与移植物之间形成侧支循环,能够促进移植物血管化的形成,增强移植物的功能[21-23],在本部分实验中也观察到这种现象,良好的血供是移植存活的基础。其次,腹腔内移植时,移植物并没有直接与受体血液接触,免疫排斥反应相对较弱,这是TEL内肝细胞存活长达两周的重要原因之一。此外,大网膜或肠系膜包裹的TEL接受的血液来源于肠道,对TEL中肝细胞起到一种保护作用[16, 24-27],利于肝细胞的存活。这种简单安全有效的移植方式,是目前最可行的移植方式之一,有望用于组织工程肝脏的临床应用,具有广阔的应用前景。
本研究利用脾脏脱细胞支架及原代肝细胞构建了组织工程肝脏,在体内植入策略比较中证实肠系膜包裹移植的方法操作简单,血供丰富,能使TEL中原代肝细胞存活2周以上。此种移植方法是现阶段可行的组织工程肝脏的移植方式。
| [1] |
Zhou Q, Li L, Li J. Stem cells with decellularized liver scaffolds in liver regeneration and their potential clinical applications[J].
Liver Int, 2015, 35(3): 687-94.
DOI: 10.1111/liv.2015.35.issue-3. |
| [2] |
Mazza G, Simons JP, Al-Shawi R, et al. Amyloid persistence in decellularized liver: biochemical and histopathological characterization[J].
Amyloid, 2016, 23(1): 1-7.
DOI: 10.3109/13506129.2015.1110518. |
| [3] |
Faulk DM, Wildemann JD, Badylak SF. Decellularization and cell seeding of whole liver biologic scaffolds composed of extracellular matrix[J].
J Clin Exp Hepatol, 2015, 5(1): 69-80.
DOI: 10.1016/j.jceh.2014.03.043. |
| [4] |
Wiltfang J, Rohnen M, Egberts JH, et al. Man as a living bioreactor: prefabrication of a custom vascularized bone graft in the gastrocolic omentum[J].
Tissue Eng Part C Methods, 2016, 22(8): 740-6.
DOI: 10.1089/ten.tec.2015.0501. |
| [5] |
Kakabadze Z, Kakabadze A, Chakhunashvili D, et al. Decellularized human placenta supports hepatic tissue and allows rescue in acute liver failure[J].
Hepatology, 2018, 67(5): 1956-69.
DOI: 10.1002/hep.v67.5. |
| [6] |
Gao R, Wu W, Xiang J, et al. Hepatocyte culture in autologous decellularized spleen matrix[J].
Organogenesis, 2015, 11(1): 16-29.
DOI: 10.1080/15476278.2015.1011908. |
| [7] |
Jun JX, Xiang, Xing XL, et al. Liver regeneration using decellularized splenic scaffold: a novel approach in tissue engineering[J].
Hepatobiliary Pancreat Dis Int, 2015, 14(5): 502-8.
DOI: 10.1016/S1499-3872(15)60423-4. |
| [8] |
Zheng XL, Xiang JX, Wu WQ, et al. Using a decellularized splenic matrix as a 3D scaffold for hepatocyte cultivation in vitro: a preliminary trial[J].
Biomed Mater, 2015, 10(4): 045023.
DOI: 10.1088/1748-6041/10/4/045023. |
| [9] |
Seglen PO. Preparation of isolated rat liver cells[J].
Methods Cell Biol, 1976, 13(13): 29-83.
|
| [10] |
Zhang K, Chen JY, Qin W, et al. Constructing bio-layer of heparin and type Ⅳ collagen on Titanium surface for improving its endothelialization and blood compatibility[J].
J Mater Sci Mater Med, 2016, 27(4): 81.
DOI: 10.1007/s10856-016-5693-6. |
| [11] |
Ferreira AM, Gentile P, Toumpaniari S, et al. Impact of collagen/heparin multilayers for regulating bone cellular functions[J].
ACS Appl Mater Interfaces, 2016, 8(44): 29923-32.
DOI: 10.1021/acsami.6b09241. |
| [12] |
De Jonge J, Zondervan PE, Kooi PP, et al. Portal flow diversion is essential for graft survival in canine auxiliary partial orthotopic liver transplantation[J].
Eur Surg Res, 2003, 35(1): 14-21.
DOI: 10.1159/000067030. |
| [13] |
Farid WR, De Jonge J, Slieker JC, et al. The importance of portal venous blood flow in ischemic-type biliary lesions after liver transplantation[J].
Am J Transplant, 2011, 11(4): 857-62.
DOI: 10.1111/j.1600-6143.2011.03438.x. |
| [14] |
Ott R, Böhner C, Müller S, et al. Outcome of patients with preexisting portal vein thrombosis undergoing arterialization of the portal vein during liver transplantation[J].
Transpl Int, 2003, 16(1): 15-20.
DOI: 10.1111/tri.2003.16.issue-1. |
| [15] |
Charco R, Margarit C, López-Talavera JC, et al. Outcome and hepatic hemodynamics in liver transplant patients with portal vein arterialization[J].
Am J Transplant, 2001, 1(2): 146-51.
DOI: 10.1034/j.1600-6143.2001.10208.x. |
| [16] |
Zhang J, Xi J, Dong C, et al. Effects of dual arterial blood supply on liver regeneration in the graft and the host following heterotopic auxiliary liver transplantation[J].
Exp Ther Med, 2014, 8(5): 1428-32.
DOI: 10.3892/etm.2014.1976. |
| [17] |
Yu Y, Shao YK, Ding YQ, et al. Decellularized kidney scaffoldmediated renal regeneration[J].
Biomaterials, 2014, 35(25): 6822-8.
DOI: 10.1016/j.biomaterials.2014.04.074. |
| [18] |
Xiang J, Liu P, Zheng X, et al. The effect of riboflavin/UVA crosslinking on anti-degeneration and promoting angiogenic capability of decellularized liver matrix[J].
J Biomed Mater Res A, 2017, 105(10): 2662-9.
DOI: 10.1002/jbm.a.v105.10. |
| [19] |
Bigham-Sadegh A, Oryan A, Mirshokraei P, et al. Bone tissue engineering with periosteal-free graft and pedicle omentum[J].
ANZ J Surg, 2013, 83(4): 255-61.
DOI: 10.1111/ans.2013.83.issue-4. |
| [20] |
Khorramirouz R, Kameli SM, Eftekharzadeh S, et al. Application of omentum as an in vivo bioreactor for regeneration of decellularized human internal mammary artery[J].
J Biomed Mater Res A, 2017, 105(10): 2685-93.
DOI: 10.1002/jbm.a.v105.10. |
| [21] |
Zhang YG, Huang JH, Hu XY, et al. Omentum-wrapped scaffold with longitudinally oriented micro- channels promotes axonal regeneration and motor functional recovery in rats[J].
PLoS One, 2011, 6(12): e29184.
DOI: 10.1371/journal.pone.0029184. |
| [22] |
Shapira A, Kim DH, Dvir T. Advanced micro- and nanofabrication technologies for tissue engineering[J].
Biofabrication, 2014, 6(2): 020301.
DOI: 10.1088/1758-5082/6/2/020301. |
| [23] |
Reis LA, Chiu LL, Feric N, et al. Biomaterials in myocardial tissue engineering[J].
J Tissue Eng Regen Med, 2016, 10(1): 11-28.
DOI: 10.1002/term.v10.1. |
| [24] |
Michalopoulos GK. Liver regeneration[J].
J Cell Physiol, 2007, 213(2): 286-300.
DOI: 10.1002/(ISSN)1097-4652. |
| [25] |
Ratchyk VM. Results of surgical treatment of patients with subhepatic cholestasis of non-tumor etiology[J].
Klin Khir, 2008(10): 24-7.
|
| [26] |
Ikeda O, Ozaki M, Murata S, et al. Autonomic regulation of liver regeneration after partial hepatectomy in mice[J].
J Surg Res, 2009, 152(2): 218-23.
DOI: 10.1016/j.jss.2008.02.059. |
| [27] |
Tashiro S. Mechanism of liver regeneration after liver resection and portal vein embolization (ligation) is different[J].
? J Hepatobil Pancreat Surg, 2009, 16(3): 292-9.
DOI: 10.1007/s00534-009-0058-x. |
 2018, Vol. 38
2018, Vol. 38

