2. 蚌埠医学院第二附属医院内分泌科,安徽 蚌埠 233040
2. Department of Endocrinology, Second Affiliated Hospital of Bengbu Medical College, Bengbu 233040, China
脑缺血性疾病是最重要的致死性疾病之一,严重威胁人类的健康,其预防与治疗一直是医学界攻关的难题。研究表明,小脑性共济失调和震颤与浦肯野细胞功能损伤密切相关[1-3]。针刺疗法是中医学重要组成部分之一,近年来在脑缺血性疾病治疗方面发挥着较以往更广泛、更重要的作用。针刺预处理指在脑缺血前给予针刺,从而对缺血后脑组织产生保护的现象。目前研究[4-5]发现,针刺预处理能改善脑血液循环、增加脑血供、提高脑组织对缺血缺氧的耐受性和细胞存活率,但其内在机制尚未完全阐明。本文利用小脑脑片,通过对单纯脑缺血组和针刺预处理脑缺血组大鼠小脑浦肯野细胞的全细胞记录,在细胞水平上观察缺血早期对单个浦肯野细胞动作电位发放的影响,探讨针刺特定穴位是否可以保护由缺血导致的小脑浦肯野细胞的功能损伤及可能机制,为改善脑缺血性疾病患者的预后提供一定的实验和理论参考。
1 材料和方法 1.1 实验动物及分组正常雄性SD大鼠40只,动物许可证号[SYXK(皖2012-002)],由安徽省蚌埠医学院实验动物中心提供。40只大鼠随机分2组:单纯脑缺血组(包括正常对照组和脑缺血组)和针刺预处理脑缺血组(包括针刺预处理脑缺血前和脑缺血后组),每组20只。单纯脑缺血组大鼠未作针刺预处理操作。针刺预处理组大鼠于出生后13 d起给予针刺操作,持续7 d。
1.2 试剂和仪器NaCl、KCl、NaH2PO4、CaCl2、MgSO4、dextrose、HEPES、KOH、EGTA、Mg2+-ATP、Tris-GTP、葡萄糖酸钾和NaOH(sigma公司),95% O2和5% CO2(合肥巨网气体有限公司),IR-DIC光学显微镜(Nikon E600FN,日本Nikon公司);Axoclamp-200B放大器(美国Axon公司);微电极管拉制仪(P-97,美国SUUTTER公司);振荡切片机(美国VIBRATOME公司);显微操纵仪(PCS-5000 series EXFO,美国Burleigh公司);图像采集系统及显示屏(TYALUX,美国Burleigh公司)。
1.3 溶液配制[6-14]人工脑脊液(ACSF)Ⅰ内含124 mmol/L NaCl、3 mmol/L KCl、1.2 mmol/L NaH2PO4、26 mmol/L NaHCO3、10 mmol/L dextrose、5 mmol/L HEPES、0.5 mmol/L CaCl2和4 mmol/L MgSO4,pH 7.35-7.45(1 mol/L NaOH调节pH)。ACSF Ⅱ含124 mmol/L NaCl、3 mmol/L KCl、1.2 mmol/L NaH2PO4、26 mmol/L NaHCO3、2.4 mmol/L CaCl2、1.3 mmol/L MgSO4、10 mmol/L dextrose和5 mmol/L HEPES,pH 7.35-7.45(1 mol/L NaOH调节pH)。全细胞记录微电极内标准电极液含150 mmol/L葡萄糖酸钾、5 mmol/L NaCl、5 mmol/L HEPES、0.4 mmol/L EGTA、4 mmol/L Mg2+- ATP、0.5 mmol/L Tris-GTP和5 mmol/L磷酸肌酸,pH 7.35(2 mol/L KOH调节pH)。每次新鲜电极液使用前,用孔径为0.1 μm的离心过滤器过滤,渗透压为295~305 mOsmol,电极阻抗为5~6 MΩ。
1.4 针刺预处理方法针刺部位选择百会穴和双侧足三里穴[15-18],参照《实验动物针灸穴位图谱》,选用华佗牌无菌针灸针(苏州医疗用品有限公司)。针刺预处理组大鼠于出生后13 d起给予针刺预处理,两人配合操作,一人抓取活体大鼠以固定,另一人以0.25 mm ×25 mm毫针向百会穴平刺约3 mm,同时以0.25 mm ×40 mm毫针向双侧足三里穴直刺约5 mm,每日2次,间歇5 min捻转1次,留针30 min,连续针刺7 d。针刺预处理结束后,大鼠被断头取脑,制备成脑片,用以全细胞记录。
1.5 脑片制备[6-14]2组大鼠于出生后20 d以异氟烷(0.55 mL/kg)腹腔注射麻醉,刀片断头,迅速取出小脑,去除脑干及小脑半球,将小脑蚓部放入充分氧合的冰水混合ACSFⅠ中,震荡切片机切成400 μm脑片,脑片放入充分氧合ACSFⅡ孵育1 h,孵育温度为25 ℃。孵育好的脑片转运至31 ℃充分氧合的ACSFⅡ浸没的记录槽内(Warner RC-26G),灌流速度为2 mL/min,在IR-DIC光学显微镜下选择小脑浦肯野细胞进行全细胞记录。浦肯野细胞位于小脑皮层的分子层与颗粒层之间,形态在显微镜下可见有圆形或卵圆形的胞体和巨大的树突。
1.6 体外脑缺血模型制备[6, 9-10]在单纯脑缺血组中,正常对照组脑片ACSFⅡ的灌流速度为2 mL/min,记录小脑浦肯野细胞动作电位。脑缺血组脑片ACSFⅡ的灌流速度从正常状态下的2 mL/min减慢到0.2 mL/min,模拟在体缺血性脑中风过程中的动脉阻塞和侧枝循环,持续4 min后再次记录其动作电位。正常对照组和脑缺血组动作电位记录在同一批细胞上进行。
在针刺预处理中,脑缺血前组脑片ACSFⅡ的灌流速度为2 mL/min,记录浦肯野细胞动作电位。脑缺血后组脑片ACSFⅡ的灌流速度从正常状态下的2 mL/min减慢到0.2 mL/min,持续4 min后再次记录其动作电位。脑缺血前、后组动作电位记录在同一批细胞上进行。
1.7 全细胞记录和细胞功能的测定利用Axoclamp-200B放大器电流钳模式记录小脑浦肯野细胞动作电位,采集的电信号输入pClamp 10.0(Axon Instrument Inc., Foster CA, USA)分析软件获取和分析资料。放大器高频滤波为3 kHz,利用去极化电流脉冲诱发动作电位。动作电位发放能力可用动作电位峰间距(ISI)、动作电位峰时程标准差(SDST)及阈电位[6-14]表示。ISI表示序列动作电位中相邻两个动作电位峰顶点之间的距离,代表动作电位的发放能力;SDST表示多次刺激下动作电位发放的精确性和稳定性;阈电位表示动作电位从静息状态到动作电位发放起始点间的差值,代表动作电位发放的能障。
1.8 统计学方法实验数据用SPSS软件进行统计分析,以均数±标准差表示,多组比较采用方差分析,两两比较采用q检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 各组大鼠浦肯野细胞动作电位发放比较测量各组浦肯野细胞对去极化电流脉冲诱发动作电位的叠加波形,可见单纯脑缺血组细胞缺血后动作电位发放能力增加、精确性降低,即细胞兴奋性增加,而针刺预处理能明显改善由脑缺血诱导的动作电位变化(图 1)。
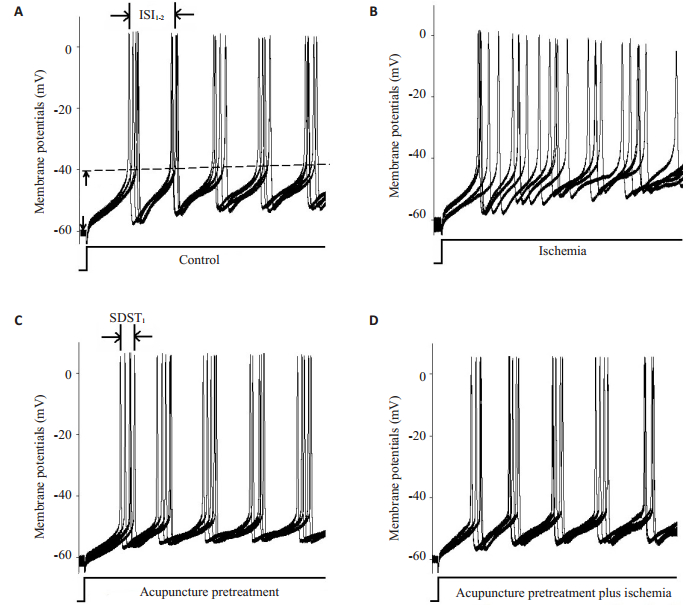
|
图 1 各组大鼠浦肯野细胞动作电位发放比较 Figure 1 Changes of sequential spikes in cerebellar Purkinje cells (CPC) in control (A), ischemia (B), acupuncture pretreatment (C) and acupuncture pretreatment plus ischemia groups (D). Sequential spikes were induced by injecting a depolarization pulse (0.3 nA, 120 ms) into the cerebellar Purkenje cells. |
测量浦肯野细胞相同编号动作电位ISI值,单纯脑缺血组较正常对照组高(P < 0.01),针刺预处理脑缺血前和脑缺血后组比较无统计学差异(P > 0.05),且正常对照组与针刺预处理脑缺血前组间比较差异无统计学意义(P > 0.05,图 2)。可见针刺预处理特定穴位可明显减轻由脑缺血诱导的浦肯野细胞动作电位发放的过度增加,防止细胞过度兴奋。
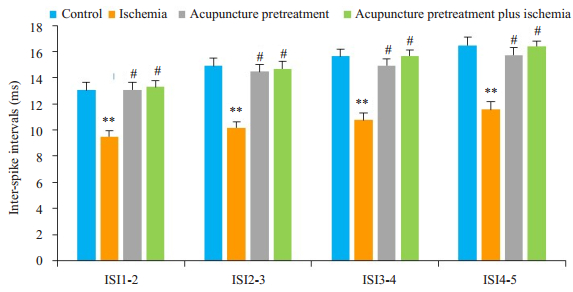
|
图 2 各组大鼠浦肯野细胞动作电位ISI比较 Figure 2 Comparison of ISI of the sequential spikes in cerebellar Purkenje cells among control, ischemia, acupuncture pretreatment, and acupuncture pretreatment plus ischemia groups (Mean±SD, n=12). **P < 0.01, #P > 0.05. |
测量浦肯野细胞相同编号动作电位SDST值,可见单纯脑缺血组较正常对照组高(P < 0.01),针刺预处理脑缺血前和脑缺血后组比较无统计学差异(P > 0.05),且单纯对照组与针刺预处理脑缺血前组间比较亦无统计学差异(P > 0.05,图 3)。可见针刺预处理特定穴位可使浦肯野细胞的动作电位在缺血状态下发放稳定。
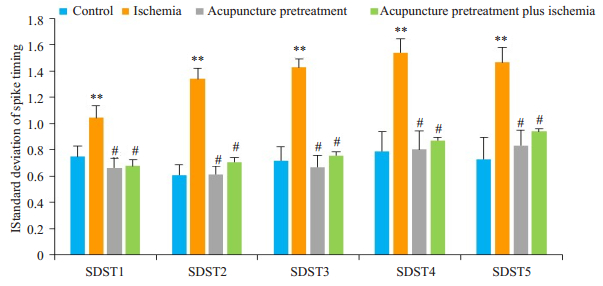
|
图 3 各组大鼠浦肯野细胞动作电位SDST比较 Figure 3 Comparisons of SDST of the sequential spikes in cerebellar Purkenje cells among control, ischemia, acupuncture pretreatment, and acupuncture pretreatment plus ischemia groups (Mean±SD, n=12). **P < 0.01, #P > 0.05. |
测量各组浦肯野细胞动作电位阈电位,可见单纯脑缺血组较正常对照组低(P < 0.01),针刺预处理脑缺血前和脑缺血后组比较无统计学差异(P > 0.05),且单纯对照组与针刺预处理脑缺血前组间比较差异无统计学意义(P > 0.05,图 4)。
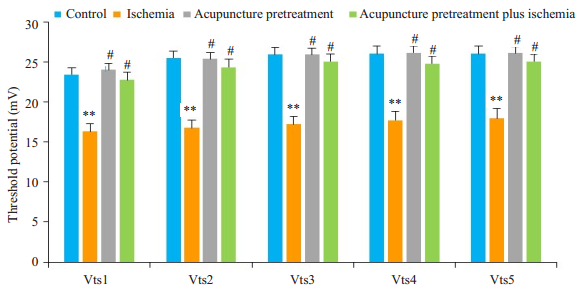
|
图 4 各组大鼠浦肯野细胞动作电位阈电位比较 Figure 4 Comparison of the threshold potential of the sequential spikes in cerebellar Purkenje cells among control, ischemia, acupuncture pretreatment, and acupuncture pretreatment plus ischemia groups (Mean±SD, n=12). **P < 0.01, #P > 0.05. |
脑缺血性损伤模型较多,包括整体动物模型和离体模型。以往在对脑片和神经细胞培养的缺血性研究中,大多采用无氧/糖ACSF灌流[19],这是一种较为理想化的实验模型,并不完全符合在体缺血性脑中风的特点。本实验采用减慢脑片灌流速度的脑缺血模型,模拟在体缺血性脑中风过程中的动脉阻塞和侧支循环,该模型已在前期实验中广泛应用,并已得到认可[6, 9-10]。本文以大鼠小脑浦肯野细胞为研究对象,重点研究针刺预处理特定穴位对浦肯野细胞动作电位发放的影响。通过比较各组细胞动作电位相关指标的变化,我们可以得出结论:针刺预处理百会穴+双侧足三里穴能显著改善由脑缺血导致的浦肯野细胞动作电位发放的变化,减轻兴奋神经毒性损伤,表明针刺预处理对小脑缺血性损伤具有一定的保护作用[6-7, 17]。
ISI、SDST和阈电位被认为是神经细胞动作电位的重要表现形式。ISI表示长时程刺激细胞产生序列动作电位中相邻两个动作电位峰顶点间的距离,代表动作电位的发放能力,ISI值降低表示在相同刺激强度和时间下,动作电位发放个数增加,即细胞兴奋性增加。SDST表示在多次相同刺激下动作电位发放的精确性,即动作电位发放的稳定性,SDST值变大表明神经细胞动作电位发放的稳定性变差。阈电位表示从静息状态到动作电位发放起始点间的电位差,代表动作电位发放的能障,它能更好的显示输入信号是如何驱动神经元激发动作电位产生的。阈电位降低,表明神经细胞更容易达到诱发动作电位的阈值,即动作电位更容易发放,细胞兴奋性增加。在实验中我们发现脑缺血后,大鼠小脑浦肯野细胞发放动作电位的ISI明显降低,SDST显著增加,阈电位降低(P < 0.01),表明脑缺血使得浦肯野细胞过度兴奋,动作电位发放的稳定性降低;而针刺预处理百会穴+双侧足三里穴后缺血浦肯野细胞发放动作电位的ISI、SDST及阈电位与正常对照组比较无统计学差异(P > 0.05),表明针刺预处理特定穴位能预防脑缺血诱导的动作电位各项指标的损伤性变化,从而避免了浦肯野细胞的过度兴奋,并使其缺血后动作电位的发放稳定。
动作电位发放由电压门控性钠通道(VGSC)动力学控制[13-14]。脑缺血时能量生成减少,胞内钙离子大量增加,引起细胞功能及结构等多方面改变[20]。脑缺血诱导ISI缩短、SDST增加及阈电位降低可能由VGSC的活性增加和胞内钙超载引起。倘若如此,抑制VGSC活性和减轻胞内钙超载将能保护小脑浦肯野细胞的兴奋性损伤。研究表明,阻断钠通道和钙通道对脑缺血有神经保护作用[21],这也支持我们的结果。
百会穴位于头顶正中线与两耳尖连线交点处,是调节大脑功能的重要穴位;足三里穴在膝关节下侧腓骨小头下缘5 mm处。现代医学普遍认为针刺百会穴和足三里穴能够改善脑血管功能,促进脑血管侧支循环建立,改善脑血流,促进脑功能恢复,对中风偏瘫患者大脑皮层中枢生物电活动有良好的调节作用,明显改善中风患者的预后[6-7, 12]。在分子研究方面,针刺特定穴位可通过下调脑缺血诱导的caspase-3,核因子-κB和环氧合酶的表达和上调上皮细胞生长因子的表达来减轻缺血性脑组织的损伤程度[22-23]。因此,针刺预处理可能通过预防神经细胞的坏死和凋亡和促进神经细胞的再生等途径达到预防缺血性脑中风患者中枢神经系统的功能障碍的目的。
本实验研究结果表明,针刺预处理百会穴+双侧足三里穴能够通过改善脑缺血时浦肯野细胞动作电位的发放而减轻兴奋性神经毒性损伤,从而对小脑缺血性损伤发挥一定的保护作用,这也可能是针刺预处理改善缺血性脑损伤的机制之一。
| [1] |
Piccolo G, Tavazzi E, Cavallaro T, et al. Clinico-pathological findings in a patient with progressive cerebellar ataxia, autoimmune polyendocrine syndrome, hepatocellular carcinoma and anti-GAD autoantibodies[J].
J Neurol Sci, 2010, 290(1/2): 148-9.
|
| [2] |
Gao Z, Todorov B, Barrett CF, et al. Cerebellar ataxia by enhanced Ca(V)2.1 currents is alleviated by Ca2+-dependent K+-channel activators in Cacna1a(S218L) mutant mice[J].
J Neurosci, 2012, 32(44): 15533-46.
DOI: 10.1523/JNEUROSCI.2454-12.2012. |
| [3] |
Chonpathompikunlert P, Boonruamkaew PA, Hutamekalin P, et al. The antioxidant and neurochemical activity of Apium graveolens L. and its ameliorative effect on MPTP-induced Parkinson-like symptoms in mice[J].
BMC Complement Altern Med, 2018, 18(1): 103-15.
DOI: 10.1186/s12906-018-2166-0. |
| [4] |
Li Y, Wang Y, Liao C, et al. Longitudinal brain functional connectivity changes of the cortical Motor-Related network in subcortical stroke patients with acupuncture treatment[J].
Neural Plast, 2017, 12(11): 1-9.
|
| [5] |
黄丽, 王春, 赵士弟. 针刺预处理对大鼠小脑浦肯野细胞缺血性损伤的影响[J].
蚌埠医学院学报, 2016, 41(1): 7-9, 15.
|
| [6] |
Huang L, Chen N, Ge M, et al. Ca2+ and acidosis synergistically Lead to the dysfunction of cortical GABAergic neurons during ischemia[J].
Biochem Biophys Res Commun, 2010, 394(3): 709-14.
DOI: 10.1016/j.bbrc.2010.03.056. |
| [7] |
Lu W, Wen B, Zhang FY, et al. Voltage-independent Sodium channels emerge for an expression of activity-induced spontaneous spikes in GABAergic neurons[J].
Mol Brain, 2014, 7(7): 38-56.
|
| [8] |
Huang L, Zhao SD, Lu W, et al. Acidosis-Induced dysfunction of cortical GABAergic neurons through Astrocyte-Related excitotoxicity[J].
PLoS One, 2015, 10(10): 24-42.
|
| [9] |
Zhang SY, Yang ZC, Zhang ZX, et al. Cortical GABAergic neurons and cerebellar Purkinje cells respond to ischemia-pathogenic factors differently[J].
Brain Res, 2011, 1382(3): 291-7.
|
| [10] |
Huang L, Wang C, Ge RJ, et al. Ischemia deteriorates spike encoding at cortical GABAergic neurons and cerebellar Purkinje cells by increasing the intracellular Ca2+[J].
Brain Res Bull, 2017, 131(3): 55-61.
|
| [11] |
Huang L, Wang C, Zhao S, et al. PKC and CaMK-Ⅱ inhibitions synergistically rescue ischemia-induced GABAergic neuron dysfunction[J].
Oncotarget, 2017, 4(4): 1-14.
|
| [12] |
Yeo LL, Tan BY, Yee W, et al. Reperfusion therapies in acute ischemic stroke[J].
Recent Pat CNS Drug Discov, 2015, 10(1): 45-54.
DOI: 10.2174/1574889810666150701142836. |
| [13] |
Ge RJ, Qian H, Chen N, et al. Input-dependent subcellular localization of spike initiation between soma and axon at cortical pyramidal neurons[J].
Mol Brain, 2014, 7(4): 26-38.
|
| [14] |
Sun L, Zhang KL, Li JL, et al. An impairment of cortical GABAergic neurons is involved in alkalosis-induced brain dysfunctions[J].
Biochem Biophys Res Commun, 2012, 419(4): 627-31.
DOI: 10.1016/j.bbrc.2012.02.061. |
| [15] |
Nam MH, Yin CS, Soh KS, et al. Adult neurogenesis and acupuncture stimulation at ST36[J].
Acupunct Meridian Stud, 2011, 4(3): 153-8.
DOI: 10.1016/j.jams.2011.09.001. |
| [16] |
Zhu W, Ye Y, Liu Y, et al. Mechanisms of acupuncture therapy for cerebral ischemia: an evidence-based review of clinical and animal studies on cerebral ischemia[J].
J Neuroimmune Pharmacol, 2017, 12(4): 575-92.
DOI: 10.1007/s11481-017-9747-4. |
| [17] |
Wang WW, Xie CL, Lu L, et al. A systematic review and metaanalysis of Baihui (GV20)-based scalp acupuncture in experimental ischemic stroke[J].
Sci Rep, 2014, 4(2): 3981-91.
|
| [18] |
Hwang IK, Chung JY, Yoo DY, et al. Comparing the effects of acupuncture and electroacupuncture at zusanli and baihui on cell proliferation and neuroblast differentiation in the rat hippocampus[J].
J Vet Med Sci, 2010, 72(3): 279-84.
DOI: 10.1292/jvms.09-0374. |
| [19] |
Yang Z, Chen N, Ge R, et al. Functional compatibility between Purkinje cell axon branches and their target neurons in the cerebellum[J].
Oncotarget, 2017, 8(42): 72424-37.
|
| [20] |
Szalay G, Martinecz B, Lénárt N, et al. Microglia protect against brain injury and their selective elimination dysregulates neuronal network activity after stroke[J].
Nat Commun, 2016, 7(2): 11499-507.
|
| [21] |
O'neill MJ, Hicks CA, Ward MA, et al. LY393615, a novel neuronal Ca2+ and Na+ Channel blocker with neuroprotective effects in models of in vitro and in vivo cerebral ischemia[J].
Brain Res, 2001, 888(1): 138-49.
DOI: 10.1016/S0006-8993(00)03043-2. |
| [22] |
Cheng CY, Lin JG, Tang NY, et al. Electroacupuncture at different frequencies (5 Hz and 25 Hz) ameliorates cerebral ischemiareperfusion injury in rats: possible involvement of p38 MAPKmediated anti-apoptotic signaling pathways[J].
BMC Complement Altern Med, 2015, 15(7): 241-56.
|
| [23] |
秦文熠, 罗勇, 余超. 电针对局灶性脑缺血再灌注大鼠海马内白介素-1β及转录核因子κB抑制蛋白激酶的影响[J].
针刺研究, 2013, 38(4): 271-6.
|
 2018, Vol. 38
2018, Vol. 38

