2. 陆军军医大学大坪医院野战外科研究所//创伤、烧伤与复合伤国家重点实验室第一研究室,重庆 400042;
3. 四川大学华西医院临床药学部,四川 成都 610041
2. Research Institute of Surgery, Daping Hospital, Army Medical University, Chongqing 400042, China;
3. Department of Clinical Pharmacy, West China Hospital, Sichuan University, Chengdu 610041, China
脓毒症是感染、创伤、休克等临床危重症患者常见的并发症之一,具有极高的病死率,且缺乏有效的早期诊断及治疗策略。血管内皮细胞(VEC)作为调控机体稳态及维持循环血液与组织交换平衡的最重要器官,其过度活化及损伤被认为是脓毒症的主要特征之一[1]。脓毒症时革兰阴性菌外膜主要成分脂多糖(LPS)作用于VEC表面病原识别受体TLR4,一是激活NF-κB通路,表达并产生大量粘附分子及趋化因子,引起白细胞的异常激活与聚集,分泌过多细胞因子使VEC持续活化[2-3];二是VEC自身产生过量活性氧(ROS),不能及时被抗氧化酶消除,自由基积聚后进一步加重VEC活化及损伤。最终机体丧失正常的稳态环境,VEC严重功能失调引起全身性微血管渗漏、组织水肿甚至多器官衰竭。胍丁胺是近年来发现具有生物保护效应的活性胺类,其有显著的抗应激、抗抑郁、抗惊厥及抗炎[4-7]等功能。本课题组前期首次发现胍丁胺降低脓毒症小鼠血清中血管内皮损伤指标水平ICAM-1、vWF等,并降低肝肺组织血管通透性[8]。但胍丁胺的保护效应是否通过作用于血管内皮细胞实现尚无相关报道。本实验在离体水平以脂多糖(LPS)刺激人脐静脉内皮细胞株(HUVECs)建立内皮细胞活化及损伤模型,旨在探讨胍丁胺干预对HUVECs活化及损伤的影响,并首次发现胍丁胺对LPS刺激的HUVECs具有保护效应,为深入理解重度炎症反应中内皮细胞活化和损伤的机制及探究新型临床治疗策略提供理论基础。
1 材料和方法 1.1 主要材料胍丁胺酸盐(纯度 > 97%)、LPS(Sigma);RPMI 1640培养液、胎牛血清、胰蛋白酶消化液(Gibco);PDTC、青-链霉素双抗、BCA蛋白浓度试剂盒及RIPA裂解液(强)(碧云天);逆转录及qPCR试剂盒(TaKaRa);兔抗人p65、p-p65、IκBα、p38、p-p38、ERK、p- ERK、β-actin及鼠抗人p- IκBα抗体、SB203580、PD98059及MTT粉末(Santa Cruz);辣根过氧化物酶标记的羊抗兔及羊抗鼠IgG抗体(CST),ECGS(ScienCell)。荧光倒置显微镜(OLYMPS),酶标仪(BioTek)。荧光定量PCR仪(Bio-Rad)。其他试剂均为国产分析纯。
1.2 HUVECs细胞培养HUVECs购于齐氏生物科技有限公司(源于ATCC),培养于含10%胎牛血清、1%双抗、20 ng/mL ECGS及15 U/L肝素的RPMI 1640培养液,置于37 ℃、5% CO2培养箱中,根据细胞状态、密度等定期进行换液、传代,收集对数生长期细胞进行后续实验。
1.3 分组及干预HUVECs生长融合至单层后,随机分为5组:空白对照组(C组):仅含无血清RPMI 1640培养基;模型组(L组):LPS(10 μg/mL)刺激HUVECs;药物治疗组:LPS(10 μg/mL)与胍丁胺(1、0.5、0.25、0.125 mmol/L)共同作用组(L+A1、L+A2、L+A3、L+A4)。处理24 h后,收集上清。选择胍丁胺作用最明显浓度(1 mmol/L)进行实验,分组如下:C组;L组;A组(胍丁胺1 mmol/L);L+ A组,收集1、6及24 h贴壁细胞及上清进行后续检测。抑制剂处理组:PDTC(终浓度10 μmmol/L)、SB203580(终浓度10 μmmol/L)、PD98059(终浓度10 μmmol/L)于LPS作用前1 h加入,作用24 h后收集上清。
1.4 MTT法检测HUVECs细胞增殖活力取对数生长期HUVECs细胞,5×103/孔接种于96孔板,每孔100 μL培养液,贴壁培养12 h,以不同浓度胍丁胺(0.125、0.25、0.5、1、2、4 mmol/L)及上述分组进行处理,设置对照组及空白组,每组设置3个复孔。同样,当LPS(10 μg/mL)刺激HUVECs后,用胍丁胺(0、0.125、0.25、0.5、1 mmol/L)干预检测细胞活力,设置对照组及空白组,每组设置3个复孔。药物作用24 h后,每孔加入5 mg/mL MTT 10 μL,37 ℃孵育4 h后,用酶标仪于490 nm处检测各组细胞的吸光度A490 nm。空白组细胞增殖活力为100%,其他各组细胞增殖活力=[处理组A490/空白组A490]×100%。
1.5 实时荧光定量PCR6孔板每孔接种1×106细胞,干预6 h;弃上清,PBS洗涤细胞后,每孔加1 mL TRIzol完全裂解细胞,氯仿抽提,异丙醇沉淀,离心静置,提取总RNA,紫外分光光度计测定浓度及纯度;应用TaKaRa RR047A试剂盒,逆转录RNA为cDNA;应用TaKaRa RR820A试剂盒进行qPCR定量分析,引物序列见表 1。扩增条件:95 ℃、3 min;95 ℃、10 s,60 ℃、30 s,40个循环。本实验设定β-actin为内参照。引物由大连宝生物工程公司合成,具体序列见表 1。根据得到的Ct值,用2-△Ct法计算基因表达量。
| 表 1 实验用各引物序列与片段大小 Table 1 Sequence of primers for real-time PCR and the length of the products |
6孔板每孔接种1×106细胞,干预24 h;取上清,严格按照ELISA试剂盒(Bio-Rad公司)说明书检测上清液中的sICAM-1、sVCAM-1、sE-selectin及MCP-1。
1.7 细胞核蛋白及胞浆蛋白提取10 cm2培养皿每皿接种1×107细胞,干预24 h。加入预冷的PBS刮下细胞,低速离心收集细胞,加入预冷的细胞浆蛋白提取试剂A及蛋白酶抑制剂(PMSF),涡旋振荡15 s,冰上放置10 min。加入预冷的蛋白提取试剂B,涡旋振荡5 s,4 ℃、12 000 g离心10 min,上清为浆蛋白。沉淀加入细胞核蛋白提取试剂及PMSF,置于冰上30 min,每隔30 s涡旋5 s,4 ℃、12 000 g离心10 min,上清为核蛋白,-20 ℃保存。
1.8 细胞总蛋白提取6孔板每孔接种1×106细胞,干预24 h;PBS洗细胞2次,加入预冷的RIPA(强)裂解液,冰上裂解10 min后,4 ℃、12 000 g离心10 min,取上清,用BCA法进行蛋白定量,根据蛋白浓度,每组取120 μg蛋白,加入5 × loading buffer,煮沸10 min蛋白变性后,置于-80 ℃保存备用。
1.9 Western blotting取上述蛋白样品蛋白经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶分离后,转至PVDF膜上。5%脱脂奶粉(TBST配制)室温封闭1 h后,孵育特异性一抗,即抗p38、p-p38(磷酸化-p38)、p65、p-p65、ERK、p-ERK、JNK、p-JNK、p-IκBα、IκBα、β-actin抗体(1:1000),4 ℃孵育过夜。TBST洗膜4次后用辣根过氧化物酶(HRP)标记的二抗(羊抗鼠、羊抗兔)(1:10 000)室温孵育1 h。TBST洗膜5次,每次5 min,用ECL显影,凝胶成像系统曝光。
1.10 ROS检测6孔板每孔接种1×106细胞,干预24 h;弃培养液,PBS洗2遍后每孔加入400 μL DCFH-DA探针(20 μmol/L),37 ℃避光孵育20 min;PBS洗细胞后,于倒置荧光显微镜及流式细胞仪分析荧光强度,绿色荧光强度与细胞内产生的ROS量呈正比。
1.11 统计学分析各实验均重复3次。各数据均用SPSS 15.0统计软件进行分析,以均数±标准差表示,组间比较行单因素方差分析,以P < 0.05为差异有统计学意义。
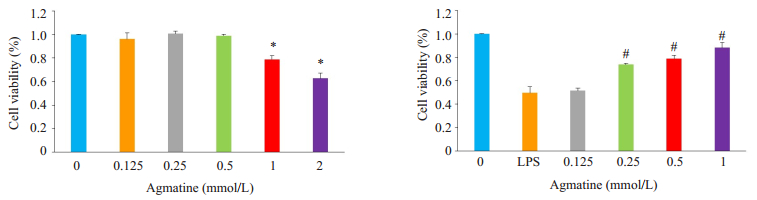
2 结果 2.1 外源性胍丁胺抑制LPS引起的HUVECs活力下降MTT结果显示(图 1A),不同浓度胍丁胺作用HUVECs 24 h后,2 mmol/L与4 mmol/L胍丁胺组HUVECs细胞死亡明显,细胞存活率分别下降至(78.9± 3.2)%和(62.8±4.3)%,与正常组相比有显著差异(P < 0.05);选取1、0.5、0.25、0.125 mmol/L胍丁胺与10 mg/L LPS共同作用24 h,LPS刺激组细胞存活率下降至(53±4.6)%,与对照组相比,差异显著(P < 0.05),而1、0.5、0.25 mmol/L胍丁胺干预组细胞存活率明显上升至(88.3±2.1)%、(78.7±3.1)%、(73.8±3.2)%,并与LPS组比较差异显著(P < 0.05),且存活率与胍丁胺浓度升高呈正相关(P < 0.05)(图 1B)。
|
图 1 MTT法检测胍丁胺对HUVECs活力的影响 Figure 1 Effect of agmatine on the viability of HUVECs (Mean±SD, n=3). *P < 0.05 vs control group; #P < 0.05 vs LPS group. |
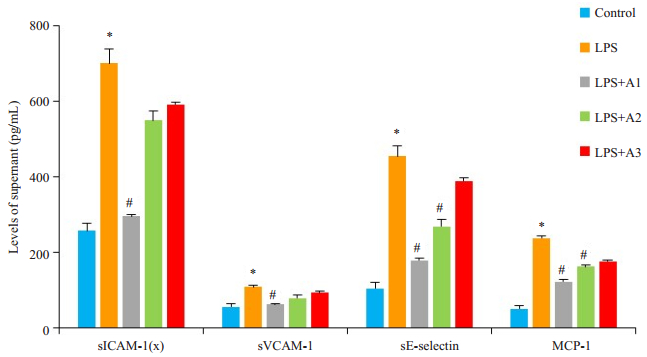
10 μg/mL LPS刺激,胍丁胺(1、0.5、0.25 mmol/L)共同作用24 h(图 2),ELISA法检测细胞上清中可溶性粘附分子及趋化因子水平,对照组因子水平极低,LPS刺激24 h后,各因子水平明显升高(P < 0.05),说明内皮细胞发生活化,胍丁胺干预后上述因子水平降低(P < 0.05),且降低趋势与胍丁胺浓度升高呈正相关。
|
图 2 胍丁胺对LPS诱导的HUVECs分泌粘附分子及趋化因子的影响 Figure 2 Effects of agmatine at different concentrations on LPS-induced expressions of sICAM-1, sVCAM-1, sE-selectin, and MCP-1 in the supernatant of HUVECs determined by ELISA (Mean±SD, n=3). *P < 0.05 vs control group; #P < 0.05 vs LPS group. |
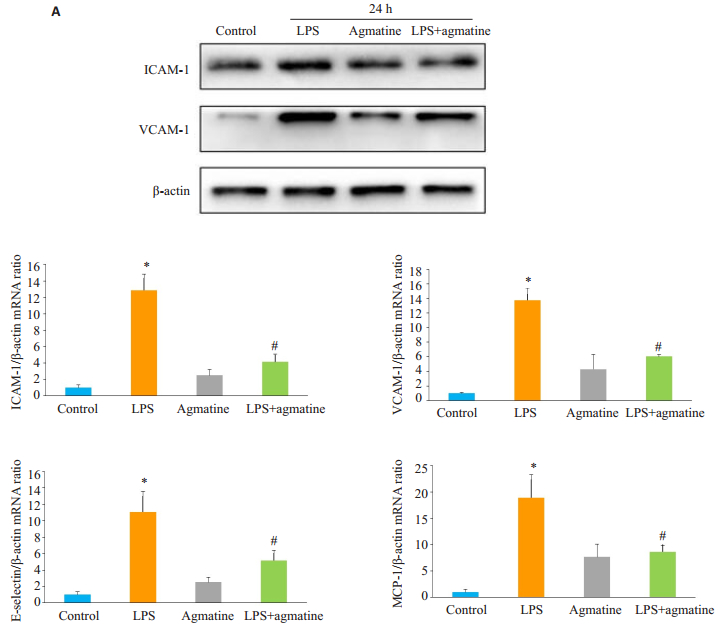
为了检测胍丁胺对粘附分子及趋化因子表达的影响,用10 μg/mL LPS刺激,1 mmol/L胍丁胺干预,Western blotting结果显示LPS组24 h后ICAM- 1及VCAM-1蛋白表达水平明显增加(图 3A),qPCR结果显示细胞表达各粘附分子及MCP-1 mRNA水平明显升高(P < 0.05)(图 3B),胍丁胺干预后上述因子表达水平下调。
|
图 3 胍丁胺抑制LPS诱导ICAM-1、VCAM-1、E-selectin及MCP-1的表达 Figure 3 Effect of agmatine on LPS-induced ICAM- 1 and VCAM-1 protein expressions (A) and mRNA expressions of ICAM-1, VCAM-1, E-selectin and MCP-1 (B) in HUVECs determined by Western blotting and qPCR (Mean±SD, n=3). *P < 0.05 vs control group; #P < 0.05 vs LPS group. |
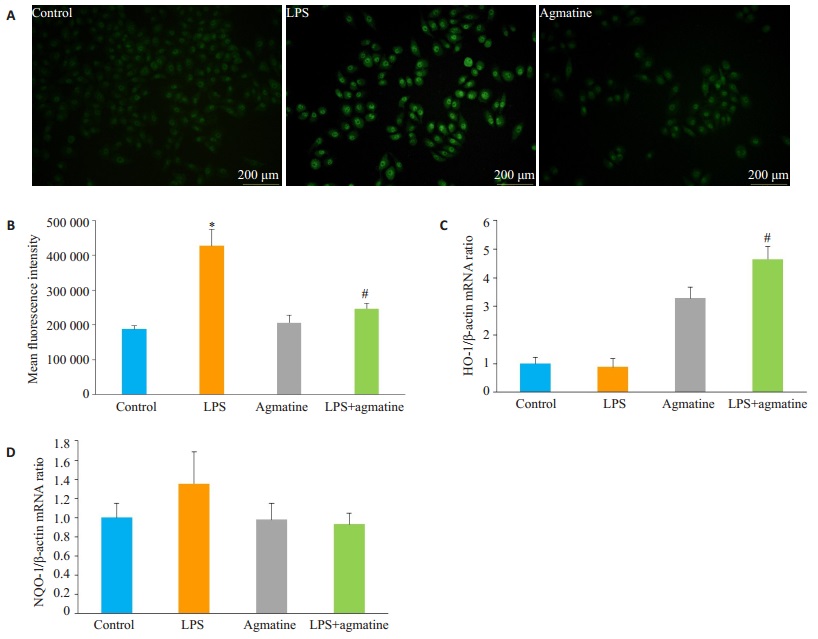
用DCFH-DA探针检测HUVECs细胞内ROS变化情况。免疫荧光结果发现(图 4A),10 mg/L LPS刺激细胞24 h产生大量ROS,提示LPS引起内皮细胞内氧化物堆积,发生损伤;1 mmol/L胍丁胺干预后,荧光明显下降。用流式细胞仪检测细胞平均荧光强度发现,LPS组明显变强(P < 0.05),而胍丁胺干预后下降(P < 0.05)。qRT-PCR检测发现,LPS组HO-1及NQO-1均变化不明显,而胍丁胺干预后HO-1显著上调(P < 0.05),但对NQO-1没有影响。
|
图 4 胍丁胺抑制LPS诱导的HUVECs产生ROS并上调HO-1 mRNA表达 Figure 4 Agmatine inhibits accumulation of reactive oxygen species (ROS) and up-regulates mRNA expression of HO-1 but not NQO- 1 in LPS- induced HUVECs. A: Intracellular ROS detected using DCFH-DA probe at 24 h; B: Expressions of mRNAs of HO-1 and NQO-1 at 6 h detected using qRT-PCR assay. AGM produced no significant effect on NQO-1 mRNA expression in HUVECs (Mean±SD, n=3). *P < 0.05 vs control group; #P < 0.05 vs LPS group. |
10 μmol/L PDTC、10 μmol/L PD98059、10 μmol/L SB203580单独或共同作用于HUVECs 1 h后,给予10 μg/mL LPS刺激24 h,ELISA结果显示LPS组可溶性粘附分子及MCP-1水平显著升高(P < 0.05),而抑制剂组因子水平呈不同程度降低,且p38和ERK1/2通路抑制剂共同作用及PDTC组各因子水平明显下降(P < 0.05)。
2.6 胍丁胺抑制LPS诱导的NF-κB及MAPK信号通路激活LPS作用24 h,细胞核内p65磷酸化明显,细胞浆IκBα磷酸化水平升高,而IκBα蛋白表达受到抑制,提示LPS可能促进p65入核并磷酸化发挥效应,同时LPS促进细胞浆IκBα磷酸化并使IκBα降解增多;胍丁胺干预后核内p65明显下降,细胞浆IκBα表达增加,故胍丁胺有较明显的对抗NF-κB的激活的作用(图 6A)。LPS作用1 h后MAPK信号通路明显激活,表现为p38、ERK1/2及JNK的磷酸化,而胍丁胺干预后主要抑制p38及ERK1/2的磷酸化,对JNK无明显影响(图 6B)。
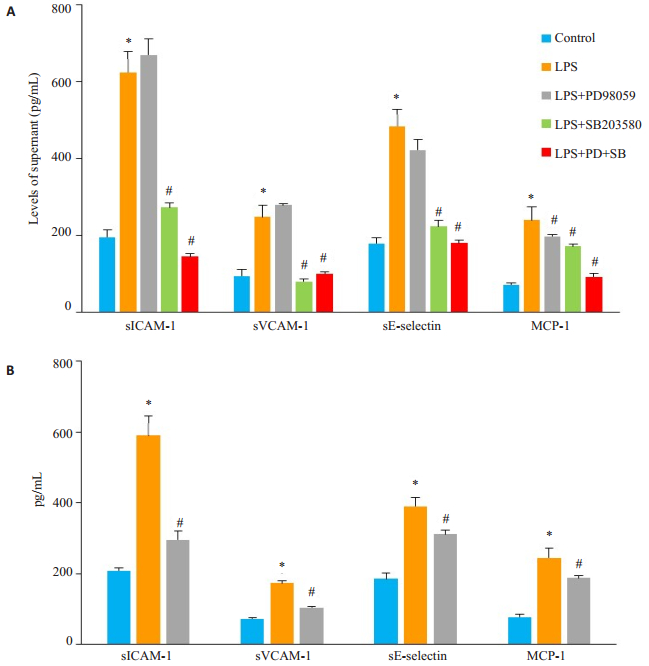
|
图 5 MAPK与NF-κB信号通路抑制剂对LPS诱导的HUVECs分泌粘附分子及趋化因子的影响 Figure 5 Effect of p38 inhibitor (SB203580, 10 μmol/L), ERK1/2 inhibitor (PD98059, 10 μmol/L) and NF-κB inhibitor (PDTC, 10 μmol/L) on secretion of adhesion molecules and chemokines in LPS-induced HUVECs. A: Levels of the molecules detected using ELISA in HUVECs treated with DMSO, PD98059 and/or SB203580 for 1 h before 10 μg/mL LPS stimulation for 24 h; B: Levels of the molecules detected using ELISA in HUVECs treated with PDTC for 1 h before LPS stimulation (Mean±SD, n=3). *P < 0.05 vs control group; #P < 0.05 vs LPS group. |
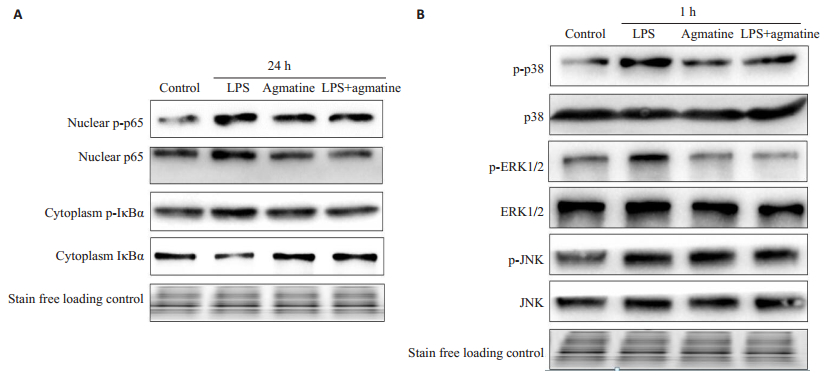
|
图 6 胍丁胺抑制LPS诱导的MAPK及NF-κB信号通路激活 Figure 6 Agmatine inhibits LPS-induced activation of MAPK and NF-κB signaling pathways (n=3). A: The levels of phosphorylated nuclear p65 and cytoplasmic IκBα at 24 h measured with Western blotting; B: The protein expression of MAPK pathway at 1 h measured with Western blotting. The levels of phosphorylated p38 and ERK1/2 decreased after AGM intervention, but JNK expression showed no obvious changes. |
广泛的血管内皮细胞活化及损伤是脓毒症的中心环节,与其致病率和死亡率密切相关[9-10]。目前,VEC过度活化所致的内皮损伤及功能障碍已公认是脓毒症及多器官功能障碍(MODS)的重要特征。脓毒症发生发展过程中,多种介质(如LPS、炎症因子等)刺激VEC活化产生大量粘附分子及趋化因子,白细胞被激活后粘附并穿过内皮迁移至组织,释放大量促炎因子作用于VEC加剧其损伤,引起组织器官衰竭甚至危及生命[11-12]。因此,如何评价内皮细胞活化状态并逆转其损伤状态可能为治疗炎性疾病提供新策略。本研究通过建立LPS活化HUVECs模型,证实了LPS引起内皮细胞活化及损伤,表现为内皮细胞活力下降、产生大量粘附分子及趋化因子、氧化应激增强(细胞内ROS堆积)等。
胍丁胺是精氨酸经线粒体外膜精氨酸脱羧酶催化脱羧生成的活性胺,除对神经、肝、肺、肾等重要器官有保护作用外[13-15],同时具有强大的抗炎作用。Li等[4]发现,胍丁胺降低肺组织表达iNOS同时阻断NF-κB通路,延缓脓毒症小鼠的急性肺损伤;胍丁胺通过抗炎及抗氧化作用缓解大鼠缺血再灌注损伤[16];在LPS诱导的抑郁症动物模型中,胍丁胺同样表现出抗炎及抗氧化作用[17]。但胍丁胺对LPS诱导的内皮细胞活化及损伤的影响尚少见报道。通过实验,我们发现,外源性加入胍丁胺能增强HUVECs细胞活力,且具有一定的浓度依赖性。1 mmol/L胍丁胺对内皮细胞的保护效应最为明显,故在后续实验中选用此浓度。进一步研究发现,胍丁胺下调粘附分子及趋化因子过度表达及分泌,提示胍丁胺抑制内皮细胞活化。
内皮细胞表达过量粘附分子及趋化因子与NF-κB及MAPK信号通路的激活密切相关[3, 18-19]。研究发现,NF-κB p65亚基磷酸化,尤其是536位点处的丝氨酸磷酸化与NF-κB活性升高相关[20],并参与调节下游粘附分子转录水平[21]。本研究通过WB实验发现,LPS作用24 h后胞浆IκBα明显磷酸化,IκBα蛋白表达下调,同时核内p65明显磷酸化。预先使用NF-κB信号通路抑制剂PDTC(抑制IκB磷酸化)作用1 h后sICAM-1、sVCAM-1、sE-selectin和MCP-1分泌减少,说明细胞分泌上述因子受到NF-κB信号通路调控。而胍丁胺逆转LPS的作用效应,即抑制NF-κB信号通路激活并下调粘附分子和MCP-1的分泌及表达,提示其抑制内皮细胞活化可能是通过抑制NF-κB通路的激活实现。报道显示LPS诱导的炎症反应中MAPK上调NF-κB表达[22-23],即MAPK被认为是NF-kB的上游信号分子。我们发现LPS刺激HUVECs 1 h后,3种MAPK家族蛋白ERK1/2、p38及JNK磷酸化,而外源性胍丁胺干预后,ERK1/2和p38磷酸化水平下调,JNK无明显变化。随后,在LPS作用前预先给予p38、ERK1/2抑制剂作用1 h发现,p38抑制剂明显下调粘附分子及趋化因子分泌,而ERK1/2抑制剂作用不明显。我们推测,LPS刺激的HUVECs表达粘附分子主要与p38及NF-κB通路相关,ERK1/2在其中发挥的作用不大,这与前人的研究相一致[24]。因此,我们认为,胍丁胺抑制内皮细胞活化可能部分通过抑制p38磷酸化且抑制下游NF-κB信号通路相关。另有新近研究对此辅证,胍丁胺缓解尼古丁动物模型的内皮损伤[25],提示胍丁胺对血管活化及损伤极具应用价值。
VEC在机体发挥强大的屏障功能,当LPS或炎症因子直接作用于内皮细胞后诱发氧化损伤,引起中间代谢产物ROS在细胞内大量堆积[26],加重脓毒症病情。我们发现,1 mmol/L胍丁胺明显减少LPS诱导的24 h ROS产生并提高细胞活力,提示胍丁胺具有一定的抗氧化能力。进一步探索机制发现胍丁胺促进HO-1的mRNA表达,但对NQO-1无明显影响。血红素氧合酶(HO-1)是机体广泛存在的抗氧化酶[27-28],催化血红素生成的CO、胆绿素及铁均具有抗炎抗氧化效果[29],故HO-1的升高被看作是机体受到刺激后的适应性和保护性反应[30]。HO-1同样可通过抑制NF-κB磷酸化下调炎症因子表达[31]。故我们推断,胍丁胺可能部分通过上调HO-1以减少ROS产生发挥抗炎及抗氧化效应。
综上所述,本研究通过构建LPS诱导的内皮细胞活化及损伤模型,以胍丁胺为治疗策略,于mRNA和蛋白水平上进行机制探究,发现胍丁胺通过抑制NF-κB及MAPK信号通路的激活和减少ROS产生逆转LPS所致的内皮活化及损伤,但具体的分子机制仍有待于进一步探索,且此实验仅局限于细胞实验,仍需在动物模型中进行研究。这一发现可能为有效治疗脓毒症或内毒素休克等全身感染性疾病提供新策略。
| [1] |
Leligdowicz A, Richard-Greenblatt M, Wright J, et al. Endothelial activation: the Ang/tie axis in sepsis[J].
Front Immunol, 2018, 9: 838.
DOI: 10.3389/fimmu.2018.00838. |
| [2] |
Zhao H, Anand AR, Ganju RK. Slit2-Robo4 pathway modulates Lipopolysaccharide-Induced endothelial inflammation and its expression is dysregulated during endotoxemia[J].
J Immunol, 2014, 192(1): 385-93.
DOI: 10.4049/jimmunol.1302021. |
| [3] |
Liao JK. Linking endothelial dysfunction with endothelial cell activation[J].
J Clin Invest, 2013, 123(2): 540-1.
DOI: 10.1172/JCI66843. |
| [4] |
Bahremand T, Payandemehr P, Riazi K, et al. Modulation of the anticonvulsant effect of swim stress by agmatine[J].
Epilepsy Behav, 2018, 78: 142-8.
DOI: 10.1016/j.yebeh.2017.11.005. |
| [5] |
Donertas B, Cengelli UC, Aydin S, et al. Agmatine co-treatment attenuates allodynia and structural abnormalities in cisplatininduced neuropathy in rats[J].
Fundam Clin Pharmacol, 2018, 32(3): 288-96.
DOI: 10.1111/fcp.2018.32.issue-3. |
| [6] |
Li X, Liu Z, Jin H, et al. Agmatine protects against zymosaninduced acute lung injury in mice by inhibiting NF-κB-mediated inflammatory response[J].
Biomed Res Int, 2014, 2014: 583736.
|
| [7] |
Xu W, Gao L, Li T, et al. Neuroprotective role of Agmatine in Neurological Diseases[J].
Curr Neuropharmacol, 2017, 8: 15.
|
| [8] |
杨霞, 朱俊宇, 范霞, 等. 胍丁胺对脓毒症小鼠血管内皮损伤的保护作用[J].
中国中西医结合急救杂志, 2016, 23(2): 182-5.
|
| [9] |
Lee WL, Liles WC. Endothelial activation, dysfunction and permeability during severe infections[J].
Curr Opin Hematol, 2011, 18(3): 191-6.
DOI: 10.1097/MOH.0b013e328345a3d1. |
| [10] |
杨霞, 李香琴, 马晓媛, 等. 脓毒症血管内皮损伤及调节策略的研究进展[J].
中国中西医结合急救杂志, 2016, 23(1): 108-10.
|
| [11] |
Lubkin A, Torres VJ. Bacteria and endothelial cells: a toxic relationship[J].
Curr Opin Microbiol, 2017, 35(58/63): 58-63.
|
| [12] |
Papurica M, Rogobete AF, Sandesc DA, et al. The expression of nuclear transcription factor kappa B (NF-kappa B) in the case of critically ill polytrauma patients with sepsis and its interactions with microRNAs[J].
Biochem Genet, 2016, 54(4): 337-47.
DOI: 10.1007/s10528-016-9727-z. |
| [13] |
Halaris A, Plietz J. Agmatine: metabolic pathway and spectrum of activity in brain[J].
CNS Drugs, 2007, 21(11): 885-900.
DOI: 10.2165/00023210-200721110-00002. |
| [14] |
马晓媛, 田李星, 梁华平. 胍丁胺在创伤/脓毒症及休克中的研究进展[J].
感染、炎症、修复, 2016, 17(2): 114-7.
|
| [15] |
Piletz JE, Aricioglu F, Cheng JT, et al. Agmatine: clinical applications after 100 years in translation[J].
Drug Discov Today, 2013, 18(17/18): 880-93.
|
| [16] |
Turan I, Ozacmak HS, Ozacmak VH, et al. Agmatine attenuates intestinal ischemia and reperfusion injury by reducing oxidative stress and inflammatory reaction in rats[J].
Life Sci, 2017, 189: 23-8.
DOI: 10.1016/j.lfs.2017.08.032. |
| [17] |
Gawali NB, Bulani VD, Chowdhury AA, et al. Agmatine ameliorates lipopolysaccharide induced depressive-like behaviour in mice by targeting the underlying inflammatory and oxido-nitrosative mediators[J].
Pharmacol Biochem Behav, 2016, 149: 1-8.
DOI: 10.1016/j.pbb.2016.07.004. |
| [18] |
Son WR, Nam MH, Hong CO, et al. Plantamajoside from Plantago asiatica modulates human umbilical vein endothelial cell dysfunction by glyceraldehyde-induced AGEs via MAPK/NF-κ B[J].
BMC Complement Altern Med, 2017, 17(1): 66.
DOI: 10.1186/s12906-017-1570-1. |
| [19] |
He H, Guo F, Li Y, et al. Adiporedoxin suppresses endothelial activation via inhibiting MAPK and NF-kappa B signaling[J].
Sci Rep, 2016, 6: 38975.
DOI: 10.1038/srep38975. |
| [20] |
Hoesel B, Schmid JA. The complexity of NF-kappa B signaling in inflammation and cancer[J].
Mol Cancer, 2013, 12: 86.
DOI: 10.1186/1476-4598-12-86. |
| [21] |
Song KH, Park JH, Jo I, et al. Telmisartan attenuates hyperglycemiaexacerbated VCAM-1 expression and monocytes adhesion in TNF alpha-stimulated endothelial cells by inhibiting IKK beta expression[J].
Vascul Pharmacol, 2016, 78: 43-52.
DOI: 10.1016/j.vph.2015.10.001. |
| [22] |
Liu S, Feng G, Wang GL, et al. P38MAPK inhibition attenuates LPS-induced acute lung injury involvement of NF-kappa B pathway[J].
Eur J Pharmacol, 2008, 584(1): 159-65.
DOI: 10.1016/j.ejphar.2008.02.009. |
| [23] |
Gao HW, Liu X, Sun W, et al. Total tanshinones exhibits antiinflammatory effects through blocking TLR4 dimerization via the MyD88 pathway[J].
Cell Death Dis, 2017, 8(8): e3004.
|
| [24] |
Cho YS, Kim CH, Ha TS. Ginsenoside rg2 inhibits lipopolysaccharideinduced adhesion molecule expression in human umbilical vein endothelial cell[J].
Korean J Physiol Cardiol, 2013, 17(2): 133-7.
DOI: 10.4196/kjpp.2013.17.2.133. |
| [25] |
Nader MA, Gamiel NM, El-Kashef H, et al. Effect of agmatine on experimental vascular endothelial dysfunction[J].
Hum Exp Toxicol, 2016, 35(5): 573-82.
DOI: 10.1177/0960327115597311. |
| [26] |
Chen YY, Chen J, Hu JW, et al. Enhancement of lipopolysaccharideinduced toll-like receptor 2 expression and inflammatory cytokine secretion in HUVECs under high glucose conditions[J].
Life Sci, 2013, 92(10): 582-8.
DOI: 10.1016/j.lfs.2013.01.021. |
| [27] |
Lawal AO, Marnewick JL, Ellis EM. Heme oxygenase-1 attenuates cadmium-induced mitochondrial-caspase 3-dependent apoptosis in human hepatoma cell line[J].
BMC Pharmacol Toxicol, 2015, 16(1): 1-13.
DOI: 10.1186/2050-6511-16-1. |
| [28] |
Ooi BK, Goh BH, Yap WH. Oxidative stress in cardiovascular diseases: involvement of Nrf2 antioxidant redox signaling in macrophage foam cells formation[J].
Int J Mol Sci, 2017, 18(11): E2336.
DOI: 10.3390/ijms18112336. |
| [29] |
Calay D, Mason JC. The multifunctional role and therapeutic potential of HO-1 in the vascular endothelium[J].
Antioxid Redox Signal, 2014, 20(11): 1789-809.
DOI: 10.1089/ars.2013.5659. |
| [30] |
Marcantoni E, Di Francesco L, Totani LA, et al. Effects of estrogen on endothelial prostanoid production and cyclooxygenase-2 and heme oxygenase-1 expression[J].
Prostaglandins Other Lipid Mediat, 2012, 98(3/4, SI): 122-8.
|
| [31] |
Dai C, Li B, Zhou Y, et al. Curcumin attenuates quinocetone induced apoptosis and inflammation via the opposite modulation of Nrf2/HO-1 and NF-kB pathway in human hepatocyte L02 cells[J].
Food Chem Toxicoly, 2016, 95: 52-63.
DOI: 10.1016/j.fct.2016.06.025. |
 2018, Vol. 38
2018, Vol. 38

