白癜风是皮肤科临床常见的色素障碍性疾病,目前病因尚不明确,较难治愈,探索其有效、副作用小的治疗方法一直是本学科的热点问题。根据多年的临床经验,我们将白癜风进展期发病关键因素归纳为“风”、“瘀”[1],并拟疏风活血方:苍耳子10 g,紫背浮萍10 g,蝉蜕6 g,丹参10 g、丹皮10 g、白蒺藜10 g,且在前期对疏风活血方的疗效进行了验证,研究显示疏风活血颗粒联合西药组有效率优于西药组[2],证实疏风活血方临床治疗白癜风有效。自噬是一种广泛存在于真核生物代谢中的过程,自噬的过度活跃或缺乏均可能与多种疾病相关,近年来研究表明,色素障碍性皮肤病、银屑病、黑素瘤等多种皮肤病中均可观察到自噬上调或下调的现象[3-5]。自噬在黑素代谢中作用的研究逐渐成为本学科的热点[6],但未见中药调节黑素代谢与自噬调节黑素代谢相关性的研究。本研究观察了疏风活血方及自噬诱导剂雷帕霉素对体外培养的鼠B16黑素瘤细胞增殖及黑素代谢的影响,并检测了各组对自噬相关蛋白LC3B、Beclin1、P62、p-mTOR的作用,首次探索疏风活血方临床治疗白癜风有效的机理,以期为中医药调节黑素代谢提供新的实验基础和科学依据。
1 材料和方法 1.1 试剂和材料中药颗粒剂:疏风活血方组方(苍耳子10 g,紫背浮萍10 g,蝉蜕6 g,丹参10 g、丹皮10 g、白蒺藜10 g),所有中药颗粒剂均购自南方医科大学南方医院中药房,每种中药颗粒剂生产厂家明确,同一批号;Olympus倒置显微镜;胎牛血清(四季青)、F12培养基(Gbico);胰蛋白酶、L-DOPA(sigma);Anti-LC3B、Anti-Beclin1、AntiP62、Anti- mTOR- phospho(abcam);紫外分光光度仪(PerkinelmerLambda25)、1/10万电子天平(德国赛多利斯CP225D);超纯水;MTT;RIAP裂解液(碧云天);ECL试剂盒(Abbkine)其他试剂为国产分析纯。
1.2 疏风活血方的制备选用疏风活血方颗粒剂:苍耳子10 g,紫背浮萍10 g,蝉蜕6 g,丹参10 g、丹皮10 g、白蒺藜10 g,将各种药物颗粒剂按比例溶于蒸馏水中,使终浓度为1 g/mL,搅拌30 min,超声溶解1 h,离心去除辅助添加剂,-4 ℃冰箱避光保存备用。
1.3 鼠B16黑素瘤细胞的培养F12培养基加10%胎牛血清,37 ℃,5% CO2条件下培养。
1.4 实验分组预实验选取疏风活血方0.001、0.01、0.1、1、10mg/mL 5个浓度组检测对B16细胞增值率的影响,使用SPSS回归法处理数据,得出IC50=1.955,保留两位小数取IC50= 1.96。根据IC50结果将疏风活血方各组浓度确定为1/ 16 IC50、1/8 IC50、1/4 IC50、1/2 IC50及IC50即为0.12、0.25、0.49、0.98、1.96 mg/mL;自噬诱导剂雷帕霉素组选取工作浓度,2倍工作浓度、4倍工作浓度,分别为50 nmol/L、100 nmol/L、200 nmol/L;自噬诱导剂加疏风活血方组根据雷帕霉素细胞增殖实验结果,选取50 nmol/L雷帕霉素预处理1 h后,加入各浓度疏风活血方,对照组使用不加入药物的纯培养基,每一处理因素重复测定3次。
1.5 细胞增殖率检测细胞培养至对数生长期后,计数为3000/孔,铺于96孔板,24 h后弃原培养基,S组加入含不同浓度疏风活血方的培养基;RS组使用50 nmol/L雷帕霉素预处理1 h,去除培养基,加入含不同浓度疏风活血方培养液;C组加入完全培养基。均于作用48 h后,加入MTT处理4 h后检测结果,并在490 nm波长测吸光度值。细胞增殖率=含药处理组A490/空白对照组A490×100%。
1.6 酪氨酸酶活性检测根据各组细胞增值率结果选取相应浓度,将细胞浓度调整为2×105/mL的B16细胞悬液按每孔1 mL接种于6孔培养板,置37 ℃、5% CO2培养箱中培养24 h待细胞贴壁,弃培养液,S组加入含不同浓度疏风活血方的培养基;RS组使用50 nmol/L雷帕霉素预处理1 h,去除培养基,加入含不同浓度疏风活血方培养液;C组加入空白培养基2 mL。均于48 h后,弃上清液,PBS洗1次,冰上操作配制蛋白抽提液;用0.05%胰酶/0.004% EDTA消化6孔板中细胞,终止消化后收集在EP管中离心,弃上清,每孔加入100 μL 0.1%L-DOPA溶液;37 ℃避光孵育15 min后在酶标仪中测定490 nm波长吸光度。酪氨酸酶活性计算公式如下:相对酪氨酸酶活性(%)=[药物处理组A490/空白对照组A490×100]。
1.7 黑素含量检测根据各组细胞增值率结果选取相应浓度,将细胞浓度调整为2×105/mL的B16细胞悬液按每孔1 mL接种于6孔培养板,置37 ℃、5% CO2培养箱中培养24 h待细胞贴壁,弃培养液,S组加入含不同浓度疏风活血方的培养基;RS组使用50 nmol/L雷帕霉素预处理1 h,去除培养基,加入含不同浓度疏风活血方培养液;C组加入空白培养基2 mL。培养48 h后,倾去培养液,PBS洗涤1次,冰上裂解30 min,弃上清,沉淀加入含10% DMSO的NaOH 150 μL,在80 ℃水浴保温2 h,酶标仪450 nm波长下测吸光度值,即A450值。
1.8 Western blot检测自噬相关蛋白选取酪氨酸酶活性及黑素含量最高的疏风活血方组,即促进黑素合成的最佳浓度组0.98 mg/mL组为待测疏风活血方组,及50 nmol/L雷帕霉素+0.98 mg/mL疏风活血方组、50 nmol/L雷帕霉素组、空白对照组检测自噬相关蛋白含量。各组细胞培养48 h后分别收集各组总蛋白,98 ℃煮沸变性,进行凝胶电泳,并电转印至PVDF膜(恒流200 mv,转膜时间120 min),于常温下,非磷酸化蛋白使用5%脱脂奶粉封闭1 h,磷酸化蛋白使用5% BSA(牛血清白蛋白)封闭1 h,分别加入LC3B、Beclin1、P62、p-mTOR单克隆抗体,4 ℃恒温过夜,TBST洗膜15 min×3次,二抗室温孵育1 h,再使用TBST洗膜15 min×3次,加入显影液曝光,采用Image Lab凝胶成像分析系统进行灰度扫描并进行灰度值分析。
1.9 统计学方法数据用SPSS20.0统计软件处理。以均数±标准差描述,组间比较采用单因素方差分析检验,P < 0.05为差异有统计学意义。
2 结果 2.1 疏风活血方及雷帕霉素对鼠B16黑素瘤细胞增值率的影响经统计学比较显示,中高浓度(>0.12 mg/mL)的S组及RS组与空白对照组相比,对B16细胞呈浓度依赖的抑制作用(P < 0.05),RS组与同浓度S组相比,在高浓度(>0.49 mg/mL)增值率更低,但此差异无统计学意义(P>0.05);R组各浓度对B16细胞呈抑制作用(P < 0.05),各浓度间细胞增值率无差异(P>0.05,表 1)。
| 表 1 不同浓度疏风活血方及雷帕霉素对鼠B16黑素瘤细胞增值率的影响 Table 1 Effect of Shufeng Huoxue Fumula and rapamycin at different concentrations on proliferation of B16 melanoma cells (Mean±SD, n=3) |
经统计学比较,各浓度S组及RS组与空白对照组相比,对B16细胞酪氨酸酶活性呈激活作用(P < 0.05),两组同浓度相比,激活率无统计学意义(P>0.05);R组对B16细胞酪氨酸酶活性亦呈激活作用(P < 0.05,表 2)。
| 表 2 不同浓度疏风活血方及雷帕霉素对鼠B16黑素瘤细胞酪氨酸酶活性的影响 Table 2 Effect of different concentrations of Shufeng Huoxue Fumula at and rapamycin on tyrosinase activity in B16 melanoma cells (Mean±SD, n=3) |
与空白对照组相比,各浓度S组、高浓度RS组(>0.49 mg/mL)对B16细胞黑素含量呈促进作用(P < 0.05),而两组同浓度相比无统计学意义(P>0.05);R组对B16细胞黑素含量亦呈促进作用(P < 0.05,表 3)。
| 表 3 不同浓度疏风活血方及雷帕霉素对鼠B16黑素瘤细胞黑素合成的影响 Table 3 Effect of different concentrations of Shufeng Huoxue Fumula and rapamycin on melanin content in B16 melanoma cells (Mean±SD, n=3) |
Western blot检测结果(图 1)显示,与空白对照组相比,S0.98、RS0.98及Rap50组的P62、p-mTOR蛋白含量水平均有所下降,其中RS0.98及Rap50组下降比率高于S0.98组;各组Beclin1和LC3B蛋白含量相对水平均有所增加,其中Rap50组增加最为明显,S0.98组增加最少,使用雷帕霉素预处理1 h后,再使用0.98 mg/mL疏风活血方干预(RS0.98),两蛋白表达量较S0.98组均上调。
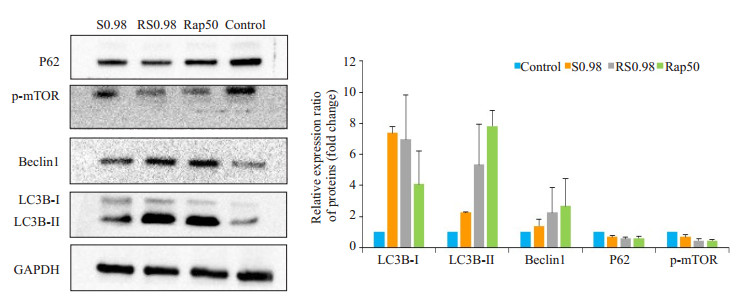
|
图 1 Western blotting检测自噬相关蛋白在各组中的表达 Figure 1 Western blotting for detecting autophagy-related protein expressions in the different groups |
本研究中我们的初步研究结果显示,疏风活血方能通过激活酪氨酸酶活性促进黑素合成,结合近年来对自噬与黑素代谢的研究,我们提出假设:疏风活血方可能通过自噬途径调节黑素代谢。
自噬是一种广泛存在于真核生物中的代谢过程,mTOR(哺乳动物雷帕霉素靶蛋白)是自噬三条通路PI3K-1/Akt、MAPK/Erk1/2、p53/Genotoxic的连接点,也是重要的调定点。雷帕霉素是mTOR的变构抑制剂,mTOR受到抑制时,磷酸化mTOR(p-mTOR)蛋白减少,可激活自噬,其通路下游Beclin1、LC3II蛋白表达上调,而其上游的P62蛋白含量减少。Beclin1在自噬体形成早期发挥重要作用[7];LC3II蛋白是自噬体的标志分子,随自噬体膜的增多而增多[8];P62是自噬体与底物之间的适配蛋白[9],当自噬抑制时P62在细胞内蓄积,自噬激活时,P62随自噬过程降解,其含量下降[10];p-mTOR含量反应了mTOR的活性。此四种蛋白是最常用于自噬检测的标志物。近年来研究认为[11-13],自噬在黑素调节中亦起着重要的作用,自噬通路的激活或抑制能够引起黑素调节通路中重要的靶蛋白MITF(小眼畸形相关因子)、TYR(酪氨酸酶)等的改变;多个研究报道自噬激活剂雷帕霉素对MITF、TYR有上调作用[11, 14-15]。自噬除能影响黑素细胞的黑素合成,也能在黑素细胞的增殖[16-18]、黑素降解[19-20]中起到作用,Atg(自噬相关基因)家族还可能影响黑素转运的过程[21],可能从各个途径影响黑素代谢。
为初步探索疏风活血方促进黑素合成与自噬途径的关系,我们使用上述对黑素合成有明确作用的自噬诱导剂雷帕霉素作为阳性对照组,观察其对B16黑素瘤细胞的作用,并处理细胞诱导自噬,这是报道中常用的诱导自噬的方式[15-22],且加入疏风活血方作用于诱导后细胞,结果显示自噬诱导后各浓度疏风活血方对B16细胞增殖的抑制作用进一步降低(P>0.05),而酪氨酸酶活性及黑素含量并未继续升高,而是与同浓度单纯疏风活血方组含量相当(P>0.05),可能与自噬诱导后B16细胞增殖被进一步抑制,细胞数量减少,而导致总酪氨酸酶活性与总黑素含量未增加有关。为进一步确定疏风活血方调节黑素代谢与自噬的关系,我们选取酪氨酸酶活性及黑素含量最高的疏风活血方组,即促进黑素合成的最佳浓度组0.98 mg/mL组为待测疏风活血方组,以及同浓度的自噬诱导预处理组、50 nmol/L雷帕霉素组、空白对照组,使用Western Blot法测定四组中自噬相关蛋白P62、p-mTOR、Beclin1、LC3B的表达量,结果显示与空白对照组相比,疏风活血方组、同浓度疏风活血方自噬诱导组以及雷帕霉素组的P62、p-mTOR蛋白含量水平均有所下降,Beclin1、LC3B-Ⅱ蛋白含量有所上升,其中雷帕霉素组作为mTOR抑制剂,下调P62、p-mTOR及上调Beclin1、LC3B-Ⅱ的作用均最强;自噬诱导后再加入疏风活血方处理与单独使用疏风活血方相比,下调P62、p-mTOR及上调Beclin1、LC3B-Ⅱ的作用增强,说明疏风活血方与自噬诱导剂对自噬相关蛋白的调节有协同作用。
近年来自噬通路调节黑素代谢的研究报道结论不一,Cao等[23]报道通过抑制TSC(结节性硬化症)蛋白TSC1、TSC2可激活mTORC1使自噬活性降低,并下调MITF表达量,减少黑素含量,且雷帕霉素能够翻转这种抑制作用,而mTORCl/2抑制剂Torin-1则未能恢复被减少的MITF及黑素含量;聂等[24]报道电镜观察正常组(HI)、节段型白癜风(SV)和非节段型白癜风(GV)人群皮肤培养的黑素细胞,HI及SV组黑素细胞存在自噬现象而GV未见,认为自噬可能与白癜风发病与分型相关。有报道认为LC3表达下调或敲除Atg7,自噬抑制时可降低黑素含量[14-16];但也见研究显示激活自噬能够引起黑素含量下降[11-12, 25]。自噬途径与黑素代谢关系的研究尚处初始阶段,研究结果相左可能与选择的研究模型、自噬上游通路、自噬诱导剂与抑制剂的不同等相关,其与黑素代谢的关系值得进一步研究。
本研究使用不同浓度疏风活血方及阳性对照自噬诱导剂雷帕霉素作用于鼠B16黑素瘤细胞,分析疏风活血方及自噬诱导剂对细胞增殖及黑素代谢的作用,首先证明疏风活血方可促进酪氨酸酶活性并促进黑素合成,是疏风活血方临床治疗白癜风有效的基本机制;并可下调自噬相关蛋白P62、p-mTOR及上调Beclin1、LC3B-Ⅱ,可能通过诱导自噬促进黑素合成,为下一步实验提供了基础。而疏风活血方对自噬及黑素合成通路中各蛋白的作用如何,需在后续实验中进一步阐明。
| [1] |
邓燕, 杨柳. 杨柳论治白癜风经验介绍[J].
广州中医药大学学报, 2013, 30(3): 419-420, 423.
|
| [2] |
邓燕, 杨柳, 张明明, 等. 复色1号联合方案治疗进展期白癫风疗效观察[J].
新中医, 2013, 45(6): 67-8.
|
| [3] |
Ma XH, Piao S, Wang D, et al. Measurements of tumor cell autophagy predict invasiveness, resistance to chemotherapy, and survival in melanoma[J].
Clin Cancer Res, 2011, 17(10): 3478-89.
DOI: 10.1158/1078-0432.CCR-10-2372. |
| [4] |
Mahil SK, Twelves S, Farkas K, et al. AP1S3 mutations cause skin autoinflammation by disrupting keratinocyte autophagy and UpRegulating IL-36 production[J].
J Invest Dermatol, 2016, 136(11): 2251-9.
DOI: 10.1016/j.jid.2016.06.618. |
| [5] |
Ryabaya OO, Inshakov AN, Egorova AV, et al. Autophagy inhibitors chloroquine and LY294002 enhance temozolomide cytotoxicity on cutaneous melanoma cell lines in vitro[J].
Anticancer Drugs, 2017, 28(3): 307-15.
DOI: 10.1097/CAD.0000000000000463. |
| [6] |
耿忆薇, 傅楷励, 王亚兰, 等. 黑素细胞自噬研究新进展[J].
新中医, 2017(6): 152-4.
|
| [7] |
Backer JM. The regulation and function of Class Ⅲ PI3Ks: novel roles for Vps34[J].
Biochem J, 2008, 410(1): 1-17.
|
| [8] |
Dancourt J, Melia TJ. Lipidation of the autophagy proteins LC3 and GABARAP is a membrane-curvature dependent process[J].
Autophagy, 2014, 10(8): 1470-1.
DOI: 10.4161/auto.29468. |
| [9] |
赵萍萍, 要乐, 蔚丹丹, 等. p62蛋白功能及相关信号通路研究[J].
生命科学, 2018, 30(1): 1-7.
DOI: 10.3785/j.issn.1008-9209.2017.06.281. |
| [10] |
Komatsu M, Kurokawa H, Waguri S, et al. The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1[J].
Nat Cell Biol, 2010, 12(3): 213-23.
|
| [11] |
Lee KW, Ryu HW, Oh SS, et al. Depigmentation of α-melanocytestimulating hormone-treated melanoma cells by β-mangostin is mediated by selective autophagy[J].
Exp Dermatol, 2017, 26(7): 585-91.
DOI: 10.1111/exd.2017.26.issue-7. |
| [12] |
Kim ES, Jo YK, Park SJ, et al. ARP101 inhibits α-MSH-stimulated melanogenesis by regulation of autophagy in melanocytes[J].
FEBS Lett, 2013, 587(24): 3955-60.
DOI: 10.1016/j.febslet.2013.10.027. |
| [13] |
Tsao YT, Huang YF, Kuo CY, et al. Hinokitiol inhibits melanogenesis via AKT/mTOR signaling in B16F10 mouse melanoma cells[J].
Int J Mol Sci, 2016, 17(2): 248.
DOI: 10.3390/ijms17020248. |
| [14] |
Yun WJ, Kim EY, Park JE, et al. Microtubule-associated protein light chain 3 is involved in melanogenesis via regulation of MITF expression in melanocytes[J].
Sci Rep, 2016, 6(3): 19914.
|
| [15] |
Zhang CF, Gruber F, Ni C, et al. Suppression of autophagy dysregulates the antioxidant response and causes premature senescence of melanocytes[J].
J Invest Dermatol, 2015, 135(5): 1348-57.
DOI: 10.1038/jid.2014.439. |
| [16] |
Gong Q, Li X, Sun J, et al. The effects of calcipotriol on the dendritic morphology of human melanocytes under oxidative stress and a possible mechanism: is it a mitochondrial Protector?[J].
J Dermatol Sci, 2015, 77(2): 117-24.
DOI: 10.1016/j.jdermsci.2014.12.006. |
| [17] |
Sasaki M, Kondo M, Sato K, et al. Rhododendrol, a depigmentationinducing phenolic compound, exerts melanocyte cytotoxicity via a tyrosinase- dependent mechanism[J].
Pigment Cell Melanoma Res, 2014, 27(5): 754-63.
DOI: 10.1111/pcmr.2014.27.issue-5. |
| [18] |
Abe Y, Okamura K, Kawaguchi M, et al. Rhododenol- induced leukoderma in a mouse model mimicking Japanese skin[J].
J Dermatol Sci, 2016, 81(1): 35-43.
DOI: 10.1016/j.jdermsci.2015.10.011. |
| [19] |
Murase D, Hachiya A, Fullenkamp R, et al. Variation in Hsp70-1A expression contributes to skin color diversity[J].
J Invest Dermatol, 2016, 136(8): 1681-91.
DOI: 10.1016/j.jid.2016.03.038. |
| [20] |
Murase D, Hachiya A, Takano K, et al. Autophagy has a significant role in determining skin color by regulating melanosome degradation in keratinocytes[J].
J Invest Dermatol, 2013, 133(10): 2416-24.
DOI: 10.1038/jid.2013.165. |
| [21] |
Ni C, Narzt MS, Nagelreiter IM, et al. Autophagy deficient melanocytes display a senescence associated secretory phenotype that includes oxidized lipid mediators[J].
Int J Biochem Cell Biol, 2016, 81(Pt B): 375-82.
|
| [22] |
Sahan-Firat S, Temiz-Resitoglu M, Guden DS, et al. Protection by mTOR inhibition on Zymosan-induced systemic inflammatory response and oxidative/nitrosative stress: contribution of mTOR/ MEK1/ERK1/2/IKKβ/IκB-α/NF-κB signalling pathway[J].
Inflammation, 2018, 41(1): 276-98.
DOI: 10.1007/s10753-017-0686-2. |
| [23] |
Cao J, Tyburczy ME, Moss J, et al. Tuberous sclerosis complex inactivation disrupts melanogenesis via mTORC1 activation[J].
J Clin Invest, 2017, 127(1): 349-64.
|
| [24] |
聂慧琼, 王平, 张小燕, 等. 不同类型白癜风基因谱表达差异的初步研究[J].
安徽医科大学学报, 2016(5): 707-11.
|
 2018, Vol. 38
2018, Vol. 38

