2. 蚌埠医学院 基础医学院,安徽 蚌埠 233000;
3. 安徽省感染与免疫重点实验室,安徽 蚌埠 233000;
4. 山西医科大学基础医学院生理系,山西 太原 030000
2. College of Basic Medical Sciences, Bengbu Medical College, Bengbu 233000, China;
3. Key Lab of Infection and Immunology of Anhui Province, Bengbu 233000, China;
4. Department of Physiology, College of Basic Medical College, Shanxin Medical University, Taiyuan 030000, China
脓毒症(Sepsis)作为世界范围内难以彻底攻克的临床疾病之一,是由机体感染病原微生物而形成的全身炎性反应综合征(SIRS),病情危重时还可能会导致多器官功能障碍综合征(MODS)的发生,是临床上有严重疾病的患者(如多发性创伤、重度烧伤患者等)主要死因之一[1]。在脓毒症的整个发病过程中,过度的炎症反应所诱导的促炎因子的大量释放起到最为重要的作用[2-3]。因此,抑制过度炎症反应在整个脓毒症的治疗过程中显得尤为重要。
流行病学以及大量实验研究的证据表明寄生虫感染(特别是蠕虫感染)可通过分泌多种虫源性蛋白下调宿主对寄生虫的特异性免疫攻击,从而减弱过度的炎性反应[4],形成利于其寄生的微环境[5]。在这些虫源性蛋白中,来自不同蠕虫的半胱氨酸蛋白酶抑制剂已经被证明可调控宿主的免疫反应,从而使蠕虫逃避宿主的免疫攻击,主要机制是通过干扰抗原加工和递呈、T细胞反应、细胞因子和一氧化氮(NO)的分泌等发挥免疫调节作用[6-8]。本研究选用的日本血吸虫半胱氨酸蛋白酶抑制剂(SjCystatin),前期已有体外实验证实其可显著抑制脂多糖(LPS)刺激的巨噬细胞释放如TNF-α、IL-6和IL-1β等促炎性细胞因子[9],这表明SjCystatin可直接抑制被LPS激活的巨噬细胞[10]。而LPS与巨噬细胞上的TLR4受体结合,引起的促炎因子大量释放则是脓毒症早期过度炎症反应的关键因素[11-13]。但SjCystatin在体内实验中究竟能否调节脓毒症的过度炎症反应尚未有报道。因此,本实验通过给BALB/c小鼠体内腹腔注射脂多糖来制备脓毒症模型,建模后用SjCystatin进行干预,观察其干预效果,并且进一步探讨其作用机制,为以后科学研究及临床治疗提供实验基础及理论依据。
1 材料和方法 1.1 实验材料 1.1.1 实验动物实验所需动物选雄性BALB/c小鼠,约6~8周龄,体质量20~22 g(清洁级,蚌埠医学院实验动物中心,动物伦理批准文号LAEC-2014-039)。
1.2 主要试剂与仪器实验所需脂多糖LPS(索莱宝),ELISA试剂盒(达科为),酶标仪Model 550(BIO-Rad),GST标签蛋白纯化剂盒(BD),全自动生化分析仪(Beckman Coulter),组织切片机(Leica),内毒素去除试剂盒(Thermo Scientific)。
1.3 实验方法 1.3.1 重组Sj-Cys蛋白的表达和提纯重组质粒由武汉大学医学院何立教授惠赠,将重组质粒经钙转染法转化大肠杆菌BL21/DE3后,经IPTG(终浓度为0.8 mmol/L)30 ℃诱导4 h。收集细菌,按照试剂盒操作说明书利用GST标签蛋白纯化剂盒进行纯化,并依次经凝血酶酶切、SDS-PAGE鉴定纯化效果后,去除纯化蛋白内毒素,BCA法测定蛋白浓度后分装冻存于-80 ℃备用。利用氨基酸测序仪进行测序,测定参数如下:样品总量为1560 pmol;样品偶联方法为Edman降解;上样量为1560 pmol;PTH标准数为20;循环数为23;起始收率60%;重复收率96.4%;理论相对分子质量为11 300 D。
1.3.2 实验小鼠的分组采购雄性BALB/c小鼠(清洁级),实验室适应性饲养1周后,取54只健康个体随机分为3组,即正常对照组(PBS组,A组)、脓毒症造模组(PBS + LPS组,B组)、蛋白干预组(PBS + LPS + SjCystatin组,C组)。A组腹腔注射PBS(100 μL/只),B组、C组腹腔注射PBS+LPS(100 μL/只),其中C组小鼠于注射LPS后30 min腹腔注射含25 μg SjCystatin蛋白的PBS(100 μL/只)。各实验组随机抽取10只小鼠,术后24 h取小鼠血清,ELISA检测TNF-α、IL-6、IL-10水平,全自动生化分析仪检测ALT、AST、BUN和Cr水平,取小鼠肺、肝和肾组织制备病理切片并观察组织病变;各实验组剩下8只小鼠,造模成功后,观察并记录小鼠72 h生存率和一般状态的改变。
1.3.3 LPS小鼠脓毒症模型的建立实验前小鼠无需禁食禁水,记录每只小鼠体质量。以每千克小鼠注射10 mg LPS的换算关系精确计算每只小鼠注射LPS的量,且用缓冲液PBS100 μL稀释,用1 mL注射器吸取已稀释的LPS液体,缓缓注入小鼠腹腔。其中治疗组(C组)小鼠在建模后0.5 h腹腔注射含25 μg SjCystatin蛋白的PBS(100 μL/只),B组腹腔注射PBS(100 μL/只)。
1.4 标本的采集及检测方法 1.4.1 检测小鼠血清中细胞因子的变化将小鼠麻醉后摘眼球取血,常温静置40 min后,3000 r/min,离心时间20 min,收集上层血清,保存于-80 ℃冰箱。ELISA检测血清细胞因子A值,绘制标准曲线计算各组小鼠血清中TNF-α、IL-6、IL-10水平。1.4.2检测小鼠肝、肾功能取已收集小鼠血清,全自动生化分析仪检测各组小鼠血清中ALT、AST、BUN和Cr水平。
1.4.3 制备病理切片小鼠取血死亡后,立刻取出已死亡小鼠肝、肺、肾器官,生理盐水冲洗后用4%甲醛固定,石蜡包埋、切片,HE染色。显微镜下观察各组小鼠组织切片的病理变化并且摄取照片。
1.4.4 生存率测定观察术后小鼠精神形态及活动状况,记录术后72 h内各个时间段死亡/生存小鼠,根据存活小鼠占比计算小鼠生存率并且绘制生存曲线。
1.5 统计学分析采用SPSS 16.0统计软件处理数据,通过方差齐性检验后,多组比较采用方差分析,生存率比较进一步两两比较采用q检验使用Kaplan-Meier检验,以P < 0.05为差异具有统计学意义。
2 结果 2.1 术后72 h各实验组小鼠生存率的变化A组小鼠术后精神、活力、食量正常,不抱团,体毛 顺滑。B组小鼠术后精神不振,小鼠抱团不活动,体温降低,进食量极少,体毛暗淡杂乱,小鼠眼角黄白色分泌物增多,某些小鼠肛周有血便,72 h生存率为0。相对于B组小鼠术后状态,C组小鼠的精神、活力、食量有所好转,小鼠肛周无血便,眼角分泌物较少,且72 h生存率为36%,较B组有所升高(图 1)。
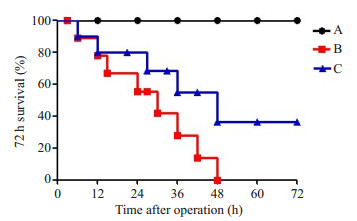
|
图 1 各实验组小鼠的72 h生存率 Figure 1 Survival of the mice within 72 h in each group. A: Normal control group; B: PBS+LPS group; C: PBS+LPS+ rSjCystatin group |
取已收集血清,全自动生化分析仪分析各实验组小鼠血清中ALT、AST、BUN、Cr水平,评价各组小鼠肝肾功能差异,结果显示:在3组血清中,上述肝肾功能检测指标具有一定的差异;其中B组小鼠与A组相比,术后血清中ALT、AST、BUN和Cr水平明显上升(P < 0.05);C组小鼠与B组相比,术后血清中ALT、AST、BUN和Cr水平下降(P < 0.05,图 2)。
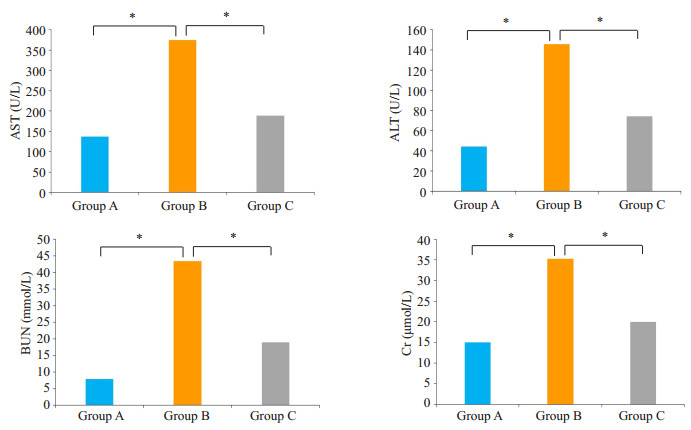
|
图 2 各实验组小鼠肝、肾功能的变化 Figure 2 Changes of liver and kidney functions of the mice in each group (*P < 0.05). A: Normal control group; B: PBS+LPS group; C: PBS+LPS+rSjCystatin group |
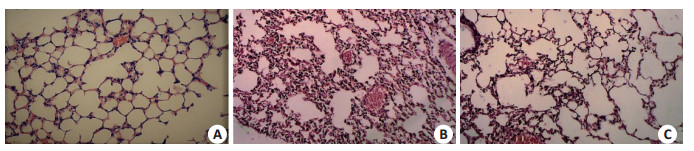
A组切片镜下可见肝细胞索形态正常且由中心向四周呈放射状分布,未见细胞水肿,炎性细胞浸润等异常现象;肺泡、肺间隔结构正常;肾中组织结构清晰,无血管球萎缩现象,肾小管正常无变化。B组镜下切片可见肝细胞水肿且分布无规则,肝血窦淤血,有炎性细胞浸润;肺切片中可见多数肺泡缺损或肿胀,肺泡隔显著增粗增厚;肾切片可见部分血管球萎缩较为严重。C组小鼠肝、肾和肺组织结构损伤较B组减轻,肝细胞索分布较为规则,肝细胞水肿程度不明显;肾中萎缩的血管球数量减少,程度减轻,肺泡轮廓较为完整,肺泡隔增厚程度较轻(图 3~5)。
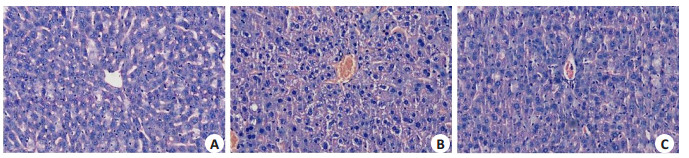
|
图 3 各实验组组小鼠肝组织结构变化 Figure 3 Structural changes of the liver tissue of the mice in each experimental group (HE staining, original magnification: ×200).A: Normal control group; B: PBS+LPS group; C: PBS+LPS+rSjCystatin group |
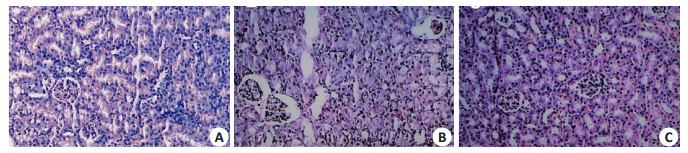
|
图 4 各实验组组小鼠肾组织结构变化 Figure 4 Structural changes of the kidney tissue of the mice in each group (HE staining, × 200). A: Normal control group; B: PBS+LPS group; C: PBS+LPS+rSjCystatin group |
|
图 5 各实验组组小鼠肾组织结构变化 Figure 5 Structural changes of the lung tissue of the mice in each group (HE staining, ×200).A: Normal control group; B: PBS+LPS group; C: PBS+LPS+rSjCystatin group |
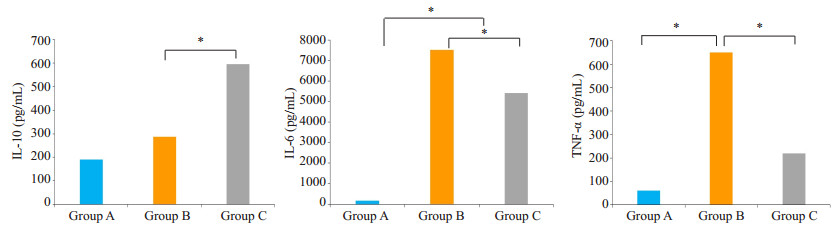
采用ELISA检测小鼠血清中细胞因子水平,结果显示;与A组相比,B组小鼠经腹腔注射LPS后,3组细胞因子都可见升高,IL-6、TNF-α升高更为明显(P < 0.05);C组小鼠经蛋白治疗后,与B组小鼠相比IL-6、TNF-α因子水平显著降低,IL-10因子水平显著升高(P < 0.05,图 6)。
|
图 6 各实验组小鼠血清中细胞因子的变化 Figure 6 Changes of serum levels of cytokines in the mice in each group (*P < 0.05). A: Normal control group; B: PBS+LPS group; C: PBS+LPS+rSjCystatin group |
脓毒症是临床上常见危重病的并发症之一,虽然近几年在临床上的受到高度关注,但仍然有着较高的致死率。有资料显示,脓毒症早期即可引起较为严重的机体损伤,主要原因在于TNF-α、IL-6等炎性因子大量释放所致的“炎性风暴”现象,从而致使全身炎症反应[14-15]。脓毒症诱发原因很多,临床上认为细菌感染导致的LPS大量释放入血从而诱发的全身炎症反应是其主要发病机制之一[16]。本实验经腹腔注射LPS后,小鼠在短时间内(24 h)即出现精神萎靡、活动量减少等一般状态恶化的现象,且血清中TNF-α、IL-6因子水平上升,并出现因过度炎症而导致的肝、肺、肾组织器官的损伤。这些现象均符合临床上对脓毒症的定义,说明本实验以腹腔注射LPS来建立脓毒症模型的方法是成功的。
常期以来,半胱氨酸蛋白酶抑制剂Cystatin被认为是在蛋白质降解以及抗原呈递、细胞凋亡、蛋白质处理、炎症和癌症发生发展中起一定的调节作用[17-20]。有研究证实,日本血吸虫Cystatin能刺激CD4+CD25+Foxp3+ Treg细胞[21],减轻以Th1反应为主的免疫失调性疾病,减少单核细胞活化,增强IL-10的产生,降低促炎因子TNF-α和IL-6的释放。因此本实验用SjCystatin干预小鼠脓毒症模型后,结果显示:脓毒症组小鼠(B组)较对照组(A组)小鼠血清中细胞因子TNF-α、IL-6、IL-10均有所升高,这是因为在脓毒症早期,因细胞因子微环境的改变,不仅会促使炎性因子TNF-α、IL-6的升高,抑炎因子也会升高,而IL-10作为一种抑炎因子,其在脓毒症模型中的消耗直接关系着模型小鼠的死亡率[22-23],而我们发现经SjCystatin蛋白干预后,即C组与脓毒症组小鼠(B组)比较,不仅可显著降低血清中致炎因子TNF-α、IL-6的水平,亦可明显升高免疫调节因子IL-10的分泌,与此同时,C组小鼠的生存率、肝肾功能及病理损伤较B组小鼠均有不同程度的改善,这些结果表明重组SjCystatin对于LPS诱导的脓毒症有一定的治疗效果,主要机制即其可明显减少炎性因子TNF-α、IL-6的释放,增加IL-10水平,从而抑制脓毒症过度的炎症反应,改善小鼠肝、肺、肾组织损伤,降低脓毒症小鼠的死亡率。与此相似的是,SjCystatin已被证明可以显著抑制多种自身免疫性疾病的炎症反应从而减轻疾病症状,如哮喘[24]、炎性肠炎[25]、胶原诱导性关节炎[26],本实验结果进一步验证了SjCystatin可抑制过度的炎症反应。
一直以来,传统的治疗方法比如促炎因子拮抗剂治疗(TNF-α,IL-1β受体拮抗剂等)并没有明显减轻多器官损伤和降低死亡率。而本实验结果可提示SjCystatin可作为一个新的、有效的治疗脓毒症的方法来应用于临床及科研上。但是重组SjCystatin具体的调节机制还有待进一步探讨,因此进一步研究重组SjCystatin在体内发挥的调节作用原理非常重要,并且为重组SjCystatin治疗脓毒症的安全性、可靠性提供实验依据。
| [1] |
杨小迪, 贺文欣, 方强, 等. 旋毛虫成虫排泄分泌蛋白抗CLP诱导的小鼠脓毒症的观察[J].
中国血吸虫病防治杂志, 2016, 28(3): 293-6, 322.
|
| [2] |
Morel J, Singer M. Statins, fibrates, thiazolidinediones and resveratrol as adjunctive therapies in sepsis: could mitochondria be a common target?[J].
Intensive Care Med Exp, 2014, 2(1): 9.
DOI: 10.1186/2197-425X-2-9. |
| [3] |
Kaukonen KM, Bailey M, Pilcher D, et al. Systemic inflammatory response syndrome criteria in defining severe sepsis[J].
N Engl J Med, 2015, 372(17): 1629-38.
DOI: 10.1056/NEJMoa1415236. |
| [4] |
Wammes LJ, Mpairwe H, Elliott AM, et al. Helminth therapy or elimination: epidemiological, immunological, and clinical considerations[J].
Lancet Infect Dis, 2014, 14(11): 1150-62.
DOI: 10.1016/S1473-3099(14)70771-6. |
| [5] |
Shepherd C, Navarro S, Wangchuk P, et al. Identifying the immunomodulatory components of helminths[J].
Parasite Immunol, 2015, 37(6): 293-303.
DOI: 10.1111/pim.2015.37.issue-6. |
| [6] |
Vray B, Hartmann S, Hoebeke J. Immunomodulatory properties of cystatins[J].
Cell Mol Life Sci, 2002, 59(9): 1503-12.
DOI: 10.1007/s00018-002-8525-4. |
| [7] |
Zavasnik- Bergant T. Cystatin protease inhibitors and immune functions[J].
Front Biosci, 2008, 13: 4625-37.
|
| [8] |
Hartmann S, Lucius R. Modulation of host immune responses by nematode cystatins[J].
Int J Parasitol, 2003, 33(11): 1291-302.
DOI: 10.1016/S0020-7519(03)00163-2. |
| [9] |
Yang X, Liu J, Yue Y, et al. Cloning, expression and characterisation of a type Ⅱ cystatin from Schistosoma japonicum, which could regulate macrophage activation[J].
Parasitol Res, 2014, 113(11): 3985-92.
DOI: 10.1007/s00436-014-4064-9. |
| [10] |
Li H, Wang S, Zhan B, et al. Therapeutic effect of Schistosoma japonicum cystatin on bacterial sepsis in mice[J].
Parasit Vectors, 2017, 10(1): 222.
DOI: 10.1186/s13071-017-2162-0. |
| [11] |
Van Amersfoort ES, Van Berkel TJ, Kuiper J. Receptors, mediators, and mechanisms involved in bacterial sepsis and septic shock[J].
Clin Microbiol Rev, 2003, 16(3): 379-414.
DOI: 10.1128/CMR.16.3.379-414.2003. |
| [12] |
Cailhier JF, Partolina M, Vuthoori S, et al. Conditional macrophage ablation demonstrates that resident macrophages initiate acute peritoneal inflammation[J].
J Immunol, 2005, 174(4): 2336-42.
DOI: 10.4049/jimmunol.174.4.2336. |
| [13] |
Martinon F, Mayor A, Tschopp J. The inflammasomes: guardians of the body[J].
Annu Rev Immunol, 2009, 27: 229-65.
DOI: 10.1146/annurev.immunol.021908.132715. |
| [14] |
Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy[J].
Nat Rev Immunol, 2013, 13(12): 862-74.
DOI: 10.1038/nri3552. |
| [15] |
Ulloa L, Tracey KJ. The "cytokine profile": a code for sepsis[J].
Trends Mol Med, 2005, 11(2): 56-63.
DOI: 10.1016/j.molmed.2004.12.007. |
| [16] |
Wang S, Xie Y, Yang X, et al. Therapeutic potential of recombinant cystatin from Schistosoma japonicum in TNBS- induced experimental colitis of mice[J].
Parasit Vectors, 2016, 9: 6.
DOI: 10.1186/s13071-015-1288-1. |
| [17] |
Klotz C, Ziegler T, Figueiredo AS, et al. A helminth immunomodulator exploits host signaling events to regulate cytokine production in macrophages[J].
PLoS Pathog, 2011, 7(1): e1001248.
DOI: 10.1371/journal.ppat.1001248. |
| [18] |
Ji P, Hu H, Yang X, et al. AcCystatin, an immunoregulatory molecule from Angiostrongylus cantonensis, ameliorates the asthmatic response in an aluminium hydroxide/ovalbumin-induced rat model of asthma[J].
Parasitol Res, 2015, 114(2): 613-24.
DOI: 10.1007/s00436-014-4223-z. |
| [19] |
Harnett W. Secretory products of helminth parasites as immunomodulators[J].
Mol Biochem Parasitol, 2014, 195(2): 130-6.
DOI: 10.1016/j.molbiopara.2014.03.007. |
| [20] |
Schuijs MJ, Hartmann S, Selkirk ME, et al. The Helminth-Derived immunomodulator AvCystatin reduces virus enhanced inflammation by induction of regulatory IL-10(+) T cells[J].
PLoS One, 2016, 11(8): 0161885.
|
| [21] |
He B, Cai G, Ni Y, et al. Characterization and expression of a novel cystatin gene from Schistosoma japonicum[J].
Mol Cell Probes, 2011, 25(4): 186-93.
DOI: 10.1016/j.mcp.2011.05.001. |
| [22] |
李徽徽, 贺文欣, 宋迪, 等. 旋毛虫及其虫源性蛋白对盲肠结扎穿孔诱导的小鼠脓毒症的影响[J].
南方医科大学学报, 2016, 36(8): 1048-54.
|
| [23] |
Hotchkiss RS, Nicholson DW. Apoptosis and caspases regulate death and inflammation in sepsis[J].
Nat Rev Immunol, 2006, 6(11): 813-22.
DOI: 10.1038/nri1943. |
| [24] |
Schnoeller C, Rausch S, Pillai S, et al. A helminth immunomodulator reduces allergic and inflammatory responses by induction of IL-10- producing macrophages[J].
J Immunol, 2008, 180(6): 4265-72.
DOI: 10.4049/jimmunol.180.6.4265. |
| [25] |
Jang SW, Cho MK, Park MK, et al. Parasitic helminth cystatin inhibits DSS-induced intestinal inflammation via IL-10(+)F4/80(+) macrophage recruitment[J].
Korean J Parasitol, 2011, 49(3): 245-54.
DOI: 10.3347/kjp.2011.49.3.245. |
| [26] |
Liu F, Cheng W, Pappoe F, et al. Schistosoma japonicum cystatin attenuates murine collagen-induced arthritis[J].
Parasitol Res, 2016, 115(10): 3795-806.
DOI: 10.1007/s00436-016-5140-0. |
 2018, Vol. 38
2018, Vol. 38

