2. 南方医科大学南方医院 影像中心,广东 广州 510515;
3. 南方医科大学基础医学院人体解剖学教研室,广东 广州 510515;
4. 深圳市一图智能科技有限公司,广东 深圳 518044
2. Imaging center, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
3. Department of Anatomy, School of Basic Medical Sciences, Southern Medical University, Guangzhou 510515, China;
4. Shenzhen Smart Vision Co., Ltd, Shenzhen 518044, China
肾部分切除术(PN)既能保留部分肾功能,又能达到根治性肾切除的手术效果,从而成为T1期肾肿瘤的标准术式[1],而腹腔镜下肾部分切除术(LPN)由于损伤小、恢复快的特点,目前已在国内外得到广泛应用。2012年,Buffi等[2]提出LPN的手术目标为手术切缘阴性、低于20 min的热缺血损伤且无严重并发症(Clavien-Dindo[3]分类中3或4级并发症)。其中,LPN手术切缘阳性率已经很低,仅为0.7%~4%[4],严重并发症的发生率也降至3%左右[5],而LPN术中的热缺血时间却难以达到目标。Thompson等[6]随访362例肾门血管阻断的患者后发现,即使平均阻断21 min,患者依然有可能出现急性肾功能衰竭,而且,每增加1 min的热缺血损伤,肾功能损害的危险度相应增加6%。尽管术中低温处理[7-8]、提前开放肾动脉[9]等技术已经相继报道,但受技术限制其在国内尚未推广应用。
传统CT图像无法直观地展现肿瘤毗邻及血管分布,难以实现精准化的手术规划。而CT血管重建技术(CTA)仅能立体显示肾动脉分布与走行,用于指导肾动脉段血管阻断的LPN手术以减轻肾脏热缺血损伤[10-12],但无法重建出肾肿瘤、肾盂等结构,因而缺乏相对应的手术规划价值。随着数字医学的发展,3D重建技术开始应用于肾肿瘤的LPN手术中,Gill等[13]通过3D重建识别肿瘤供血分支的位置和走行,通过术前精准规划及术中超声定位,实现“零缺血”的LPN手术。Komai等[14]不仅用3D模型定位肿瘤血供,而且预判术中切除肿瘤时血管与集合系统的损伤位置,为精准手术提供立体影像学的支撑。相比传统平面CT而言,3D模型不仅立体直观地展现肾肿瘤各个结构,而更重要的是3D空间测量能够量化肾脏缺损的大小、肿瘤与其他结构的位置关系,实现精准化的术前规划,然而目前国内尚缺乏肾肿瘤的3D解剖参数及临床应用报道。本研究利用自主开发的“Uromedix-3D”系统(软著字:2017SR200785)进行肾肿瘤3D重建,将3D空间测量技术应用在LPN各阶段的手术操作中,并通过对比研究探讨3D空间测量在降低术中热缺血损伤及术后并发症方面的优势。
1 材料和方法 1.1 研究对象选取2016年2月~2017年10月我院75例T1期肾肿瘤手术患者的临床资料,纳入标准:(1)影像学提示T1期肾癌且对侧肾脏结构无异常;(2)生化检查提示术前肾功能正常;(3)无既往肾脏相关手术史。排除标准:(1)影像学提示肾脏良性肿瘤;(2)非T1期肾癌;(3)合并肾结石及囊肿;(4)既往患肾手术史及患侧肾上腺、输尿管等腹膜后其他手术;(5)术前提示肾功能不全;(6)合并慢性肾脏疾病。其中37例在我院行肾脏增强CT检查,并完成3D重建指导下的LPN手术(A组);同期,38例患者携带外院CT至我院接受LPN手术(B组)。两组病例一般资料(表 1)。
| 表 1 两组患者的术前资料对比 Table 1 Comparison of preoperative data between the two groups (Mean±SD) |
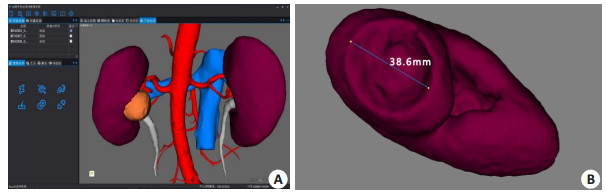
利用256层双源螺旋CT获取肾脏增强扫描的四期DICOM数据。其中增强扫描时,静脉注射非离子型对比剂80 mL,生理盐水40 mL,速率3.5 mL/s。动脉期监测腹主动脉CT值而自动触发扫描,触发阈值为150 HU。静脉期和排泄期延迟扫描时间分别为75 s和300 s。扫描参数为管电压100 000V,管电流自动,螺距0.601 mm。扫描后图像拆薄为0.9 mm,并即刻采集数据并导入“Uromedix-3D”系统(图 1A),利用自动阈值分割等重建技术能快速重建出动脉、静脉、肾脏、肾盂、肿瘤等三维模型,并在系统中测量肾肿瘤解剖学参数,包括肾脏缺损长、宽、深及肿瘤与集合系统的距离(图 1B)。
|
图 1 Uromedix-3D系统及3D空间测量 Figure 1 Uromedix-3D system and 3D spatial measurement. A: 3D reconstruction of renal tumor in Uromedix-3D system; B: 3D spatial measurement of the renal defect |
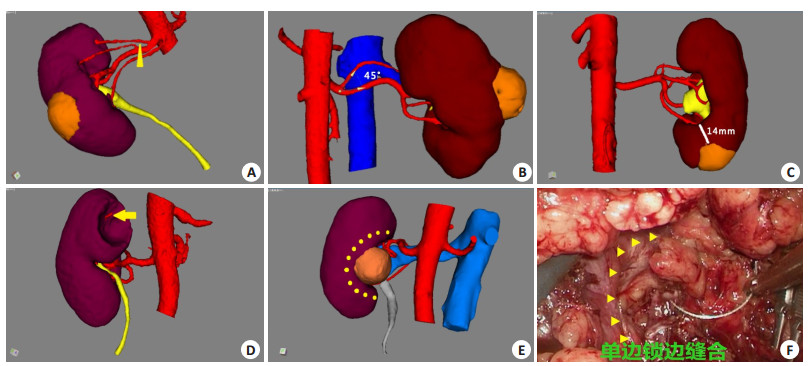
两组患者均由同一术者采用后腹腔入路行LPN手术,按照动脉处理、肿瘤切除及肾脏缺损修补的手术顺序进行手术规划:(1)根据肾动脉分支走形、肿瘤血供来规划肾动脉最佳阻断位置(图 2A、B);(2)根据肿瘤与肾门距离,规划肿瘤切缘宽度(图 2C);(3)深层缝合时,根据缺损断面的血管或肾盂损伤结构确定重点缝合部位(图 2D),并根据肾脏缺损的长宽深规划缝合针数及缝线长度;(4)针对特殊位置的缺损缝合,设计单侧锁边等个体化缝合方式(图 2E、F)。
|
图 2 术前规划与术中导航 Figure 2 Preoperative planning and intraoperative navigation. A: Clamping position for accessory renal arterial branches (yellow triangle); B: Angle between the two renal arterial branches; C: Planning tumor margin width; D: Location of the stump artery; E, F: Planning suture position and surgical navigation |
测量并统计A组3D模型解剖参数,收集并记录两组患者术中及术后临床资料,采用SPSS 22.0统计软件对结果进行分析。两组数据中计量资料用两独立样本t检验,计数资料用χ2检验。P < 0.05时认为差异有统计学意义。
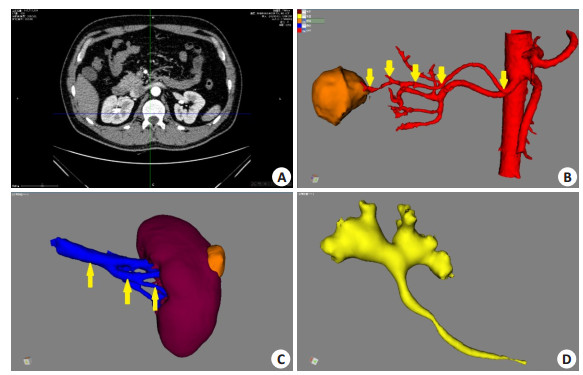
2 结果 2.1 CT图像与3D重建37例肾肿瘤CT图像数据(DICOM格式)包括平扫期、动脉期、静脉期及排泄期,每期图像为400~600张,层厚0.9 mm,分辨率768×768,原始图像清晰(图 3A)。“Uromedix-3D”系统操作简便,肾脏重建过程耗时短,肾肿瘤各重建结构完整、清晰、立体感强。血管分支平滑连贯,肾动脉可达5级分支(图 3B),肾静脉可达3级属支(图 3C)。肿瘤及肾脏表面光整无凹凸,系统集合清晰完整(图 3D)。A组37例肾肿瘤3D重建相关参数(表 2)。
|
图 3 高精度CT图像及3D模型 Figure 3 High precision CT image and 3D models. A: CT image (768×768 pixels); B: Fifth branch of renal artery; C: Third branch of renal vein; D: Clear and intact collecting system |
| 表 2 肾肿瘤3D重建结果 Table 2 3D reconstruction result of the renal tumor (Mean±SD) |
75例肾肿瘤均成功采用后腹腔镜下肾部分切除术,手术无中转开放,肿瘤切缘均为阴性。术中结果显示A组肾动脉阻断时间比B组短,其中,A组肿瘤切除时间(肾动脉开始阻断至肿瘤完整切除的时间)、肾脏缺损缝合时间(肿瘤完整切除后至肾动脉开放的时间)均少于B组;术后结果显示A组术后24、48 h腹膜后引流量均明显低于B组,以上差异均有统计学意义;在手术并发症方面,A组未出现明显并发症,B组1例因术中损伤肾静脉而输血,1例术后7 d因出血行选择性动脉栓塞术。而两组手术时间、出血量、术后住院天数等临床资料差异无统计学意义(表 3)。
| 表 3 两组围手术期结果对比 Table 3 Perioperative data in the two groups (Mean±SD) |
虽然肾脏3D技术广泛应用在临床中[15-18],但肾脏3D重建精度差和效率低的问题[10-21]未引起重视。高精度CT图像是3D重建的前提,本研究得到的亚毫米(0.9 mm)、高分辨(768×768)超薄层CT图像精度高于文献报道的图像精度[18, 22-23],同时此次肾脏3D重建精度可达5级动脉分支、3级静脉属支。其次,由于Mimics等软件难以重建复杂的软组织结构,重建时过度依赖人工繁琐的重复操作,重建效率较低。而Uromedix-3D系统通过优化软组织图像分割算法,更加自动化地重建肾脏各目标结构,此次肾脏重建平均用时29.3 min,重建效率明显高于Mimics及Synapse Vincent系统[14, 19]。以往有研究报道肾静脉难以重建,常需手工逐层“画”出轮廓,图像的提取过程存在较大主观性,造成不同人员重建结果不一致[14],而本研究采用自动化重建技术能够有效避免人为误差。所以,在3D技术的临床应用中,重建精度决定手术规划的可靠性,重建效率影响技术的推广应用,提高重建精度与效率是3D技术在泌尿外科进一步推广应用的必要条件。
3.2 3D空间测量的技术优势3D手术规划不仅能更加直观的展现各结构毗邻特点,而且能通过3D空间测量精准量化肾肿瘤解剖特征,从立体形态和量化参数两方面满足精准化的术前规划要求。王振龙等[24]在肾肿瘤模型上通过3D空间测量精准锁定完全内生性肿瘤的位置,解决了内生性肾肿瘤的切除难题,但在其他规划方面缺少深入应用,因而笔者将3D空间测量拓展应用在LPN肾脏缺损修补方面。在A组37例肾肿瘤重建模型中,图 1B示“切除”肿瘤后,3D空间测量肾脏缺损的长宽深平均为3.2、2.6、1.7 cm,目前鲜有报道LPN手术肾缺损的3D解剖参数。在3D组手术规划中,笔者认为肾脏3D解剖参数有利于准确评估缝合难度,一方面,肾脏缺损深度常用于评估LPN术中单层或双层缝合,而3D模型缺损面的形状大小有利于判断最佳缝合方向。另一方面,肾脏缺损的长与宽能够估算术中缝合针数及缝线长度,从而降低缝合难度、缩短缝合时间。既往研究显示肾动脉的解剖变异比较常见[25-26],而此次37例重建模型中也发现了5例血管变异,其中2例肾动脉过早分支、3例合并副肾动脉。在合并血管变异的LPN手术中,3D空间测量能够准确定位异位血管,有利于肾蒂血管精准游离,避免术中损伤异位血管。
3.3 3D规划提高手术质量曾有研究指出3D技术在复杂肾肿瘤(R.E.N.A.L ≥8)的术前规划中比传统CT更具优势,能够有效缩短手术时间并降低术后尿瘘发生率[27],而本研究通过分析多层次的手术结果来进一步讨论3D技术在LPN手术规划中的优势。此次术中结果显示,3D手术规划不仅能缩短总手术时间,而且平均缩短了5.2 min的肾热缺血时间。由于LPN热缺血过程主要包括肿瘤切除及缺损修补两个阶段,因而笔者进一步将热缺血时间细分为肿瘤切除时间和肾缺损修补时间,从而发现3D组的这两部分时间分别减少了2 min和3.2 min。研究表明小肾癌的肿瘤切缘宽度与术后复发不相关[28-29],小于4 cm的肾肿瘤可行简单的肿瘤剜除术[30],3D模型从位置形态和空间距离两方面帮助术者定位肿瘤,规划最小切缘宽度,减少术中决策时间,从而提高肿瘤切除速度;在肾缺损修补阶段,3D模型从缺损位置、形态、大小和毗邻等方面系统地评估缺损修补难度,术前制定最佳缝合方案,减少术中无效操作,从而加快缺损修补进程;不仅如此,术后结果显示3D组术后24 h及48 h腹膜后引流量均明显少于CT组,这得益于术前3D模型能预判肾脏缺损的重要修补区域,帮助术者准确缝扎残端血管和修补集合系统,降低肾脏创面的渗血渗液,从而显著提高手术质量;在手术并发症方面,CT对照组有1例术中损伤肾静脉,有1例术后活动性出血,而3D组未出现严重并发症。本研究两组手术均未出现尿瘘并发症,因而无法评估3D技术在降低尿瘘方面的作用,这与Wang等[27]的对比研究存在差异。有研究认为内生型肿瘤LPN术后尿瘘等并发症发生率较高[31],所以有必要进一步研究3D技术在内生型肾肿瘤中降低术后并发症等方面的价值。
综上所述,专科化的“Uromedix-3D”系统能够高效、准确地完成肾脏3D重建,3D空间测量比传统CT规划更准确直观,是精准LPN手术规划的有效工具,能够降低肾脏热缺血损伤以及潜在手术并发症。
| [1] |
Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update[J].
Eur Urol, 2015, 67(5): 913-24.
DOI: 10.1016/j.eururo.2015.01.005. |
| [2] |
Buffi N, Lista G, Larcher A, et al. Margin, ischemia, and complications (MIC) score in partial nephrectomy: a new system for evaluating achievement of optimal outcomes in nephron- sparing surgery[J].
Eur Urol, 2012, 62(4): 617-8.
DOI: 10.1016/j.eururo.2012.06.001. |
| [3] |
Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J].
Ann Surg, 2004, 240(2): 205-13.
DOI: 10.1097/01.sla.0000133083.54934.ae. |
| [4] |
Marszalek M, Carini M, Chlosta P, et al. Positive surgical margins after nephron-sparing surgery[J].
Eur Urol, 2012, 61(4): 757-63.
DOI: 10.1016/j.eururo.2011.11.028. |
| [5] |
Mearini L, Nunzi E, Vianello A, et al. Margin and complication rates in clampless partial nephrectomy: a comparison of open, laparoscopic and robotic surgeries[J].
J Robot Surg, 2016, 10(2): 135-44.
DOI: 10.1007/s11701-016-0584-x. |
| [6] |
Thompson RH, Lane BR, Lohse CM, et al. Every minute counts when the renal hilum is clamped during partial nephrectomy[J].
Eur Urol, 2010, 58(3): 340-5.
DOI: 10.1016/j.eururo.2010.05.047. |
| [7] |
Beri A, Lattouf JB, Deambros O, et al. Partial nephrectomy using renal artery perfusion for cold ischemia: functional and oncologic outcomes[J].
J Endourol, 2008, 22(6): 1285-90.
DOI: 10.1089/end.2008.0152. |
| [8] |
Abe T, Sazawa A, Harabayashi T, et al. Renal hypothermia with ice slush in laparoscopic partial nephrectomy: the outcome of renal function[J].
J Endourol, 2012, 26(11): 1483-8.
DOI: 10.1089/end.2012.0122. |
| [9] |
Nguyen MM, Gill IS. Halving ischemia time during laparoscopic partial nephrectomy[J].
J Urol, 2008, 179(2): 627-32.
DOI: 10.1016/j.juro.2007.09.086. |
| [10] |
Shao P, Qin C, Yin C, et al. Laparoscopic partial nephrectomy with segmental renal artery clamping: technique and clinical outcomes[J].
Eur Urol, 2011, 59(5): 849-55.
DOI: 10.1016/j.eururo.2010.11.037. |
| [11] |
Shao P, Tang L, Li P, et al. Precise segmental renal artery clamping under the guidance of dual- source computed tomography angiography during laparoscopic partial nephrectomy[J].
Eur Urol, 2012, 62(6): 1001-8.
DOI: 10.1016/j.eururo.2012.05.056. |
| [12] |
Shao P, Tang L, Li P, et al. Application of a vasculature model and standardization of the renal hilar approach in laparoscopic partial nephrectomy for precise segmental artery clamping[J].
Eur Urol, 2013, 63(6): 1072-81.
DOI: 10.1016/j.eururo.2012.10.017. |
| [13] |
Ukimura O, Nakamoto M, Gill IS. Three-dimensional Reconstruction of renovascular-tumor anatomy to facilitate zero-ischemia partial nephrectomy[J].
Eur Urol, 2012, 61(1): 211-7.
DOI: 10.1016/j.eururo.2011.07.068. |
| [14] |
Komai Y, Sakai Y, Gotohda N, et al. A novel 3- dimensional image analysis system for case- specific kidney anatomy and surgical simulation to facilitate clampless partial nephrectomy[J].
Urology, 2014, 83(2): 500-6.
DOI: 10.1016/j.urology.2013.09.053. |
| [15] |
Silberstein JL, Maddox MM, Dorsey PA, et al. Physical models of renal malignancies using standard cross-sectional imaging and 3- Dimensional printers: a pilot study[J].
Urology, 2014, 84(2): 268-72.
DOI: 10.1016/j.urology.2014.03.042. |
| [16] |
Cheung CL, Looi T, Lendvay TS, et al. Use of 3-dimensional printing technology and silicone modeling in surgical simulation: development and face validation in pediatric laparoscopic pyeloplasty[J].
J Surg Educ, 2014, 71(5): 762-7.
DOI: 10.1016/j.jsurg.2014.03.001. |
| [17] |
Bernhard JC, Isotani S, Matsugasumi T, et al. Personalized 3D printed model of kidney and tumor anatomy: a useful tool for patient education[J].
World J Urol, 2016, 34(3): 337-45.
DOI: 10.1007/s00345-015-1632-2. |
| [18] |
Komai Y, Sugimoto M, Gotohda N, et al. Patient-specific 3- dimensional printed kidney designed for "4D" surgical navigation: a novel aid to facilitate minimally invasive off-clamp partial nephrectomy in complex tumor cases[J].
Urology, 2016, 91: 226-33.
DOI: 10.1016/j.urology.2015.11.060. |
| [19] |
葛宏伟, 张弋, 李宁忱, 等. 3D打印技术在肾肿瘤手术规划中的应用研究初探[J].
中华泌尿外科杂志, 2014, 35(9): 659-63.
|
| [20] |
曹志强, 柳云恩, 刘龙, 等. 3D打印技术在肾脏部分切除术中的应用[J].
解放军医药杂志, 2015, 27(11): 6-9, 20.
DOI: 10.3969/j.issn.2095-140X.2015.11.002. |
| [21] |
魏晓松, 刘征, 庄乾元, 等. 3D打印技术在经皮肾镜取石术术前规划及医患沟通中的应用研究[J].
中华泌尿外科杂志, 2015, 36(12): 881-5.
DOI: 10.3760/cma.j.issn.1000-6702.2015.12.001. |
| [22] |
汤润, 刘林, 时湛, 等. 用于经皮肾镜取石术模拟的肾脏3D打印模型研究初探[J].
中华泌尿外科杂志, 2015, 36(12): 886-90.
DOI: 10.3760/cma.j.issn.1000-6702.2015.12.003. |
| [23] |
Zhang Y, Ge HW, Li NC, et al. Evaluation of three-dimensional printing for laparoscopic partial nephrectomy of renal tumors: a preliminary report[J].
World J Urol, 2016, 34(4): 533-7.
DOI: 10.1007/s00345-015-1530-7. |
| [24] |
王振龙, 李晓会, 李和程, 等. 3D打印模型或CT三维重建指导下的肿瘤四点定位法在完全内生型肾癌腹腔镜下肾部分切除术中的应用[J].
中华泌尿外科杂志, 2016, 37(10): 735-9.
DOI: 10.3760/cma.j.issn.1000-6702.2016.10.004. |
| [25] |
Chai JW, Lee W, Yin YH, et al. CT angiography for living kidney donors: accuracy, cause of misinterpretation and prevalence of variation[J].
Korean J Radiol, 2008, 9(4): 333-9.
DOI: 10.3348/kjr.2008.9.4.333. |
| [26] |
鲁继东. 中国成人副肾动脉及其肾脏供血比例的应用解剖学研究[D]. 复旦大学, 2013.
|
| [27] |
Wang Z, Qi L, Yuan P, et al. Application of three-dimensional visualization technology in laparoscopic partial nephrectomy of renal tumor: a comparative study[J].
J Laparoendosc Adv Surg Tech A, 2017, 27(5): 516-23.
DOI: 10.1089/lap.2016.0645. |
| [28] |
Sutherland SE, Resnick MI, Maclennan GT, et al. Does the size of the surgical margin in partial nephrectomy for renal cell cancer really matter?[J].
J Urol, 2002, 167(1): 61-4.
DOI: 10.1016/S0022-5347(05)65383-9. |
| [29] |
Jeong SJ, Kim KT, Chung MS, et al. The prognostic value of the width of the surgical margin in the enucleoresection of small renal cell carcinoma: an intermediate-term follow-up[J].
Urology, 2010, 76(3): 587-92.
DOI: 10.1016/j.urology.2009.10.046. |
| [30] |
魏东, 张伟, 王鑫, 等. 肾癌多中心病灶和假包膜外肿瘤浸润的病理研究[J].
中华泌尿外科杂志, 2011, 32(3): 181-4.
|
| [31] |
Venkatesh R, Weld K, Ames CD, et al. Laparoscopic partial nephrectomy for renal masses: effect of tumor location[J]. Urology, 2006, 67(6): 1169-74; discussion 1174.
|
 2018, Vol. 38
2018, Vol. 38

