2. 珠海市人民医院 药学部, 广东 珠海 519000;
3. 珠海市人口和计划生育服务中心, 广东 珠海 519000
2. Department of Pharmacy, Zhuhai People's Hospital, Zhuhai 519000, China;
3. Population and Family Planning Service Center of Zhuhai, Zhuhai 519000, China
肺癌细胞表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKIs)已被广泛用于EGFR突变非小细胞性肺癌(NSCLC)的靶向治疗, 显示出良好的抗肿瘤疗效。然而, EGFR-TKIs治疗过程中, 会逐渐出现耐药现象。早期研究发现, 在使用吉非替尼等治疗的NSCLC病例中, 可逐步出现EGFR的“二次耐药突变”和“癌基因激酶启闭”, 如继发性T790M、MET、IGF基因的突变等[1-4]。此外, IP3激酶、长非编码RNA和微小RNA也有报道参与了EGFR-TKIs耐药的形成[5]。上述信号转导物质的基因突变, 促进癌细胞逆生长, 导致治疗过程中EGFRTKIs耐药的产生。近年来, 活化的B细胞核因子κ-轻链增强子(NF-κB)促进NSCLC产生EGFR-TKIs耐药的报道, 已受到广泛的关注。NF-κB可通过胞内某些介质, 如STAT3, HIF-1, PPARγ, β-catenin, ROS等的分子串扰而被大量激活[6-7], 可导致NSCLC等多种恶性肿瘤的发生, 被称为癌细胞的NF-κB成瘾[8-9]。Trever等[10]通过沉默κB抑制因子(IκB)方法, 使NF-κB激活, 可引起EGFR突变的肺癌H1650细胞对厄洛替尼产生耐药, 当敲除其主要的亚单位RELA后, 对厄洛替尼的敏感性恢复, 表明NF-κB的激活, 与EGFR突变的肺癌细胞产生EGFR-TKIs继发性耐药密切相关。新近的研究表明, 一种NF-κB特异性抑制剂吡咯烷二硫代氨基甲酸盐(PDTC), 可抑制人肺癌HCC827/GR-8-2细胞株NF-κB的表达, 逆转HCC827/GR-8-2细胞株对吉非替尼的耐药[11]。上述敲除RELA亚单位或使用PDTC抑制NF- κB, 遏制肺腺癌细胞生长, 逆转EGFR-TKIs的耐药性, 是否是通过阻断NF-κB亚单位的磷酸化、减少磷酸化亚单位进入胞核、从而抑制NF-κB信号通路的转导?尚有待证明, 为此, 本研究选用人EGFR突变肺腺癌亲代细胞株, 通过吉非替尼诱导成耐药细胞株, 测定和比较该细胞株NF-κB亚单位胞浆和胞核磷酸化水平, 分析其转导通路活化的状况, 以期探明肺腺癌细胞EGFR-TKIs耐药是否与NF-κB亚单位磷酸化增强, 继而激活其信号转导通路有关。
1 材料和方法 1.1 材料 1.1.1 细胞株选用人肺腺癌细胞株HCC827 (EGFRTKIs敏感株, EGFR exon19 delE746-A750), H1650 (EGFR-TKIs相对不敏感株, EGFR exon19 delE746- A750)均购自于上海中科院典型培养物保藏委员会细胞库。
1.1.2 试剂及仪器耗材吉非替尼(Astrazenecahengs), PDTC (Sigma), β-actin、Histone 3抗体(cat: 1854-s, 华安生物), 磷酸化IκBα抗体(Novus Biologicals), P-NF- κB p50、p65抗体(Santa Cruz)。High DMEM基础培养基(cat: SH30022.01B, Hyclone), FBS胎牛血清(cat: 16400- 044, GIBCO), CO2培养箱(cat: BC- J160S, 博讯), SW-CJ-2FD超净工作台(博讯), MULTISKAN MK3酶标仪(Thermo)。
1.2 方法 1.2.1 H1650耐吉非替尼药物细胞株建立培养的人肺腺癌H1650细胞株间隔3~4 d消化、传代1次。吉非替尼作用浓度从25 μmol/L开始, 处于对数生长期的H1650细胞在吉非替尼作用24 h后, 弃去含药培养基, 加入新鲜培养基, 待其恢复正常生长, 消化传代后复用25 μmol/L吉非替尼作用24 h, 相同浓度吉非替尼作用2次, 然后药物浓度递增, 直至100 μmol/L, 反复换液、传代培养出H1650耐药株细胞。
1.2.2 MTT检测3类细胞株生长情况取对数生长期的HCC827、H1650亲本和耐药细胞株, 以5000/孔的密度接种于96孔板, 每孔设置3个复孔; 37 ℃, 5% CO2饱和湿度培养细胞24 h后, 将3类细胞株分成2个干预组, 一组为吉非替尼干预组, 干预浓度1、2.5、10、20、40、80、100 μmol/L, 作用时间48 h; 另一组为吉非替尼联合PDTC, 吉非替尼干预浓度如前, PDTC浓度固定为1 μmol/L, 作用时间48 h后, 每孔各加入10 mL MTT溶液, 将培养板箱内孵育4 h, 用酶标仪测定595 nm处的吸光度(A595)。
1.2.3 Western blot法检测3类细胞株NF-κBP-p50和P-p65蛋白表达分别提取3类细胞株胞浆和胞核蛋白, 将每类细胞加入一定量蛋白裂解液, 冰上裂解40~50 min, 于4 ℃下12 000 r/min离心10 min; 测定蛋白质浓度; 将离心后的上清加入loading buffer, 100 ℃ 5 min, 然后放于-80 ℃保存。选用H1650亲本细胞株细胞达半数抑制率相对应的吉非替尼半数抑制浓度(IC50)干预3类细胞株48 h, 然后分别用Western blot法检测胞浆中P-IκBα蛋白、胞浆和胞核内参蛋白、NF-κB磷酸化(Phospho-) p50 (P-p50)和P-p65蛋白表达, 同法检测吉非替尼联合PDTC干预下3类细胞株上述蛋白表达。
1.2.4 细胞抑制率和耐药指数计算按下列公式计算细胞抑制率:抑制率=1(- A实验组-A空白对照组/A对照组-A空白对照组) ×100%。以药物浓度为横轴, 抑制率为纵轴, 做出量-效曲线, 求得抑制率达最大值50%时吉非替尼浓度(IC50)。耐药指数:耐药指数=耐药细胞IC50/亲本细胞IC50。
1.2.5 统计学分析数据使用SPSS 19.0软件分析。Levene法检验方差齐性, t检验比较两独立样本数据差异, 检验水准α=0.05, 不满足方差齐性条件时, 采用秩和检验; 多组间均数差异采用完全随机设计资料的方差分析及随机区组设计资料的方差分析。P < 0.05表明差异具有统计学意义。
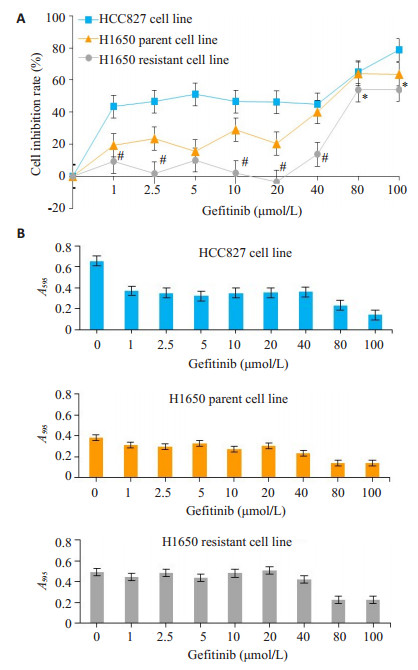
2 结果 2.1 H1650耐药细胞株的建立经过2个月对H1650细胞株吉非替尼施药诱导, 获得了H1650细胞吉非替尼耐药株。将HCC827, H1650亲本细胞株和耐药细胞株分别置于不同浓度吉非替尼处理48 h后, 用MTT法检测显示:随着吉非替尼浓度的增加, 吉非替尼对HCC827细胞株和H1650亲本细胞株细胞生长抑制率均增高, 但对H1650耐药细胞株抑制率较低, 提示H1650耐药细胞株对吉非替尼产生了耐药。求得H1650亲本细胞株和H1650耐药细胞株的IC50分别为59.07 μmol/L和83.74 μmol/L, 两者具有显著差异(P < 0.01), H1650亲本细胞株和H1650耐药细胞株对吉非替尼的耐药指数计算值为1.418。经随机区组设计资料的方差分析, 细胞抑制率在3类细胞株间和吉非替尼各浓度组间显示统计学意义的差异(F=54.15, P < 0.01)。3种细胞株在不同浓度吉非替尼干预下, 酶标仪测定的各细胞株595 nm吸光度。与HCC827细胞株和H1650亲本细胞株比较, H1650耐药细胞株吸光度强和曲线下面积大, 吉非替尼各浓度组吸光度均较H1650亲本细胞株显著增强(F= 9.876, P < 0.01, 图 1)。
|
图 1 吉非替尼对3类细胞株的细胞抑制率 Figure 1 Inhibitory effect of gefitinib on the growth of the 3 cell lines. A: Growth inhibition rate of the cells in the presence of different concentrations of gefitinib (Mean±SD, n=6). #P < 0.01, *P < 0.05 vs H1650 parent cell line; B: Absorbance at 595 nm of the 3 cell lines in the presence of different concentrations of gefitinib. |
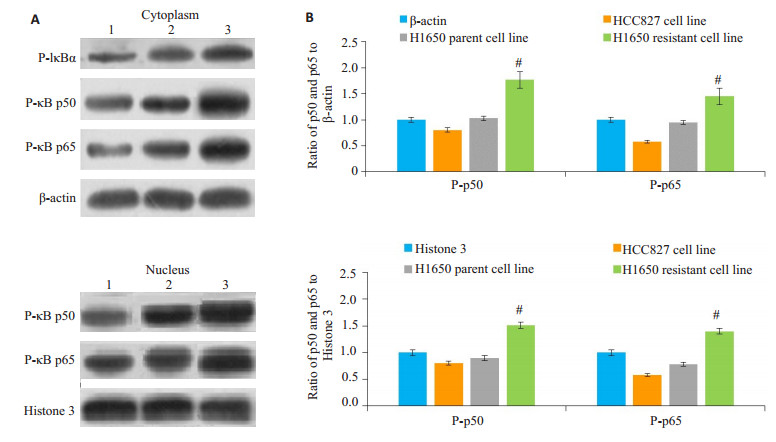
Western blot检测结果示与相应的胞浆和胞核内参印迹比较, H1650耐药细胞株胞浆中P-IκBα、胞浆和胞核NF-κB P-p50和P-p65条带深粗, H1650亲本细胞株次之, HCC827细胞株蛋白条带相对较浅(图 2)。同时, 通过Image J灰度扫描软件扫描并计算出P-p50及P-p65与内参的灰度比值, 以此作为P-p50和P-p65的相对表达量, H1650耐药细胞株胞浆和胞核中NF-κB P-p50和P-p65表达显著增高, 较H1650亲本细胞株和HCC827细胞株灰度比值具有显著差异(P < 0.01)。
|
图 2 Western blot检测3类细胞株不加药状态下NF-κB亚单位P-p50和P-p65蛋白的表达 Figure 2 Expression of NF-κB subunit P-p50 and P-p65 proteins in the 3 untreated cell lines detected by Western blotting. A: Immunoblots of cytoplasmic and nuclear P-p50 and P-p65 expressions. 1: HCC827 cells; 2: parental H1650 cells; 3: Resistant H1650 cells; B, C: Rray ratio of P-p50/β-actin or Histone 3, P-p65/β-actin or Histone 3 calculated with Image J grayscale scanning software (Mean±SD, n=6). #P < 0.01 vs parental H1650 cells and HCC827 cells. |
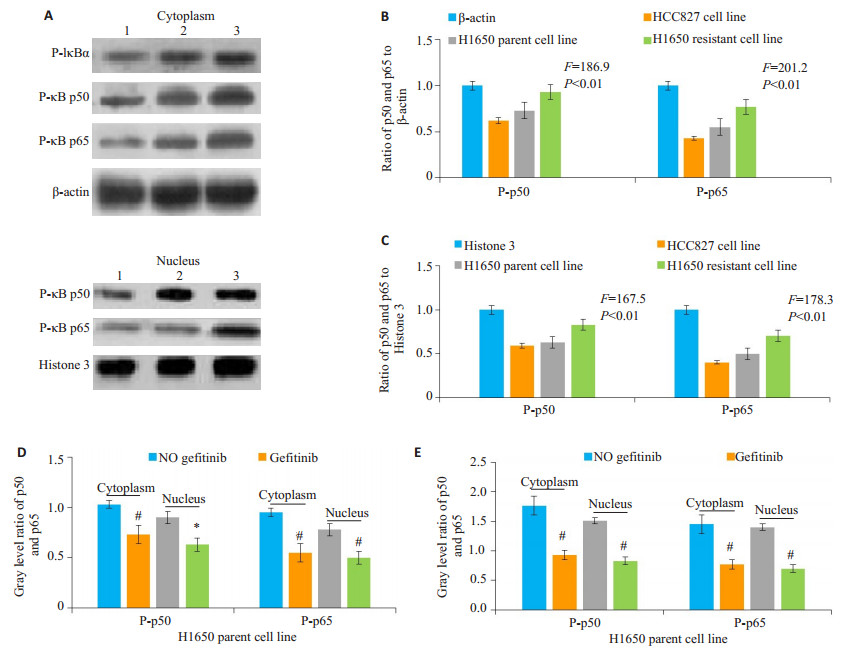
吉非替尼为IC50处理3类细胞株48 h后, Western blot法测定3类细胞株胞浆P-IκBα、胞浆和胞核NF-κB P-p50和P-p65蛋白的表达(图 3)。以P-p50及P-p65与相应内参的灰度比值作图, 可见H1650耐药细胞株胞浆和胞核P- p50、P- p65灰度值远高于亲本细胞株和HCC827细胞株。各组间P-p50及P-p65灰度值及蛋白表达量具有显著差异。值得注意的是, 使用吉非替尼处理后, 胞浆和胞核P-p50和P-p65表达量均较不用药状态下显著下降(P < 0.05)。
|
图 3 吉非替尼干预组3类细胞株NF-κB P-p50和P-p65蛋白的表达 Figure 3 Expression of P-p50 and P-p65 proteins in the 3 cell lines treated with gefitinib. A: Immunoblots of cytoplasmic and nuclear P-p50 and P-p65 expressions. 1: HCC827 cells; 2: parental H1650 cells; 3: Resistant H1650 cells; B, C: Gray ratio of P-p50 /β-actin or Histone 3, P-p65/β-actin or Histone 3 calculated in gefitinib intervention; D, E: Gray ratio of P-p50 and P-p65 of parental and resistant H1650 cells with or without gefitinib treatment (n=6). *P < 0.05, #P < 0.01 vs no gefitinib. |
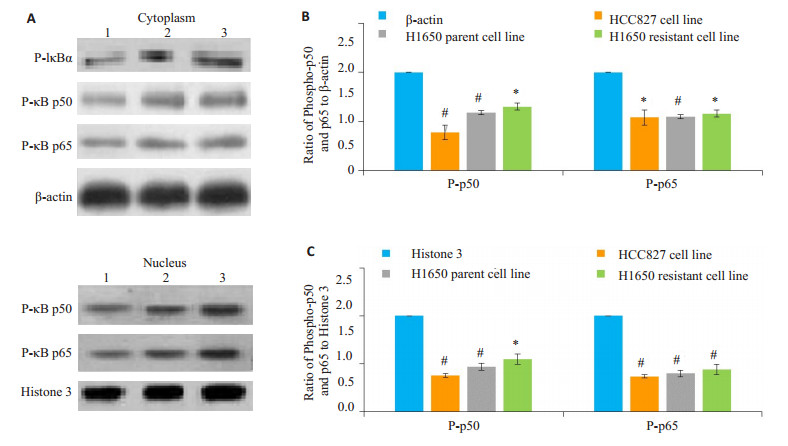
选用吉非替尼IC50加NF-κB抑制剂PDTC (1 μmol/L)作为联合用药配伍, 干预3类细胞株48 h, 测定P-IκBα、P-p50和P-p65表达量(图 4)。与相应内参印迹灰度比较, 各细胞株P-IκBα、胞浆和胞核P-p50和P-p65蛋白印迹均减弱。P-p50及P-p65与内参的灰度比值, 显示在吉非替尼联合PDTC干预下, 3类细胞株胞浆和胞核NF-κB P-p50和P-p65表达量均较内参显著降低(P < 0.05)。
|
图 4 吉非替尼联合PDTC干预组3类细胞株NF-κB P-p50和P-p65蛋白的表达 Figure 4 Effects of gefitinib combined with PDTC on the expression of P-p50 and P-p65 proteins in the 3 cell lines. A: The immunoblots of P-p50 and P-p65 expressions. 1: HCC827 cells; 2: parental H1650 cells; 3: Resistant H1650 cells; B, C: Gray ratio of P-p50/β-actin or Histone 3 and P-p65/β-actin or Histone 3 in the cells (n=6). *P < 0.05, #P < 0.01 vs β-actin or Histone. |
分别比较吉非替尼和吉非替尼联合PDTC干预下, H1650亲本和耐药细胞株的细胞存活率、胞浆P-IκB、胞浆和胞核P-p50、P-p65表达(图 5)。与单独吉非替尼干预比较, 吉非替尼联合PDTC干预下, 两类细胞株的细胞存活率在吉非替尼为10~40 μmol/L时明显降低(P < 0.01), H1650亲本细胞株细胞存活率平均值由吉非替尼干预组56.98%下降至28.63%, 耐药细胞株细胞存活率平均值则由76.0%下降至29.8%。NF-κB胞浆P-p65和P-p50、P-p50和P-p65蛋白印迹及灰度比较, 吉非替尼联合PDTC干预组明显低于吉非替尼干预组(P < 0.05)
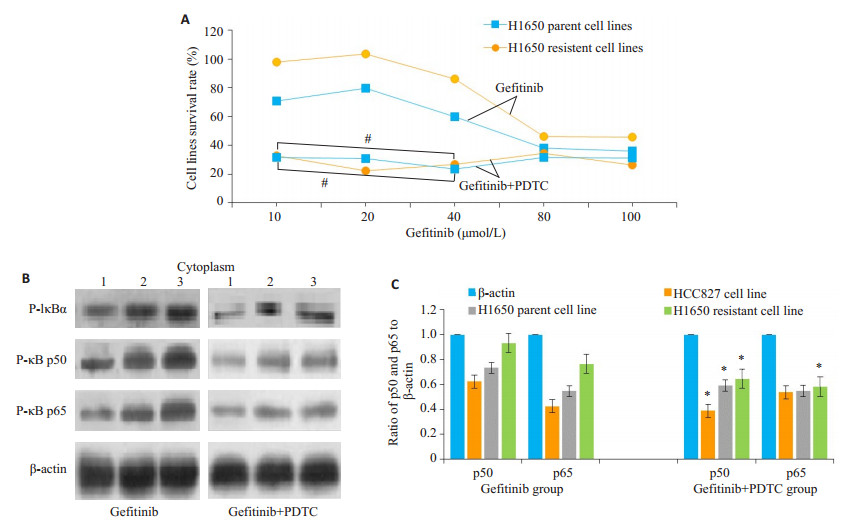
|
图 5 吉非替尼干预组和吉非替尼联合PDTC干预组细胞功效的比较 Figure 5 Effect of gefitinib alone or in combination with PDTC on survival rate and cytoplasmic P-p50 and P-p65 expressions in parental and resistant H1650 cells. A: Cell survival rate; B: Immunoblots of cytoplasmic P- p50 and P- p65 expression. 1: HCC827 cell line. 2: Parental H1650 cell. 3: Resistant H1650 cells; C: Gray ratio of cytoplasmic P-p50/β-actin and P-p65/β-actin in parental and resistant H1650 cells (Mean±SD, n=6). #P < 0.01, *P < 0.05 vs gefitinib group. |
本研究选择EGFR-TKIs相对不敏感的H1650亲代细胞株, 利用吉非替尼小剂量倍增、间歇性慢性诱导方法, 将其逐步培养成吉非替尼耐药细胞株。用不同浓度吉非替尼处理48小时后, 检测可见H1650耐药细胞株的抑制率远低于亲代细胞株和HCC827细胞株, 并且其IC50由亲代细胞株的59.07 μmol/L显著提高至83.74 μmol/L, 表明H1650耐药细胞株细胞存活率高, 形成了获得性吉非替尼耐药逆生长特性。
从吉非替尼给药浓度与3种细胞株抑制率的量-效关系曲线上可以看出, 吉非替尼倍增浓度从1~40 μmol/L, 对H1650耐药细胞株抑制率远较亲代细胞株和HCC827为低, 尤其是吉非替尼剂量为10~20 μmol/L时, H1650耐药细胞株抑制率几乎为零, 表明H1650耐药细胞株在此浓度范围中极易产生耐药生长。吉非替尼浓度从80~100 μmol/L时, 尽管吉非替尼对H1650耐药细胞株抑制率低于另外两种细胞株, 但3种细胞株的抑制率均可达到50%以上, 形成高抑制率的平台效应。这种吉非替尼浓度和细胞抑制率的量-效关系可为临床用药所借鉴。
H1650耐药细胞株对吉非替尼产生耐药改变, 是否与NF-κB信号通路激活有关?有报道表明, 由癌基因KRASG12D等因素所诱导的鼠NSCLC, 其肿瘤基质中, RelB和p100/p52表达量很低, 但p50和p65表达量均增高, 尤其是基质细胞浆中, 提示p50/p65数量增加可能与上述诱发因素致癌有关[12]。然而, p50/p65二聚体数量增加, 尚不能表明NF-κB通路被激活, 因为NF-κB由Rel, p65, RelB, p50和p52组成, 各亚单位多以二聚体结构存在胞浆[13-15]。信号通路的激活需要这些信号蛋白进入核内。NF-κB入核转导通路包括经典和非经典两种方式, 前者是经常性的调节通路[16-17]。经典通路信号蛋白常以IκB/p65/p50无活性的三聚体存在于胞质中, 在IKK的作用下, IκB被磷酸化, 尤其是IκB-a亚基发生磷酸化后与p65/p50二聚体解离, p50和p65游离至胞浆, 在IKK和蛋白激酶A的作用下, p65亚基536和276位点、p50亚基337位点的苏氨酸被磷酸化, 形成P-p65和P-p50进入核内, 暴露出核定位序列, 并与特定的DNA序列结合, 调控相应基因的表达, 介导细胞分化和肿瘤发生等[18-19]。因此, 判断NF-κB经典信号通路是否被激活, 关键取决于IκB、p50和p65的磷酸化和后两者进入核内的行踪及数量。
本研究显示, 在不加药状态下, H1650耐药细胞株胞浆P-IκBα、胞浆和胞核P-p50和P-p65表达量较亲本细胞株和HCC827细胞株显著增高, 提示IκB在胞浆激酶的作用下被大量磷酸化和去抑制, 使胞浆游离的p50和p65数量增加, 后者相继被磷酸化后进入胞核的数量增加。由此可判断耐药细胞株NF-κB通路胞浆至胞核段被相对激活程度增强。在使用吉非替尼干预下, 3种细胞株胞浆P-IκBα, 胞浆和胞核P-p50和P-p65表达量均较不加药状态下明显降低, 但总体可见H1650耐药细胞株P-IκBα、P-p50和P-p65表达量仍较其它两种细胞株为高。这一结果表明, 吉非替尼本身可能对P-p50、P-p65的表达及其NF-κB经典通路的激活有一定的抑制效应, 这似乎与先前报道的肺腺癌EGFR-TKIs耐药病例, NF-κB活性增强的研究结果相矛盾[20-21]。我们认为, 从实验的直接结果可以证明, 使用H1650亲代细胞株吉非替尼IC50 (59.074 μmol/L)处理的3种细胞株, Pp50和P-p65表达量均较不加药状态下有所降低, 可见其抑制效应。为何耐药细胞株在吉非替尼条件下, NF-κB激活仍能相对增强, 产生细胞的逆生长呢?推测可能是吉非替尼诱导H1650耐药细胞株过程中, 其膜EGFR产生了“二次耐药突变”或信号分子间“串扰”, 间接激活了NF-κB经典通路, 促进耐药细胞株的生长和瘤体复发[22-23]。吉非替尼直接抑制和间接增强NF-κB通路的研究是一个值得探索的课题。
为了进一步证实H1650亲代细胞转化为吉非替尼耐药细胞, 是由于NF-κB经典通路激活调控所致, 我们使用了特异性NF-κB抑制剂PDTC联合吉非替尼用药方法。PDTC是一种金属螯合剂和抗氧化剂, 能通过阻止胞浆IκB磷酸化, 使IkB不能与NF-κB p50/p65解离, 从而抑制NF-kB经典通路的激活[24-25]。本实验发现, 在吉非替尼联合PDTC施药状态下, 3类细胞株P-IκBα、P-p50和P-p65表达量均较单独吉非替尼用药状态下显著降低, H1650亲本细胞株细胞平均生存率由56.98%下降至28.63%, 耐药细胞株由76.0%下降至29.8%, 提示PDTC通过阻止P-IκB的形成, 抑制NF-κB经典信号转导通路的活化, 降低H1650亲代细胞的残存率和耐药细胞的转化, 相反也证明H1650亲代细胞吉非替尼条件下得以残存并转化为耐药细胞, 与NF-κB经典信号转导通路的激活密切相关。
综上所述, 本研究所诱导的吉非替尼耐药H1650细胞, 其胞浆P-IκB、P-p50和P-p65表达相对较高, 可通过NF-κB经典信号转导通路扩增细胞数量, 转化为吉非替尼肺腺癌H1650耐药细胞。吉非替尼联合PDTC用药, 可通过抑制H1650细胞P-IκBα的形成, 抑制上述过程。此外, 本研究发现吉非替尼对IκBα、p50和p65的磷酸化过程有直接抑制作用, 而不是促进作用。吉非替尼耐药细胞NF-κB通路活化增强, 不排除吉非替尼使细胞膜EGFR发生了二次突变, 或间接刺激了某种尚不明确的诱导物, 转而激活NF-κB通路, 增加H1650耐药细胞数量, 导致瘤体的生长和复发。
| [1] |
Nguyen KS, Kobayashi S, Costa DB. Acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in nonsmall-cell lung cancers dependent on the epidermal growth factor receptor pathway[J].
Clin Lung Cancer, 2009, 10(4): 281-9.
DOI: 10.3816/CLC.2009.n.039. |
| [2] |
Rizzolio S, Battistini C, Cagnoni GA, et al. Downregulating neuropilin-2 triggers a novel mechanism enabling EGFR-Dependent resistance to Oncogene-Targeted therapies[J].
Cancer Res, 2018, 78(4): 1058-68.
DOI: 10.1158/0008-5472.CAN-17-2020. |
| [3] |
Konda JD, Olivero M, Musiani D, et al. Heat-shock protein 27 (HSP27, HSPB1) is synthetic lethal to cells with oncogenic activation of Met, EGFR and BRAF[J].
Mol Oncol, 2017, 11(6): 599-611.
DOI: 10.1002/mol2.2017.11.issue-6. |
| [4] |
Liu Q, Yu SN, Zhao WH, et al. EGFR-TKIs resistance via EGFRindependent signaling pathways[J].
Mol Cancer, 2018, 17(53): 2-9.
|
| [5] |
Zhang KX, Yuan QQ. Current mechanism of acquired resistance to epidermal growth factor receptor-tyrosine kinase inhibitors and updated therapy strategies in human nonsmall cell lung cancer[J].
J Cancer Res Ther, 2016, 12(7, S): C131-7.
DOI: 10.4103/0973-1482.200613. |
| [6] |
Chaturvedi MM, Sung B, Yadav VR, et al. NF-κB addiction and its role in cancer: 'one size does not fit all'[J].
Oncogene, 2011, 30(14): 1615-30.
DOI: 10.1038/onc.2010.566. |
| [7] |
Spirina LV, Usynin YA, Yurmazov ZA, et al. Transcription factors NF-κB, HIF-1, HIF- 2, growth factor VEGF, VEGFR2 and carboanhydrase Ⅸ mRNA and protein level in the development of kidney cancer metastasis[J].
Mol Biol, 2017, 51(2): 328-32.
DOI: 10.1134/S0026893317020194. |
| [8] |
Chung S, Jin YL, Han BC, et al. Identification of EGF-NF-kappa BFOXC1 signaling axis in basal-like breast cancer[J].
Cell Commun Signal, 2017, 15(1): 22.
DOI: 10.1186/s12964-017-0180-3. |
| [9] |
Wang X, Chen Z, Li X, et al. Geraniin suppresses ovarian cancer growth through inhibition of NF-κB activation and downregulation of Mcl-1 expression[J].
J Biochem Mol Toxicol, 2017, 31(9): 32-3.
|
| [10] |
Bivona TG, Hieronymus H, Parker J, et al. FAS and NF- kappa B signalling modulate dependence of lung cancers on mutant EGFR[J].
Nature, 2011, 471(7339): 523-6.
DOI: 10.1038/nature09870. |
| [11] |
Hu Y, Zang JL, Cao HX, et al. Liver X receptors agonist GW3965 resensitizes gefitinib-resistant human non-small cell lung cancer cell to gefitinib treatment by inhibiting NF-kappa B in vitro[J].
Oncotarget, 2017, 8(9): 15802-14.
|
| [12] |
Giopanou I, Lilis I, Papaleonidopoulos VA, et al. Comprehensive evaluation of nuclear factor-kappa B expression patterns in NonSmall cell lung cancer[J].
PLoS One, 2015, 10(7): e0132527.
DOI: 10.1371/journal.pone.0132527. |
| [13] |
Véronique B, Davi C. Post-Translational modifications of RelB NF- _BSubunit and associated functions[J].
Cells, 2016, 5(22): 1-11.
|
| [14] |
Wenshu Chen, Zi Li, Lang Bai, Yong Lin. NF- kappaB, a mediator for lung carcinogenesis and a target for lung cancer prevention and therapy[J].
Front Biosci (Landmark Ed), 2011, 16: 1172-85.
DOI: 10.2741/3782. |
| [15] |
Hou A, Tin MQ, Tong L. Toll-like receptor 2-mediated NF-kappa B pathway activation in ocular surface epithelial cells[J].
Eye Vis (Lond), 2017, 4(17): 2-7.
|
| [16] |
Morotti A, Crivellaro S, Panuzzo C, et al. IκB-α: at the crossroad between oncogenic and tumor- suppressive signals[J].
Oncol Lett, 2017, 13(2): 531-4.
DOI: 10.3892/ol.2016.5465. |
| [17] |
Cildir G, Low KC, Tergaonkar V. Noncanonical NF- kappa B Signaling in Health and Disease[J].
Trends Mol Med, 2016, 22(5): 414-29.
DOI: 10.1016/j.molmed.2016.03.002. |
| [18] |
Postler TS, Ghosh S. Bridging the gap: A regulator of NF-kappa B linking inflammation and cancer[J].
J Oral Biosci, 2015, 57(3): 143-7.
DOI: 10.1016/j.job.2015.05.001. |
| [19] |
Krappmann D, Vincendeau M. Mechanisms of NF-kappa B deregulation in lymphoid malignancies[J].
Semin Cancer Biol, 2016, 39(2): 3-14.
|
| [20] |
Jiang N, Dong XP, Zhang SL, et al. Triptolide reverses the Taxol resistance of lung adenocarcinoma by inhibiting the NF-κB signaling pathway and the expression of NF- κB- regulated drugresistant genes[J].
Mol Med Rep, 2016, 13(1): 153-9.
DOI: 10.3892/mmr.2015.4493. |
| [21] |
Lin KL, Cheng JA, Yang T, et al. EGFR-TKI down-regulates PD-L1 in EGFR mutant NSCLC through inhibiting NF-kappa B[J].
Biochem Biophys Res Commun, 2015, 463(1/2): 95-101.
|
| [22] |
La Monica S, Caffarra C, Saccani FA, et al. Gefitinib inhibits invasive phenotype and epithelial-mesenchymal transition in drugresistant NSCLC cells with met amplification[J].
PLoS One, 2013, 8(10): e78656.
DOI: 10.1371/journal.pone.0078656. |
| [23] |
Tian R, Li Y, Gao M. Shikonin causes cell-cycle arrest and induces apoptosis by regulating the EGFR-NF-kappa B signalling pathway in human epidermoid carcinoma A431 cells[J].
Biosci Rep, 2015, 35(2): e00189.
|
| [24] |
Yang HF, Sun RQ, Ma N, et al. Inhibition of nuclear factor-kappa B signal by pyrrolidine dithiocarbamate alleviates lipopolysaccharideinduced acute lung injury[J].
Oncotarget, 2017, 8(29): 47296-304.
|
| [25] |
Zheng X, Lv J, Shen Q, et al. Synergistic effect of pyrrolidine dithiocarbamate and cisplatin in human cervical carcinoma[J].
Reprod Sci, 2014, 21(10): 1319-25.
DOI: 10.1177/1933719114525272. |
 2018, Vol. 38
2018, Vol. 38

