妊娠期肝内胆汁淤积症(ICP)是以皮肤瘙痒和黄疸为主要临床表现, 血清胆酸升高为主要生化特征的妊娠期疾病[1-2]。ICP常发生于妊娠中晚期, 可引起胎儿宫内窘迫、早产、死胎、死产等严重并发症, 对胎儿危害极大[3-4]。既往研究发现, 高浓度胆酸可以引起ICP孕妇胎盘组织凋亡相关蛋白表达增加及绒毛滋养细胞过度凋亡[5-9], 进而导致胎儿缺氧等不良妊娠结局的发生[10]。因此, 深入探讨高胆酸介导滋养细胞凋亡发生的分子机制是防治ICP胎儿宫内缺氧等不良妊娠结局的关键。内质网应激(ERS)是细胞对自身的一种自我保护反应, 但长期或过度的内质网应激则会造成细胞损伤甚至导致细胞调亡[11-14]。随着研究的不断深入, 发现滋养细胞的内质网应激是ICP胎盘的重要病理生理表现[15], 然而, 在高胆酸诱导的滋养细胞凋亡中是否有内质网应激的参与目前未见报道。本研究拟利用临床ICP孕妇胎盘组织及体外细胞模型, 进一步深入探讨内质网应激在ICP滋养细胞凋亡发生中的作用及机制。
1 材料和方法 1.1 实验材料选择南方医科大学附属南方医院2015年12月~ 2016年12月住院分娩的ICP孕妇20例为研究对象, 另以同期因社会因素行择期剖宫产术的20例无合并症的正常孕妇为正常对照组。ICP组孕妇和对照组孕妇的年龄分别为(29±4)岁和(27±2)岁, 两组间分别比较, 差异无统计学意义(P>0.05)。ICP组孕妇和对照组孕妇的母血中总胆汁酸水平分别为(45.0±19.4)和(3.5± 1.6)μmol/L, 两组间分别比较, 差异有统计学意义(P < 0.01)。本研究取得了所有受试对象的知情同意, 并且通过了南方医科大学附属南方医院伦理委员会的批准。ICP诊断参照中华医学会妇产科学分会产科学组2015年提出的妊娠期肝内胆汁游积症诊疗指南[16], 排除其他可能导致肝功能异常的疾病。所有研究对象均为单胎妊娠; 孕妇无吸烟、酗酒及长期服用药物史, 无高血压、糖原病、心脏病、肾脏病等妊娠合并症; 既往未发生过反复自然流产、胎儿崎形、死胎、死产等。
本研究所用的细胞系为永生化的人早孕滋养细胞系HTR-8/SVneo细胞, 由加拿大皇后大学Charles H. Graham教授惠赠。
主要试剂:培养基RPMI 1640和胎牛血清(GIBCO); 去氧胆酸(DCA, Sigma); GRP78、CHOP、caspase-3及caspase-7引物由上海生工公司合成; caspase-3活性检测试剂盒及caspase7活性检测试剂盒(碧云天)。
1.2 实验方法 1.2.1 标本收集胎盘娩出后5 min内于胎盘母体面脐带旁开2 cm左右处, 避开机化灶、钙化灶、出血灶迅速取胎盘组织4块, 每块约1.0 cm×1.0 cm×l.0 cm, 部分置于10%甲醛固定, 用于随后组织形态观察; 部分置于液氮中, 用于后续mRNA相关检测。
1.2.2 HE染色观察ICP胎盘组织形态胎盘组织经固定、脱水、透明、石蜡包埋及切片, 切片厚度为4 μm, 常规HE染色, 观测胎盘组织病理学改变。
1.2.3 胎盘组织RT-PCR检测通过Quick-RNA MiniPrep (Zymo Research)从胎盘组织提取总RNA, 随之使用Maxima First Strand Synthesis Kit(Thermo Scientific)从1 μg总RNA逆转录合成cDNA。采用SYBR Green PCR master mix(Applied Biosystems)通过StepOne Real-Time PCR System(Applied Biosystems)进行定量PCR, 扩增40个循环。主要检测GRP78、CHOP、caspase-3及caspase-7的mRNA表达水平。引物序列:
GRP78 F: CACGGTCTTTGACGCCAAG, R: CC AAATAAGCCTCAGCGGTTT;
CHOP F: GGAAACAGAGTGGTCATTCC, R: CT GCTTGAGCCGTTCATTCTC;
caspase-3 F: CATGGAAGCGAATCAATGGACT, R: CTGTACCAGACCGAGATGTCA;
caspase-7 F: CGGTCCTCGTTTGTACCGTC, R: CGCCCATACCTGTCACTTTATCA;
GAPDH F: GGAGCGAGATCCCTCCAAAAT, R: GGCTGTTGTCATACTTCTCATGG。上述引物序列来自于PrimerBank。
1.2.4 细胞培养及处理HTR-8/SVneo细胞系培养于含10%胎牛血清的1640培养基, 适时换掖及传代。细胞置于6孔板, 不同浓度去氧胆酸(10、50、100 μmol/L)处理细胞24 h后提取RNA, RT-PCR检测GRP78、CHOP、caspase-3及caspase-7 mRNA表达情况, RT-PCR方法同上。
1.2.5 蛋白印迹法检测GRP78、CHOP蛋白的表达水平取对数生长期细胞计数后按1:3比例接种于60 mm细胞培养皿内, 培养箱中预培养24 h后, 0、10、50、100 μmol/L去氧胆酸分别处理HTR-8/SVneo细胞6 h。取各组HTR-8/SVneo细胞, 根据总蛋白提取试剂盒提取细胞总蛋白, 用全自动生化分析仪(Beckman)测定蛋白质浓度。根据蛋白浓度取适量进行SDS-PAGE分离蛋白。将蛋白转移到硝酸纤维素膜后, 将膜置于含5%脱脂奶粉的TBST中摇床上封闭2 h, 用TBST洗膜10 min, 共3次, 分别用GRP78、CHOP和β-actin的Ⅰ抗按适当比例4 ℃孵育过夜, 再洗膜3次, 加入辣根过氧化物酶标记的抗兔IgG孵育2 h, 最后洗膜3×10 min, 进行显色, 胶片曝光, 结果用LabWork 3.0软件, 以目的条带/ β-actin的灰度值进行分析。实验重复3次。
1.2.6 细胞caspase-3、caspase-7活性检测细胞置于6孔板, 50 μmol/L去氧胆酸处理24 h, 采用caspase3活性检测试剂盒及caspase-7活性检测试剂盒分别检测caspase-3及caspase-7活性, 检测方法参考试剂说明。
1.2.7 透射电镜检测细胞凋亡形态细胞置于6孔板, 50 μmol/L去氧胆酸处理12 h, 收集细胞, 立即置于2.5%戊二醛固定, 经脱水、包埋、固化、超薄切片及染色, 利用透射电镜观察细胞凋亡情况。
1.3 统计学方法采用SPSS 16.0软件对数据进行统计学分析。计量资料均用Kolmogorov-Smirnov检验方法检验符合正态性分布, 采用均数±标准差表示, 组间比较采用t检验。两独立样本t检验方法检验其方差齐性, 采用单因素方差分析。以P < 0.05为差异有统计学意义。
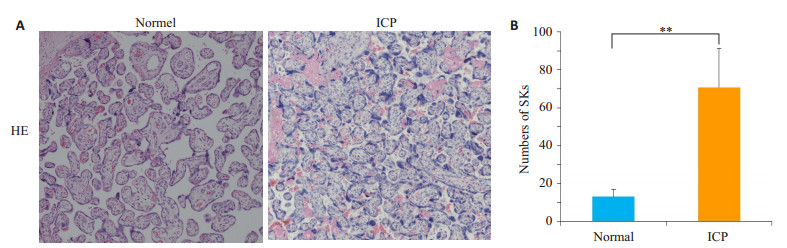
2 结果 2.1 ICP孕妇胎盘组织形态学异常HE染色显示, 与对照组孕妇比较, ICP组孕妇的胎盘组织可见合体细胞结节数量明显增多, 差异有统计学意义(P < 0.01, 图 1)。
|
图 1 ICP孕妇胎盘组织形态学异常 Figure 1 Histological abnormalities of the trophoblasts in ICP placenta. A: Histological observation of the trophoblasts in normal and ICP placentas. Arrows indicate the syncytial knots (SKs)(Original magnification: ×200); B: Number (Mean±SD) of SKs in the placenta (averaged from at least 4 fields per section; n=20). **P < 0.01. |
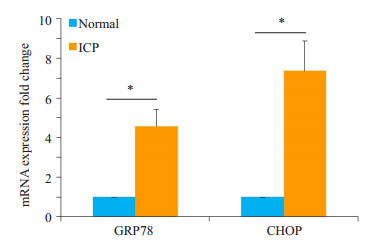
GRP78及CHOP被认为是内质网应激反应的标志分子, 我们采用RT-PCR法检测对照组及ICP组孕妇胎盘组织中GRP78及CHOP mRNA的表达, 结果表明ICP组GRP78及CHOP mRNA的表达水平明显高于对照组, 且存在显著性差异(P < 0.05, 图 2)。
|
图 2 ICP孕妇胎盘组织GRP78及CHOP mRNA表达增高 Figure 2 mRNA expression of GRP78 and CHOP were significantly higher in ICP placenta. GRP78 and CHOP mRNA levels were detected by RT-PCR (n= 20). The data are shown as Mean±SD. *P < 0.05. |
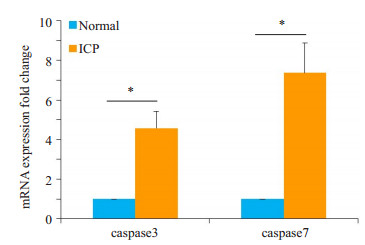
同样采用RT-PCR法检测对照组及ICP组孕妇胎盘组织中凋亡相关蛋白caspase-3及caspase-7 mRNA的表达, 结果表明ICP组caspase-3及caspase-7 mRNA的表达水平明显高于对照组, 且存在显著性差异(P < 0.05, 图 3)。
|
图 3 ICP孕妇胎盘组织caspase-3 and caspase-7 mRNA表达增高 Figure 3 mRNA expression of caspase-3 and caspase-7 were significantly higher in ICP placenta as detected by RT-PCR (n=20). The data are shown as Mean±SD. *P < 0.05. |
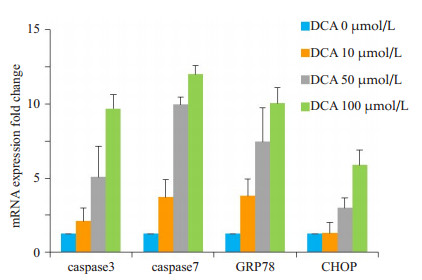
去氧胆酸是主要的疏水性胆酸成分, 不同浓度(10、50、100 μmol/L)去氧胆酸作用细胞24 h后, RT-PCR法检测内质网应激及细胞凋亡相关蛋白。结果发现, GRP78、CHOP、caspase-3及caspase-7 mRNA的表达水平较对照组显著上升, 且存在浓度依赖效应(图 4)。
|
图 4 去氧胆酸上调HTR- 8/SVneo细胞中GRP78、CHOP、caspase-3及caspase-7 mRNA的表达 Figure 4 Upregulated mRNA expressions of GRP78, CHOP, caspase-3, and caspase-7 detected by RT-PCR in HTR-8/ SVneo cells treated with DCA at 10, 50, and 100 µmol/L for 24 h. Data are shown as Mean±SD. |
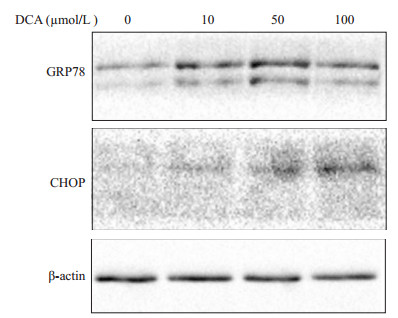
不同浓度(10、50、100 μmol/L)去氧胆酸作用细胞24 h后, 蛋白印迹法检测GRP78、CHOP蛋白的表达水平。结果发现, GRP78、CHOP蛋白的表达水平较对照组显著上升, 且存在浓度依赖效应(图 5)。
|
图 5 去氧胆酸上调HTR- 8/SVneo细胞中GRP78、CHOP蛋白的表达 Figure 5 Upregulated protein expressions of GRP78 and CHOP detected by Western blotting in HTR- 8/SVneo cells treated with DCA at 10, 50, and 100 µmol/L for 24 h. |
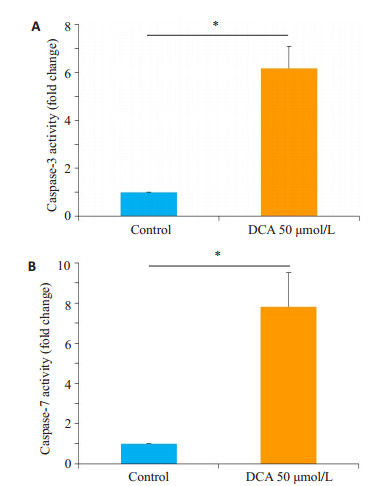
50 μmol/L去氧胆酸作用细胞24 h后, 收集细胞, 采用caspase-3及caspase-7活性检测试剂盒检测其活化程度。50 μmol/L去氧胆酸处理后, 细胞caspase-3及caspase-7活化程度较对照组显著增高, 且具有统计学差异(P < 0.05, 图 6)。
|
图 6 去氧胆酸增高HTR- 8/SVneo细胞中caspase-3及caspase-7的活性 Figure 6 DCA treatment at 50 μmol/L for 24 h upregulated the levels of caspase-3 (A) and caspase-7 (B) activity in HTR-8/SVneo cells. Data are shown as Mean±SD. *P < 0.05. |
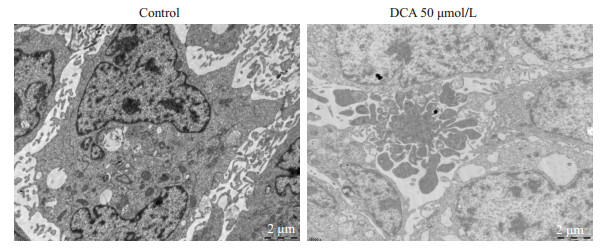
50 μmol/L去氧胆酸作用细胞12 h后, 收集细胞, 采用透射电镜观测细胞凋亡形态, 与对照组相比, 50 μmol/L去氧胆酸处理后, 细胞呈现明显的凋亡小体(图 7)。
|
图 7 去氧胆酸促进HTR-8/SVneo细胞凋亡小体形成 Figure 7 DCA treatment at 50 μmol/L for 12 h promoted the formation of apoptotic bodies in HTR-8/ SVneo cells (electron microscopy, ×10 000). |
ICP是一种重要的妊娠期并发症, 主要导致围产儿死亡率增加。ICP以母血总胆汁酸水平升高为主要生化特征, 去氧胆酸为其主要成分。胎盘是母儿间进行物质交换的重要器官, 胎盘功能障碍可干扰孕妇与胎儿间胆汁酸的正常转运。Zhang等[17]对ICP孕妇胎盘组织进行蛋白质组学分析, 发现与正常孕妇胎盘组织比较, 差异蛋白主要与氧化应激、内质网应激、脂质代谢、凋亡等细胞生物学过程有关。
内质网是真核细胞中一种多功能细胞器, 参与蛋白质翻译后的修饰、折叠和寡聚化[18-19]。钙稳态失衡、营养或能量缺乏等病理情况都可破坏内质网的自我平衡能力, 引起蛋白的错误折叠, 进而激活内质网应激反应[20-21], 使编码GRP78等蛋白的基因表达增加, 恢复蛋白质正确构象; 但长期或过度的内质网应激反应则会造成细胞损伤甚至导致细胞调亡[11]。Bernstein等[22]在胆汁性肝硬化的研究中发现, 通过去氧胆酸刺激肝细胞系HepG细胞48 h后, 细胞内GRP78的表达明显增强, 提示胆酸刺激可使肝细胞发生内质网应激。Yu等[15]利用透射电镜观察ICP孕妇胎盘组织滋养细胞, 发现内质网较正常孕妇有明显的扩张及肿胀性改变, 使用甘胆酸刺激Swan71细胞后, 发现内质网肿胀明显, GRP78 mRNA和蛋白的表达水平升高。本研究采用RT-PCR法检测对照组及ICP组孕妇胎盘组织中GRP78及CHOP mRNA的表达, 结果发现ICP组GRP78及CHOP mRNA的表达水平明显高于对照组, 该结果提示, 在ICP孕妇的绒毛滋养细胞中存在内质网应激。进一步的体外细胞实验同样发现, 不同浓度去氧胆酸刺激可以显著增加HTR-8/SVneo细胞中GRP78及CHOP mRNA表达水平及蛋白表达水平, 且呈浓度依赖效应。我们所观察到的现象与以往的研究类似, 内质网应激存在于ICP胎盘滋养细胞, 且可能是ICP病理发生的机制之一。与以往研究不同的是, 我们发现去氧胆酸是内质网应激的关键刺激物, 可诱导显著的内质网应激反应。就去氧胆酸的物理性质而言, 其具有较好的脂溶性, 可以溶解细胞膜膜脂, 引起细胞膜通透性增加, 具有较强的细胞毒性。是否去氧胆酸的浓度可以作为胎儿不良结局的早期诊断指标或预后的相关性指标, 需要结合临床做进一步探讨。
研究证实, 严重的内质网应激发生时, 前凋亡基因CHOP/GADD153的转录显著上调[23-25], CHOP/GADD153的过度表达也可导致细胞凋亡的发生。ICP孕妇胎盘组织中存在凋亡相关基因表达平衡的破坏, 进而导致绒毛滋养细胞过度凋亡[5]。Du等[26]利用石胆酸体外刺激合体滋养细胞, 发现石胆酸可通过上调TNF-α的表达介导细胞凋亡。本研究发现ICP组孕妇胎盘组织中凋亡相关基因caspase-3及caspase-7 mRNA的表达水平明显高于对照组。随后进一步体外细胞实验表明, 不同浓度去氧胆酸处理HTR- 8/SVneo细胞, caspase-3及caspase-7 mRNA的表达水平较对照组显著上升, 且存在浓度依赖效应; 同时caspase-3及caspase-7活化程度显著增加; 透射电镜观测可发现典型的凋亡小体, 提示去氧胆酸处理可诱导细胞发生明显凋亡。细胞凋亡参与众多疾病的发生, 如糖尿病、肿瘤、神经退行性疾病等。我们的实验表明去氧胆酸诱导的内质网应激可产生显著的细胞凋亡。正如前述, 细胞凋亡参与了ICP的发生发展, 但对于凋亡的诱导因素, 目前仍不清楚。我们的研究为该致病机制提供了一条线索, 即去氧胆酸是诱导滋养细胞发生凋亡的关键因素, 且介导的内质网应激可能是其发生的主要机制之一。
综上所述, 去氧胆酸可以呈浓度依赖性地促进滋养细胞内质网应激相关基因mRNA和蛋白的表达, 引起细胞凋亡, 提示内质网应激介导的滋养细胞凋亡在ICP的发病机制中可能起着重要的作用。这将为ICP发病机制的研究开辟一个全新的切入点, 为早期预防和干预ICP患者胎儿宫内缺氧等不良妊娠结局的发生提供治疗的新靶标。
| [1] |
Geenes V, Chappell LC, Seed PT, et al. Association of severe intrahepatic cholestasis of pregnancy with adverse pregnancy outcomes: a prospective population-based case-control study[J].
Hepatology, 2014, 59(4): 1482-1491.
DOI: 10.1002/hep.26617. |
| [2] |
Ozkan S, Ceylan Y, Ozkan OV, et al. Review of a challenging clinical issue: Intrahepatic cholestasis of pregnancy[J].
World J Gastroenterol, 2015, 21(23): 7134-41.
DOI: 10.3748/wjg.v21.i23.7134. |
| [3] |
Henderson CE, Rezai S, Mercado R. The risk of infant and fetal death by each additional week of expectant management in intrahepatic cholestasis of pregnancy by gestational age[J].
Am J Obst Gynecol, 2015, 212(1): S52-3.
|
| [4] |
Pilliod RA, Page J, Snowden J, et al. 110: The small for gestational age fetus: risk of stillbirth and infant death by each additional week of expectant management[J].
Am J Obst Gynecol, 2016, 214(1): S77.
|
| [5] |
王冬梅, 朱启英, 丁丽, 等. 妊娠肝内胆汁淤积症患者胎盘细胞凋亡及调控基因的研究[J].
中华妇产科杂志, 2003(1): 8-10.
|
| [6] |
Geenes VL, Lim YH, Bowman N, et al. A placental phenotype for intrahepatic cholestasis of pregnancy[J].
Placenta, 2011, 32(12): 1026-32.
DOI: 10.1016/j.placenta.2011.09.006. |
| [7] |
Shemer EW, Thorsell M, Ostlund E, et al. Stereological assessment of placental morphology in intrahepatic cholestasis of pregnancy[J].
Placenta, 2012, 33(11): 914-8.
DOI: 10.1016/j.placenta.2012.08.005. |
| [8] |
Zhang Y, Hu L, Cui Y, et al. Roles of PPARγ/NF-κB signaling pathway in the pathogenesis of intrahepatic cholestasis of pregnancy[J].
Plos One, 2014, 9(1): e87343.
DOI: 10.1371/journal.pone.0087343. |
| [9] |
Dixon PH, Williamson C. The pathophysiology of intrahepatic cholestasis of pregnancy[J].
Clin Res Hepatol Gastroenterol, 2016, 40(2): 141.
DOI: 10.1016/j.clinre.2015.12.008. |
| [10] |
Chen J, Deng W, Wang J, et al. Primary bile acids as potential biomarkers for the clinical grading of intrahepatic cholestasis of pregnancy[J].
Int J Gynecol Obste, 2013, 122(1): 5-8.
DOI: 10.1016/j.ijgo.2013.02.015. |
| [11] |
Kim R, Emi M, Tanabe K, et al. Role of the unfolded protein response in cell death[J].
Apoptosis, 2006, 11(1): 5-13.
DOI: 10.1007/s10495-005-3088-0. |
| [12] |
Malhi H, Kaufman R J. Endoplasmic reticulum stress in liver disease[J].
J Hepatology, 2011, 54(4): 795-809.
DOI: 10.1016/j.jhep.2010.11.005. |
| [13] |
Olivier P, Albin P, Corinne A. The unfolded protein response and cellular senescence. A review in the theme: cellular mechanisms of endoplasmic reticulum stress signaling in health and disease[J].
Am J Physiol Cell Physiol, 2015, 308(6): 415-25.
DOI: 10.1152/ajpcell.00334.2014. |
| [14] |
Cybulsky AV. Endoplasmic reticulum stress, the unfolded protein response and autophagy in kidney diseases[J].
Nat Rev Nephrol, 2017, 13(11): 681.
DOI: 10.1038/nrneph.2017.129. |
| [15] |
俞颖, 周承亮, 俞田田, 等. 滋养细胞的内质网应激在妊娠期肝内胆汁淤积症中的作用[J].
中华妇产科杂志, 2017, 52(6): 392-7.
|
| [16] |
贺晶, 杨慧霞, 段涛, 等. 妊娠期肝内胆汁淤积症诊疗指南(2015)[J].
临床肝胆病杂志, 2015, 31(10): 1575-8.
DOI: 10.3969/j.issn.1001-5256.2015.10.003. |
| [17] |
Zhang T, Guo Y, Guo X, et al. Comparative proteomics analysis of placenta from pregnant women with intrahepatic cholestasis of pregnancy[J].
Plos One, 2013, 8(12): e83281.
DOI: 10.1371/journal.pone.0083281. |
| [18] |
Çetinkaya S, Dursun HG. Cell life and death decision in endoplasmic reticulum stress[J]. 2016, 6(2): 56-63.
|
| [19] |
Márton M, Kurucz A, Lizák B, et al. A systems biological view of life-and-death decision with respect to endoplasmic reticulum stressthe role of PERK pathway[J].
Int J Mol Sc, 2017, 18(1): 58.
DOI: 10.3390/ijms18010058. |
| [20] |
Hetz C, Saxena S. ER stress and the unfolded protein response in neurodegeneration[J].
Nat Rev Neurol, 2017, 13(8): 477-91.
DOI: 10.1038/nrneurol.2017.99. |
| [21] |
Thomas Rutkowski D. Liver function and dysfunction: a unique window into the physiological reach of ER stress and the unfolded protein response[J]. Febs J, 2018 Jan 23. doi: 10.1111/febs.14389.[Epubaheadofprint].
|
| [22] |
Bernstein H, Payne CM, Bernstein C, et al. Activation of the promoters of genes associated with DNA damage, oxidative stress, ER stress and protein malfolding by the bile salt, deoxycholate[J].
Toxicology letters, 1999, 108(1): 37-46.
DOI: 10.1016/S0378-4274(99)00113-7. |
| [23] |
Sánchez AM, Martínez-Botas J, Malagarie-Cazenave S, et al. Induction of the endoplasmic reticulum stress protein GADD153/ CHOP by capsaicin in prostate PC-3 cells: a microarray study[J].
Biochem Biophy Res Communi, 2008, 372(4): 785-791.
DOI: 10.1016/j.bbrc.2008.05.138. |
| [24] |
Ying Y, Gao Y Y, Liu BQ, et al. Resveratrol-induced cytotoxicity in human Burkitt's lymphoma cells is coupled to the unfolded protein response[J].
BMC Cancer, 2010, 10(1): 445.
DOI: 10.1186/1471-2407-10-445. |
| [25] |
Li G, Petiwala S, Pierce D, et al. Abstract 3676: Selective modulation of CHOP/GADD153 in prostate cancer cells by alpha-mangostin promotes cell death[J].
Cancer Res, 2013, 73(8 Suppl): 3676.
|
| [26] |
Du Q, Zhang Y, Pan Y, et al. Lithocholic acid- induced placental tumor necrosis factor-alpha upregulation and syncytiotrophoblast cell apoptosis in intrahepatic cholestasis of pregnancy[J].
Hepatol Res, 2014, 44(5): 532-41.
DOI: 10.1111/hepr.2014.44.issue-5. |
 2018, Vol. 38
2018, Vol. 38

