高胆红素血症是新生儿常见的临床症状, 未结合胆红素透过血脑屏障沉积于中枢神经系统, 导致部分患儿发生胆红素诱导的神经功能障碍, 甚至胆红素脑病。在近期, 国内一项多中心临床研究表明[1], 国内33家医院2009年共收治348例新生儿胆红素脑病患者, 可见该病在我国并不少见。虽然目前蓝光光疗、换血等医疗技术的降低了胆红素脑病的发生, 但该治疗只能降低血清未结合胆红素水平, 无法置换沉积于神经细胞的胆红素, 不能逆转已发生的神经损伤。目前研究认为, 胆红素透过血脑屏障沉积于神经细胞, 通过氧化应激、内质网应激、神经退行性变等, 导致细胞死亡和神经炎症发生[2-4]。但是研究表明通过各种方法调控神经细胞死亡的相关途径并不能发挥有效的神经保护作用[5], 而且, 调控胆红素诱导的炎症反应缺乏关键的靶点, 通过抑制单一炎症因子释放发挥的保护效果也不理想。
Caspase-1, 也称为IL-1β转化酶, 是半胱氨酸天冬氨酸特异性蛋白酶家族的一员, 近年来发现其在调控细胞死亡和炎症反应中发挥重要作用, 可成为调控二者的新靶点[6]。最初在感染性疾病中发现, 细菌、病毒等感染后可诱导caspase-1活化, 发生依赖于caspase-1的细胞程序性死亡[7-9]。近年来, 在细菌性脑膜炎、创伤性脑损伤和阿尔兹海默症等多种神经系统疾病中证实caspase-1也发挥重要作用, 活化的caspase-1剪切IL-1β、IL-18前体, 使之成为有活性的细胞因子, 参与炎症反应, 导致细胞损伤甚至死亡, 抑制其活化可减少炎症因子释放, 发挥神经保护作用[10-12]。本课题组前期研究表明[13], 胆红素可诱导原代培养星形胶质细胞中caspase-1活化, 抑制其活化可发挥神经保护作用。VX-765作为caspase-1特异性抑制剂, 可透过血脑屏障, 在癫痫的动物模型以及Ⅱ期临床研究中显示出良好的安全性及治疗效果, 有良好的应用前景[14-15]。
本研究旨在探究caspase-1活化在胆红素诱导的原代培养海马神经元中的作用, 及应用VX-765抑制caspase-1活化能否通过减少神经元死亡及减轻炎症反应发挥神经保护作用, 为胆红素脑损伤的防治提供新的方法。
1 材料和方法 1.1 实验动物SPF级SD大鼠(许可证号: SYXK (渝) 2017-0012重庆医科大学附属儿童医院), 体质量250±30 g, 雌雄1: 1合笼, 见到脱落的阴栓为交配成功(孕0 d)。
1.2 试剂和仪器DMED/F12培养基、胎牛血清, B27 (Gibco), 胰蛋白酶、多聚赖氨酸、胆红素、台盼蓝、二甲基亚砜(DMSO)、3(- 4, 5-二甲基噻唑-2) -2, 5-二苯基四氮唑溴盐(MTT)(Sigma), NLRP3、Caspase-1、β-actin抗体(Abcam), VX-765 (Selleck), LDH细胞毒性试剂盒(碧云天), IL-18 ELISA检测试剂盒(武汉优尔生)。CO2细胞培养箱(Thermo), 酶标仪(Bio-Tek), ECL成像仪(Bio-Rad), 倒置相差显微镜(Olympus)。
1.3 方法 1.3.1 大鼠海马神经元原代培养参照文献[16], 无菌条件下取孕17~19 d SD大鼠胎鼠, 快速断头取脑, 分离海马置于DMED/F12培养基, 经机械剪碎、胰酶消化制备单细胞悬液, 调整密度后接种于多聚赖氨酸包被的T 75 cm2培养瓶中, 5% CO2细胞培养箱孵育。接种后6~ 10 h用含2% B27无血清DMED/F12培养基全量换液, 之后每3 d半量换液1次。
1.3.2 药物配置及实验分组胆红素溶于DMSO配成17.1 mmol/L溶液, -20 ℃保存, 实验时胆红素组加入胆红素溶液50 μmol/L。VX-765溶于DMSO配成50 mmol/L溶液, -20 ℃保存, 实验时VX-765组加入VX-765溶液50 μmol/L。细胞培养5 d后, 随机分为胆红素组、对照组、VX-765组, 胆红素组给予胆红素(50 μmol/L), 对照组给予同体积DMSO, VX-765组在胆红素干预前1 h给予VX-765 (50 μmol/L)。
1.3.3 Western blot检测细胞中caspase-1及NLRP3蛋白表达各组细胞干预至相应时间点, 用Western及IP细胞裂解液提蛋白, BCA法测定蛋白浓度后按照Western blot标准步骤进行电泳、转膜, 5%脱脂牛奶封闭, 一抗(caspase-1、NLRP3或β-actin) 4 ℃冷库孵育过夜, 洗膜后二抗室温孵育1.5 h, 洗膜后ECL显影。
1.3.4 改良MTT法测定细胞相对存活率改良MTT法, 检测胆红素作用24 h各组细胞的相对存活率。酶标仪(波长570 nm)检测各孔吸光度A570 nm。对照组细胞存活率标化为100%, 计算细胞相对存活率(%) =各组A570 nm/对照组A570 nm×100%。
1.3.5 原代培养上清液LDH的测定按照试剂盒说明书操作, 酶标仪(波长490 nm)检测胆红素作用24 h各组细胞的吸光度A490 nm。LDH释放率(%) = (处理样品吸光度-样品对照孔吸光度) /(细胞最大酶活性吸光度-样品对照孔吸光度) ×100%。
1.3.6 台盼蓝染色测定细胞死亡率按照使用说明配置台盼蓝溶液, 胆红素作用24 h后用细胞计数板于倒置相差显微镜下计数各组细胞台盼蓝染色阳性率。细胞死亡率(%) =染色细胞数/细胞总数×100%。
1.3.7 ELISA法检测原代培养上清液IL-18表达细胞分组处理后收集细胞培养上清液, 按照说明书, 酶标仪(波长450 nm), 检测各孔吸光度, 建立回归方程计算得到相应样品浓度(pg/mL)。
1.4 统计学分析采用SPSS 17.0软件进行统计分析, 计量资料经正态及方差齐性检验后多组间比较采用单因素方差分析, 数据用均数±标准差表示, P < 0.05认为差异有统计学意义。
2 结果 2.1 胆红素诱导原代培养大鼠海马神经元NLRP3、caspase-1表达情况Western blot结果显示, 胆红素作用神经元3、6 h活化caspase-1表达与对照组相比明显升高(P < 0.05), 1、12和24 h与对照组相比无统计学差异(P>0.05图 1A、B)。胆红素作用神经元3、6 h NLRP3表达与对照组相比明显升高(P < 0.05), 1、12和24 h与对照组相比无统计学差异(P>0.05, 图 1A、C)。
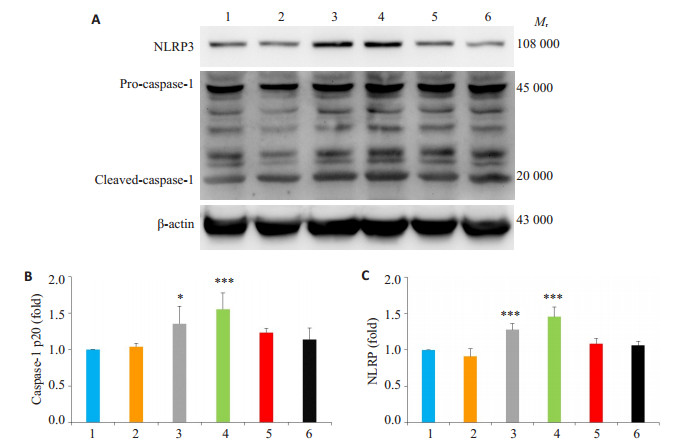
|
图 1 胆红素诱导原代培养大鼠海马神经元各时间点NLRP3、caspase-1表达 Figure 1 Western blotting for detecting expression of NLRP3 and activated caspase-1 in cultured rat hippocampal neurons treated with bilirubin. 1: Control group; 2: Bilirubin treatment for 1 h; 3: Bilirubin treatment for 3 h; 4: Bilirubin treatment for 6 h; 5: Bilirubin treatment for 12 h; 6: Bilirubin treatment for 24 h. *P < 0.05, ***P < 0.001 vs control group. |
Western blot结果显示, 原代培养大鼠海马神经元分组干预3 h, VX-765组活化caspase-1表达明显低于胆红素组(P=0.0063), 与对照组相比无统计学差异(P> 0.05, 图 2A、C)。原代培养大鼠海马神经元分组干预6 h, VX-765组活化caspase-1表达明显低于胆红素组(P= 0.002), 与对照组相比无统计学差异(P>0.05, 图 2B、D)。
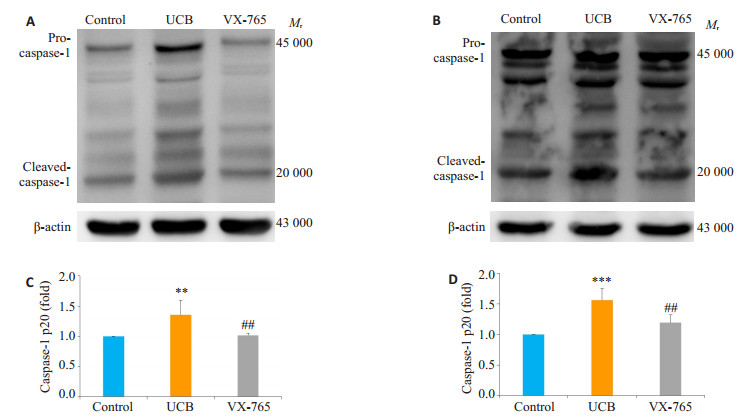
|
图 2 各组原代培养大鼠海马神经元3、6 h caspase-1表达 Figure 2 VX-765 treatment for 3 h (A, C) and 6 h (B, D) inhibits caspase-1 activation after bilirubin exposure as shown by Western blotting. UCB: Bilirubin group; VX-765: VX-765+bilirubin group. **P < 0.01, ***P < 0.001 vs control group; ##P < 0.01 vs bilirubin group. |
原代培养大鼠海马神经元分组干预24 h, 对照组、胆红素组和VX-765组的相对存活率分别为100%, (57.340±3.104)%, (84.020±2.311)%。VX-765组细胞相对存活率较胆红素组明显提高(P < 0.001), 低于对照组(P < 0.001, 图 3)。
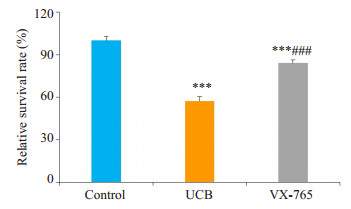
|
图 3 各组原代培养大鼠海马神经元相对存活率(改良MTT法) Figure 3 Relative survival rates of hippocampal neurons assessed using a modified MTT assay. UCB: Bilirubin group; VX-765: VX- 765 + bilirubin group. ***P < 0.001 vs control group, ###P < 0.001vs bilirubin group. |
原代培养大鼠海马神经元分组干预24 h, 对照组、胆红素组和VX-765组的LDH释放率分别为(6.524± 0.332)%, (19.540±1.497)%, (10.780±1.577)%。VX- 765组LDH释放率较胆红素组明显减少(P < 0.001), 高于对照组(P=0.000, 图 4)。
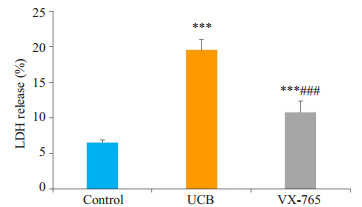
|
图 4 各组原代培养大鼠海马神经元LDH释放率(比色法) Figure 4 LDH release rate in the hippocampal neurons assessed using calorimetric method. UCB: Bilirubin group; VX- 765: VX- 765 + bilirubin group. ***P < 0.001 vs control group, ###P < 0.001 vs bilirubin group. |
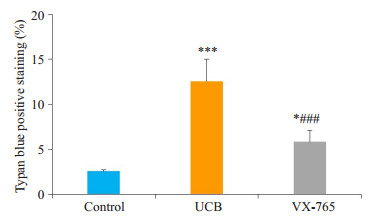
各组原代培养大鼠海马神经元分组干预24 h, 在倒置相差显微镜下观察计数, 对照组、胆红素组和VX-765组的台盼蓝染色阳性率分别为(2.575 ± 0.126)%, (12.580±2.474)%, (5.580±1.234)%。VX-765组台盼蓝染色阳性率较胆红素组明显降低(P=0.0006), 高于对照组(P=0.0424, 图 5)。
|
图 5 各组原代培养大鼠海马神经元台盼蓝染色阳性率 Figure 5 Result of Typan blue staining of the hippocampal neurons. UCB: Bilirubin group; VX-765: VX-765+bilirubin group. *P < 0.05, ***P < 0.001 vs control group; ###P < 0.001vs bilirubin group. |
按照试剂盒说明书进行检测, 结果显示胆红素诱导各时间点, 对照组、胆红素组和VX-765组相比上清液中IL-18含量均低于试剂盒可检测的下限。
3 讨论游离胆红素作为脂溶性的小分子物质, 既可作为外源性信号作用于Toll样受体(TLRs), 又可直接进入细胞, 激活胞内炎症相关信号通路, 导致胆红素诱导的神经功能障碍。本研究为了更好地模拟临床中高胆红素血症患儿血清胆红素水平, 根据实验室和临床研究报道选择50 μmol/L胆红素浓度, 符合绝大多数患儿血清胆红素水平[17-19]。结果表明在该浓度胆红素诱导下可导致原代培养海马神经元caspase-1活化, 破坏胞膜完整性使LDH大量释放, 降低细胞活性, 细胞死亡率明显升高; VX-765可抑制caspase-1活化, 减少LDH释放, 提高细胞活性, 显著降低细胞死亡率。但值得注意的是, 胆红素作用后原代培养神经元的上清中IL-18的含量远低于可检测的下限。文献报道在相同条件下, IL-1β的含量也低于可检测的范围[20]。表明胆红素诱导caspase-1活化使神经元损伤死亡, 可能不是通过促进IL-1β、IL-18成熟释放, 加剧炎症反应这一途径实现的。Le Feuvre等发现[21], caspase-1参与ATP刺激导致的巨噬细胞死亡, caspase-1−/−组细胞LDH释放显著减少, 细胞存活率明显增加, 但是IL-1β−/−、IL-18−/−却不能发挥相同的保护作用。由此可见, 该实验中caspase-1活化导致巨噬细胞损伤死亡, 不是IL-1β、IL-18释放引起炎症反应导致的。Kotas等发现[22], caspase-1在调节脂质代谢中发挥作用, caspase-1−/−组老鼠甘油三酯的清除较对照组显著加快, 血清甘油三酯循环和脂肪酸含量也明显减少, 而IL-1β−/−、IL-18−/−组老鼠的脂肪代谢水平与对照组相比没有明显变化。综上可知, 剪切释放炎症因子IL-1β、IL-18, 促进炎症反应并不是caspase-1发挥作用的唯一途径。虽然, 在多种疾病的体内外实验中证实, caspase-1活化促进炎症因子释放、导致细胞损伤, 但是, caspase-1的作用复杂且广泛。有研究报道, 在角质细胞、肝细胞、心肌细胞等非免疫性细胞中, 活化的caspase-1通过调控细胞保护反应、组织修复、细胞死亡等发挥保护性作用, 而且caspase-1活化不伴随IL- 1β、IL-18等炎症因子的释放增加[23-25]。UVB诱导原代培养皮肤角质细胞的caspase-1活化, 发挥保护作用[24]。肝细胞经历氧化应激后, 活化caspase-1限制线粒体活性氧的过度释放, 发挥保护作用[25]。因此, 在不同刺激条件下、不同类型细胞中, caspase-1发挥的作用可能不完全相同, 具体的机制尚待进一步研究。
NLRP3炎症小体是炎性体NLR家族成员之一, 由NOD样受体家族成员NLRP3、凋亡相关点样蛋白和caspase-1前体构成, 是目前研究最多的一种炎症小体[26]。它不仅能被细菌、病毒等病原体激活, 还能被体内自身产生的“危险信号”如: ATP、尿酸盐、淀粉样蛋白等激活[10-11, 27]。Caspase-1调节脂质代谢不通过炎症因子IL-1β、IL-18途径, 仍依赖于NLRP3炎症小体, 而且脂肪刺激可导致NLRP3炎症小体活化, 参与脂肪代谢的调节(具体不详) [22]。本研究在胆红素作用原代培养的神经元中发现, NLRP3蛋白的表达与caspase-1活化随胆红素作用时间出现一致性变化。据此推测, 本研究中胆红素作为刺激因素可能激活NLRP3炎症小体。但是, 炎症小体如何调控caspase-1发挥作用, 是否还有其他机制参与caspase-1介导的胆红素神经毒性, 目前仍不清楚。
综上所述, 在原代培养的大鼠海马神经元中, caspase-1活化参与胆红素神经毒性的发生, VX-765抑制caspase-1活化, 发挥神经保护作用。该发现可能成为防治胆红素脑损伤潜在的新靶点, 但具体机制尚待进一步研究。
| [1] |
中国新生儿胆红素脑病研究协作组中华医学会儿科学分会新生儿学组. 中国新生儿胆红素脑病的多中心流行病学调查研究[J].
中华儿科杂志, 2012, 50(5): 331-5.
|
| [2] |
Watchko JF, Tiribelli C. Bilirubin-Induced neurologic damagemechanisms and management approaches[J].
N Engl J Med, 2013, 369(21): 2021-30.
DOI: 10.1056/NEJMra1308124. |
| [3] |
Vodret S, Bortolussi G, Jasprova J, et al. Inflammatory signature of cerebellar neurodegeneration during neonatal hyperbilirubinemia in Ugt1(-/-) mouse model[J].
J Neuroinflammation, 2017, 14(1): 64.
DOI: 10.1186/s12974-017-0838-1. |
| [4] |
Tiribelli C, Ostrow JD. The molecular basis of bilirubin encephalopathy and toxicity: report of an EASL Single Topic Conference, Trieste, Italy, 1-2 October, 2004[J].
J Hepatol, 2005, 43(1): 156-66.
DOI: 10.1016/j.jhep.2005.04.003. |
| [5] |
Li M, Song S, Li S, et al. The blockade of NF-κB activation by a specific inhibitory peptide has a strong neuroprotective role in a Sprague- Dawley rat kernicterus model[J].
J Biol Chem, 2015, 290(50): 30042-52.
DOI: 10.1074/jbc.M115.673525. |
| [6] |
Sollberger G, Strittmatter GE, Garstkiewicz M, et al. Caspase-1: the inflammasome and beyond[J].
Innate Immun, 2014, 20(2): 115-25.
DOI: 10.1177/1753425913484374. |
| [7] |
Miao EA, Leaf IA, Treuting PM, et al. Caspase-1-induced pyroptosis is an innate immune effector mechanism against intracellular bacteria[J].
Nat Immunol, 2010, 11(12): 1U94-136.
|
| [8] |
Vande Walle L, Lamkanfi M. Inflammasomes: caspase-1-activating platforms with critical roles in host defense[J].
Front Microbiol, 2011, 2: 3.
|
| [9] |
Mamik MK, Hui E, Branton WG, et al. HIV- 1 viral protein R activates NLRP3 inflammasome in microglia: implications for HIV- 1 associated neuroinflammation[J].
J Neuroimmune Pharmacol, 2017, 12(2): 233-48.
DOI: 10.1007/s11481-016-9708-3. |
| [10] |
Zhou K, Shi LG, Wang Y, et al. Recent advances of the NLRP3 inflammasome in central nervous system disorders[J].
J Immunol Res, 2016, 2016: 9238290.
|
| [11] |
Heneka MT, Kummer MP, Stutz A, et al. NLRP3 is activated in Alzheimer's disease and contributes to pathology in APP/PS1 mice[J].
Nature, 2013, 493(7434): 674-8.
|
| [12] |
Liu W, Chen Y, Meng J, et al. Ablation of caspase-1 protects against TBI-induced pyroptosis in vitro and in vivo[J].
J Neuroinflammation, 2018, 15(1): 48.
DOI: 10.1186/s12974-018-1083-y. |
| [13] |
Feng J, Li MW, Wei Q, et al. Unconjugated bilirubin induces pyroptosis in cultured rat cortical astrocytes[J].
J Neuroinflammation, 2018, 15(1): 23.
DOI: 10.1186/s12974-018-1064-1. |
| [14] |
Bialer M, Johannessen SI, Levy RH, et al. Progress report on new antiepileptic drugs: A summary of the eleventh eilat conference (EILAT XI)[J].
Epilepsy Res, 2013, 103(1): 2-30.
DOI: 10.1016/j.eplepsyres.2012.10.001. |
| [15] |
Noe FM, Polascheck N, Frigerio F, et al. Pharmacological blockade of IL-1 beta/IL-1 receptor type 1 axis during epileptogenesis provides neuroprotection in two rat models of temporal lobe epilepsy[J].
Neurobiol Dis, 2013, 59: 183-93.
DOI: 10.1016/j.nbd.2013.07.015. |
| [16] |
Silva RF, Rodrigues CM, Brites D. Rat cultured neuronal and glial cells respond differently to toxicity of unconjugated bilirubin[J].
Pediatr Res, 2002, 51(4): 535-41.
DOI: 10.1203/00006450-200204000-00022. |
| [17] |
Brites D. The evolving landscape of neurotoxicity by unconjugated bilirubin: role of glial cells and inflammation[J].
Front Pharmacol, 2012, 3: 88.
|
| [18] |
Palmela I, Sasaki H, Cardoso FL, et al. Time-dependent dual effects of high levels of unconjugated bilirubin on the human blood- brain barrier lining[J].
Front Cell Neurosci, 2012, 6: 22.
|
| [19] |
Ahlfors CE, Wennberg RP, Ostrow JD, et al. Unbound (free) bilirubin: improving the paradigm for evaluating neonatal jaundice[J].
Clin Chem, 2009, 55(7): 1288-99.
DOI: 10.1373/clinchem.2008.121269. |
| [20] |
Falcao AS, Fernandes A, Brito MA, et al. Bilirubin- induced immunostimulant effects and toxicity vary with neural cell type and maturation state[J].
Acta Neuropathol, 2006, 112(1): 95-105.
DOI: 10.1007/s00401-006-0078-4. |
| [21] |
Le Feuvre RA, Brough D, Iwakura Y, et al. Priming of macrophages with lipopolysaccharide potentiates P2X7-mediated cell death via a caspase-1-dependent mechanism, independently of cytokine production[J].
J Biol Chem, 2002, 277(5): 3210-8.
DOI: 10.1074/jbc.M104388200. |
| [22] |
Kotas ME, Jurczak MJ, Annicelli CA, et al. Role of caspase- 1 in regulation of triglyceride metabolism[J].
Proc Natl Acad Sci USA, 2013, 110(12): 4810-5.
DOI: 10.1073/pnas.1301996110. |
| [23] |
Sun Q, Scott MJ. Caspase-1 as a multifunctional inflammatory mediator: noncytokine maturation roles[J].
J Leukoc Biol, 2016, 100(5): 961-7.
DOI: 10.1189/jlb.3MR0516-224R. |
| [24] |
Sollberger G, Strittmatter GE, Grossi SA, et al. Caspase-1 activity is required for UVB- Induced apoptosis of human keratinocytes[J].
J Invest Dermatol, 2015, 135(5): 1395-404.
DOI: 10.1038/jid.2014.551. |
| [25] |
Sun Q, Gao WT, Loughran P, et al. Caspase 1 activation is protective against hepatocyte cell death by up-regulating beclin 1 protein and mitochondrial autophagy in the setting of redox stress[J].
J Biol Chem, 2013, 288(22): 15947-58.
DOI: 10.1074/jbc.M112.426791. |
| [26] |
Song LM, Pei L, Yao SL, et al. NLRP3 inflammasome in neurological diseases, from functions to therapies[J].
Front Cell Neurosci, 2017, 11: 63.
|
| [27] |
Braga TT, Forni MF, Correa-Costa M, et al. Soluble uric acid activates the NLRP3 inflammasome[J].
Sci Rep, 2017, 7: 39884.
DOI: 10.1038/srep39884. |
 2018, Vol. 38
2018, Vol. 38

