2. 重庆医科大学附属儿童医院 神经内科, 重庆 400014;
3. 重庆医科大学附属儿童医院 儿童发育疾病研究教育部重点实验室//儿科学重点实验室, 重庆 400014
2. Department of Neurology, Children's Hospital of Chongqing Medical University, Ministry of Education Key Laboratory of Child Development and Disorders, Chongqing 400014, China;
3. Pediatric Research Institute, Ministry of Education Key Laboratory of Child Development and Disorders/Key Laboratory of Pediatrics of Chongqing, Chongqing 400014, China
骨肉瘤是儿童期最多见的骨恶性肿瘤之一, 发病率高, 约为小儿肿瘤的5%, 目前治疗是以手术为主, 辅以术后巩固性放化疗, 截肢后3~5年存活率仅为5%~ 20%。骨肉瘤恶性程度高, 极易发生扩散和转移, 是预后差的重要因素[1-3]。研究骨肉瘤的侵袭转移的分子机制, 控制肿瘤转移的发生, 有助于提高患者生存率, 对骨肉瘤的诊断、治疗和预后评估等具有重要的临床意义[4-5]。
Twist属于高度保守的碱性螺旋-环-螺旋(bHLH)转录因子家族的重要一员, 在胚胎发育过程能调控细胞的迁徙, 对细胞重建和组织塑性有重要作用[6]。同时, Twist具有原癌基因的特性, 可抑制细胞凋亡, 参与上皮间质转化, 与恶性肿瘤的生长、侵袭、转移和耐药密切相关[7-8]。在骨肉瘤组织中, Twist高表达, 并与E-cadherin呈负相关, Twist表达阳性者的生存率显著低于Twist表达阴性者, 提示Twist与骨肉瘤的转移及预后密切相关[9]。Lei等[10]也发现Twist与骨肉瘤的临床分期相关, 在Ⅲ期OS组织中的表达阳性率显著高于Ⅰ/Ⅱ期OS组织。目前的研究仅证实了Twist与骨肉瘤发生发展的密切关系, 然而Twist高表达仅仅是肿瘤恶性发展的结果, 还是骨肉瘤转移侵袭能力增强的重要因素?目前尚不清楚, 对这一问题的解答, 有助于明确Twist能否用于骨肉瘤疾病的临床分期诊断及预后判断, 亦或是作为骨肉瘤治疗的潜在靶点。本文以3种恶性程度不同的骨肉瘤细胞为研究对象, 通过腺病毒调控Twist的表达水平, 探讨Twist对骨肉瘤细胞体外增殖迁移侵袭及体内成瘤能力的影响, 明确Twist在骨肉瘤发生发展中的生物学作用, 为深入研究探讨骨肉瘤的转移机制提供重要的理论基础与实验依据。
1 材料和方法 1.1 实验材料人骨肉瘤细胞143B、MG63、TE85来源于ATCC; 腺病毒Ad-Twist、Ad-siTwist及携带荧光素酶Luc基因的143B细胞由美国芝加哥大学分子肿瘤实验室馈赠。DMEM高糖培养基、胎牛血清、胰酶购自Gibco; 细胞总蛋白提取试剂盒、RNA提取试剂盒及Real-time PCR试剂盒购自Bioteck; 结晶紫染液、台盘蓝、Western Blot试剂盒、ECL发光液购自碧云天公司; Transwell小室、基质胶Matrigel购自BD。小鼠来源的Twist一抗及β-actin一抗、羊抗小鼠二抗购自Santa Cruz。
1.2 实验方法 1.2.1 骨肉瘤细胞培养配制含10%胎牛血清, 100 U/mL青霉素和100 µg/mL链霉素的DMEM培养基, 于37 ℃、5% CO2温育箱中培养细胞, 待贴壁生长至约90%的汇合率时, 胰酶消化、传代。Ad-RFP、Ad-Twist及Ad-siTwist分别感染细胞, 选取感染率为60%~70%为该病毒的最佳感染滴度。
1.2.2 Real-time PCR检测Twist的mRNA水平表达细胞按2×105/孔接种于6孔板, 病毒感染3 d后提取细胞总RNA, 逆转录获得cDNA。Real-time PCR(反应体系20 µL: cDNA模板2 µg, 330 mg/L引物各0.5 µL, 2× SYBR Green反应液10 µL, 加水至20 µL; PCR参数: 95 ℃ 3 min; 94 ℃ 10 s, 55 ℃ 20 s, 72 ℃ 20 s, 40循环; 溶解曲线65~95 ℃每5 s增加0.5 ℃, 读板)检测Twist表达, 甘油醛-3-磷酸脱氢酶(GAPDH)为内参标化各组cDNA。引物由华大基因合成(Twist:上游: 5'-CGGCC AGGTACATCGACT-3', 下游: 5'-CCATCCTCCAGAC GGAGA-3'; GAPDH:上游: 5'-GGCTGCCCAGAACA TCAT-3', 下游: 5'-CGGACACATTGG GGGTAG-3)。'
1.2.3 Western blot检测Twist的蛋白水平表达设置各处理组, 提取细胞总蛋白, 等量蛋白进行10%聚丙烯酰胺凝胶电泳(120 V, 2 h), 转移至PVDF膜(80 V, 1 h)。用5%脱脂奶粉室温封闭1 h, 加入抗Twist (1: 200)或抗β-actin(1:500)一抗, 4 ℃过夜; TBST洗膜3次, 加入HRP标记的二抗(1: 500), 室温1~2 h, 洗膜, ECL发光, 用Image Pro Plus 6.0软件分析灰度值。
1.2.4 生长曲线检测细胞增殖情况细胞按5×104/孔接种于12孔板, 设置三复孔, Ad-RFP、Ad-Twist及AdsiTwist感染细胞, 处理1、2、3、4、5 d时胰酶消化细胞, 制备细胞悬液, 1: 1加0.4%台盼蓝染液, 血球计数槽计数未被染蓝的细胞数目, 绘制生长曲线。实验重复3次。
1.2.5 划痕实验检测细胞平行迁移能力将细胞以2× 106/孔接种至6孔板, 腺病毒感染3 d后, 细胞汇合度接近100%, 用枪头划痕, 宽度保持一致, PBS洗3次, 清除漂浮细胞, 加入无血清培养基。分别于0、1、2、3 d在同一部位拍照, 随机划取6~8条水平线, 测量不同部位划痕宽度, 计算划痕愈合率, 划痕愈合率(%) = (0 h划痕宽度-待测h划痕宽度) /0 h划痕宽度×100%, 实验重复3次。
1.3.5 Transwell实验检测细胞垂直迁移及侵袭能力迁移实验:腺病毒感染3 d后的骨肉瘤细胞, 消化后用无血清DMEM培养基重悬。将含1×105细胞的100 µL悬液加入上室, 下室加入500 µL含10% FBS的DMEM培养基, 每组设3个复孔。48 h后取出小室, 吸弃上室培养基, 用棉签轻拭去上室细胞, 结晶紫染色5 min, PBS洗涤3次, 显微镜下观察拍照。将膜风干后, 加入33%醋酸200 µL将结晶紫洗脱, 洗脱液至于96孔板检测570 nm处的吸光度。侵袭实验:预先将50 mg/L的Matrigel 1: 8稀释后包被Transwell小室底部膜, 4 ℃风干。每孔加入50 µL含10 g/L BSA的无血清培养液, 37 ℃, 30 min水化基底膜, 其余步骤同迁移实验。
1.3.6 裸鼠成瘤试验将携带荧光素酶基因的143B细胞接种于10 cm的培养皿中, 分别感染Ad-RFP、Ad-Twist、Ad-siTwist, 3 d后制备为2×107/100 µL的细胞悬液。裸鼠右后肢四肢胫骨上端处进针, 注射10 µL细胞悬液, 每周4只, 于注射后1、2、3、4周动态成像。Xenogen 200活体成像:新鲜配置2 mg/mL的D-Luciferin底物, 异氟醚麻醉裸鼠, 腹腔注射100 µL D-Luciferin, 将小鼠放置于Xenogen仪器内部成像板, 腹部向下, 持续麻醉, 10 min后成像。Living Image 4.50.1软件分析信号。
1.4 统计学分析数据以均数±标准差表达, SPSS13.0软件进行统计学检验, 组间比较采用单因素方差分析, P < 0.05认为差异有统计学意义。
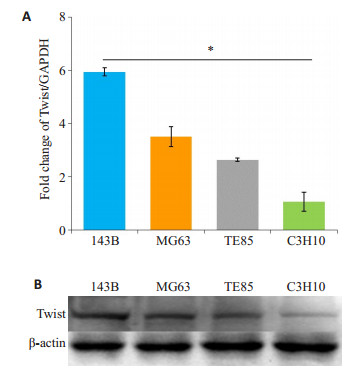
2 结果 2.1 Twist在不同恶性程度的骨肉瘤细胞中的基础表达Twist在C3H10细胞中有较低水平的表达, 在骨肉瘤细胞中的表达显著高于C3H10细胞(P < 0.05, 图 1), 且Twist表达水平与骨肉瘤细胞的恶性程度呈正相关, 在分化程度低, 转移性高的143B细胞中表达最高。
|
图 1 不同骨肉瘤细胞中Twist的表达水平 Figure 1 Expression of Twist in different osteosarcoma cells. A: mRNA expression; B: Protein expression, *P < 0.05. |
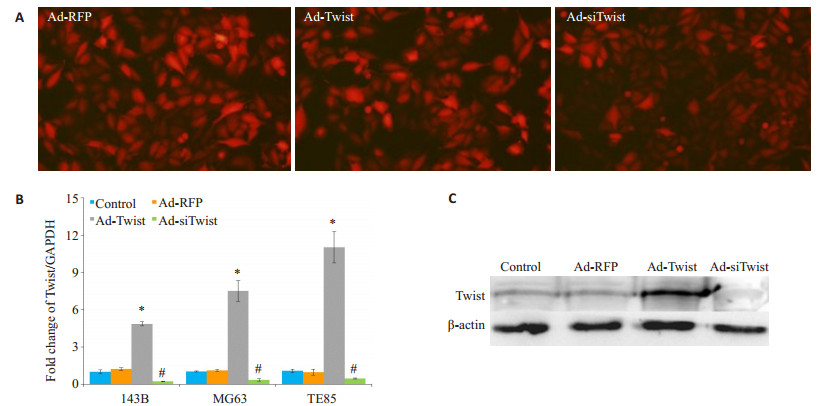
携带Twist过表达基因的腺病毒Ad-Twist和针对Twist的siRNA腺病毒Ad-siTwist均能有效感染骨肉瘤细胞, 感染后48 h可见60%~70%细胞呈现红色荧光。感染后3 d检测, Ad-Twist能显著提高骨肉瘤细胞中Twist的mRNA及蛋白表达水平, 而Ad-siTwist能有效抑制骨肉瘤细胞中Twist的mRNA及蛋白表达水平(P < 0.05, 图 2)。
|
图 2 腺病毒Ad-Twist及Ad-siTwist对Twist表达的影响(以MG63细胞为例) Figure 2 Cellular expression of Twist in MG63 cells after infection with the adenoviruses Ad-twist and Ad-siTwist. A: Adenovirus infection (Original magnification: × 200); B: mRNA expression of Twist detected by real-time PCR (*P < 0.05, Ad-Twist group compared with Ad-RFP group; #P < 0.05, Ad-siTwist group compared with Ad-RFP group); C: Protein expression of Twist detected by Western blotting. |
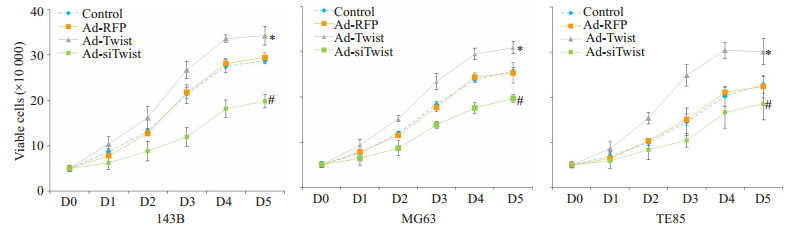
与对照组相比, Ad-Twist组的细胞增殖能力显著提高, 而Ad-siTwist组的细胞的增殖能力显著降低(P < 0.05, 图 3)。
|
图 3 调控Twist表达影响骨肉瘤细胞的增殖能力 Figure 3 Effect of Twist overexpression and knockdown on proliferation of osteosarcoma cells. *P < 0.05, Ad-Twist group compared with Ad-RFP group; #P < 0.05, Ad-siTwist group compared with Ad-RFP group. |
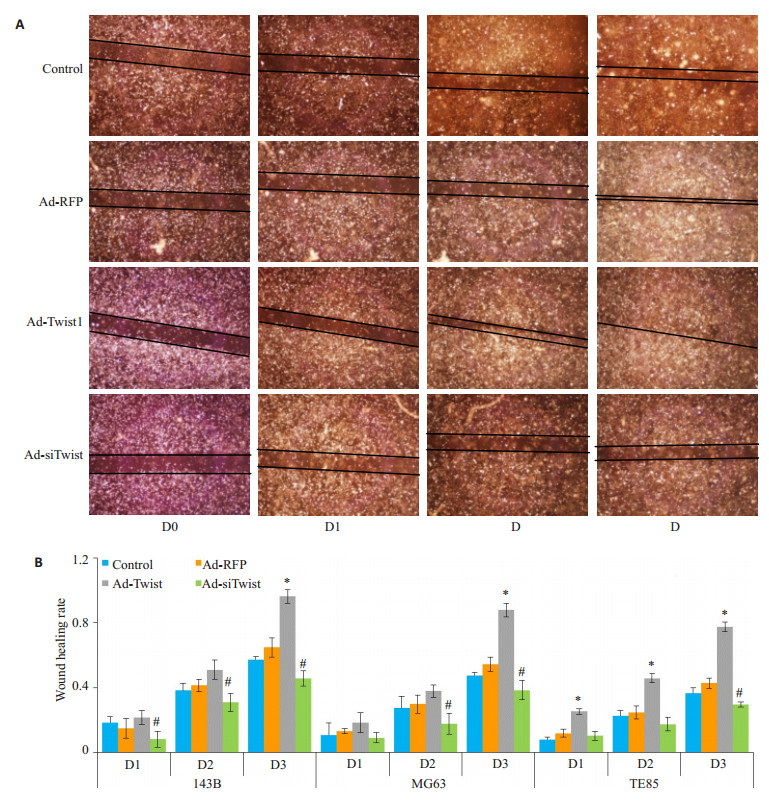
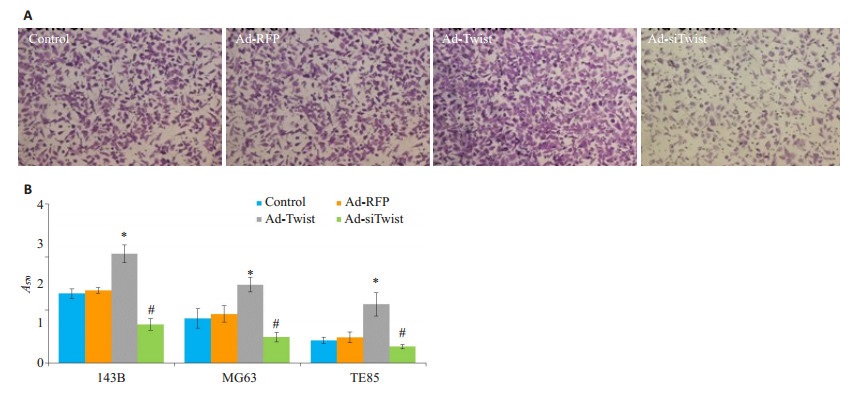
细胞划痕实验显示, 各细胞划痕愈合率143B细胞>TE85细胞>MG63细胞, 诱导Twist过表达可显著促进细胞迁移, 划痕愈合率提高, 而抑制Twist表达可抑制细胞迁移, 降低细胞划痕愈合率(P < 0.05, 图 4)。Transwell检测细胞的垂直迁移能力, 结果一致(P < 0.05, 图 5)。
|
图 4 调控Twist表达影响骨肉瘤细胞的平行迁移能力 Figure 4 Effect of Twist overexpression and knockdown on parallel migration ability of osteosarcoma cells. A: Would healing assay of 143B cells (×40); B: Scar healing rate. *P < 0.05, Ad-Twist group compared with Ad-RFP group; #P < 0.05, Ad-siTwist group compared with Ad-RFP group. |
|
图 5 调控Twist表达影响骨肉瘤细胞的垂直迁移能力 Figure 5 Effect of Twist overexpression and knockdown on vertical migration ability of osteosarcoma cells. A: Would healing assay of 143B cells (×100); B: A570 value. *P < 0.05, Ad-Twist group compared with Ad-RFP group; #P < 0.05, Ad-siTwist group compared with Ad-RFP group. |
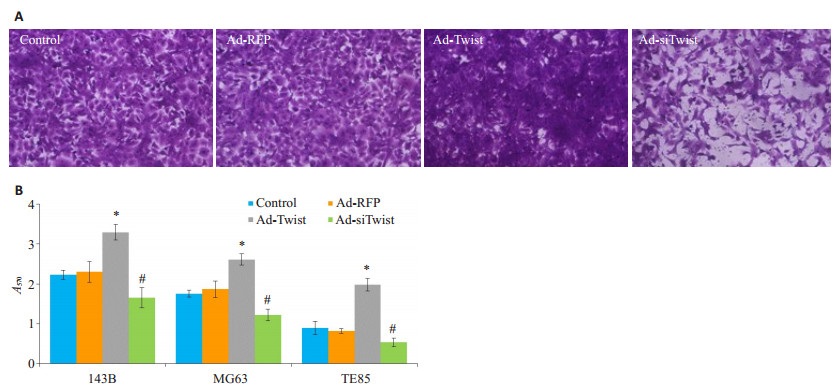
Matrigel Transwell实验发现, 各骨肉瘤细胞的侵袭能力: 143B细胞>TE85细胞>MG63。诱导Twist过表达可显著促进细胞侵袭, 特别是MG63细胞, 而抑制Twist表达可显著抑制细胞侵袭(P < 0.05, 图 6)。
|
图 6 调控Twist表达影响骨肉瘤细胞的侵袭能力 Figure 6 Effect of Twist overexpression and knockdown on invasion ability of osteosarcoma cells. A: Matrigel Transwell invasion assay of143B cells (×100); B: A570 value. *P < 0.05, Ad-Twist group compared with Ad- RFP group; #P < 0.05, Ad-siTwist group compared with Ad-RFP group. |
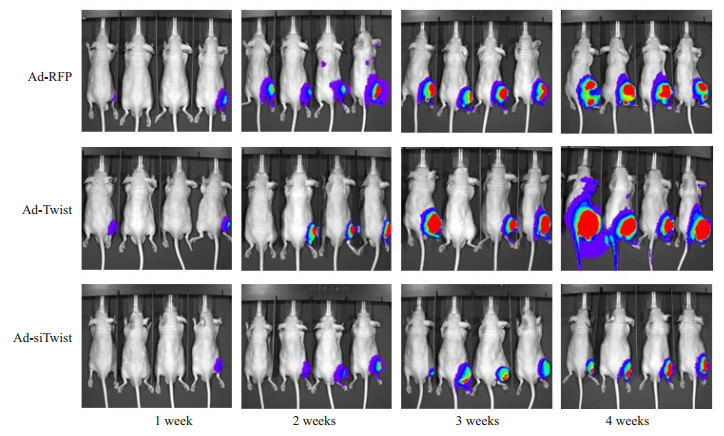
人骨肉瘤143B及MG63细胞可在裸鼠体内成瘤, 而恶性程度低的TE85无法成瘤。将携带荧光素酶基因的143B细胞经原位胫骨近端移植建立裸鼠骨肉瘤。活体成像结果显示: 143B细胞具有良好的体内成瘤能力, 移植后1、2、3、4周, 细胞信号逐渐增强, 瘤体逐渐增大。Twist过表达促进143B细胞在裸鼠体内生长, 信号显著增强。抑制Twist表达可显著抑制细胞在裸鼠体内生长, 信号明显弱于对照组(图 7)。
|
图 7 活体成像观察143B细胞在裸鼠胫骨骨端的成瘤能力 Figure 7 Intratibial tumorigenesis of 143B cells with Twist overexpression and knockdown in nude mice detected using living body imaging. |
骨肉瘤是一种恶性程度极高的恶性肿瘤, 极易发生早期转移, 最常见是肺转移, 约为90%, 其次是脑转移, 还有80%的微小转移通过现有技术手段无法发现。原发骨肉瘤患者术后生存率约为65%, 一旦发生转移, 生存率大大降低, 至25%以下。同时, 骨肉瘤是否发生转移与肿瘤组织的化疗敏感性、复发风险、疾病预后等密切相关[11-13]。因此, 针对骨肉瘤转移侵袭相关机制的研究越来越多的受到广泛关注。
Twist是胚胎进化过程中一个保守的转录因子, 调控细胞重建, 细胞迁移。同时Twist转录调控在肿瘤的发生发展、迁移侵袭、血管生成与肿瘤细胞耐药发挥重要作用, 其Twist的高表达与肿瘤的预后差和总生存率低密切相关[6-9, 14]。目前已在乳腺癌、胃癌、肝癌等多种恶性肿瘤中发现Twist表达增高[15-17]。多项研究显示Twist在骨肉瘤组织中高表达, 并与骨肉瘤的恶性程度成正相关[11-12, 14, 18]。Twist在骨肉瘤转移组中的表达高于非转移组, 可能通过上调VEGF的表达促进肿瘤微血管生成, 促进肿瘤生长转移[19]。Chen等[20]发现HDAC5可促进诱导骨肉瘤细胞的增殖, 可能与上调twist的表达有关。本研究中采用三种不同恶性程度的骨肉瘤细胞143B、MG63、TE85 [21-22], 发现Twist在恶性程度最高的143B细胞中表达最强, MG63细胞次之, 分化度最高的TE85细胞表达最低。提示Twist的表达水平与骨肉瘤细胞的恶性程度有密切关系。然而, 目前并不清楚Twist在骨肉瘤中的表达增高是骨肉瘤发生发展的结果, 还是增强骨肉瘤转移侵袭能力的重要分子生物学机制?这有助于进一步探讨Twist用于骨肉瘤的预后评估, 还是将其作为治疗的分子靶点。上皮间质转化是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。近年来研究认为, Twist是一种凋亡抑制蛋白, 其过量表达可能参与了肿瘤细胞转移起始阶段的上皮间质转化的进程, 通过下调E-cadherin等上皮表型基因的表达, 并激活α-SMA、Vimentin等间质表型基因的表达, 促进细胞的运动和迁移, 使肿瘤呈现恶性表型[23-25]。
腺病毒是目前最常用最有效的基因转导技术之一, 在哺乳细胞中可瞬时及高水平地表达目的蛋白。我们采用腺病毒能有效调控Twist的表达[26], 由于细胞中Twist的基础表达不一致, 腺病毒Ad-Twist介导过表达的增高丰度不完全一致, 基础表达低的TE85细胞, 在Ad-Twist感染后表达增高的倍数最多, 对TE85细胞增殖的促进作用也最显著。而143B细胞的Twist基础表达高, Ad-siTwist抑制的效果最明显, 对细胞增殖的抑制作用也最显著。证实Twist能促进骨肉瘤细胞的增殖, 细胞增殖与Twist的表达水平呈正相关。本研究也发现上调Twist表达能促进骨肿瘤细胞的迁移及侵袭能力, 而下调Twist的表达对骨肿瘤细胞的体外迁移及侵袭能力有显著的抑制作用。胫骨近端是原发恶性骨肿瘤仅次于股骨远端的第二大好发部位, 裸鼠胫骨原位移植模型是研究骨肉瘤体内生长的经典成瘤模型, 而3种骨肉瘤细胞中, 143B的成瘤作用最强, TE85细胞在裸鼠体内不能成瘤[27], 因此, 本研究采用143B细胞制备裸鼠成瘤模型。与对照组相比, Ad-Twist组肿瘤体积增高, 细胞信号显著增强, Ad-siTwist组反之, 证实Twist可增强骨肉瘤细胞的体内成瘤能力。
综上所述, 本研究证实了Twist表达水平与骨肉瘤细胞恶性程度、增殖、迁移及侵袭能力相关, Twist影响细胞生物学行为能力, 可能是促进肿瘤转移重要病理生理学机制之一。本研究为进一步探讨骨肉瘤的分子生物学机制提供了重要的理论基础与实验依据。最近有报道显示通过shRNA技术抑制尤文肉瘤中Twist的表达, 可显著抑制肿瘤的迁移侵袭及体内的转移能力[28], 因此, 针对Twist靶点的基因治疗可成为骨肉瘤治疗的潜在手段。
| [1] |
Cao J, An Q, Wang L. Pediatric sarcomas[J].
Oncol Lett, 2018, 15(2): 1397-402.
|
| [2] |
Harrison DJ, Geller DS, Gill JD, et al. Current and future therapeutic approaches for osteosarcoma[J].
Expert Rev Anticancer Ther, 2018, 18(1): 39-50.
DOI: 10.1080/14737140.2018.1413939. |
| [3] |
Harrison DJ, Schwartz CL. Osteogenic sarcoma: systemic chemotherapy options for localized disease[J].
Curr Treat Options Oncol, 2017, 18(4): 24.
DOI: 10.1007/s11864-017-0464-2. |
| [4] |
Saraf AJ, Fenger JM, Roberts RD. Osteosarcoma: accelerating progress makes for a hopeful future[J].
Front Oncol, 2018, 8(5): 4.
|
| [5] |
Bishop MW, Janeway KA, Gorlick R. Future directions in the treatment of osteosarcoma[J].
Curr Opin Pediatr, 2016, 28(1): 26-33.
DOI: 10.1097/MOP.0000000000000298. |
| [6] |
Sozen B, Pehlivanoglu S, Demir N. Differential expression pattern of Twist1 in mouse preimplantation embryos suggests its multiple roles during early development[J].
J Assist Reprod Genet, 2016, 33(11): 1533-40.
DOI: 10.1007/s10815-016-0794-1. |
| [7] |
Zhu QQ, Ma C, Wang Q, et al. The role of TWIST1 in epithelialmesenchymal transition and cancers[J].
Tumour Biol, 2016, 37(1): 185-97.
DOI: 10.1007/s13277-015-4450-7. |
| [8] |
Wicki A, Mandalà M, Massi D, et al. Acquired resistance to clinical cancer therapy: a twist in physiological signaling[J].
Physiol Rev, 2016, 96(3): 805-29.
DOI: 10.1152/physrev.00024.2015. |
| [9] |
Yin K, Liao Q, He H, et al. Prognostic value of twist and E-cadherin in patients with osteosarcoma[J].
Med Oncol, 2012, 29(5): 3449-55.
DOI: 10.1007/s12032-012-0317-6. |
| [10] |
Lei P, Ding D, Xie J, et al. Expression profile of Twist, vascular endothelial growth factor and CD34 in patients with different phases of osteosarcoma[J].
Oncol Lett, 2015, 10(1): 417-21.
DOI: 10.3892/ol.2015.3246. |
| [11] |
Narhari P, Haseeb A, Lee S, et al. Spontaneous conventional osteosarcoma transformation of a chondroblastoma: a case report and literature review[J].
Indian J Orthop, 2018, 52(1): 87-90.
DOI: 10.4103/ortho.IJOrtho_495_17. |
| [12] |
Ren XF, Mu LP, Jiang YS, et al. LY2109761 inhibits metastasis and enhances chemosensitivity in osteosarcoma MG-63 cells[J].
Eur Rev Med Pharmacol Sci, 2015, 19(7): 1182-90.
|
| [13] |
Yue B, Ma JF, Yao G, et al. Knockdown of neuropilin-1 suppresses invasion, angiogenesis, and increases the chemosensitivity to doxorubicin in osteosarcoma cells -an in vitro study[J].
Eur Rev Med Pharmacol Sci, 2014, 18(12): 1735-41.
|
| [14] |
Wushou A, Hou J, Zhao YJ, et al. Twist-1 up-regulation in carcinoma correlates to poor survival[J].
Int J Mol Sci, 2014, 15(12): 21621-30.
DOI: 10.3390/ijms151221621. |
| [15] |
Malamas AS, Hammond SA, Schlom J, et al. Combination therapy with an OX40L fusion protein and a vaccine targeting the transcription factor twist inhibits metastasis in a murine model of breast cancer[J].
Oncotarget, 2017, 8(53): 90825-41.
|
| [16] |
Xu Z, Zheng G, Wang Y, et al. Aqueous huaier extract suppresses gastric cancer metastasis and epithelial to mesenchymal transition by targeting twist[J].
J Cancer, 2017, 8(18): 3876-86.
DOI: 10.7150/jca.20380. |
| [17] |
Wang LT, Chiou SS, Chai CY, et al. Transcription factor SPZ1 promotes TWIST-mediated epithelial-mesenchymal transition and oncogenesis in human liver cancer[J].
Oncogene, 2017, 36(31): 4405-14.
DOI: 10.1038/onc.2017.69. |
| [18] |
Li Y, Du W, Han J, et al. LAMP3 promotes the invasion of osteosarcoma cells via SPP1 signaling[J].
Mol Med Rep, 2017, 16(5): 5947-53.
DOI: 10.3892/mmr.2017.7349. |
| [19] |
丁登峰. TWIST、VEGF在骨肉瘤中的表达及其与血管生成的关系[D]. 长沙: 中南大学, 2013: 8-18.
|
| [20] |
Chen J, Xia J, Yu YL, et al. HDAC5 promotes osteosarcoma progression by upregulation of Twist 1 expression[J].
Tumour Biol, 2014, 35(2): 1383-7.
DOI: 10.1007/s13277-013-1189-x. |
| [21] |
Luo X, Chen J, Song WX, et al. Osteogenic BMPs promote tumor growth of human osteosarcomas that harbor differentiation defects[J].
Lab Invest, 2008, 88(12): 1264-77.
DOI: 10.1038/labinvest.2008.98. |
| [22] |
Vega OA, Lucero CMJ, Araya HF, et al. Wnt/β-Catenin signaling activates expression of the bone-related transcription factor RUNX2 in select human osteosarcoma cell types[J].
J Cell Biochem, 2017, 118(11): 3662-74.
DOI: 10.1002/jcb.v118.11. |
| [23] |
Wang D, Rai B, Qi F, et al. Influence of the twist gene on the invasion and metastasis of colon cancer[J].
Oncol Rep, 2018, 39(1): 31-44.
|
| [24] |
Wei L, Sun JJ, Cui YC, et al. Twist May be associated with invasion and metastasis of hypoxic NSCLC cells[J].
Tumour Biol, 2016, 37(7): 9979-87.
DOI: 10.1007/s13277-016-4896-2. |
| [25] |
Smith BN, Bhowmick NA. Role of EMT in metastasis and therapy resistance[J].
J Clin Med, 2016, 5(2): 25.
DOI: 10.3390/jcm5020025. |
| [26] |
何昀, 毕杨, 刘星, 等. 转录因子Twist的siRNA筛选、腺病毒构建及功能检测[J].
医学分子生物学杂志, 2010, 7(3): 236-41.
|
| [27] |
Igarashi K, Kawaguchi K, Kiyuna T, et al. Effective metabolic targeting of human osteosarcoma cells in vitro and in orthotopic nude-mouse models with recombinant methioninase[J].
Anticancer Res, 2017, 37(9): 4807-12.
|
| [28] |
Choo S, Wang P, Newbury R, et al. Reactivation of TWIST1 contributes to ewing sarcoma metastasis[J].
Pediatr Blood Cancer, 2018, 65(1): 26721.
DOI: 10.1002/pbc.26721. |
 2018, Vol. 38
2018, Vol. 38

