2. 苏州大学药学院, 江苏 苏州 215123;
3. 蚌埠医学院 科研中心, 安徽 蚌埠 233030
2. Soochow University College of Pharmacy, Suzhou 215123, China;
3. Science Research Center, Bengbu Medical College, Bengbu 233030, China
心肌缺血再灌注损伤(MIRI)常发生于缺血性心脏病的再灌治疗过程中, 是临床常见且亟待解决的病理生理现象。在MIRI发生过程中, 钙超载、氧化应激、内质网应激、线粒体功能障碍、细胞凋亡、蛋白激酶活化和炎症等都起重要作用且相互关联[1]。线粒体通透性转换孔(MPTP)是位于线粒体内外膜连接位点的非特异性通道, 在诱导细胞死亡和线粒体Ca2+动态平衡中发挥作用[2]。MPTP开放导致线粒体内膜通透性改变, 继而膜内外离子浓度差和电位差失衡, 钠钾泵活性下降、Na+- K+跨膜转运受阻, 进而引发线粒体功能障碍, 线粒体膜电位降低, 细胞色素C (Cyt-C)释放[3], 启动Caspase凋亡级联反应。Lim等[4]研究结果表明, 在心肌缺血预处理和后处理过程中, MPTP都发挥了重要作用。
内吗啡肽-1 (EM-1)是µ阿片受体激动剂, 可调节机体心血管活动。前期实验[5-6]已证明, 在大鼠MIRI模型中, EM-1后处理能够保护心肌细胞, 改善心肌的心功能, 但目前尚不清楚EM-1是否通过调节MPTP开放来减少MIRI。为此, 我们研究了MPTP在大鼠MIRI模型中的作用, 静脉给予MPTP特异性开放剂苍术苷(Atr)以诱导MPTP开放。通过检测大鼠血流动力学监测指标心率(HR)和平均动脉压(MAP), 并计算心率-血压乘积(RPP); 检测大鼠血浆乳酸脱氢酶(LDH)、肌酸激酶(CK-MB)、心肌肌钙蛋白(I cTnI), 测定心肌梗死面积, 检测超氧化物歧化酶(SOD)、丙二醛(MDA)、白介素-6 (IL-6)、肿瘤坏死因子-α (TNF-α)和细胞色素C(Cyt-C)等指标反映大鼠心肌炎症反应及抗氧化能力; Western blot检测各处理组大鼠心肌组织中凋亡相关蛋白Bax、Bcl-2和cleaved caspase-3的表达量, 以探讨MPTP在EM-1后处理减轻大鼠MIRI中的作用。
1 材料和方法 1.1 实验动物及分组SPF级SD雄性大鼠45只, 体质量为280±10 g, 购自蚌埠医学院实验动物中心。将大鼠置于相同生存条件下, 接受人道关怀和标准饮食。待SD大鼠适应饲养条件, 随机分为5组:假手术组(S组)、缺血再灌注组(IR组)、EM-1后处理组(EM50组)、EM-1联合苍术苷后处理(EM50+Atr组)和苍术苷后处理组(Atr组)。S组于冠脉左前降支(LAD)下穿丝线不结扎维持150 min。其余四组均结扎LAD缺血30 min, 再灌注120 min, 在再灌注前5 min, 分别静脉给予生理盐水0.5 mL、内吗啡肽-1 (50 μg/kg)、内吗啡肽-1 (50 μg/kg) +苍术苷(5 mg/kg)、苍术苷(5 mg/kg)。
1.2 主要试剂与仪器(1) 试剂: EM-1 (Sigma); 苍术苷(曼妥思); 抗体Bax、Bcl-2 (ABclonal)、β-actin (Cell Signaling Technology)、HRP标记羊抗兔IgG(博士德)、羊抗小鼠IgG (Biosharp); SOD、MDA、LDH、CK-MB、TNF-α、IL-6和Cyt-C检测试剂盒(南京建成); (2)仪器:动物呼吸机(MED-LAB ALC-V9);生物信号采集处理系统(MEDLABU/4C501H); EPOCH酶标仪(Biotek); 凝胶成像分析系统(Tanon GIS-3500)等。
1.3 实验方法 1.3.1 实验设计和MIRI模型的建立参照文献Zhang [5]、王娅等[6]的方法构建MIRI模型:阻断LAD缺血30 min后恢复血流灌注120 min。
1.3.2 血流动力学指标的测定通过生物信号采集处理系统, 实时监测大鼠的HR、MAP, 计算RPP=HR × MAP, 记录各指标并进行统计学分析。
1.3.3 测定血浆酶学及生化指标再灌注结束时, 立即从颈动脉采集血液置于肝素抗凝管中, 4 ℃环境中离心15 min, 3500 r/min。利用分光光度法检测指标SOD、MDA和LDH, ELISA法检测指标CK-MB、cTnI、IL-6、TNF-α和Cyt-C。
1.3.4 大鼠心肌HE染色参照王娅[6]的方法
1.3.5 TTC染色法确定心肌梗死范围, 计算梗死面积 1.3.6 Western blot检测凋亡相关蛋白Bax、Bcl-2和cleaved caspase-3的表达量取0.1 g缺血区心肌组织加入1 mL蛋白提取液, 用研钵在冰上充分研磨, 将混合液移入EP管中, 于4 ℃条件下离心15 min, 12 000 r/min, 收集上清并测浓度。经过上样缓冲液稀释、95 ℃ 5 min蛋白变性、上样, 先后用90 V-30 min和100 mA-90 min电泳, 140 m A-1 h转膜, 5% BSA室温封闭2 h。1:1500 TBST稀释的Bax抗体, 1:1200 TBST稀释的Bcl-2抗体, 1:500 TBST稀释的β-actin抗体分别加入孵育袋中, 37 ℃孵育30 min, 60 r/min摇床30 min, 4 ℃过夜后取出, TBST洗涤(10 min/次) 4次后, 加入1: 5000稀释的二抗, 37 ℃孵育60 min, 100 r/min摇床30 min, TBST洗涤共4次(10 min/次), 浸入显影试剂中并吹打均匀后上机曝光, 并对曝光结果进行灰度值统计分析。
1.3.7 统计学方法数据用均数±标准差表示, 用SPSS19.0软件分析各组之间的统计学差异, 组间比较用单因素方差分析, P < 0.05表示有统计学意义。
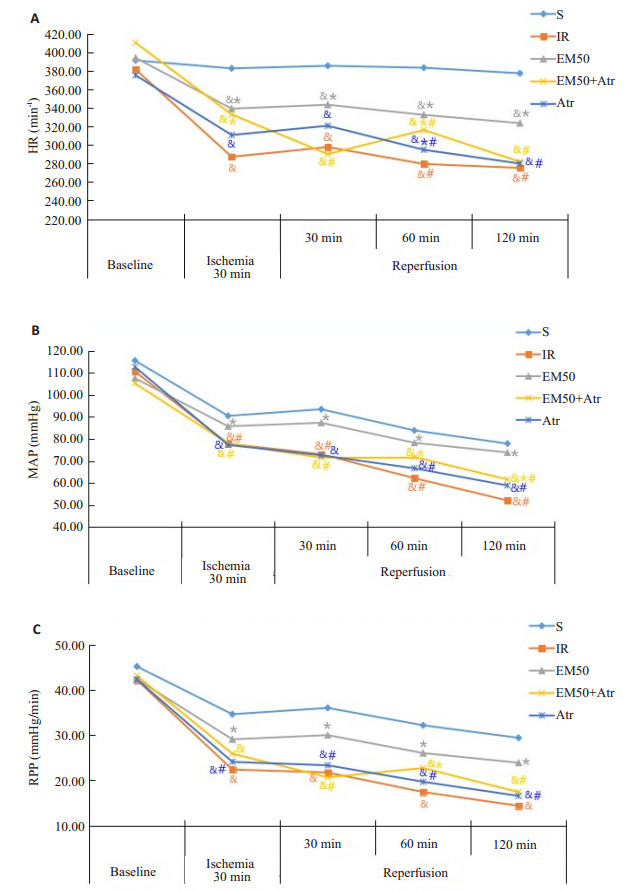
2 结果 2.1 各组大鼠血流动力学监测指标的改变在基线时, 基线HR、MAP和RPP均无统计学差异(P>0.05)。与IR组相比, EM50组的HR、MAP和RPP均升高(P < 0.05);与EM50组比较, EM50+Atr组HR、MAP和RPP均有所下降(P < 0.05), 同时Atr组的HR、MAP和RPP均降低(P < 0.05, 图 1)。
|
图 1 各处理组对MIRI大鼠血流动力学的影响 Figure 1 Effects of different treatments on hemodynamics of the rats (Mean±SD, n=6). & P < 0.05 vs S group; *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
与S组相比, IR组SOD活性降低, MDA含量较高(P < 0.05);与IR组相比, EM50组SOD活性较高, MDA含量略低(P < 0.05); EM50+Atr组和Atr组的SOD活性均低于EM50组, MDA含量则高于EM50组(P < 0.05, 表 1)。
| 表 1 各处理组大鼠血浆SOD、MDA的含量或活性 Table 1 Plasma SOD and MDA contents or activity in different treatment groups (Mean±SD, n=6) |
结果显示, EM50组LDH、CK-MB、cTnI活性或含量低于IR组、EM50+Atr组和Atr组(P < 0.05, 表 2)。
| 表 2 各处理组大鼠血浆CK-MB、cTnI、LDH的含量或活性 Table 2 Plasma CK- MB, cTnI, and LDH contents or activity in different treatment groups (Mean±SD, n=6) |
EM50组IL-6、TNF-α的含量均显著低于IR组、EM50+Atr组和Atr组(P < 0.05, 表 3)。
| 表 3 各处理组大鼠血浆IL-6、TNF-α的含量 Table 3 Plasma concentrations of IL- 6 and TNF-α in different treatment groups (Mean±SD, n=6) |
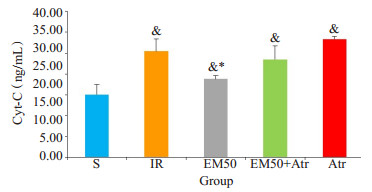
与S组相比, 其余各组Cyt-C的含量明显升高(P < 0.05); EM50组Cyt-C的含量低于IR组、EM50+Atr组及Atr组(P < 0.05, 图 2)。
|
图 2 各处理组大鼠血浆Cyt-C的变化 Figure 2 Changes of Cyt-C in rat plasma in different treatment groups (Mean±SD, n=6). & P < 0.05 vs S group; *P < 0.05 vs IR group. |
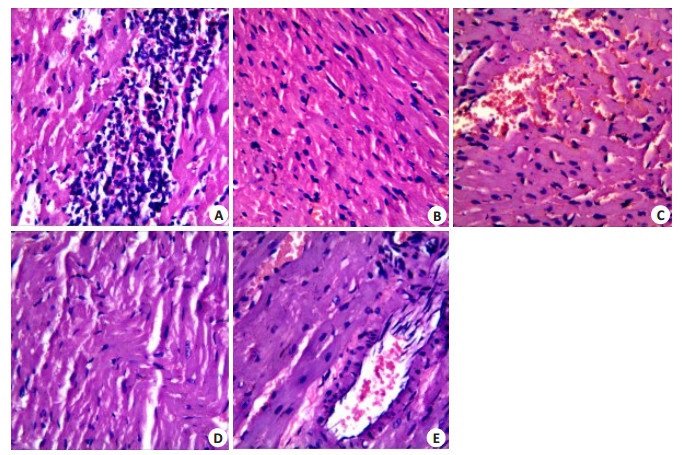
S组:心肌细胞整齐紧密排列, 细胞质清晰, 肌纤维完整, 无红细胞及炎细胞浸润; IR组:心肌纤维萎缩排列紊乱, 间质扩大, 血管扩张伴充血, 多重区域间质红细胞外渗, 局部区域心肌细胞消失, 且有白细胞浸润伴红细胞漏出; EM50组:心肌细胞排列相对紧密, 局部区域纤维呈波浪状紊乱排列, 间质中无红细胞及炎细胞浸润; Atr组:细胞之间无明显界线, 核固缩、碎裂, 心肌纤维溶解断裂, 间质充血, 大量红细胞外渗伴有炎细胞浸润; EM50+Atr组:心肌纤维排列较紊乱, 间质具有较多的红细胞和炎细胞浸润。总之, 相比于IR组、Atr组和EM50+Atr组, EM50组心肌受损程度较轻(图 3)。
|
图 3 各处理组大鼠心肌组织HE染色 Figure 3 HE staining of myocardial tissue of rats in different treatment groups. A: S group; B: IR group; C: EM50 group; D: Atr group; E: EM50 + Atr group (Original magnification: × 400, n=4). |
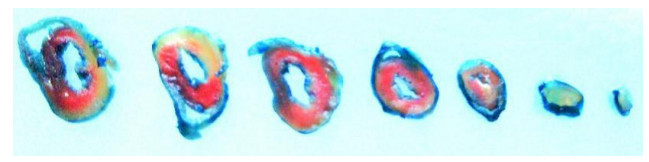
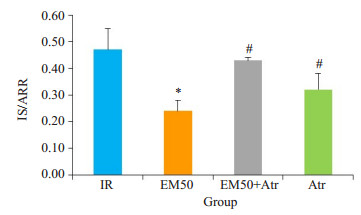
蓝染区为非缺血梗死区, 红染区为缺血但未发生梗死的危险区(AAR), 白色区域为梗死区(IS)(图 4)。采集图像, 使用Image-Pro Plus 6.0测量相对面积, 计算IS/ AAR值。与IR组、Atr组和EM50+Atr组相比, EM50组心肌梗死面积明显减少(P < 0.05, 图 5)。
|
图 4 经TTC双染后的心肌标本 Figure 4 Images showing the infarct area in rat myocardium. Blue: Non-infarct tissues; Red: Area at risk; White: Infarct area. |
|
图 5 各处理组下大鼠心肌梗死面积百分比 Figure 5 Percentages of myocardial infarct area in different treatment groups (Mean±SD, n=5). *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
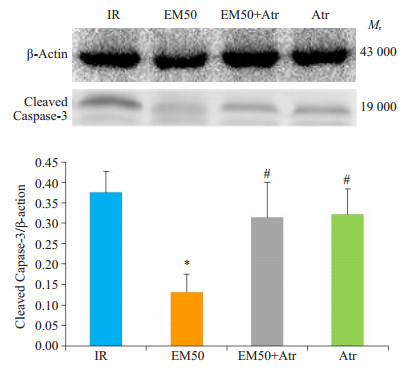
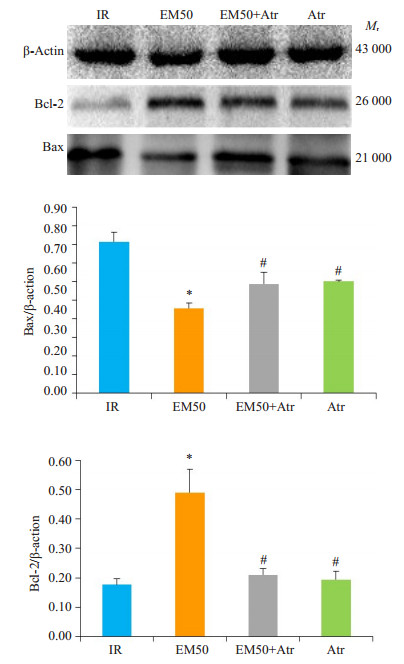
细胞凋亡是由抗凋亡因子Bcl-2和凋亡水解酶caspase-3通过一系列复杂过程调控的, 是MIRI引起细胞死亡的机制之一, 在IR损伤和预后中有重要作用[7]。Bcl-2家族成员在细胞凋亡的线粒体途径中起重要调控作用。在细胞凋亡过程中, Bcl-2减小MPTP的大小, 而Bax的作用与之相反[8]。与其余各组相比, EM50组Bax、cleaved caspase-3的表达量显著降低, Bcl-2的表达量明显升高(P < 0.05, 图 6、7)。
|
图 6 各处理组下大鼠心肌中cleaved caspase-3蛋白表达情况 Figure 6 Expression of cleaved caspase-3 protein in different treatment groups (Mean±SD, n=3). *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
|
图 7 各处理组大鼠心肌中Bax和Bcl-2蛋白表达情况 Figure 7 Expression of Bax and Bcl-2 proteins in different treatment groups (Mean ± SD, n=3). *P < 0.05 vs IR group; #P < 0.05 vs EM50 group. |
实验结果表明, EM-1后处理组改善了MIRI大鼠心肌的心功能, 减小了心梗面积, 减轻心肌组织病理学改变, 说明内吗啡肽-1后处理具有一定的心肌保护作用。此结果与Zhang [5]、王娅等[6]的实验结果一致。
MPTP是线粒体功能的关键调节因子[9], 是在凋亡条件下形成的非选择性孔, 能够使线粒体结构紊乱并因此影响其功能[10]。MPTP在正常生理条件下保持闭合, 在由Ca2+超载和活性氧形成过度引起的再灌注开始时开放[11], 在缺血再灌注过程中有诱发组织损伤和细胞死亡的作用[12]。He等[13]研究表明, 吗啡预处理通过抑制MPTP的开放、减少细胞Ca2+超载的发生和Cyt-C的释放, 发挥心肌保护作用。Obame等[14]在体内和体外获得的数据表明抑制MPTP开放在预防吗啡再灌注损伤中具有重要作用。Chen [15]、Xi [16]、Dorsch [17]等结果表明吗啡通过抑制MPTP开放, 发挥对MIRI的保护作用。
MPTP特异性开放剂苍术苷是从中药苍术中提取出的一种糖苷型化合物, 主要通过抑制钠钾泵和Ca2+- Mg2+-ATP酶的活性[18]等机制促进MPTP的开放。本实验在构建MIRI大鼠模型的基础上, 联合应用EM-1和苍术苷后处理, 通过检测大鼠血流动力学指标, 测定大鼠血浆心肌酶学指标以及大鼠心肌梗死面积; 检测大鼠血浆IL-6、TNF-α, 以探讨MPTP在EM-1后处理减轻大鼠MIRI中的作用。结果表明与内吗啡肽-1后处理组相比, 联合EM-1和苍术苷后处理组明显抑制了EM-1对MIRI大鼠的心肌保护作用, 说明在EM-1后处理减轻大鼠MIRI的作用中有MPTP参与。
在MIRI病理条件下, 苍术苷的加入使MPTP通透性增加, 线粒体膜电位降低, 氧化磷酸化解偶联, 促凋亡因子Cyt-C、AIF、Smac/Diablo等膜内容物释放到细胞质中[19]。其中, 在三磷酸脱氧腺苷(dATP)的存在下, Cyt-C/Apaf-1复合物激活caspase-9, caspase-9再激活caspase-3和下游其他caspase [20]。Caspase-3是caspase依赖的凋亡信号级联中的基本效应器[21]。在细胞凋亡过程中, Cyt-C的释放机制涉及由Bcl-2家族的促凋亡蛋白如Bax、Bak和Bad调节的线粒体外膜特殊的通透性, 其作用可被家族的抗凋亡蛋白如Bcl-2和Bcl-xL拮抗[22]。Bcl-2/Bax比值是决定细胞存亡的重要指标[23]。因此, 通过检测血浆Cyt-C含量, 不仅可以反映MPTP的开放程度, 而且间接反映心肌细胞凋亡情况。有文献报道[24]内吗啡肽通过抑制Cyt-C释放, 保护脑线粒体, 防止氧化性损伤引起脑细胞凋亡。本实验也检测了各处理组大鼠血浆Cyt-C含量, 结果表明, IR组Cyt-C的含量明显升高; 与IR组相比, EM50组Cyt-C的含量是下降的; 与EM50组相比, EM50+Atr组Cyt-C的含量有所升高, 说明EM-1可能通过抑制MPTP开放, 减少CytC的释放, 减少心肌细胞凋亡, 减轻心肌损伤。
我们进一步采用Western blot分析细胞凋亡调节基因的蛋白产物Bax、Bcl-2和cleaved caspase-3在大鼠心肌组织中的表达情况, 观察MPTP开放对EM-1后处理减轻心肌细胞凋亡的影响。Bax和Bcl-2蛋白均属于Bcl-2蛋白家族。Bax是Bcl-2家族蛋白的促凋亡成员, 能够形成足够大的跨膜孔, 释放Cyt-C, 并激活MPTP [25], 促进MPTP的形成和开放; Bcl-2是细胞凋亡的负调控因子, 抑制caspase的激活以阻止细胞凋亡[26]。细胞的存活与否最终取决于Bcl-2和Bax两种调控因子的平衡结果, 因此常用Bcl-2/Bax来反映在外界因素刺激下, 心肌细胞的凋亡情况[27]。Caspase的活化是导致细胞凋亡的中心环节。线粒体膜结构受损后, 在Bax蛋白的协同作用下MPTP进一步开放, 线粒体释放大量Cyt-C激活下游的caspase-3, 启动caspase蛋白水解级联反应, 在Asp34处剪切形成cleaved caspase-3, 从而加速细胞凋亡[28]。实验结果显示, 苍术苷可能部分抵消了EM-1的抗心肌细胞凋亡作用, 这与Yao等[29]通过对MIRI模型大鼠离体心脏进行七氟醚加或不加苍术苷后处理所得结果一致。本实验目前只探讨了对EM-1后处理过程中MPTP的开放程度, 但MPTP的开放的具体时段还需要进一步的探索。
综上所述, 在心肌缺血再灌注过程中, EM-1可能通过抑制MPTP的开放, 保持线粒体结构和功能上的完整性, 减少线粒体中Cyt-C的释放, 下调凋亡相关蛋白cleaved caspase-3的表达, 减少心肌细胞凋亡, 发挥心肌保护作用。
| [1] |
Lejay A, Fang F, John R, et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus[J].
J Mol Cell Cardiol, 2016, 91: 11-22.
DOI: 10.1016/j.yjmcc.2015.12.020. |
| [2] |
De Marchi E, Bonora M, Giorgi C, et al. The mitochondrial permeability transition pore is a dispensable element for mitochondrial calcium efflux[J].
Cell Calcium, 2014, 56(1): 1-13.
DOI: 10.1016/j.ceca.2014.03.004. |
| [3] |
Petrosillo G, Di Venosa N, Moro N. In vivo hyperoxic preconditioning protects against rat- heart ischemia/reperfusion injury by inhibiting mitochondrial permeability transition pore opening and cytochrome c release[J].
Free Radic Biol Med, 2011, 50(3): 477-83.
DOI: 10.1016/j.freeradbiomed.2010.11.030. |
| [4] |
Lim SY, Davidson SM, Hausenloy DJ, et al. Preconditioning and postconditioning: theessential role of the mitochondrial permeability transition pore[J].
Cardiovasc Res, 2007, 75(3): 530-5.
DOI: 10.1016/j.cardiores.2007.04.022. |
| [5] |
Zhang WP, Zong QF, Gao Q, et al. Effects of endomorphin-1 postconditioning on myocardial ischemia/reperfusion injury and myocardial cell apoptosis in a rat model[J].
Mol Med Rep, 2016, 14(4): 3992-8.
DOI: 10.3892/mmr.2016.5695. |
| [6] |
王娅, 刘明珠, 李红俊, 等. 内吗啡肽-1后处理的心肌保护作用及其对Erk1/2信号通路的影响[J].
J South Med Univ, 2017, 37(8): 1028-34.
|
| [7] |
Meng XY, Yu HL, Zhang WC, et al. ZFP580, a novel zinc-finger transcription factor, is involved in cardioprotection of intermittent high-altitude hypoxia against myocardial ischemia-reperfusion injury[J].
PLoS One, 2014, 9(4): e94635.
DOI: 10.1371/journal.pone.0094635. |
| [8] |
Lindsay J, Esposti MD, Gilmore AP. Bcl-2 proteins and mitochondria- specificity in membrane targeting for death[J].
Biochim Biophys Acta, 2011, 1813(4): 532-9.
DOI: 10.1016/j.bbamcr.2010.10.017. |
| [9] |
Laker RC, Taddeo EP, Akhtar YN, et al. The mitochondrial permeability transition pore regulator cyclophilin D exhibits tissuespecific control of metabolic homeostasis[J].
PLoS One, 2016, 11(12): e0167910.
DOI: 10.1371/journal.pone.0167910. |
| [10] |
Arrazola MS, Ramos-Fernandez E, Cisternas P, et al. Wnt signaling prevents the Aβ oligomer-induced mitochondrial permeability transition pore opening preserving mitochondrial structure in hippocampal neurons[J].
PLoS One, 2017, 12(1): e0168840.
DOI: 10.1371/journal.pone.0168840. |
| [11] |
Piper HM, Meuter K, Schäfer C. Cellular mechanisms of ischemiareperfusion injury[J].
Ann Thorac Surg, 2003, 75(2): S644-8.
DOI: 10.1016/S0003-4975(02)04686-6. |
| [12] |
Seidlmayer LK, Juettner VV, Kettlewell S, et al. Distinct mPTP activation mechanisms in ischaemia-reperfusion: contributions of Ca2+, ROS, pH, and inorganic polyphosphate[J].
Cardiovasc Res, 2015, 106(2): 237-48.
DOI: 10.1093/cvr/cvv097. |
| [13] |
He ZB, Peng ZM, Jin LY, et al. Effect of morphine preconditioning on mitochondrial permeability transition pore after myocardial ischemia-reperfusion injury in rats[J].
J Cent South Univ (Med Sci), 2010, 35(8): 800-6.
|
| [14] |
Obame FN, Plin-Mercier C, Assaly R, et al. Cardioprotective effect of morphine and a blocker of glycogen synthase kinase 3β, SB216763 [3-(2, 4-dichlorophenyl)-4(1-methyl-1H-indol-3-yl)- 1Hpyrrole- 2, 5- dione], via inhibition of the Mitochondrial Peability Transition Pore[J].
J Pharmacol Exp Ther, 2008, 326(1): 252-8.
DOI: 10.1124/jpet.108.138008. |
| [15] |
Chen Z, Spahn DR, Zhang X, et al. Morphine postconditioning protects against reperfusion injury: the role of protein kinase Cepsilon, extracellular signal-regulated kinase 1/2 and mitochondrial permeability transition pores[J].
Cell Physiol Biochem, 2016, 39(5): 1930-40.
DOI: 10.1159/000447890. |
| [16] |
Xi J, Tian W, Zhang L, et al. Morphine prevents the mitochondrial permeability transition pore opening through NO/cGMP/PKG/Zn2+/ GSK- 3beta signal pathway in cardiomyocytes[J].
Am J Physiol Heart Circ Physiol, 2010, 298(2): H601-7.
DOI: 10.1152/ajpheart.00453.2009. |
| [17] |
Dorsch M, Behmenburg F, Raible M, et al. Morphine-induced preconditioning: involvement of protein kinase a and mitochondrial permeability transition pore[J].
PLoS One, 2016, 11(3): e0151025.
DOI: 10.1371/journal.pone.0151025. |
| [18] |
张文明, 杨桂蓉, 李弘烨, 等. 苍术苷抑制氧化磷酸化的作用机制研究[J].
中药新药与临床药理, 2014, 25(6): 660-3.
|
| [19] |
Shahzad T, Kasseckert SA, Iraqi W, et al. Mechanisms involved in postconditioning protection of cardiomyocytes against acute reperfusion injury[J].
J Mol Cell Cardiol, 2013, 58: 209-16.
DOI: 10.1016/j.yjmcc.2013.01.003. |
| [20] |
Zou H, Yang R, Hao J, et al. Regulation of the apaf-1/caspase- 9 apoptosome by caspase-3 and XIAP[J].
J Biol Chem, 2003, 278(10): 8091-8.
DOI: 10.1074/jbc.M204783200. |
| [21] |
Harvey KL, Hussain A, Maddock HL. Maddock. Ipratropium bromide-mediated myocardial injury in in vitro models of myocardial ischaemia/reperfusion[J].
Toxicol Sci, 2014, 138(2): 457-67.
DOI: 10.1093/toxsci/kfu001. |
| [22] |
Tait SW, Green DR. Mitochondria and cell death: outer membrane permeabilization and beyond[J].
Nat Rev Mol Cell Biol, 2010, 11(9): 621-32.
DOI: 10.1038/nrm2952. |
| [23] |
Brenner D, Mak TW. Mitochondrial cell death effectors[J].
Curr Opin Cell Biol, 2009, 21(6): 871-7.
DOI: 10.1016/j.ceb.2009.09.004. |
| [24] |
Feng Y, Lu YW, Lin X, et al. Endomorphins and morphine limit anoxia- reoxygenation- induced brain mitochondrial dysfunction in the mouse[J].
Life Sci, 2008, 82(13-14): 752-63.
DOI: 10.1016/j.lfs.2008.01.004. |
| [25] |
Gómez- Crisóstomo N P, López-Marure R, Zapata E, et al. Bax induces cytochrome c release by multiple mechanisms in mitochondria from MCF7 cells[J].
J Bioenerg Biomembr, 2013, 45(5): 441-8.
DOI: 10.1007/s10863-013-9508-x. |
| [26] |
Cory S, Adams J M. The Bcl2 family: regulators of the cellular lifeor-death switch[J].
Nat Rev Cancer, 2002, 2(9): 647-56.
DOI: 10.1038/nrc883. |
| [27] |
Singh L, Neelam Pushker M D, Saini N, et al. Expression of proapoptotic Bax and anti-apoptotic Bcl-2 proteins in human retinoblastoma[J].
Clin Exp Ophthalmol, 2015, 43(3): 259-67.
DOI: 10.1111/ceo.2015.43.issue-3. |
| [28] |
Kroemer G, Reed JC. Mitochondrial control of cell death[J].
Nat Med, 2000, 6(5): 513-9.
DOI: 10.1038/74994. |
| [29] |
Yao YT, Li LH, Chen L, et al. Sevoflurane postconditioning protects isolated rat hearts against ischemia-reperfusion injury: the role of radical oxygen species, extracellular signal-related kinases 1/2 and mitochondrial permeability transition pore[J].
Mol Biol Rep, 2010, 37(5): 2439-46.
DOI: 10.1007/s11033-009-9755-4. |
 2018, Vol. 38
2018, Vol. 38

