结肠直肠癌(CRC)发病率呈逐渐上升而年龄呈逐渐下降趋势[1-3]。CRC病例与一系列危险因素有关,包括家族性问题,炎性肠病(IBD),吸烟、酗酒和肥胖等[4]。炎症与CRC之间的关系已经确立了好久,炎性细胞因子在CRC的病理过程中起重要作用,包括增殖,转移,凋亡和血管生成[5]。因此,寻找合适的参与CRC进展的炎性细胞因子,探讨其可能的作用机制,有利于开发新的分子标记物和治疗靶点。
同种异体移植物炎症因子-1(AIF-1)是首先从大鼠心脏移植物中活化的巨噬细胞中发现的一种与炎症密切相关的因子[6]。其主要参与各种炎症性疾病,如类风湿性关节炎(RA)[7],1型糖尿病[8]和三硝基苯磺酸(TNBS)-诱导的结肠炎[9]等。而TNBS诱导的结肠炎是一种类似于人类炎症性肠病(IBD)的鼠类结肠炎模型[10],AIF-1可以改善TNBS诱导的结肠炎[9]。因此,我们猜测AIF-1也可能参与CRC的进展。在癌症方面,AIF-1已被报道通过激活NF-κB/cyclinD1途径促进乳腺癌增殖[11],并通过p38 MAPK信号通路上调TNF-α促进乳腺癌细胞迁移[12]。此外,AIF-1可通过调控β-catenin在胃癌中作为保护性预后的指标[13]。然而,AIF-1在CRC发展中的作用仍不清楚。
因此,本研究旨在探索AIF-1在CRC发展中的作用以及可能的作用机制。在实验设计方面,本研究主要分两部分进行,先采用免疫组织化学和免疫印迹的方法比较临床病例CRC组织和癌旁正常组织中AIF-1的表达情况,并分析AIF-1与临床病理特征的关系。然后,我们在体外研究AIF-1在CRC细胞系中的功能,主要包括对CRC细胞增殖,迁移以及凋亡的影响,并用Western blot实验来探索可能涉及的分子机制。
1 资料和方法 1.1 患者和标本我们收集了2013年~2014年间在南方医科大学南方医院普外科的70例结直肠癌组织及癌旁的正常组织标本。手术过程中切取肿瘤中心直径大概0.5 cm的非坏死组织标本作为检测的癌组织标本,同时留取距离肿瘤边缘5 cm以外的癌旁组织作为检测的癌旁正常组织。手术中获得的组织立即在液氮中快速冷冻,然后储存在-80 ℃以等待随后的分析。我们还从手术记录中收集了一系列临床信息,包括性别,年龄,部位,TNM分期,浸润深度,淋巴结转移和肿瘤大小。患者标本采集的纳入标准如下:(1)患者的临床病例资料完整;(2)术前肠镜病理结果提示为结直肠癌,行手术切除后的病理结果支持诊断;(3)所有患者术前未接受过放疗、化疗、免疫治疗等其他抗肿瘤治疗;(4)所有患者为原发性结直肠癌,排除其他肿瘤的干扰;(5)获得患者及医院伦理委员会的知情同意。
1.2 免疫组化染色组织用4%福尔马林固定,石蜡包埋,平行切片4 μm厚度后烤干,然后用二甲苯脱蜡,用不同梯度的乙醇水化。接着用3%过氧化氢阻断内源性过氧化物酶活性,在柠檬酸缓冲液(pH 6.0)中进行微波炉抗原修复。随后在室温下用5% FBS溶液封闭1 h,在4 ℃用AIF-1抗体(Proteintech, China)过夜温育后,用HRP连接的兔二抗在室温下孵育1 h。然后用3,3'-二氨基联苯胺(DAB)进行显色并用苏木精复染,在正置显微镜(Olympus,日本)200及400放大倍率下捕获图像。
在不知道临床数据下对AIF-1在CRC组织进行评分,并使用之前描述的标准系统进行评分[14]。AIF-1表达的染色强度分级如下:0(阴性),1(弱阳性),2(中等阳性)和3(强阳性);AIF-1阳性细胞的比例如下:1(0~ 25%),2(26~50%),3(51~75%)和4(76%~100%)。通过将染色强度评分乘以阳性细胞数评分,我们能够得出0到12的免疫反应评分(IRS):然后我们把IRS≤4的样品被定义为AIF-1低表达,而IRS>4的样品是定义为AIF-1高表达。
1.3 细胞培养从南方医科大学南方医院临床医学研究中心获得人正常结肠上皮细胞系(NCM460)和一系列人结肠癌细胞系(SW480, SW620, HCT116, LOVO)。所有细胞系都在含有10%胎牛血清(Gibco, NY)的DMEM高糖培基(Gibco, NY)中培养,并在含5% CO2的37℃的细胞培养箱中培养。
1.4 质粒构建和转染本研究采取的AIF-1过表达质粒是由上海吉凯基因所提供的。质粒载体GV230采用含绿色荧光标记的EGFP,对照编号为CON083。目的质粒记为(AIF-1),空载对照质粒记为(NC)。将SW480细胞以每孔3×105个细胞的密度接种到6孔板中并培养24 h。然后根据制造商的方案使用Lipofectamine 3000(英潍捷基,美国)转染细胞。转染48 h后,收集RNA和蛋白质样品做后续实验。
1.5 EdU细胞增殖实验根据制造商的说明,通过EdU细胞增殖测定试剂盒(瑞博,广州)测定细胞增殖。简而言之,在转染48 h后,将细胞与50 μmol/L的EdU试剂温育2 h以进行染色,然后进行固定和透化。随后立即用流式细胞仪(BD LSRFortessa, Becton Dickinson, CA)分析染色的细胞。通过FACS Diva软件确定EdU阳性细胞的比例(%)。
1.6 细胞周期分析为了评估细胞周期,在质粒转染48 h后收集SW480细胞,用PBS洗涤2次并在冰冷的70%乙醇中过夜固定。与100 μL RNase A(凯基生物,南京)在37 ℃下相互作用30 min后,细胞用400 μL碘化丙啶在4 ℃避光染色30 min。然后,使用流式细胞仪评估染色的细胞。通过ModFiT软件定义G1,S和G2期的细胞。
1.7 Transwell迁移分析使用24孔的Transwell小室(康宁,美国)来测量细胞迁移的能力。转染后,将1×105/孔的细胞重悬于无血清培养基中并接种于上室中。然后,将500 μL含有10% FBS的培养基添加到下室以吸引细胞。温育48 h后,将细胞固定在甲醇中并用结晶紫染色。上面的非迁移细胞用棉签擦掉。使用倒置显微镜(Olympus,日本)从五个随机视野中确定迁移细胞的数量。
1.8 细胞凋亡分析使用Annexin V-APC/7-AAD细胞凋亡检测试剂盒(凯基生物,南京)来评估细胞凋亡。操作步骤根据其说明书,简而言之,使用不含EDTA的胰蛋白酶消化转染的细胞(经或不经由10 μmol/L SB203580(selleck, 美国)预处理24 h),并用PBS洗涤两次。然后,将细胞重悬于500 μL的结合缓冲液中,用5 μL膜联蛋白V-APC和5 μL的7-AAD染色,并在室温下避光孵育15 min。用流式细胞仪检测总共10 000个细胞,并用FACS Diva软件分析。
1.9 实时定量PCR使用TRIZOL试剂(Takara,东京,日本)从细胞中提取总RNA。然后使用PrimeScriptTM RT试剂盒(Takara)将提取的RNA逆转录成cDNA。使用SYBR®Premix Ex TaqTM(Takara)来量化AIF-1、CyclinD1和CDK4的相对水平,其中GAPDH作为内部对照。引物序列示于表 1中。在Light Cycler 480软件(Roche, Germany)上进行PCR反应,并使用2-ΔΔCt方法显示相对的mRNA表达水平
| 表 1 正向和反向引物的序列 Table 1 Sequence of forward and reverse primers |
使用含有蛋白酶抑制剂cocktail和PMSF的RIPA缓冲液(凯基生物,南京),从患者组织样品或培养的细胞中提取总蛋白质。离心后,收集上清液并使用BCA试剂盒(博彩生物,上海)进行定量分析。蛋白质样品通过SDS-PAGE电泳,并转移到PVDF膜上。一抗AIF-1和GAPDH购自Proteintech公司(中国上海),一抗CyclinD1,CDK4,P21,P27,Bax,Bcl2,Bcl-xl,P38,p-P38,MMP2和MMP9购自CST公司(美国),所有抗体在4 ℃下孵育过夜。洗涤后,将山羊抗兔或驴抗小鼠的二抗(LI-COR bioscience, NE)在室温下孵育1 h。使用Odyssey红外激光成像分析系统(LI-COR)进行免疫染色,并使用Quantity One-1-D软件分析结果。
1.11 统计分析所有的统计分析都采用SPSS 20.0软件(SPSS Inc., Chicago, IL)。结果用均数±标准差来表示。使用two-tailed Student's t检验分析两组之间的差异。采用χ2检验分析AIF-1表达与不同临床病理参数的相关性。P < 0.05被认为差异有统计学意义。
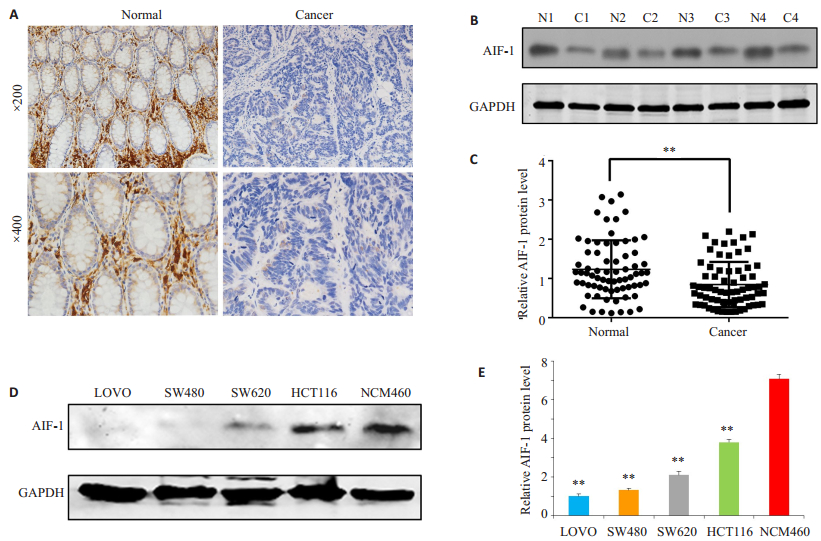
2 结果 2.1 AIF-1在结直肠癌组织和细胞系中表达下调为了探讨AIF-1在结直肠癌中的潜在作用,我们首先检测了AIF-1在70对结直肠癌组织和相邻的正常组织中的表达情况。免疫组化结果显示AIF-1主要定位于正常年末腺体间质细胞和癌组织间质细胞的胞质中,且AIF-1的表达在结直肠癌组织中明显低于癌旁正常组织(图 1A)。Western blot检测结果进一步证实AIF-1蛋白在47/70(67.14%)CRC组织中的表达明显低于癌旁正常组织(1.23±0.74比0.84±0.58,P < 0.01,图 1B、C)。此外,与正常结肠上皮细胞系NCM460相比,四种人结肠癌细胞系(LOVO,SW480,SW620和HCT116)中的AIF-1的蛋白水平明显降低(P < 0.01,图 1D、E)。
|
图 1 AIF-1在结直肠癌组织和细胞系中表达下调 Figure 1 AIF-1 expression level is lowered in human colorectal cancer tissues and cells.A: Representative results of immunohistochemistry showing down-regulation of AIF-1 protein in CRC tissues compared with the adjacent normal tissues.Two magnifications were shown (Original magnification: ×200 and ×400).B: Representative results of Western blotting showed downregulated AIF-1 protein in 4 CRC tissues; C: Relative expression of AIF-1 protein in 70 CRC tissues and paired adjacent normal tissues; D: Western blotting results showing down-regulated AIF-1 protein in 4 CRC cells compared with normal colon epithelial cells NCM460; E: Relative AIF-1 protein level in 4 CRC cell lines and normal colon epithelial cells NCM460.**P < 0.01 vs NCM460. GAPDH was used as loading control.Normal and N represent adjacent normal tissues; cancer and C represent colorectal cancer tissues. |
根据AIF-1在CRC组织中的免疫组织化学染色结果,我们把将70例CRC患者分为两组:一组AIF-1表达相对较高组(29例),另一组是AIF-1表达相对较低组(41例)。然后根据CRC患者的临床资料,研究AIF-1表达水平与临床病理特征的关系,探讨AIF-1在CRC中的临床意义。如表 2所示,我们发现AIF-1的表达与淋巴结转移(P=0.008),TNM分期(P=0.003)和肿瘤大小(P=0.023)显着相关,但与性别,年龄,位置,浸润深度无关。这些发现提示AIF-1的高表达可能与CRC患者良好的预后有关。
| 表 2 AIF-1在结直肠癌组织中的表达与不同临床病理特征的关系 Table 2 Correlation ofAIF-1 expression in colorectal cancer tissues with the clinicopathological features of the patients |
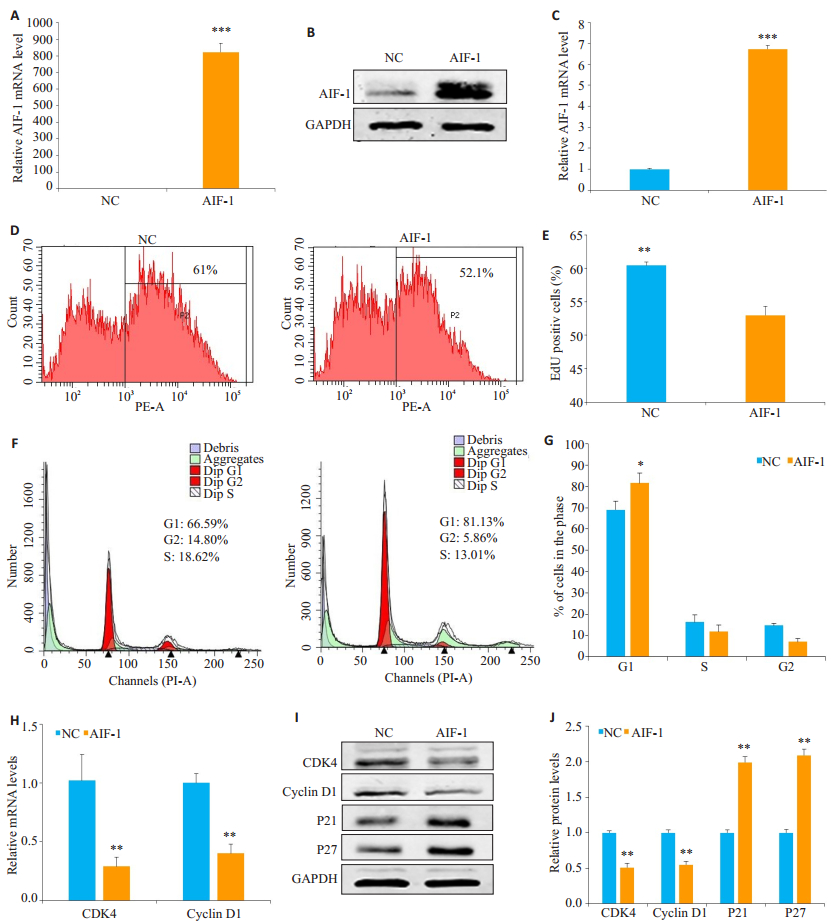
为了研究AIF-1对CRC细胞生长的影响,我们在AIF-1蛋白表达相对较低的SW480细胞中过表达AIF-1质粒(AIF-1)或阴性对照(NC)质粒(因AIF-1蛋白表达最低的LOVO细胞过表达AIF-1后细胞状态不好,所以未用此株细胞)。通过qRT-PCR和western blot来评估转染效率(图 2A~C)。使用EdU增殖测定法分析细胞生长,并且证实在SW480细胞中AIF-1的过表达降低了EdU阳性细胞率(52.97±1.33比60.43±0.51,P < 0.01)(图 2D,E)。我们进一步用流式细胞仪分析了AIF-1抑制SW480细胞生长的可能机制。结果表明,SW480细胞中AIF-1的过度表达显著增加了G1期细胞的比例(图 2F、G)。同时,AIF-1降低了G1到S期转换启动子CDK4和Cyclin D1的mRNA和蛋白水平,但增强了G1期的关守P21和P27的蛋白表达(图 2H~J)。这些结果表明,AIF-1可能作用于G1期到S期检查点来阻断CRC细胞的细胞周期,进而抑制细胞的增殖。
|
图 2 过表达AIF-1抑制SW480细胞的增殖以及阻滞细胞的G1期 Figure 2 Overexpression of AIF-1 inhibits proliferation and cause cell cycle arrest in G1 phase in SW480 cells.A-C: Quantitative RT-PCR and Western blotting showing efficient AIF-1 over-expression in SW480 cells; D-E: Overexpression of AIF-1 reduces EdU-positive cell percentage by FACS analysis; F-G: AIF-1 overexpression induces G1 phase arrest in SW480 cells by FACS analysis; H-J: The mRNA and protein levels of CDK4 and cyclin D1 were significantly down-regulated and the protein expression of p21 and p27 were up-regulated in cells withAIF-1 overexpression.All data are shown as Mean±SD.*P < 0.05, **P < 0.01, ***P < 0.001.GAPDH was used as loading control. |
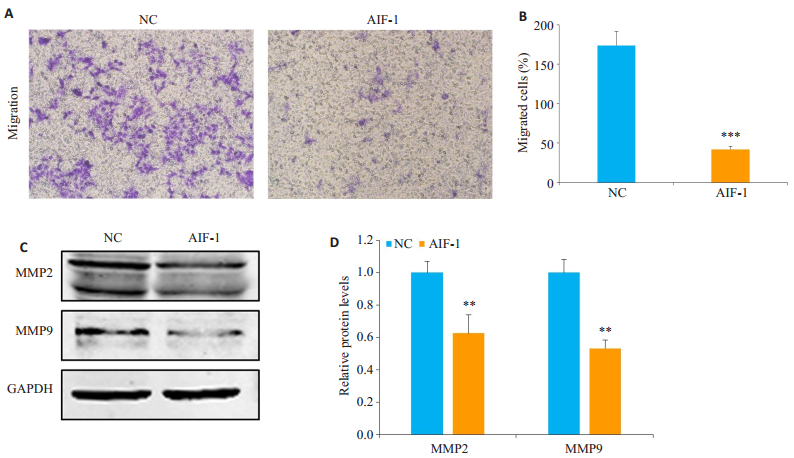
鉴于我们对临床资料的分析显示AIF-1的表达与CRC的转移相关,我们在SW480细胞中过表达AIF-1,以评估AIF-1对CRC细胞迁移能力的影响。Transwell迁移实验表明,与对照组相比,AIF-1的过表达能够显着抑制SW480细胞的迁移(173.67±17.85比42.00±3.89每高倍镜视野,P < 0.001,图 3A、B)。由于已知的基质金属蛋白酶(MMPs)在肿瘤转移中起关键作用,我们检测了相关MMPs的蛋白表达。Western blot结果显示MMPs家族成员MMP2和MMP9在过表达AIF-1的SW480细胞中显著下调(图 3C、D)。
|
图 3 AIF-1过表达抑制SW480细胞的迁移 Figure 3 Overexpression of AIF- 1 suppresses migration of SW480 cells shown by Transwell migration assay (A-B) and significantly lowers the protein levels of MMP2 and MMP9 compared with negative control cells (C-D).All data are shown as Mean±SD.**P < 0.01, ***P < 0.001.GAPDH was used as the loading control. |
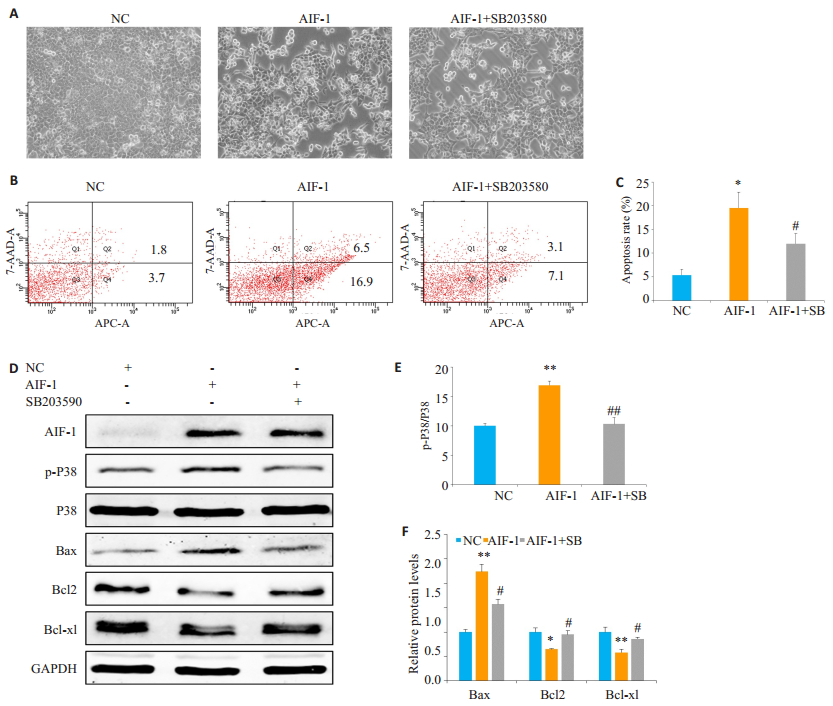
之前的研究表明,p38 MAPK途径可以调节诱导CRC细胞凋亡[15-16],且AIF-1可以调控p38 MAPK途径[12]。为了分析AIF-1对凋亡的影响以及p38 MAPK途径是否参与了这一过程,我们使用了Annexin V-APC和7-AAD双重染色的流式细胞术以及p38 MAPK通路抑制剂SB203580。根据实验方案,我们把转染的细胞分为NC、AIF-1以及AIF-1+SB203580组。在转染48 h后,我们用倒置显微镜观察细胞形态,发现AIF-1过表达组的细胞皱缩、连接松散,形成的透亮的凋亡细胞明显增加,而加SB203580后能改善细胞的形态(图 4A)。随后的流式凋亡细胞术的结果进一步证实了,AIF-1过表达于SW480细胞后能诱导细胞的凋亡,而阻断p38 MAPK途径能减弱AIF-1触发的细胞凋亡(5.37±1.21比19.5±3.35比12.00±2.16,图 4B、C)。接下来,Western blot实验证实了过表达AIF-1能引起p38 MAPK通路的激活,而SB203580有效的阻断了p38 MAPK通路(图 4D、E)。同时我们也检测了与细胞凋亡相关的关键的调节因子,发现AIF-1过表达显著增加了促凋亡因子Bax的蛋白水平,并且降低了抗凋亡因子Bcl2和Bcl-xl的蛋白水平,而SB203580能使上述凋亡调节因子得到恢复(图 4D、F)。这些结果表明AIF-1过表达诱导了SW480细胞的凋亡,且AIF-1是通过p38 MAPK途径参与了这一过程。
|
图 4 AIF-1通过激活p38 MAPK途径促进SW480细胞凋亡 Figure 4 AIF-1 promotes apoptosis by activating p38 MAPK pathway in SW480 cells.A: Morphology of transfected SW480 cells with or without treatment with 10 µmol/L SB203580.B, C: AIF-1 promotes apoptosis by activating p38 MAPK pathway in SW480 cells (flow cytometry annexin V-APC/7-AAD staining).The apoptosis cells were indicated in the UR and LR quadrants; D: Western blotting for detecting protein expression levels of AIF-1, p-P38, P38, Bax, Bcl2, Bcl-xl and GAPDH; E: Relative protein expression of p-P38/total p38 in each group; F: Relative protein expression levels of Bax, Bcl2 and Bcl- xl normalized against GAPDH.All data are shown as Mean±SD.*P < 0.05, **P < 0.01 vs NC group; #P < 0.05 vs AIF- 1 group; ##P < 0.05, compared withAIF-1+SB.SB: SB203580. |
AIF-1是一种EF-手性,钙离子结合的细胞质蛋白,主要在免疫细胞中表达,并与炎症调节有关[17]。至于AIF-1在肿瘤发生发展的报道较少,如促进乳腺癌的增殖和迁移[11, 12],在宫颈癌组织中上调[18]等,且未见有结直肠癌的报道。本文的研究发现AIF-1在结直肠癌组织中的表达明显低于癌旁正常组织,70例临床病理资料分析显示AIF-1的缺失表达与淋巴结转移,高TNM分期及较大肿瘤密切相关。结果提示AIF-1与结直肠癌的发生和转移以及良好的预后密切相关,这是AIF-1在结直肠癌研究中的重要发现,也与最近的一项报道很一致:AIF-1可作为胃癌保护性预后的指标,肿瘤AIF-1的低表达与胃癌患者降低的生存期明显相关[14]。因此本文的结果,对于阐明其在癌症,特别是结直肠癌发生中的作用具有一定的意义。
AIF-1通过调节IL-6,iNOS和IL1β参与炎症性疾病,如类风湿性关节炎,1型糖尿病和结肠炎[7-9]。这些研究表明其是一种重要炎症的因子,而多数肿瘤的发生,都是慢性炎症的最终的结果,与炎症因子的作用相关。因此,AIF-1在肿瘤发生发展中起作用,可能与其炎症调控功能有关,这也符合我们的结果。由于炎症因子的复杂性,特别是结果的间接性,我们接下来主要研究了AIF-1对细胞增殖迁移和凋亡的直接影响,以其获得AIF-1作用的直接证据。
采用体外转染实验,我们证明了AIF-1在SW480细胞中抑制细胞的增殖,抑制其迁移并诱导其凋亡。癌细胞增殖通常与细胞周期调控紊乱有关,从G1期到S期的细胞周期转变被认为是主要的监管检查点之一[19]。本研究中,EdU增殖实验和流式细胞术分析表明,AIF-1过表达导致G1期阻滞和细胞增殖抑制,这与CDK4和Cyclin D1的下调以及P21和P27的上调有关。Cyclin D1是细胞周期的调节因子,通过激活CDK4或CDK6从而促进G1期到S期的转变[20]。P21和P27是两种关键的抑制剂,与细胞周期蛋白和CDK结合,这将导致G1期停滞并抑制肿瘤生长[21]。因此,AIF-1对SW480细胞增殖的抑制作用可能解释为P21和P27表达水平的提高,导致CDK4-Cyclin D1复合物的抑制,并最终诱导G1期细胞周期停滞,进而抑制细胞增殖。至于这一作用是仅存在于结肠癌细胞,还是在其它细胞中也存在,则需进一步证明。
肿瘤转移是个复杂的过程,肿瘤细胞定植于癌巢组织浸润到周围组织甚至远处转移到其他器官涉及到很多东西,包括癌细胞上皮间质转化以及癌细胞对基底膜等周围基质成分的破坏[22]。(基质金属蛋白酶)MMPs是一种高度保守的中性锌依赖性内源酶,不仅能降解细胞外基质还能破坏基底膜[23-24]。其中,MMP2和MMP9在恶性肿瘤中的侵袭转移作用是报道的最广泛的[25-26]。之前的报道显示AIF-1可能参与细胞骨架信号网络和调节血管平滑肌细胞(VSMC)的迁移[27]。但是否与肿瘤转移的MMPs相关,目前并不清楚。我们的研究表明,AIF-1过表达降低了MMP2和MMP9的表达,也同时显著抑制了结肠癌细胞迁移。结果表明,AIF-1抑制肿瘤细胞迁移然后抑制结肠癌细胞转移可能与MMP2以及MMP9的降低有关。
细胞凋亡是一种程序性死亡,是人体对肿瘤细胞生长进行消灭和监控的重要途径,而凋亡逃逸是肿瘤细胞显著标志之一[28]。细胞凋亡与调节凋亡相关的蛋白以及涉及凋亡的相关途径密切相关,凋亡途径是结直肠癌治疗的关键治疗靶点[29],而p38 MAPK途径的激活被广泛报道可诱导结直肠癌的凋亡[15, 30-31]。此外,p38 MAPK通过直接或间接调节凋亡相关因子(如Bax和Bcl2)发挥促凋亡功能[16]。先前的研究表明,AIF-1可以上调INS-1细胞的凋亡[32];且在VSMC中,AIF-1与小GTP酶Rac2相互作用,从而激活Rac2效应蛋白及其近端效应蛋白ERK1/2和p38[33]。在我们的研究中,AIF-1诱导SW480细胞凋亡且p38 MAPK途径被激活。此外,阻断p38 MAPK途径有效地减弱了AIF-1触发的细胞凋亡并可调节凋亡调节剂(Bax,Bcl2和Bcl-xl)的恢复。因此,我们认为AIF-1可能通过激活p38 MAPK通路发生凋亡,然后调节抗凋亡蛋白(Bcl2和Bcl-xl)的减少和促凋亡蛋白(Bax)的增加。
综上所述,我们的研究发现,AIF-1可以在CRC中发挥抑癌作用。抑癌的作用可能涉及一系列的机制,包括G1细胞周期阻滞,细胞增殖减慢,转移抑制和细胞凋亡诱导增加。此外,我们也证实了AIF-1是通过p38 MAPK途径来促进结直肠癌细胞的凋亡。这些发现提示AIF-1有可能作为CRC的肿瘤抑制因子和潜在的治疗靶点。
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].
CACancer J Clin, 2015, 65(2): 87-108.
DOI: 10.3322/caac.21262. |
| [2] |
Bode AM, Dong Z, Wang H. Cancer prevention and control: alarming challenges in China[J].
Natl Sci Rev, 2016, 3(1): 117-27.
DOI: 10.1093/nsr/nwv054. |
| [3] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J].
CACancer J Clin, 2016, 66(2): 115-32.
DOI: 10.3322/caac.21338. |
| [4] |
Brenner H, Kloor M, Pox CP. Colorectal cancer[J].
Lancet, 2014, 383(9927): 1490-502.
DOI: 10.1016/S0140-6736(13)61649-9. |
| [5] |
Zhong Z, Sanchez- Lopez E, Karin M. Autophagy, Inflammation, and immunity: a troika governing cancer and its treatment[J].
Cell, 2016, 166(2): 288-98.
DOI: 10.1016/j.cell.2016.05.051. |
| [6] |
Utans U, Arceci RJ, Yamashita Y, et al. Cloning and characterization of allograft inflammatory factor-1: a novel macrophage factor identified in rat cardiac allografts with chronic rejection[J].
J Clin Invest, 1995, 95(6): 2954-62.
DOI: 10.1172/JCI118003. |
| [7] |
Kimura M, Kawahito Y, Obayashi H, et al. A critical role for allograft inflammatory factor-1 in the pathogenesis of rheumatoid arthritis[J].
J Immunol, 2007, 178(5): 3316-22.
DOI: 10.4049/jimmunol.178.5.3316. |
| [8] |
Zhao YY, Huang XY, Chen ZW. Daintain/AIF-1 (Allograft inflammatory Factor-1) accelerates type 1 diabetes in NOD mice[J].
Biochem Biophys Res Commun, 2012, 427(3): 513-7.
DOI: 10.1016/j.bbrc.2012.09.087. |
| [9] |
Morohashi T, Iwabuchi K, Watano K, et al. Allograft inflammatory factor-1 regulates trinitrobenzene sulphonic acid-induced colitis[J].
Immunology, 2003, 110(1): 112-9.
DOI: 10.1046/j.1365-2567.2003.01714.x. |
| [10] |
Elson CO, Sartor RB, Tennyson GS, et al. Experimental models of inflammatory bowel disease[J].
Gastroenterology, 1995, 109(4): 1344-67.
DOI: 10.1016/0016-5085(95)90599-5. |
| [11] |
Liu S, Tan WY, Chen QR, et al. Daintain/AIF-1 promotes breast cancer proliferation via activation of the NF-kappaB/cyclin D1 pathway and facilitates tumor growth[J].
Cancer Sci, 2008, 99(5): 952-7.
DOI: 10.1111/j.1349-7006.2008.00787.x. |
| [12] |
Li T, Feng Z, Jia S, et al. Daintain/AIF-1 promotes breast cancer cell migration by up-regulated TNF-α via activate p38 MAPK signaling pathway[J].
Breast Cancer Res Treat, 2012, 131(3): 891-8.
DOI: 10.1007/s10549-011-1519-x. |
| [13] |
Ye Y, Miao S, Lu R, et al. Allograft inflammatory factor-1 is an independent prognostic indicator that regulates β-catenin in gastric cancer[J].
Oncol Rep, 2014, 31(2): 828-34.
DOI: 10.3892/or.2013.2915. |
| [14] |
Mao X, Li P, Ren Y, et al. Cell polarity protein CRB3 is an independent favorable prognostic factor for clear cell renal cell carcinoma[J].
Int J Oncol, 2015, 46(2): 657-66.
DOI: 10.3892/ijo.2014.2763. |
| [15] |
Hsu WH, Hsieh YS, Kuo HC, et al. Berberine induces apoptosis in SW620 human colonic carcinoma cells through generation of reactive oxygen species and activation of JNK/p38 MAPK and FasL[J].
Arch Toxicol, 2007, 81(10): 719-28.
DOI: 10.1007/s00204-006-0169-y. |
| [16] |
Hui K, Yang Y, Shi K, et al. The p38 MAPK-regulated PKD1/CREB/ Bcl-2 pathway contributes to selenite-induced colorectal cancer cell apoptosis in vitro and in vivo[J].
Cancer Lett, 2014, 354(1): 189-99.
DOI: 10.1016/j.canlet.2014.08.009. |
| [17] |
Zhao YY, Yan DJ, Chen ZW. Role of AIF-1 in the regulation of inflammatory activation and diverse disease processes[J].
Cell Immunol, 2013, 284(1-2): 75-83.
DOI: 10.1016/j.cellimm.2013.07.008. |
| [18] |
Song JY, Bae HS, Koo dH, et al. Candidates for tumor markers of cervical cancer discovered by proteomic analysis[J].
J Korean Med Sci, 2012, 27(12): 1479-85.
DOI: 10.3346/jkms.2012.27.12.1479. |
| [19] |
Fischer M, Müller GA. Cell cycle transcription control: DREAM/ MuvB and RB- E2F complexes[J].
Crit Rev Biochem Mol Biol, 2017, 52(6): 638-62.
DOI: 10.1080/10409238.2017.1360836. |
| [20] |
Qie S, Diehl JA. Cyclin D1, cancer progression, and opportunities in cancer treatment[J].
J Mol Med (Berl), 2016, 94(12): 1313-26.
DOI: 10.1007/s00109-016-1475-3. |
| [21] |
Besson A, Dowdy SF, Roberts JM. CDK inhibitors: cell cycle regulators and beyond[J].
Dev Cell, 2008, 14(2): 159-69.
DOI: 10.1016/j.devcel.2008.01.013. |
| [22] |
Li W, Li S, Deng L, et al. Decreased MT1-MMP in gastric cancer suppressed cell migration and invasion via regulating MMPs and EMT[J].
Tumour Biol, 2015, 36(9): 6883-9.
DOI: 10.1007/s13277-015-3381-7. |
| [23] |
Jobim FC, Xavier NL, Uchoa DM, et al. Prevalence of vascularendothelial growth factor, matrix metalloproteinases and tissue inhibitors of metalloproteinases in primary breast cancer[J].
Braz J Med Biol Res, 2009, 42(10): 979-87.
DOI: 10.1590/S0100-879X2009005000016. |
| [24] |
Piperigkou Z, Manou D, Karamanou K, et al. Strategies to target matrix metalloproteinases as therapeutic approach in cancer[J].
Methods Mol Biol, 2018, 1731: 325-48.
DOI: 10.1007/978-1-4939-7595-2. |
| [25] |
Kermorgant S, Aparicio T, Dessirier V, et al. Hepatocyte growth factor induces colonic cancer cell invasiveness via enhanced motility and protease overproduction.Evidence for PI3 kinase and PKC involvement[J].
Carcinogenesis, 2001, 22(7): 1035-42.
DOI: 10.1093/carcin/22.7.1035. |
| [26] |
Fang JH, Zhou HC, Zeng C, et al. MicroRNA-29b suppresses tumor angiogenesis, invasion, and metastasis by regulating matrix metalloproteinase 2 expression[J].
Hepatology, 2011, 54(5): 1729-40.
DOI: 10.1002/hep.24577. |
| [27] |
Autieri MV, Kelemen SE, Wendt KW. AIF-1 is an actin-polymerizing and Rac1- activating protein that promotes vascular smooth muscle cell migration[J].
Circ Res, 2003, 92(10): 1107-14.
DOI: 10.1161/01.RES.0000074000.03562.CC. |
| [28] |
Hanahan D, Weinberg RA. The hallmarks of cancer[J].
Cell, 2000, 100(1): 57-70.
DOI: 10.1016/S0092-8674(00)81683-9. |
| [29] |
Abraha AM, Ketema EB. Apoptotic pathways as a therapeutic target for colorectal cancer treatment[J].
World J Gastrointest Oncol, 2016, 8(8): 583-91.
DOI: 10.4251/wjgo.v8.i8.583. |
| [30] |
Sui X, Kong N, Ye L, et al. p38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents[J].
Cancer Lett, 2014, 344(2): 174-9.
DOI: 10.1016/j.canlet.2013.11.019. |
| [31] |
Wang J, Huang F, Bai Z, et al. Curcumol inhibits growth and induces apoptosis of colorectal cancer LoVo cell line via IGF-1R and p38 MAPK pathway[J].
Int J Mol Sci, 2015, 16(8): 19851-67.
DOI: 10.3390/ijms160819851. |
| [32] |
Huang X, Zhao Y, Jia S, et al. Effects of daintain/AIF-1 on β cell dysfunction in INS-1 cells[J].
Biosci Biotechnol Biochem, 2011, 75(9): 1842-4.
DOI: 10.1271/bbb.110317. |
| [33] |
Tian Y, Autieri MV. Cytokine expression and AIF-1-mediated activation of Rac2 in vascular smooth muscle cells: a role for Rac2 in VSMC activation[J].
Am J Physiol Cell Physiol, 2007, 292(2): C841-9.
DOI: 10.1152/ajpcell.00334.2006. |
 2018, Vol. 38
2018, Vol. 38

