2. 深圳市第二人民医院内分泌科肾内科,广东 深圳 518037;
3. 深圳大学医学部,广东 深圳 518060
2. Department of Nephrology, Shenzhen Second People's Hospital, Shenzhen 518037, China;
3. Shenzhen University Health Science Center, Shenzhen 518060, China
2015年国际糖尿病联盟(IDF)公布的糖尿病地图数据显示,全球约有4.15亿糖尿病患者,而中国患病人数已达1.09亿,发病率高达10.6%,居全球首位[1]。2型糖尿病(T2DM)已经成为全球主要的公共健康问题。邬丹等报道,中国南方地区的T2DM患者中约25.2%合并有高尿酸血症[2]。而有研究指出[3-4],尿酸水平升高预示着糖尿病、肥胖、高血压和代谢综合征的发展,是加重肾脏病进展和心脑血管并发症发生的独立危险因素。C肽是一种广泛用于评估胰岛功能的有效方法,在一定程度上可反映胰岛素抵抗的情况[5]。研究表明,高尿酸血症患者易合并有高胰岛素血症,也存在一定的胰岛素抵抗[6]。在T2DM患者中,有关空腹C肽与高尿酸血症之间的关系的研究较少,得到的初步研究结果尚未能完全定论[7]。本研究拟采用横断面研究的方法探讨两者之间的关系,为预防糖尿病患者尿酸升高提供参考的理论依据。
1 对象和方法 1.1 研究对象收集2015年6月~2015年10月期间在我院内分泌科住院的T2DM患者,共有347例资料相对完整的患者纳入研究。糖尿病诊断与分型依据1999年WHO诊断标准。高尿酸血症诊断依据2017年《中国高尿酸血症相关疾病诊疗多学科专家共识》[8]。慢性肾脏病分期(CKD)依据美国肾脏基金会指定的指南分为CKD1~5期,CKD1期:eGFR≥90 mL/(min·1.73 m2),CKD2期:eGFR 89~60 mL/(min·1.73 m2),CKD3期:eGFR 59~ 30 mL/(min · 1.73 m2),CKD4期:eGFR 29~15 mL/(min·1.73 m2),CKD5期:eGFR < 15 mL/(min·1.73 m2)。所有2型糖尿病患者均使用口服降糖药或(和)皮下注射胰岛素。排除标准:患有其他类型的糖尿病者;糖尿病酮症酸中毒、高渗性昏迷等急性代谢紊乱;急慢性感染、急慢性心力衰竭;急慢性肾功能不全、肾移植和透析、肾血管疾病、尿路梗阻;肿瘤、中毒患者;妊娠期妇女;高尿酸血症导致的痛风发作且未规律治疗者;曾经使用降尿酸剂或利尿剂者;心脑血管疾病者。本研究由深圳市第二人民医院伦理委员会审核并批准,所有患者均已签署知情同意书。
1.2 研究方法收集患者年龄、性别、糖尿病病程、发病年龄,询问吸烟史、饮酒史、糖尿病家族史、女性月经史等,测量患者身高、体质量、腰围、臀围,计算体质量指数(BMI)、腰臀比,使用汞水银柱测量收缩压、舒张压。抽取空腹8 h后静脉血,检测空腹血糖(FBG)、空腹C肽(F-CP)、餐后2 h血糖(2 hPBG)、餐后2 hC肽(2 hP-CP)、糖化血红蛋白(HbA1c)、血尿酸(SUA)、血肌酐(SCr)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、同型半胱氨酸(HCY)等指标。其中HbA1c利用高效液相色谱法测定,FBG、2 hPBG利用己糖激酶法测定,F-CP、2 hP-CP利用放射免疫分析法测定。留取24 h尿,女性均于月经完全干净后留取,检测24 h尿白蛋白定量。eGFR由简化MDRD公式计算,即eGFR[mL/(min·1.73m2)]=186×(Cr/88.4)-1.154×年龄-0.203× 0.742(女性)。
1.3 统计学方法采用SPSS17.0、EmpowerStats软件进行统计学数据分析。各组数据均进行正态性检验,非正态分布变量经自然对数转换成近似正态分布后进行分析,以均数±标准差表示,两组间比较采用T检验。计数资料组间比较进行χ2检验。多组间比较采用单因素方差分析。正态分布资料采用Pearson相关分析,非正态分布资料采用Spearman相关分析。高尿酸血症的影响因素采用非条件Logistic逐步回归分析。矫正混杂因素后,采用EmpowerStats软件中的多元回归方程行多因素分析,采用交互作用检验行影响因素的分层分析。利用ROC曲线探索空腹C肽对血尿酸的影响程度,通过cut-off值得到最佳的影响血尿酸变化的F-CP值。P < 0.05为差异具有统计学意义。
2 结果 2.1 按照血尿酸分组的两组患者临床指标比较根据血尿酸水平将上述患者分为SUA>420 μmol/L和SUA≤420 μmol/L两组,简称为高尿酸组(HUA)和尿酸正常组(NHUA)。其中高尿酸组的患者87例,占25.07%。与尿酸正常组相比,高尿酸组男性患者较多(P < 0.001),年龄、发病年龄较小(P < 0.05),HbA1c水平较低(P=0.005),HDL、eGFR等水平偏低(均P < 0.005),BMI、腰臀比、F-CP、2 hP-CP、TG、HCY、SCr等水平增加(P < 0.05),合并有饮酒史患者比例较高(44.8%比32.6%,P=0.006)。糖尿病病程、收缩压、舒张压、FBG、2 hPBG、TC、LDL、尿白蛋白定量、吸烟史、糖尿病家族史均在两组患者的比较中未见统计学差异(P>0.05,表 1)。
| 表 1 高尿酸组(HUA)和正常组(NHUA)两组患者一般资料和临床指标的比较 Table 1 Comparison of general information and clinical indicators between the hyperuricemia (HUA) group and normal serum uric acid group (NHUA) |
根据F-CP水平按照四分位法分为C1组(< 0.74 ng/mL)72例、C2组(0.74~1.21 ng/mL)73例、C3组(1.22~1.87 ng/mL)73例、C4组(>1.87 ng/mL)74例,共292例,其中F-CP数据缺失55例。F-CP四个亚组相比较,4组间年龄、糖尿病病程、BMI、腰臀比、舒张压、HbA1c、2 hP-CP、TG、HCY、SUA均有统计学差异(均P < 0.05)。而发病年龄、收缩压、FBG、2 hPBG、TC、LDL、HDL、SCr、eGFR、24 h尿白蛋白定量、吸烟史、饮酒史、糖尿病家族史均在4组患者的比较中未见统计学差异(均P>0.05,表 2)。
| 表 2 F-CP各亚组患者一般资料及临床指标的比较 Table 2 Comparison of general information and clinical indicators among F-CP subgroups |
根据F-CP水平按照四分位法分为C1组、C2组、C3组、C4组。4个亚组组与组间F-CP水平存在明显差异,随着C肽水平的增加,血尿酸的水平也随之增加,差异具有统计学意义(P < 0.0001),且此趋势明显(P=0.0011 for trend)。另随着F-CP亚组的增加,SUA水平及其高尿酸血症的发病率也随之增加,且各亚组间差异均具有统计学意义(均P < 0.05)。分析各亚组间两两比较SUA水平,同样可见均具有明显的统计学差异(P < 0.05,表 3)。
| 表 3 F-CP各亚组与血尿酸水平及高尿酸血症发病率的比较 Table 3 Comparison of serum uric acid level and incidence of hyperuricemia in patients with different |
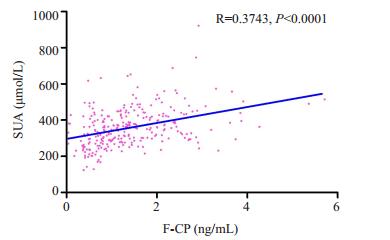
SUA与F-CP、2 hP-CP、BMI、腰臀比、舒张压、TG、HCY、SCr、吸烟史、饮酒史等呈正相关关系(均P < 0.05),而与性别、年龄、发病年龄、HbA1c、HDL、eGFR等呈负相关关系(均P < 0.05,图 1)。
|
图 1 F-CP与SUA之间的关系 Figure 1 Relationship between F-CP and SUA. F-CP: Fasting C-peptide; SUA: Serum uric acid; R: Correlation coefficient. |
把上述所有因素通过单因素Logistic回归分析,寻找所有与T2DM患者血尿酸升高的有关因素。结果分析:性别构成、年龄、饮酒史、BMI、腰臀比、HbA1c、2 hPCP、TG、HDL、HCY、SCr、eGFR及F-CP等因素与T2DM患者血尿酸升高有关。将上述变量作为协变量纳入回归方程,将SUA是否大于420 μmol/L分类后作为因变量,进行二元Logistic逐步回归分析,结果提示,F-CP、TG、SCr水平的增加为血尿酸升高的独立危险因素(均P < 0.05),而性别则为血尿酸升高的独立保护因素(P=0.005,表 4)。
| 表 4 高尿酸血症的影响因素的Logistic回归分析(向前条件) Table 4 Logistic regression analysis of risk factors of hyperuricemia (forward condition) |
性别是影响血尿酸升高的独立因素,男性较女性更易发生高尿酸血症。采用EmpowerStats软件中的分层交互检验作用对性别进行分析。在未调整任何因素前,男性和女性两个群体中F-CP与血尿酸的关系存在,在调整其他影响因素后,男性患者F-CP与血尿酸两者的关系依然存在(均P < 0.05),而女性患者则在调整其他因素后两者关系没有统计学意义(均P>0.05)。但是在经过交互检验作用(P interaction)后,发现无论是否调整其他因素,均发现性别不能影响F-CP与血尿酸之间的关系(均P interaction>0.05,表 5)。
| 表 5 分层交互分析性别对F-CP与血尿酸之间关系的影响作用 Table 5 Hierarchical interaction analysis of the impact of gender on the relationship between F-CP and serum uric acid |
由上述结果可知,性别、年龄、饮酒史、BMI、腰臀比、HbA1c、2 hP-CP、TG、HDL、HCY、SCr、eGFR及FCP等因素与T2DM患者血尿酸升高密切相关。将上述因素作为调整变量模型Ⅰ,并在模型Ⅰ基础上纳入糖尿病病程、24 h尿白蛋白作为模型Ⅱ行多元线性回归分析,其中自变量为F-CP,因变量为血尿酸水平。结果显示,未调整模型中,随着F-CP增加,血尿酸水平升高的风险也将增加(β>0),差异具有明显统计学意义(P < 0.001)。调整后的模型Ⅰ显示,F-CP每增加1 ng/mL,血尿酸升高17.1 μmol/L,95%置信区间为(1.1~33.1);调整后的模型Ⅱ显示,F-CP每增加1 ng/mL,血尿酸升高19.1 μmol/L,95%置信区间为(2.8~35.3),两个调整后的模型差异均具有明显的统计学意义(P=0.038、0.022)。在进一步调整影响血尿酸升高的多种相关混杂因素后,发现F-CP是能预测T2DM患者血尿酸升高的独立危险因素(表 6)。
| 表 6 F-CP与血尿酸水平相关危险度的多元线性回归分析 Table 6 Multiple linear regression analysis of F-CP as a risk factor of elevated serum uric acid level |
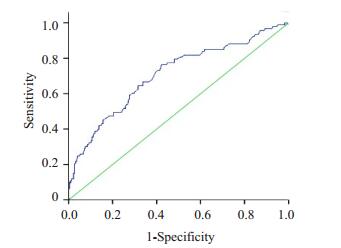
上述研究结果表明,F-CP为2型糖尿病患者血尿酸升高的独立危险因素,现通过ROC曲线进一步明确空腹C肽对血尿酸水平影响的程度(图 2)。结果发现,空腹C肽预测T2DM患者血尿酸升高的ROC曲线下面积为0.700,敏感度为0.73,特异性为0.59,由此可得到的cut-off值为1.260 ng/mL。因此,当空腹C肽在1.260 ng/mL以上时,糖尿病患者出现高尿酸血症的几率将明显增加。
|
图 2 空腹C肽影响血尿酸升高的ROC曲线 Figure 2 ROC curve of fasting C peptide affecting elevated serum uric acid. |
众所周知,T2DM的主要病因是胰岛素抵抗和胰岛β细胞功能缺陷。Abreu等[9]研究认为,高尿酸血症可加剧胰岛素抵抗和胰岛β细胞功能缺陷,从而诱发和加重糖代谢紊乱。另一方面,高尿酸血症是糖尿病大血管及微血管并发症的独立危险因素,会明显增加心血管疾病的发生率和死亡率,以及加速糖尿病肾病的恶化[10-12]。因此,对早期T2DM进行高尿酸血症的风险评估,有助于延缓糖尿病并发症的发生与发展。C肽是一种广泛应用于评估胰岛功能的有效方法,在一定程度上可反映胰岛素抵抗的情况[5],但又有研究表明,更高水平的C肽只与非糖尿病患者的心血管病和全因死亡率相关[13-14]。目前关于糖尿病患者空腹C肽与血尿酸之间的关系的研究还较少,且说法不一致。本研究拟探讨两者的关系,为预防糖尿病患者高尿酸血症及并发症的发生提供理论依据。
本研究相关性分析结果显示,BMI、腰臀比、舒张压、F-CP、2 hP-CP、TG、HCY、SCr与血尿酸水平呈正相关关系。在美国第三次全国健康和营养调查中,对8669例年龄在20岁以上的人群分析表明,随着血尿酸升高,代谢综合征(MetS)发生率明显增加[15],而MetS通常是与生活方式密切相关,以肥胖、高血糖、高血压及血脂异常等为特征的一组临床症候群。当摄入富含TG的食物将导致嘌呤合成亢进,进而SUA生成增加,同时脂肪代谢的产物会进一步抑制SUA的排泄,反之,SUA水平增加将促进脂质氧化及过氧化,从而导致血脂异常[7]。另一方面,Ye等[16]研究表明在调整了年龄、性别等混杂因素后,高尿酸水平是蛋白尿的独立预测因素,从而进一步参与恶化肾功能的进展。
研究发现,T2DM患者中约25.2%合并高尿酸血症,本研究为25.07%,与已有研究大体保持一致。高尿酸血症与胰岛素抵抗密切相关,动物实验发现,血尿酸可通过直接影响核因子-κB-诱导型一氧化氮合酶-一氧化氮(NO)(NF-κB-i NOS-NO)信号通路,进而影响介导胰岛β细胞中胰岛素的合成和分泌,而持续尿酸升高引起胰岛β细胞死亡或功能异常,故引起血糖水平升高[17]。
C肽是含31个氨基酸的多肽,它和胰岛素的A、B链组成胰岛素原,是A、B链的连接链[18]。人体内的C肽比胰岛素降解速度慢,半数的胰岛素在肝脏有首过代谢作用,但C肽可以忽略肝脏清除率,且C肽的测量能避免了外源性和内源性胰岛素之间的测定交叉反应,更能准确反映体内胰岛素的分泌。C肽偏高往往提示着可能存在胰岛素抵抗。而临床上普遍接受把葡萄糖处置指数(DI)作为评判胰岛素分泌且能很好反映胰岛β细胞功能的指标[19]。但有研究表明,体内C肽水平的增加同时将伴随着胰岛素抵抗增加和胰岛素敏感性逐渐降低[20],C肽可能是2型糖尿病中胰岛素抵抗和代谢综合征表型的标志物[21-22]。C肽在血管细胞及其病变中有着潜在作用,它可能促进炎症细胞募集到早期病变,并通过诱导平滑肌细胞增殖促进病变进展[23],这与T2DM中高尿酸血症引起胰岛素抵抗的机制如出一辙[26]。
本研究显示,高尿酸血症与空腹C肽呈正相关关系,提示尿酸升高与胰岛素抵抗密切相关。究其可能的机制为:①胰岛素刺激肾近端小管上皮细胞刷状缘,促进尿酸盐阴离子和Na+交换,增加尿酸的重吸收,且胰岛素抵抗将进一步重吸收尿酸,故引起血尿酸进一步升高[24];②胰岛素抵抗时可增加肝内脂肪合成,导致嘌呤代谢紊乱,血尿酸生成增加[25];③尿酸升高可引起内源性一氧化氮减少和内皮功能损伤,促进炎症反应和氧化应激的发生进而引起胰岛素抵抗的发生[26]。而在美国第三次全国健康和营养调查中也发现[15],空腹C肽水平与血尿酸水平之间呈强线性独立关系,也正进一步揭示了胰岛素水平、胰岛素抵抗和血清尿酸水平之间的密切联系。
本研究中,空腹C肽及高尿酸呈正相关关系,且两者均与胰岛素抵抗密切相关,结合Logistic及多元回归方程分析发现空腹C肽为高尿酸血症的独立危险的因素,空腹C肽越高,T2DM合并高尿酸血症的几率就越大。由此不难判断,空腹C肽水平可作为预测T2DM患者的血尿酸程度的重要标志。因此,临床上应该对空腹C肽的测量重视,筛选出T2DM合并高尿酸血症的危险人群,并积极控制BMI、腰臀围、血糖、血脂、舒张压、血糖等水平,减少尿蛋白,这对防止或延缓糖尿病血管并发症及心脑血管疾病的发生具有重要的理论指导意义。
综上所述,空腹C肽升高可能是2型糖尿病患者并发高尿酸血症的危险因素,空腹C肽水平可以预测T2DM患者血尿酸的进展。但是,由于本研究血尿酸与空腹C肽部分数据有所缺失,且该研究为横断面研究,缺乏随访数据进一步对T2DM患者动态观察空腹C肽与血尿酸变化水平,故有一定的局限性。T2DM患者中空腹C肽与血尿酸之间的关系还需要大样本、多中心、前瞻性、病例对照等全方位的研究来进一步探讨。
| [1] |
Whiting DR, Guariguata L, Weil C, et al. IDF diabetes Atlas: global estimates of the prevalence of diabetes for 2011 and 2030[J].
Diabetes Res Clin Pract, 2011, 94(3): 311-21.
DOI: 10.1016/j.diabres.2011.10.029. |
| [2] |
邬丹, 刘宏, 李申恒. 尿酸与2型糖尿病代谢紊乱及危险因素分析[J].
南方医科大学学报, 2011, 31(3): 544-7.
|
| [3] |
中国医师协会肾脏内科医师分会. 中国肾脏疾病高尿酸血症诊治的实践指南(2017版[J].
中华医学杂志, 2017, 97(25): 1927-36.
DOI: 10.3760/cma.j.issn.0376-2491.2017.25.003. |
| [4] |
Feig D, Kang DH, Johnson RJ. Uric acid and cardiovascular risk[J].
N Engl J Med, 2008, 359(17): 1811-21.
DOI: 10.1056/NEJMra0800885. |
| [5] |
Jones AG, Hattersley AT. The clinical utility of C-peptide measurement in the care of patients with diabetes[J].
Diabet Med, 2013, 30(7): 803-17.
DOI: 10.1111/dme.12159. |
| [6] |
Niskanen L, Laaksonen DE, Lindström J, et al. Serum uric acid as a harbinger of metabolic outcome in subjects with impaired glucose tolerance: the Finnish Diabetes Prevention Study[J].
Diabetes Care, 2006, 29(3): 709-11.
DOI: 10.2337/diacare.29.03.06.dc05-1465. |
| [7] |
马静, 赵立华, 谢云. 2型糖尿病合并高尿酸血症患者与空腹C肽和胰岛素抵抗的相关性研究[J].
中国糖尿病杂志, 2015, 23(1): 46-9.
|
| [8] |
高尿酸血症相关疾病诊疗多学科共识专家组. 中国高尿酸血症相关疾病诊疗多学科专家共识[J].
中华内科杂志, 2017, 56(3): 235-48.
|
| [9] |
Abreu E, Fonseca MJ, Santos AC. Association between hyperuricemia and insulin resistance[J].
Acta Med Port, 2011, 24(Suppl 2): 565-74.
|
| [10] |
Resl M, Clodi M, Neuhold S, et al. Serum uric acid is related to cardiovascular events and correlates with N-terminal pro-B-type natriuretic peptide and albuminuria in patients with diabetes mellitus[J].
Diabet Med, 2012, 29(6): 721-5.
DOI: 10.1111/j.1464-5491.2011.03515.x. |
| [11] |
Chen Z, Ding Z, Fu C, et al. Correlation between serum uric Acid and renal function in patients with stable coronary artery disease and type 2 diabetes[J].
J Clin Med Res, 2014, 6(6): 443-50.
|
| [12] |
Tanaka K, Hara S, Hattori M, et al. Role of elevated serum uric acid levels at the onset of overt nephropathy in the risk for renal function decline in patients with type 2 diabetes[J].
J Diabetes Investig, 2015, 6(1): 98-104.
DOI: 10.1111/jdi.12243. |
| [13] |
Min JY, Min KB. Serum C-peptide levels and risk of death among adults without diabetes mellitus[J].
CMAJ, 2013, 185(9): E402-8.
DOI: 10.1503/cmaj.121950. |
| [14] |
Cabrera De León A, Oliva García JG, Marcelino Rodríguez I, et al. C-peptide as a risk factor of coronary artery disease in the general population[J].
Diab Vasc Dis Res, 2015, 12(3): 199-207.
DOI: 10.1177/1479164114564900. |
| [15] |
Choi HK, Ford ES. Haemoglobin a1c, fasting glucose, serum cpeptide and insulin resistance in relation to serum uric acid levels--the third National health and nutrition examination survey[J].
Rheumatology (Oxford), 2008, 47(5): 713-7.
DOI: 10.1093/rheumatology/ken066. |
| [16] |
Ye X, Cao Y, Gao F, et al. Elevated serum uric acid levels are Independent risk factors for diabetic foot ulcer in female Chinese patients with type 2 diabetes[J].
J Diabetes, 2014, 6(1): 42-7.
DOI: 10.1111/jdb.2014.6.issue-1. |
| [17] |
Jia L, Xing J, Ding Y, et al. Hyperuricemia causes pancreatic β-cell death and dysfunction through NF-κB signaling pathway[J].
PLoS One, 2013, 8(10): e78284.
DOI: 10.1371/journal.pone.0078284. |
| [18] |
Yosten GL, Maric-Bilkan C, Luppi P, et al. Physiological effects and therapeutic potential of proinsulin C-peptide[J].
Am J Physiol Endocrinol Metab, 2014, 307(11): E955-68.
DOI: 10.1152/ajpendo.00130.2014. |
| [19] |
Shankar SS, Vella A, Raymond RH, et al. Standardized MixedMeal tolerance and arginine stimulation tests provide reproducible and complementary measures of β-Cell function: results from the foundation for the National institutes of health biomarkers consortium investigative series[J].
Diabetes Care, 2016, 39(9): 1602-13.
DOI: 10.2337/dc15-0931. |
| [20] |
Banu S, Jabir NR, Manjunath CN, et al. C-peptide and its correlation to parameters of insulin resistance in the metabolic syndrome[J].
CNS Neurol Disord Drug Targets, 2011, 10(8): 921-7.
DOI: 10.2174/187152711799219271. |
| [21] |
Marx N, Silbernagel G, Brandenburg V, et al. C-peptide levels are associated with mortality and cardiovascular mortality in patients undergoing angiography: the LURIC study[J].
Diabetes Care, 2013, 36(3): 708-14.
DOI: 10.2337/dc12-1211. |
| [22] |
Bo S, Gentile L, Castiglione A, et al. C-peptide and the risk for incident complications and mortality in type 2 diabetic patients: a retrospective cohort study after a 14-year follow-up[J].
Eur J Endocrinol, 2012, 167(2): 173-80.
|
| [23] |
Marx N, Walcher D. C-Peptide and atherogenesis: C-Peptide as a mediator of lesion development in patients with type 2 diabetes mellitus[J].
Exp Diabetes Res, 2008, 2018: 385108.
|
| [24] |
Bhole V, Choi JW, Kim SW, et al. Serum uric acid levels and the risk of type 2 diabetes: a prospective study[J].
Am J Med, 2010, 123(10): 957-61.
DOI: 10.1016/j.amjmed.2010.03.027. |
| [25] |
Kim HJ, Ryu J, Ahn SY, et al. Association of insulin resistance with lower glomerular filtration rate and all-cause mortality in the Korean elderly population: a community-based prospective cohort study[J].
Tohoku J Exp Med, 2013, 231(4): 271-9.
DOI: 10.1620/tjem.231.271. |
| [26] |
张妮娅, 刘超. 2型糖尿病患者血尿酸水平与高胰岛素血症和胰岛素抵抗的关系[J].
山东医药, 2015, 6(55): 44-5.
|
 2018, Vol. 38
2018, Vol. 38

