烟雾病(MMD)是一种慢性、进展性脑血管疾病。它以双侧颈内动脉末端及其主要分支进行性狭窄或闭塞,伴颅底异常新生血管网为特征[1]。在MMD发病患者中,以脑缺血为表现的患者约占60%,且发病年龄呈现双峰分布现象,即第1高峰为5~9岁,第2高峰为40岁,以脑出血为表现的患者约占20%,发病年龄基本集中在40岁,成单峰分布[2-3]。是什么原因引领MMD出现这不同的临床结局,目前尚不清楚[4]。MMD病人脑出血主要是在侧脑室三角区周围,脉络膜前动脉与髓动脉的异常吻合血管扩张出血[5]。来自后交通动脉的穿通动脉的扩张,是MMD患者丘脑出血的主要原因[6]。也有研究指出:脉络膜前动脉和后交通动脉的扩张是MMD患者脑出血的独立预测因子[7-8]。这些导致脑出血的异常血管在MMD患者之间分布有什么特点?关于MMD患者脑血管血流模式的特点,特别是侧枝循环系统分类方面,目前国内[9-11]很多研究者都在脑出血的MMD队列中去探讨MMD患者侧枝循环的特点,也有研究者以CTA影像探讨MMD患者侧枝循环的特点[12]。Jang[4]等最早按卒中的分型去分析MMD病人脑血管造影特点,但并没有对侧枝循环系统进行分类。脑出血和脑缺血是MMD病人自然病程的主要转归,通过研究两者的差异,本研究从新的角度去了解病人脑血管解剖特点。通过对病人脑血管解剖学特点的解读,有利于对患者病情的掌握,制定个体化的治疗方案。对侧枝循环系统进行分类,探索MMD患者脑血管的血流模式与疾病关系,探讨合适的MMD病人脑血流模式评价方法,国内外未见类似研究。
我们假设不同卒中类型的MMD患者脑血管血流模式存在差异。我们研究缺血性和出血性卒中MMD患者脑血管的特点,探索MMD患者脑血管的血流模式与疾病关系,探讨合适的MMD病人脑血流模式评价方法,寻找预测病人出血性卒中的敏感因素。
1 资料和方法 1.1 基本资料收集2006~2016年在南方医科大学南方医院神经外科接受DSA检查的所有成人MMD病人资料。入组条件:年龄≥18岁;DSA检查结果符合MMD诊断标准[1];CT或MR检查证明脑梗塞或脑出血;发生脑卒中事件和DSA检查时间在1月内;患者资料完整。排除标准:在后交通动脉与颈内动脉比值中,排除后交通动脉在脑血管造影下没有显影的大脑半球;排除在行脑血管造影检查之前,已行脑血管重建手术的病例;脉络膜前动脉研究中,排除脉络膜前动脉没有显影的病例。
1.2 方法两名中级以上的神经放射学专家,双盲分析临床和影像学结果,对疾病严重程度进行分级,并以协商一致的方式解决分歧。根据CT或MR检查结果分为两组:缺血组和出血组。
MMD是一种进展性的疾病,很多MMD患者左右两侧大脑半球病变程度不同,我们在研究过程中参照已发表文献,以大脑半球作为研究单位进行mSS评分[13]。文献报道[14-15],单侧MMD患者经过13~157月不等时间的随访,有17.8%~58.8%的患者进展为双侧MMD。因此,把单侧MMD患者没病变或病变轻微侧大脑半球记为mSS评分=0分加入研究。DSA结果采用改良Suzuki评分(mSS)[13](表 1)进行病情严重程度分级。
| 表 1 改良Suzuki分级表 Table 1 Modified Suzuki scoring |
(1)后交通动脉与同侧颈内动脉内径比值采集方法:在MMD病人中颈内动脉末端通常是狭窄的,我们把颈内动脉内径的测量定位在颈内动脉海绵窦段相对最宽处。后交通动脉内径的测量在其开口附近,如果后交通动脉出现腹壶,内径的测量定位在腹壶的远端。测量均在DSA机器(西门子AXIOM Artis dTA平板血管造影机)上,用机器自带测量工具进行测量;(2)记录脉络膜前动脉的异常改变(0表示没显影;1表示显影但无扩张;2表示扩张并参与代偿供血);(3)侧支循环血管系统的分组参考Baltsavias等[16]提出的方法,分为浅部脑膜组和深部脑实质组两组,浅部脑膜组再分为硬脑膜血管吻合系统和软脑膜血管吻合系统;深部脑实质组分为室管膜下血管吻合系统和丘脑、纹状体内血管吻合系统。具体如下:
软脑膜血管系统包括:大脑后动脉-大脑中动脉、大脑后动脉-大脑前动脉、大脑前动脉-大脑中动脉之间在软脑膜上的吻合;发自颈内动脉末端或脉络膜前动脉起始部的沟动脉与大脑中动脉M1段和大脑前动脉A1段在软脑膜上的吻合;垂体上动脉与前交通动脉在软脑膜上的吻合;硬脑膜血管系统包括:筛前、后动脉,镰前动脉,脑膜垂体干的小脑膜缘支,脑膜后动脉,小脑前下动脉的硬膜支,脑膜中动脉,枕动脉等血管在硬脑膜上与皮层血管的吻合;室管膜下血管吻合系统:脉络膜后外侧动脉与胼周动脉吻合;前、后丘脑穿动脉与脉络膜前动脉和脉络膜后内侧动脉吻合;纹状体动脉与髓动脉吻合;丘脑和纹状体内血管吻合系统:丘脑内部间血管吻合并向附近区域供血,纹状体动脉内部吻合并经纹状体外侧动脉向大脑中动脉M2段供血。
1.3 统计学方法采用SPSS 22.0软件进行统计学分析,检验水准均为α=0.05,用独立样本t检验分析两组患者年龄关系,用Mann-Whitney U检验分析两组之间疾病mSS分布情况。用两独立样本t检验分析两组后交通动脉与颈内动脉(Pcom/ICA)内径比值。单因素ANOVA检验分析mSS分组间后交通动脉与颈内动脉内径比值。用卡方检验和Fisher精确检验分析脉络膜前动脉扩张和大脑后动脉病变及侧支循环血管系统在各分组间分布的情况,P < 0.05为差异有统计学意义。
2 结果 2.1 基本资料统计本组MMD患者120例,男66例,女54例;临床表现为脑缺血症状者45例(37.5%),脑出血症状者75例(占62.5%),年龄为19~78岁。用独立样本t检验分析,两组患者之间年龄差异无统计学意义(P=0.109)。
2.2 两组患者病情严重程度的统计两组患者mSS评分如表 2,两组之间mSS评分的分布(χ2=5.812,v=5,P=0.325),可以认为两组间不同mSS评分病例数的分布差异无统计学意义。
| 表 2 MMD患者mSS评分分布情况(以大脑半球为单位) Table 2 mSS score distribution |
以大脑半球为单位统计,并排除不显影个案。两组比较:出血组比值(n=93,Mean=0.40)大于缺血组(n= 43,Mean=0.34,图 1A),t=2.119,v=108,P=0.036,两者差异有统计学意义,且出血组的比值的均值大于缺血组。Pcom/ICA按mSS评分分组:mSS=0(n=5,Mean= 0.230),mSS=1(n=19,Mean=0.286),mSS=2(n=15,Mean= 0.235),mSS=3(n=32 Mean=0.428),mSS=4(n=57,Mean= 0.431),mSS=5(n=8,Mean=0.508)。其分布如下(图 1B),用单因素ANOVA检验分析:f=8.924,P=0.00,各组间比值的差异有统计学意义,mSS评分=0分组视为没发生病变大脑半球,以mSS=0组作为对照,行Dunnett-t检验分析:mSS=1(P=0.786)和mSS=2(P= 1.000)组间差异无统计学意义;mSS=3(P=0.017),mSS=4(P=0.011),mSS=5(P=0.003),mSS评分在3、4、5分时比值明显大于mSS=0时,组间差异有统计学意义(P < 0.05)。
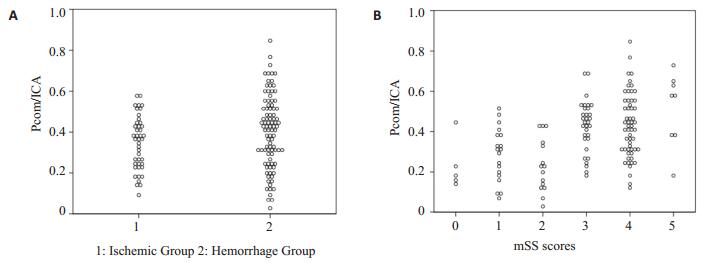
|
图 1 Pcom/ICA比值的分布图 Figure 1 Distribution of Pcom/ICA ratios. A: Distribution of Pcom/ICA ratio between hemorrhagic and ischemic groups; B: Distribution of Pcom/ICA ratios among groups with different mSS scores. |
去除不显影或没有参与代偿供血的大脑半球,进入统计的病变血管n=129根,缺血组病变血管n=45(34.9%),出血组病变血管n=84(65.1%)。用卡方检验进行比较,χ2:11.79,P=0.001,可以认为两组之间脉络膜前动脉扩张的发生率差异有统计学意义。不同的mSS评分组间脉络膜前动脉扩张分布情况:mSS=0(n=0),mSS=1(n=4,3.1%),mSS=2(n=11,8.5%),mSS=3(n= 39,30.2%),mSS=4(n=66,51.2%),mSS=5(n=9例,7%),去除mSS=0组,χ2=82.20,P=0.000,可以认为脉络膜前动脉扩张在各组间的分布不同,差异具有统计学意义(P < 0.05)。
2.5 侧支循环血管系统分布(图 2)
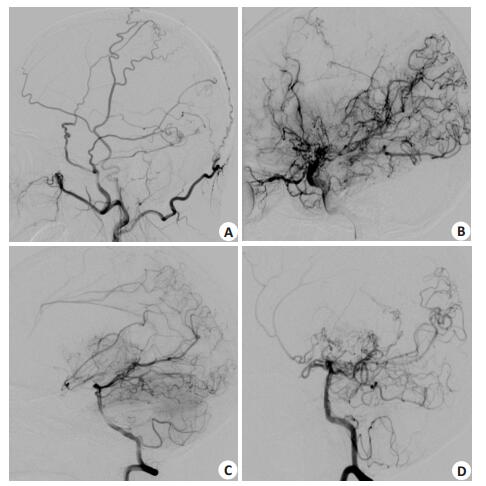
|
图 2 各种类型吻合造影图 Figure 2 Different networks in adult patients with moyamoya disease. A: Durocortical anastomotic network; B: Leptomeningeal system; C: Subependymal anastomotic network; D: Inner thalamic and striatal anastomotic networks. |
硬脑膜血管吻合组:χ2=0.327,P=0.567,可以认为两组之间硬脑膜血管吻合发生率差异无统计学意义(表 3)。软脑膜血管吻合组:Fisher精确检验,P=0.018,可以认为两组之间软脑膜血管吻合发生率差异有统计学意义,出血组出现率明显大于缺血组。室管膜下血管吻合组:χ2=0.011,P=0.917,可以认为两组之间室管膜下血管吻合发生率差异无统计学意义。纹状体内血管吻合组:χ2=7.551,P=0.006,可以认为两组之间纹状体内血管吻合发生率差异有统计学意义,出血组出现率高于缺血组。
| 表 3 侧支循环血管系统的统计量 Table 3 Collateral circulation vascular system statistics |
DSA是烟雾病诊断和评估的“金标准”,Suzuki[17]提出基于DSA的烟雾病分期方法(即Suzuki分级),主要基于颈内动脉末端周围血管狭窄程度、狭窄累及范围及颅底烟雾状血管增生的程度将烟雾病分为0~6级。Suzuki分级描述了烟雾病血管病变进程,为烟雾病血管评估提供重要的参考标准,然而其部分分级间存在交叉, 导致区分较为困难。在Suzuki分级的基础上,Donahue等[13]提出了改良的Suzuki分级。改良的Suzuki分级系统更易实施,且能够在一定程度上预测患者的临床预后[18]。我们采用改良的Suzuki分级评价两组病人,以大脑半球为单位,共240个大脑半球。两组之间mSS评分的分布差异无统计学意义(χ2=5.812,v= 5,P=0.325)。因此,我们发现mSS评分系统是评价MMD患者疾病严重程度,所处疾病阶段,它反映了疾病发展过程,该分级系统更易实施。
3.2 PCOM/ICA和脉络膜前动脉扩张与MMD病人脑出血卒中的关系MMD是一种进展性疾病,脑梗塞和脑出血是MMD患者严重的卒中表现,也是多数患者就医的原因。研究认为缺血型和出血型的MMD患者间存在不同的脑血管血流动力学特点[4]。大脑前动脉的闭塞、颅内动脉瘤的形成、胚胎型的后交通动脉更多见于脑出血卒中病例。大脑中动脉闭塞合并筛动脉和颈外动脉与硬膜血管的吻合也多见于脑出血卒中的病例。研究表明[19, 29]:脉络膜前动脉的扩张、后交通动脉的扩张是脑出血的重要预测因子,特别是在脑室内出血的研究队列中。研究者还提出脉络膜前动脉扩张的MMD患者脑出血后再次出血的风险较高[20]。然而,研究结果表明北美地区的患者中,脉络膜前动脉变化改变很敏感,但它并不是脑出血的特异性指标,这跟上面的研究结果不同[18]。本研究中,Pcom/ICA两组比较,出血组比值(n=93,Mean=0.40)大于缺血组(n=43,Mean=0.34),P=0.036,出血组的比值的均值大于缺血组。可以认为Pcom/ICA比值较高的MMD病人更容易发生脑出血。两组之间脉络膜前动脉比较,缺血组病变血管n=45(34.9%),出血组病变血管n=84(65.1%),χ2=11.79,P=0.001,可以认为出血组脉络前动脉扩张的发生率高于缺血组。可以认为脉络膜前动脉扩张的MMD病人更容易出血。本研究表明:Pcom/ICA比值和脉络前动脉扩张可能是MMD患者脑出血的重要预测因子,这与亚洲地区学者发表的研究结果相同。进一步分析,发现在mSS评分0-2时,也就是疾病早期Pcom/ICA比值变化不明显,在mSS=3-5分时该指标才显示出较大的差异。可能是因为随着MMD病人颈内动脉狭窄发展,脉络膜前动脉和后交通动脉可能通过增加血流和增大血流压力来代偿这种改变,出现血管的扩张和吻合支开放。在本研究中,PcomA/ICA与疾病严重程度的关系反映了这种进展性颈内动脉血管病变引发的血流动力学代偿机制。这也是为什么在分期早期,PcomA/ICA变化不明显的原因。而在mSS=2(n=11,8.5%)患者脉络膜前动脉的扩张已经可以观察到,所以推测在预测脑出血方面脉络膜前动脉扩张比后交通动脉扩张更敏感。
3.3 MMD病人侧枝循环的系统分类研究发现P1段损伤后,大脑中动脉供血区域出现梗塞的机率大于大脑后动脉供血区域[21]。这表明大脑后动脉发出的侧支血管在MMD患者前循环血流动力学中可能起重要作用。也有研究[22]发现P1段狭窄的MMD病人在血管重建手术后出现侧支吻合血管减少的情况,因为血管重建手术后盗血现象的减少,导致血管吻合也随着减少。这个现象证明了MMD是一个动态的病理过程。但在WASID试验中,学者发现严重狭窄伴有良好侧支循环的病例非常少出现脑卒中,也表明侧支血管吻合对脑卒中具有很好保护作用[23]。可见侧支血管吻合系统在MMD患者脑血管血流动力学中起着非常重要的作用。Matsushima等[24]就把MMD患者侧支血管吻合分成6类:颅底血管吻合;Willis环的血管吻合;皮层和软脑膜的血管吻合;硬脑膜的血管吻合;来自头皮或骨膜的血管吻合;穿硬膜血管吻合。Matsushima的分法存在一些重叠的分组。Takahashi等[25]提出另一种分法:基底节区烟雾血管;脉络膜前动脉和后交通动脉的代偿穿支血管;筛前后动脉的代偿穿支血管;来自硬膜血管的吻合血管。最近有学者[26]根据侧支吻合血管的起源,把MMD病人侧枝循环的系统分为颈内动脉-椎动脉来源和颈外动脉来源两类。对MMD患者脑血管侧支循环系统的分类,还有很多方法,目前没有统一的标准。通过参考Baltsavias等[16]通过分析小孩MMD病人脑血管造影的结果,提出基于解剖和吻合支代偿特点提出的分类方法。我们首次把这种基于解剖学的分类方法,用于分析成人MMD病人脑血管的侧支血管系统。发现在脑缺血组与脑出血组之间:硬脑膜吻合与室管膜血管吻合的出现率没有明显差异;而软脑膜血管吻合组和纹状体内血管吻合出现率,脑出血组明显高于脑缺血。
3.4 侧枝循环的系统分类与脑卒中关系研究表明[2-3]:脑出血是导致MMD患者预后差的重要原因,扩张和脆性增强的烟雾血管及动脉瘤的破裂是MMD患者发生脑出血的两个主要原因。持续紊乱的血流动力学作用于分布在基底节、丘脑和脑室旁的烟雾血管, 易导致这些烟雾血管破裂。软脑膜血管吻合很多发自颈内动脉末端或脉络膜前动脉起始部的沟动脉与大脑中动脉M1段和大脑前动脉A1段在软脑膜上的吻合。这些血管解剖上靠近MMD狭窄部位,在病程中发生较早,代偿血流压力大。随着疾病的进展,这些血管扩张,出血。最近有学者提出由前循环向后循环代偿供血的侧枝循环是MMD患者容易出血的地方[27]。有研究[5]表明:在MMD病人中,来自脉络膜前动脉和丘脑内部动脉的代偿血管可能比豆纹动脉代偿血管承受更大的压力,容易破例出血。通过FSSB-MRA观察,描绘了MMD病人异常扩张的豆纹、丘脑穿支和脉络膜前动脉,均吻合到髓质或岛叶血管向脑室周围白质区及皮层动脉供应[22]。本研究观察到丘脑和纹状体内血管吻合大部分出现在mSS评分在3~5级(96.3%)的病人,且出血组(75.9%)是缺血组(24.1%)的3.15倍,常常合并有大脑后动脉的病变(46.3%)。所以可推测随着MMD病程进展,脑缺血进一步加重,基底节区的血流重新平衡,出现基底节区血管间的吻合开放。这种吻合不仅供应基底节区血流,有的还逆流与大脑中动脉分支吻合,供应大脑中动脉或大脑前动脉的供血区。因此,发自沟动脉的软脑膜血管吻合和纹状体内的血管吻合也是患者脑出血的独立预测因子。
对于MMD病人脑血管造影的评估,目前没有统一的标准。研究发现应用改良suzuki分期结合基于解剖的侧枝循环的系统分类评估MMD病人脑血管造影,能够反映病人的病情严重程度,在一定程度上能预测未来卒中事件。在本研究中只把急性卒中病例作为研究队列,没有儿童患者,也没有无症状或TIA病例纳入研究,同时病例都是中国南方汉族病人,病例范围较窄,一定程度上局限了结果的意义。把研究焦点集中在脑卒中病例里,对探索MMD患者的脑血流模式与出血关系可能会更敏感。
我们期待有更多关于MMD患者脑血流动力血特点的研究,包括脑血流模式,血流灌注等等,从而建立完善的血流评估模型。目前,是什么编码了MMD患者的血管模型,包括血管闭塞和侧支血管系统建立,目前尚未清楚。有学者研究提出:是否在MMD患者身上也存在影响血管重构与增生的基因呢[28]?这些问题有待进一步研究。
| [1] |
Research Committee on the Pathology and Treatment of Spontaneous Occlusion of the Circle of Willis. Health labour sciences research grant for research on measures for infractable diseases. Guidelines for diagnosis and treatment of moyamoya disease (spontaneous occlusion of the circle of Willis)[J].
Neurol Med Chir (Tokyo), 2012, 52(5): 245-66.
DOI: 10.2176/nmc.52.245. |
| [2] |
Han DH, Kwon OK, Byun BJ, et al. A co-operative study: clinical characteristics of 334 Korean patients with moyamoya disease treated at neurosurgical institutes (1976-1994). The Korean Society for Cerebrovascular Disease[J]. Acta Neurochir (Wien), 2000, 142 (11): 1263-73; discussion 1273-4.
https://www.ncbi.nlm.nih.gov/pubmed/11201642
|
| [3] |
Yasaka M, Yamaguchi T, Ogata J. 40-moyamoya disease[J].
Stroke, 2016, 25(3): 658-73.
|
| [4] |
Jang DK, Lee KS, Rha HK, et al. Clinical and angiographic features and stroke types in adult moyamoya disease[J].
AJNR Am J Neuroradiol, 2014, 35(6): 1124-31.
DOI: 10.3174/ajnr.A3819. |
| [5] |
Funaki T, Fushimi Y, Takahashi JC, et al. Visualization of periventricular collaterals in moyamoya disease with flow-sensitive black-blood magnetic resonance angiography: preliminary experience[J].
Neurol Med Chir (Tokyo), 2015, 55(3): 204-9.
DOI: 10.2176/nmc.oa.2014-0360. |
| [6] |
Morioka M, Hamada J, Kawano T, et al. Angiographic dilatation and branch extension of the anterior choroidal and posterior communicating arteries are predictors of hemorrhage in adult moyamoya patients[J].
Stroke, 2003, 34(1): 90-5.
DOI: 10.1161/01.STR.0000047120.67507.0D. |
| [7] |
Liu W, Zhu S, Wang X, et al. Evaluation of angiographic changes of the anterior choroidal and posterior communicating arteries for predicting cerebrovascular lesions in adult moyamoya disease[J].
J Clin Neurosci, 2011, 18(3): 374-8.
DOI: 10.1016/j.jocn.2010.05.032. |
| [8] |
Funaki T, Takahashi JC, Houkin K, et al. Angiographic features of hemorrhagic moyamoya disease with high recurrence risk: a supplementary analysis of the Japan Adult Moyamoya Trial[J].
J Neurosurg, 2018, 128(3): 777-84.
DOI: 10.3171/2016.11.JNS161650. |
| [9] |
黄梁江, 何永培, 毛志娟, 等. 110例出血型烟雾病的血肿特点及RNF213基因突变的烟雾病一家系报道[J].
华中科技大学学报:医学版, 2018, 25(1): 100-4.
|
| [10] |
张桥. 烟雾病患者临床与脑血管造影特点分析[J].
临床合理用药杂志, 2017, 10(26): 163-4.
|
| [11] |
刘文华, 倪冠中, 黄显军, 等. 成年型烟雾病侧支循环的分布模式[J].
中华神经科杂志, 2012, 45(3): 149-53.
|
| [12] |
谢安明, 丁耀军, 李功杰. 成人烟雾病侧支循环的CT血管成像特点[J].
中国医学装备, 2016, 13(04): 64-7.
DOI: 10.3969/J.ISSN.1672-8270.2016.04.020. |
| [13] |
Donahue MJ, Ayad M, Moore R, et al. Relationships between hypercarbic reactivity, cerebral blood flow, and arterial circulation times in patients with moyamoya disease[J].
J Magn Reson Imaging, 2013, 38(5): 1129-39.
DOI: 10.1002/jmri.24070. |
| [14] |
Park EK, Lee YH, Shim KW, et al. Natural history and progression factors of unilateral moyamoya disease in pediatric patients[J].
Childs Nerv Syst, 2011, 27(8): 1281-7.
DOI: 10.1007/s00381-011-1469-y. |
| [15] |
Yeon JY, Shin HJ, Kong DS, et al. The prediction of contralateral progression in children and adolescents with unilateral moyamoya disease[J].
Stroke, 2011, 42(10): 2973-6.
DOI: 10.1161/STROKEAHA.111.622522. |
| [16] |
Baltsavias G, Khan N, Valavanis A. The collateral circulation in pediatric moyamoya disease[J].
Childs Nerv Syst, 2015, 31(3): 389-98.
DOI: 10.1007/s00381-014-2582-5. |
| [17] |
Suzuki J, Cerebrovascular"moyamoya" disease TA. Disease showing abnormal net-like vessels in base of brain[J].
Arch Neurol, 1969, 20(3): 288-99.
DOI: 10.1001/archneur.1969.00480090076012. |
| [18] |
Strother MK, Anderson MD, Singer RJ, et al. Cerebrovascular collaterals correlate with disease severity in adult North American patients with Moyamoya disease[J].
AJNR Am J Neuroradiol, 2014, 35(7): 1318-24.
DOI: 10.3174/ajnr.A3883. |
| [19] |
Nah HW, Kwon SU, Kang DW, et al. Moyamoya disease-related versus primary intracerebral hemorrhage:[corrected]location and outcomes are different[J].
Stroke, 2012, 43(7): 1947-50.
DOI: 10.1161/STROKEAHA.112.654004. |
| [20] |
Funaki T, Takahashi JC, Houkin K, et al. High rebleeding risk associated with choroidal collateral vessels in hemorrhagic moyamoya disease: analysis of a nonsurgical cohort in the Japan Adult Moyamoya Trial[J].
J Neurosurg, 2018, 35(7): 1-8.
|
| [21] |
Hishikawa T, Tokunaga K, Sugiu K, et al. Clinical and radiographic features of moyamoya disease in patients with both cerebral ischaemia and haemorrhage[J].
Br J Neurosurg, 2013, 27(2): 198-201.
DOI: 10.3109/02688697.2012.717983. |
| [22] |
Vajkoczy P. Moyamoya disease: collateralization is everything[J].
Cerebrovasc Dis, 2009, 28(5): 258.
|
| [23] |
Liebeskind DS, Cotsonis GA, Saver JL, et al. Collateral circulation in symptomatic intracranial atherosclerosis[J].
J Cereb Blood Flow Metab, 2011, 31(5): 1293-301.
DOI: 10.1038/jcbfm.2010.224. |
| [24] |
Matsushima Y, Inaba Y. The specificity of the collaterals to the brain through the study and surgical treatment of moyamoya disease[J].
Stroke, 1986, 17(1): 117-22.
DOI: 10.1161/01.STR.17.1.117. |
| [25] |
Takahashi JC, Funaki T, Houkin K, et al. Significance of the hemorrhagic site for recurrent bleeding: prespecified analysis in the Japan adult moyamoya trial[J].
Stroke, 2016, 47(1): 37-43.
DOI: 10.1161/STROKEAHA.115.010819. |
| [26] |
Zhao M, Zhang D, Wang S, et al. The collateral circulation in moyamoya disease: a Single-Center experience in 140 pediatric patients[J].
Pediatr Neurol, 2017, 77(8): 78-83.
|
| [27] |
Yamamoto S, Hori S, Kashiwazaki D, et al. Longitudinal anteriorto-posterior shift of collateral channels in patients with moyamoya disease:an implication for its hemorrhagic onset[J].
J Neurosurg, 2018, 45(8): 1-7.
|
| [28] |
Wang S, Zhang H, Dai X, et al. Genetic architecture underlying variation in extent and remodeling of the collateral circulation[J].
Circ Res, 2010, 107(4): 558-68.
DOI: 10.1161/CIRCRESAHA.110.224634. |
 2018, Vol. 38
2018, Vol. 38

