2. 广州医科大学附属第三医院药学部,广东 广州 510150
2. Department of Pharmacy, Third Affiliated Hospital of Guangzhou Medical University, Guangzhou 510150, China
肝癌发展迅速,已成为临床上常见的恶性肿瘤之一[1]。甘草酸作为临床上常用的保肝药物[2],其与代谢产物甘草次酸(GA)均有多种药理学活性。文献报道,甘草类化合物,尤其是甘草次酸,能抑制多种癌细胞体外生长,同时有抗氧化和抗病毒等作用,具有良好的应用前景[3-7]。拓扑异构酶Ⅱα(TOPO 2A)作为拓扑异构酶Ⅱ的一个重要同工酶,其表达情况与细胞增殖状态为正相关。在肿瘤细胞中,细胞增殖越快,拓扑异构酶Ⅱα的表达量越高,该蛋白已经成为临床上对原发性肝癌诊断与治疗的一个重要靶点[8-10]。拓扑异构酶Ⅱα在细胞中的表达受多种细胞因子的调节,细胞外调节蛋白激酶(ERK)作为丝裂原活化蛋白激酶(MAPK)家族的一员,涉及调控多种细胞生理过程包括细胞生长,发育与分裂等。Chen等[11]发现ERK通路参与调节TOPO 2A基因启动子的活性。许多抗肿瘤药物具有抑制拓扑异构酶Ⅱ活性的作用,但这些药物会引起诸如骨髓抑制等毒性反应[12]。基于甘草次酸具有保肝护肝的临床应用,本研究首先初步评价其对不同增殖速率的肝癌细胞抑制作用的差异性,其次基于甘草次酸的抗肿瘤活性,进一步探讨甘草次酸是否通过抑制ERK通路的激活以及拓扑异构酶Ⅱα的表达发挥抗肿瘤作用。
1 材料和方法 1.1 试剂与药物甘草次酸(大连美仑公司,纯度>98%,批号:20121210,CAS号1449-05-4);噻唑蓝粉末(MTT, methylthiazolyldiphenyl-terazolium bromide, Biosharp公司);DMSO(细胞用无菌级,Sigma),DMEM培养基(美国Gibco);胎牛血清(FBS,美国Gibco);蛋白电泳仪(Bio-red);GAPDH一抗,拓扑异构酶Ⅱα一抗;总ERK蛋白一抗与磷酸化ERK蛋白一抗(美国Cell Signaling Technology);辣根氧化氢酶标记的山羊抗兔二抗(美国Cell Signaling Technology);0.5% TBS-TWEEN缓冲液(TBST,武汉博士德生物公司);凯基全蛋白提取试剂盒(江苏凯基技术股份有限公司);SDS-PAGE凝胶试剂盒(碧云天公司生物技术公司);BCA蛋白浓度测定试剂盒(碧云天生物技术公司);5×Dual Color Protein Loading Buffer(杭州弗德生物科技有限公司);蛋白上样marker(Thermo SCIENTIFIC);ECL发光液(Millipore)。
1.2 细胞株及培养人来源肝癌细胞株SK-HEP1,HEPG2,HEP3B和SMMC-7721由南方医科大学南方医院临研中心细胞库提供。以上细胞株均用含10% FBS的DMEM培养液,在37 ℃,5%二氧化碳(CO2)的培养箱中培养。待细胞生长密度达到80%~90%时进行消化以及传代,取对数生长期细胞进行实验。
1.3 MTT法测定肝癌细胞株SK-HEP1,HEPG2,HEP3B,SMMC-7721增殖速率按照1.3方法步骤,取对数生长期的肝癌细胞株,以密度为2000/孔种于48孔板中,培养1、2、3、4、5 d,隔天换液,每天取3个孔细胞,加入1.1中MTT溶液50 μL并按后续步骤进行处理,孵育后去除培养液,加入300 μL的DMSO溶解底部紫色结晶,轻微震荡待结晶充分溶解后,用酶联免疫检测仪于490 nm波长处测定其吸光度(A值),连续记录5 d的吸收度值并绘制相应曲线图。
1.4 MTT法测定甘草次酸对人肝癌细胞株SK-HEP1,HEPG2,HEP3B,SMMC-7721增殖48 h的抑制率取对数生长期细胞,各细胞系按2000/孔接种于96孔板中,放置在37 ℃培养箱中培养24 h至细胞完全贴壁,去除培养液,加入含甘草次酸浓度分别为5、10、20、30、40、60 μmol/L的培养基,每个浓度组设置4个复孔,阴性对照组加入不含药物的培养基。培养48 h后,每孔加入5 mg·mL-1的MTT溶液20 μL,于37 ℃孵育4 h,小心去除上清液,每孔加入150 μL DMSO溶解底部结晶,轻微震荡后,用酶联免疫检测仪测定波长490 nm处的吸光度(A值),并计算细胞抑制率,实验结果重复3次并取平均值,计算梯度浓度甘草次酸作用不同肝癌细胞株48 h后对各肝细胞株的IC50。
1.5 WB考察甘草次酸刺激肝癌细胞48 h后对细胞拓扑异构酶Ⅱα的影响取对数生长期细胞,按密度为3×104/孔接种于六孔板中,培养24 h至细胞完全贴壁,加入含甘草次酸浓度为25或50 μmol/L的培养基,阴性对照组加入不含药物培养基,37 ℃孵箱中培养48 h,收集细胞,用全蛋白提取试剂盒提取细胞全蛋白,BCA法在酶标仪562 nm处测定吸光度,计算蛋白浓度。蛋白上样浓度为20 μg,进行SDS-PAGE凝胶电泳,并湿转蛋白至PVDF膜上,封闭后用稀释的GAPDH一抗,拓扑异构酶Ⅱα一抗,总ERK一抗或者磷酸ERK一抗(1:1000)在4 ℃孵育过夜,TBST洗脱3次,孵育山羊抗兔辣根氧化酶二抗(1:10 000)室温下孵育1 h,在暗室中滴加混合后的ECL发光液,显影后进行定影处理,蛋白条带通过Image J软件进行定量。
1.6 数据表示与统计分析数据以均数±标准差表示。采用SPSS 22.0统计学软件进行统计学分析,组间比较采用方差检验,当P < 0.05时差异有统计学意义。
2 结果 2.1 MTT结果MTT结果显示,4种肝癌细胞均在铺板24 h后完全贴壁,进入对数生长期,在第5天结束对数生长状态。不同分型的肝癌细胞株增殖速率并不一致。对数生长期结束时,SMMC-7721细胞的吸光度最低,增殖速率最慢,与其他3株细胞A值相比差异有统计学意义(P < 0.05)。SK-HEP1细胞增殖速率较快,而HEPG2与HEP3B细胞增殖速率相近。
梯度浓度甘草次酸刺激对4株肝癌细胞株增殖抑制作用不同。药物刺激48 h后,甘草次酸对4株肝肿瘤细胞的IC50分别为28.04±0.71 μmol/L(SMMC-7721细胞),54.99±0.13 μmol/L(SK-HEP1细胞),51.72± 0.59 μmol/L(HEPG2细胞),49.91±0.19 μmol/L(HEP3B细胞)。SMMC-7721细胞株的IC50值低于其他3株细胞(P < 0.05),而SK-HEP1细胞的IC50值最大。
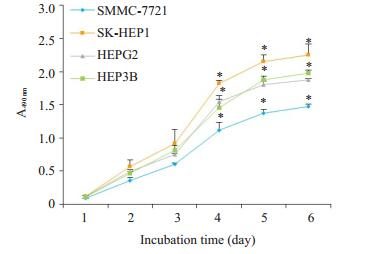
|
图 1 肝SMMC-7721,SK-HEP1,HEPG2和HEP3B细胞5 d的生长曲线 Figure 1 Growth curves of SMMC-7721, SK-HEP1, HEPG2 and HEP3B cell lines over 5 days. *P < 0.05 vs SMMC-7721 cells (n=3). |
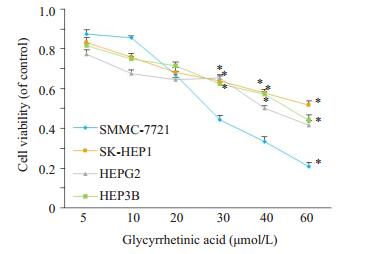
|
图 2 甘草次酸对肝癌细胞株SMMC-7721,SK-HEP1,HEPG2与HEP3B体外生长48 h细胞生存率的抑制作用 Figure 2 Viability of SMMC-7721, SK-HEP1, HEPG2 and HEP3B cells treated with glycyrrhetinic acid for 48 h. *P < 0.05 vs SMMC-7721 cells (n=3). |
图 3表示甘草次酸的刺激调节4株肝癌细胞拓扑异构酶Ⅱα(TOPO 2A)蛋白表达。上样蛋白量均为20 μg,内参GAPDH齐。图 3(E)表示对照组(空白组)4株细胞自身TOPO 2A表达的差异性。SMMC-7721细胞topoisomerase Ⅱα的表达量显著低于其他3株细胞(P < 0.05),SK-HEP1细胞的表达量最高,HEPG2与HEP3B的表达量相近但是低于SK-HEP1表达(P < 0.05)。在图 3A~D中,与阴性对照组相比,25 μmol/L和50 μmol/L甘草次酸刺激48 h,50 μmol/L浓度显著降低4株细胞TOPO 2A的表达(P < 0.05)。25 μmol/L浓度能下调SMMC-7721(图 3B),HEPG2(图 3C)和HEP3B(图 3D)细胞拓扑异构酶Ⅱα的表达(P < 0.05),但对SK-HEP1(图 3A)细胞蛋白的下调作用不明显。在本实验4株细胞中,甘草次酸的抑制作用是有选择性的,对于TOPO2A低表达肝癌细胞,选用浓度较低的甘草次酸即可达到显著性抑制作用。
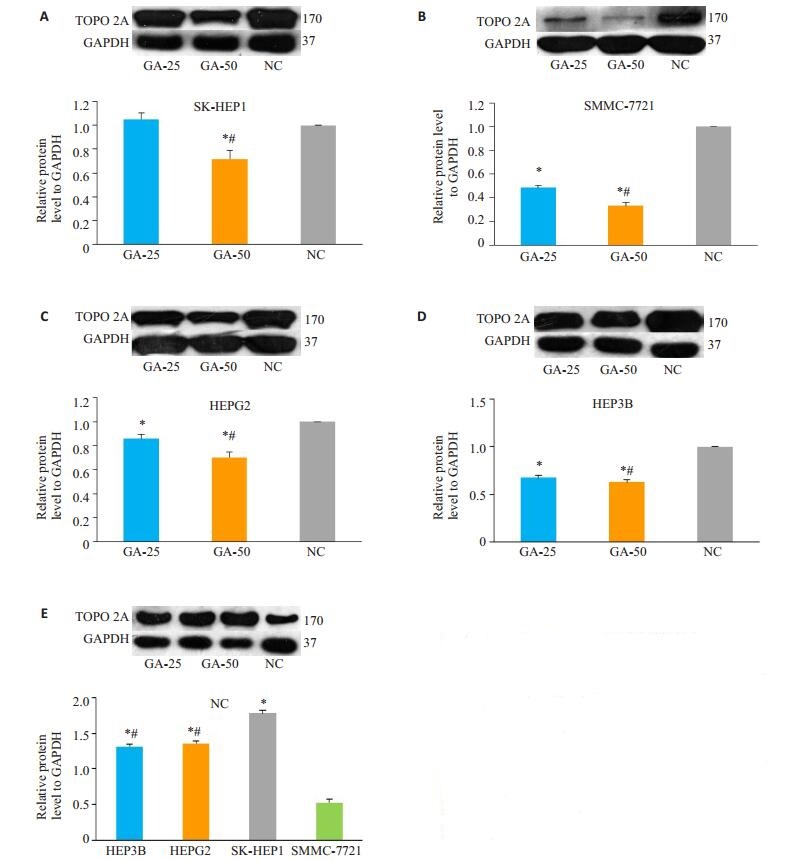
|
图 3 25 μmol/L与50 μmol/L的甘草次酸处理48 h后对肝癌细胞株拓扑异构酶Ⅱα表达的影响 Figure 3 Expression of topoisomerase Ⅱα in the 4 hepatocellar carcinoma cells after treatment with 25 or 50 μmol/L glycyrrhetinic acid for 48 h. A: SK-HEP1 cells; B: SMMC-7721 cells; C: HEPG2 cells; D: HEP3B cells; E: Control groups of SK-HEP1, SMMC-7721, HEPG2 and HEP3B cells. *P < 0.05 vs NC group in A, B, C and D; #P < 0.05 vs GA25 of glycyrrhetinic acid, *P < 0.05 vs SMMC-7721 cells in E; #P < 0.05 vs SK-HEP1 cell; n≥3. |
图 4表示甘草次酸对肝癌SMMC-7721,SK-HEP1,HEPG2和HEP3B细胞中MAPK/ERK通路表达的调节作用。以总ERK蛋白表达为内参,考察甘草次酸对ERK通路活化的影响。图 4E显示,在4株癌细胞的对照组中,SMMC-7721细胞p-ERK的表达量低于其他3株细胞。图 4A~D显示不同浓度甘草次酸对ERK蛋白的影响,25 μmol/L甘草次酸刺激48 h后,能抑制SMMC-7721(图 4B),HEG2(图 4C)和HEP3B(图 4D)细胞ERK蛋白的磷酸化而对SK-HEP1(图 4A)细胞作用无统计学意义;50 μmol/L的甘草次酸能显著下调4株实验细胞株相关蛋白表达。
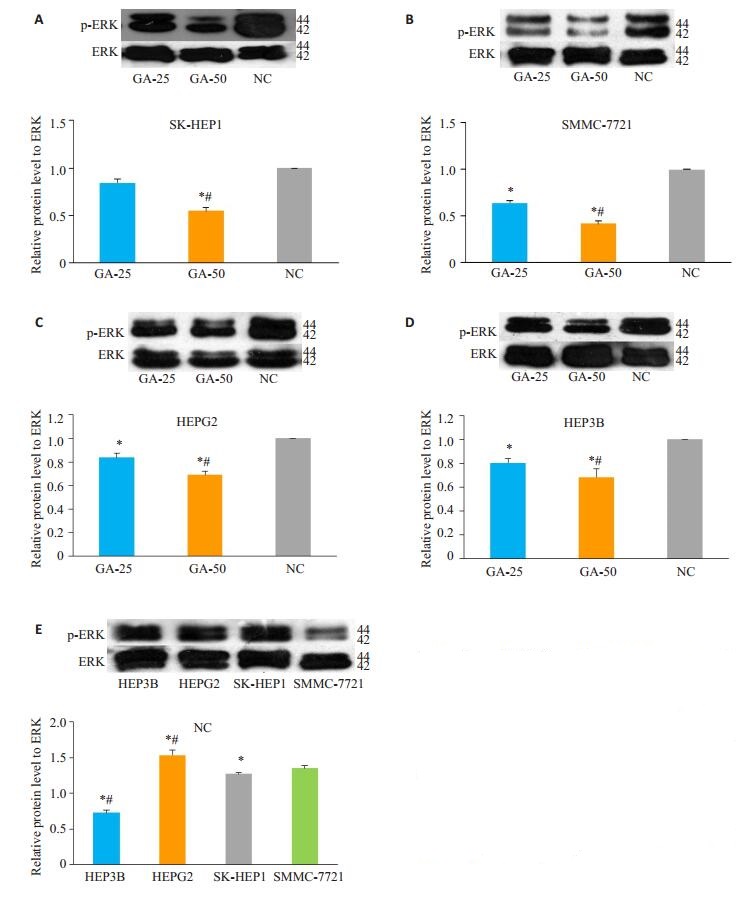
|
图 4 25 μmol/L与50 μmol/L的甘草次酸处理48 h后对肝癌细胞株总ERK蛋白与p-ERK蛋白表达的影响 Figure 4 Expressions of total ERK protein and p-ERK protein in the 4 hepatocellar carcinoma cells after treatment with 25 or 50 μmol/L of glycyrrhetinic acid for 48 h. A: SK-HEP1 cells; B: SMMC-7721 cells; C: HEPG2 cells; D: HEP3B cells; E: control groups of SK-HEP1, SMMC-7721, HEPG2 and HEP3B cells. *P < 0.05 vs negative control group in A, B, C and D; *P < 0.05 vs SMMC-7721 cells in E, n≥3. |
肝癌的发生发展与细胞内增殖失控和异常分化有关。拓扑异构酶Ⅱ作为细胞的必需核酶,作用于细胞内双链DNA并参与细胞分裂增殖,迁移和侵袭等活动[13],而拓扑异构酶Ⅱα(TOPO 2A)与拓扑异构酶Ⅱβ(TOPO 2B)为两种同工酶。其中TOPO 2A胞内表达与细胞增殖周期相关,在G2/M期中其表达量增加2~3倍[14]。细胞外调节蛋白激酶(ERK)是丝裂原活化蛋白激酶(MAPK)家族的一员,涉及调控多种细胞生理过程包括细胞生长,发育与分裂,抗凋亡等。已有文献证明ERK参与调节TOPO 2A的表达[11]。TOPO 2A在肿瘤细胞与正常细胞中表达的差异性,使其成为抗肿瘤作用的重要靶点之一[15]。临床上以该酶为靶点的抗肿瘤药物包括非嵌入型药物依托泊苷以及嵌入型药物阿霉素等,这些药物通过抑制TOPO 2A,诱导DNA双链断裂从而引起细胞增殖抑制[16]。检测肝癌细胞中TOPO 2A的表达可指导治疗用药,TOPO 2A高表达对相应抑制剂的敏感性高治疗效果好,但持续的药物治疗后,细胞内TOPO 2A的表达量下调,药物靶点减少,癌细胞出现获得性耐药[17]。目前临床上药物多为细胞周期特异性,对快增殖细胞作用效果明显,但会对快增殖正常细胞(如骨髓造血细胞)产生非特异性抑制,引起贫血等严重的不良反应[18];对TOPO 2A低表达分型的作用效果差,但其不良反应没有减轻;因此针对该靶点药物的开发仍在不断进行。
甘草酸临床上应用广泛,是抗炎保肝的一线治疗药物之一,已有临床指南[19]用以指导临床医生实际工作。文献报道,甘草酸及其水解产物甘草次酸有抑制肿瘤生长,改善患者肝功能,减少化疗引起的肝损伤以及不良反应等药理学作用,在发展成为化学预防药物或者与化疗药物联合使用等方面有广阔的应用前景[20-22]。本实验考察甘草酸临床的治疗用药除了已知的护肝作用外,对肝肿瘤细胞是否也存在作用。
甘草酸被人体摄入后,被代谢成为甘草次酸靶向肝脏组织。口服甘草酸后血液中只检测到甘草次酸的血药浓度峰;注射给药后甘草酸的血药浓度迅速降低同时甘草次酸的血药浓度逐渐升高。口服甘草类药物后体内血药浓度范围为0.4~10.0 μmol/L,注射后在健康人体内最大血药浓度为36.0 μmol/L而在肝炎病人可达120.0 μmol/L[23-24]。与甘草酸相比,甘草次酸在体内滞留时间更长,因此本实验直接考察代谢产物甘草次酸对不同分型肝癌细胞体外生长影响。
现有数据初步表明,本实验中选取的不同分型肝癌细胞的增殖速率并不一致。TOPO 2A与细胞增殖速率为正相关,4株细胞对照组TOPO 2A自身表达量有差异,增殖速率较慢的SMMC-7721表达量最低。实验中甘草次酸处理48 h对4株不同肝癌细胞的体外生长均有抑制作用,50 μmol/L浓度抑制作用强于25 μmol/L,其抗肿瘤作用与其他文献报道具有一致性[25-26]。其对4株细胞的作用具有选择性,p-ERK自身的含量以及甘草次酸对其作用与TOPO 2A趋势一致,抑制ERK蛋白通路可能是甘草次酸抗肿瘤以及下调TOPO 2A蛋白的机制之一。25 μmol/L甘草次酸刺激对SK-HEP1细胞基本没有影响;但可显著下调SMMC-7721细胞中TOPO2A的表达,抑制肿瘤细胞生长。因此在人血药浓度范围内,甘草次酸对SMMC-7721分型的肝肿瘤细胞作用较好。与临床上针对细胞周期特异性的经典化疗药相比,甘草次酸的作用对增殖较慢细胞效果更明显。因此,如果能在给药前对肿瘤进行分型鉴定,依据肿瘤细胞特性制定相应的给药方案,实现个体化给药,不但能增加疗效,而且可减少不良反应,提高病患生活质量。
Rossi等[27]研究表明,甘草酸与甘草次酸对增殖速率不同的细胞株作用有差异性,在一定程度上也揭示了甘草次酸的选择性作用,但该文献选用的是VERO肾细胞,MCF-7乳腺癌和HEG2肝癌三种不同组织的细胞株。本文首次考察了甘草次酸对4株肝癌细胞株的抑制作用以及对ERK通路和拓扑异构酶Ⅱα蛋白表达的影响,发现了甘草次酸对同为肝癌但分型不同,增值速率不同的细胞株的体外生长抑制作用具有选择性,抑制ERK通路的激活可能为其下调细胞拓扑异构酶Ⅱα的表达的作用机制之一。
本实验表明了在针对该具有生物特性的肝癌细胞株的治疗中,甘草次酸有发展成为高效低毒的药物的可能。鉴于甘草次酸本身具有抗炎抗病毒,结构与内源性激素相似等特性[28],而所选取的4株细胞均为APF阳性,SMMC-7721细胞可在免疫缺陷生物体内成瘤;HEPG2癌细胞表达多种内源活性物受体包括胰岛素受体等;HEP-3B为HBV阳性,增值速率最快的SK-HEP1细胞侵袭能力较强。对于诠释甘草次酸对肝癌细胞体外以及体内生长的复杂机制,甘草次酸作为慢生长分型的肝癌细胞治疗候选药物等的评价尚有待进一步深入的研究。
| [1] |
Wang FS, Fan JG, Zhang Z, et al. The global burden of liver disease: the major impact of China[J].
Hepatology, 2014, 60(6): 2099-108.
DOI: 10.1002/hep.v60.6. |
| [2] |
Gao L, Tang H, He H, et al. Glycyrrhizic acid alleviates bleomycininduced pulmonary fibrosis in rats[J].
Front Pharmacol, 2015, 215.
|
| [3] |
Hasan SK, Siddiqi A, Nafees S, et al. Chemopreventive effect of 18beta-glycyrrhetinic acid via modulation of inflammatory markers and induction of apoptosis in human hepatoma cell line (HepG2)[J].
Mol Cell Biochem, 2016, 416(1-2): 169-77.
DOI: 10.1007/s11010-016-2705-2. |
| [4] |
Ming LJ, Yin AC. Therapeutic effects of glycyrrhizic acid[J].
Nat Prod Commun, 2013, 8(3): 415-8.
|
| [5] |
Tang ZH, Li T, Chang LL, et al. Glycyrrhetinic acid triggers a protective autophagy by activation of extracellular regulated protein kinases in hepatocellular carcinoma cells[J].
J Agric Food Chem, 2014, 62(49): 11910-6.
DOI: 10.1021/jf503968k. |
| [6] |
Yan T, Wang H, Zhao M, et al. Glycyrrhizin protects against acetaminophen-induced acute liver injury via alleviating tumor necrosis factor alpha-mediated apoptosis[J].
Drug Metab Dispos, 2016, 44(5): 720-31.
DOI: 10.1124/dmd.116.069419. |
| [7] |
Zhu J, Chen M, Chen N, et al. Glycyrrhetinic acid induces G1phase cell cycle arrest in human nonsmall cell lung cancer cells through endoplasmic reticulum stress pathway[J].
Int J Oncol, 2015, 46(3): 981.
DOI: 10.3892/ijo.2015.2819. |
| [8] |
Gong M, Liu Y, Zhang J, et al. β-elemene inhibits cell proliferation by regulating the expression and activity of topoisomerases Ⅰ and Ⅱ alpha in human hepatocarcinoma HepG-2 cells[J].
Biomed Res Int, 2015, 153987.
|
| [9] |
Nateewattana J, Dutta S, Reabroi S, et al. Induction of apoptosis in cholangiocarcinoma by an andrographolide analogue is mediated through topoisomerase Ⅱ alpha inhibition[J].
Eur J Pharmacol, 2014, 723(15): 148.
|
| [10] |
Panvichian R, Tantiwetrueangdet A, Angkathunyakul N, et al. TOP2A amplification and overexpression in hepatocellular carcinoma tissues[J].
Biomed Res Int, 2015: 381602.
|
| [11] |
Chen G, Templeton D, Suttle DP, et al. Ras stimulates DNA topoisomerase Ⅱ alpha through MEK: a link between oncogenic signaling and a therapeutic target[J].
Oncogene, 1999, 18(50): 7149-60.
DOI: 10.1038/sj.onc.1203149. |
| [12] |
Hassan T, Badr M, Sakr H, et al. Chemotherapy-induced neutropenia among pediatric cancer patients in egypt: risks and consequences[J].
Mol Clin Oncol, 2015, 5(3): 300-6.
|
| [13] |
Bhosle J, Kiakos K Fau -Porter ACG, Porter Ac Fau -Wu J, et al. Treatment with gefitinib or lapatinib induces drug resistance through downregulation of topoisomerase Ⅱ alpha expression[J].
Mol Cancer Ther, 2013, 12(12): 2897.
DOI: 10.1158/1535-7163.MCT-12-1049. |
| [14] |
Harkin LF, Gerrelli D, Gold Diaz DC, et al. Distinct expression patterns for type Ⅱ topoisomerases ⅡA and ⅡB in the early foetal human telencephalon[J].
J Anat, 2016, 228(3): 452-63.
DOI: 10.1111/joa.2016.228.issue-3. |
| [15] |
Nitiss JL. Targeting DNA topoisomerase Ⅱ in cancer chemotherapy[J].
Nat Rev Cancer, 2009, 9(5): 388.
|
| [16] |
Wang J, Xu B Fau -Yuan P, Yuan P Fau -Zhang P, et al. TOP2A amplification in breast cancer is a predictive marker of anthracycline-based neoadjuvant chemotherapy efficacy[J].
Breast Cancer Ras Treat, 2012, 135(2): 338.
|
| [17] |
Pilati P, Nitti D, Mocellin S. Cancer resistance to type Ⅱ topoisomerase inhibitors[J].
Curr Med Chem, 2012, 19(23): 3900-6.
DOI: 10.2174/092986712802002473. |
| [18] |
Papiez MA. The effect of quercetin on oxidative DNA damage and myelosuppression induced by etoposide in bone marrow cells of rats[J].
Acta Biochim Pol, 2014, 61(7): 7-11.
|
| [19] |
曹武奎, 陈天艳, 陈永平, 等. 甘草酸制剂肝病临床应用专家共识[J].
中华实验和临床感染病杂志:电子版, 2016, 10(1): 1-9.
|
| [20] |
Gong G, Xiang L, Yuan L, et al. Protective effect of glycyrrhizin, a direct HMGB1 inhibitor, on focal cerebral ischemia/reperfusioninduced inflammation, oxidative stress, and apoptosis in rats[J].
PLoS One, 2014, 9(3): e89450.
DOI: 10.1371/journal.pone.0089450. |
| [21] |
Harada S. The broad anti-viral agent glycyrrhizin directly modulates the fluidity of plasma membrane and HIV-1 envelope[J].
Biochem J, 2005, 392(Pt 1): 191-9.
|
| [22] |
Wang YM, Du GQ. Glycyrrhizic acid prevents enteritis through reduction of NFkappaB p65 and p38MAPK expression in rat[J].
Mol Med Rep, 2016, 13(4): 3639.
DOI: 10.3892/mmr.2016.4981. |
| [23] |
Takeda S, Ishthara K, Wakui Y, et al. Bioavailability study of glycyrrhetic acid after oral administration of glycyrrhizin in rats; relevance to the intestinal bacterial hydrolysis[J].
J Pharm Pharmacol, 1996, 48(9): 902-5.
DOI: 10.1111/jphp.1996.48.issue-9. |
| [24] |
Kim DH, Hong SW, Kim BT, et al. Biotransformation of glycyrrhizin by human intestinal bacteria and its relation to biological activities[J].
Arch Pharm Res, 2000, 23(2): 172-7.
DOI: 10.1007/BF02975509. |
| [25] |
Cheng M, Gao X, Wang Y, et al. Synthesis of glycyrrhetinic acidmodified chitosan 5-fluorouracil nanoparticles and its inhibition of liver cancer characteristics in vitro and in vivo[J].
Mar Drugs, 2013, 11(9): 3517-36.
DOI: 10.3390/md11093517. |
| [26] |
Tang ZH, Zhang LL, Li T, et al. Glycyrrhetinic acid induces cytoprotective autophagy via the inositol-requiring enzyme 1alphac-Jun N-terminal kinase cascade in non-small cell lung cancer cells[J].
Oncotarget, 2015, 6(41): 43911-26.
|
| [27] |
Rossi T, Castelli M, Zandomeneghi G, et al. Selectivity of action of glycyrrhizin derivatives on the growth of MCF-7 and HEP-2 cells[J].
Anticancer Res, 2003, 23(5A): 3813-8.
|
| [28] |
Xu R, Xiao Q, Cao Y, et al. Comparison of the exposure of glycyrrhizin and its metabolites and the pseudoaldosteronism after intravenous administration of alpha-and beta-glycyrrhizin in rat[J].
Drug Res (Stuttg), 2013, 63(12): 620-4.
DOI: 10.1055/s-00023610. |
 2018, Vol. 38
2018, Vol. 38

