2. 广州医科大学第三附属医院病理科,广东 广州 510150
2. Department of Pathology, Third Affiliated Hospital of Guangzhou Medical University, Guangzhou 510150, China
子宫内膜癌是发生于子宫内膜的一组上皮性的恶性肿瘤[1],在过去20年里,子宫内膜癌的发病率和死亡率有所上升,这主要是因为它的病因还不完全清楚[2]。子宫内膜癌的发生不仅与雌、孕激素水平密切相关,也与原癌基因的异常激活,细胞异常增殖有关[3]。一些癌基因通过参与调节肿瘤细胞的代谢过程促进肿瘤细胞的增殖、侵袭和转移[4-5],其中,有氧糖酵解是肿瘤细胞获能的重要代谢改变之一[6-8]。PGK1是糖酵解过程中重要的ATP生成酶[9-10],在糖酵解第二个阶段的第二步催化1,3-二磷酸甘油酸转变成3-磷酸甘油酸(3-PG)[11-13]。研究表明PGK1在人类乳腺癌、胰腺导管腺癌、放射状星形细胞瘤、转移性胃癌和肝细胞癌中表达上调,并参与肿瘤的病理发展过程[14-18]。在脑肿瘤中,线粒体易位的PGK1降低了线粒体丙酮酸的利用率,增加了乳酸的产生,促进了脑肿瘤的发生[19-21]。PGK1在肝细胞癌组织中显著表达,与患者的存活率负相关[22]。但是尚没有研究揭示PGK1在子宫内膜癌中的作用。本次实验通过检测子宫内膜癌临床病理标本中PGK1的表达情况,探讨PGK1与子宫内膜癌临床病理参数之间的关系及对预后方面的意义。
1 材料和方法 1.1 材料收集广州医科大学附属第三医院2003~2008年手术切除的子宫内膜癌标本130例及正常子宫内膜组织标本30例,患者年龄32~82岁(平均49.6岁)。经有经验的病理科医师检查明确诊断后,分组进行检测。所有的患者临床资料包括年龄、FIGO分期、组织学分级、肌层浸润深度、淋巴结转移及病理类型等。其中子宫内膜样腺癌100例,腺鳞癌20例,棘腺癌5例,子宫乳头状浆液性腺癌4例,透明细胞癌1例。所有患者术前均未行放疗、化疗及激素治疗,随访时间为45~110月。本次实验经广州医科大学第三附属医院伦理委员会批准,并征得患者的知情同意。
1.2 主要试剂兔抗人PGK1多克隆抗体(工作浓度为:1:50稀释)购自proteintech公司。S-P及DAB试剂盒均购自北京中杉金桥公司。
1.3 方法所有标本均经4%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,烤干。采用链霉亲合素-生物素酶复合物(SP)法,所有免疫组化操作步骤严格按照试剂盒说明书进行,一抗均按1:50稀释。利用已知阳性片作为对照,以PBS液代替一抗作为空白对照。
1.4 染色结果判定双盲阅片法,由2名经验丰富的副高职称医师分别阅片。采用半定量法[23-24],随机选取10个高倍视野,每个高倍视野观察100个细胞,按每个高倍视野阳性细胞数的百分比计数:阳性细胞数 < 5%计为0分,5%~20%计1分,21%~50%计2分,51%~75%计3分,>75%计4分;胞质按色强弱计分:淡黄色计为1分,黄色计2分,棕黄色计3分。两种记分方法的乘积即为表达强度:0分设为阴性,1~4分为低表达,5分以上为高表达。
1.5 统计学方法应用SPSS 21.0软件进行统计分析。PGK1在子宫内膜癌中的表达及其与临床病理参数间的关系采用χ2检验;生存曲线用Kaplan-Meier法;多因素生存分析采用Cox比例风险回归模型。所有的检验均为双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 PGK1在子宫内膜癌组织中的表达情况PGK1的阳性表达主要为细胞质的不同程度着色,高表达时亦会出现细胞核染色。在正常子宫内膜组织PGK1低表达27例(27/30,90%),高表达3例(3/30,10%),在子宫内膜癌组织,PGK1低表达72例(72/130,55.4%),高表达(58/130,44.6%),相对于正常子宫内膜组织,PGK1在子宫内膜癌中表达上调,有统计学意义(P < 0.001,图 1)。
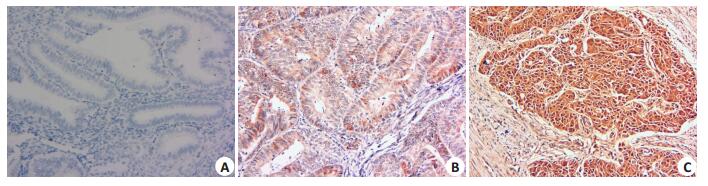
|
图 1 PGK1在正常子宫内膜及子宫内膜癌组织中的表达 Figure 1 PGK1 expression in normal endometrial tissue and endometrial carcinoma(Immunohistochemistry, original magnification: ×200). A: Normal endometrial tissue; B: Stage Ⅰ endometrial carcinoma tissue showing light yellow PGK1 staining in the cytoplasm; C: A stage Ⅱ-Ⅲ endometrial carcinoma tissue showing brown PGK1 staining in the cytoplasm and nucleus. |
通过χ2检验,我们发现PGK1在子宫内膜癌患者年龄、肌层浸润、绝经状态中的表达差异均不具有统计学意义。PGK1在子宫内膜癌的不同的病理类型(P=0.007),FIGO分期(P < 后的影响,分别将PGK1表达分为低表达组和高表达组,制出Kaplan-Meier生存曲线,结果显示PGK1低表达组平均生存时间为106.8月(随访期间),高表达组为80.7月(随访期间内),PGK1高表达患者的生存时间较低表达患者显著减少(P < 0.001,图 2)。
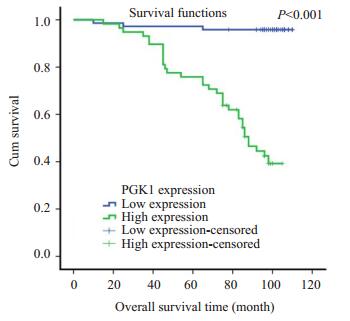
|
图 2 PGK1表达与患者生存时间的关系 Figure 2 Correlation of PGK1 expression with the patients' overall survival time. |
将患者的年龄、肿瘤家族史、月经史、FIGO分期、组织学分级、淋巴转移状态、肌层浸润状态等可能影响子宫内膜癌预后的因素进行单因素分析,发现职业(P=0.035),FIGO分期(P < 0.001),组织学分级(P=0.001),淋巴转移(P < 0.001),PGK1表达(P < 0.001)和子宫内膜癌患者预后相关。将这些临床参数进行Cox比例风险回归模型分析,我们发现FIGO分期(P=0.001)、组织学分级(P= 0.001)、淋巴转移(P=0.010)是影响子宫内膜癌患者预后的独立因素,而PGK1的表达不是影响子宫内膜癌患者预后的独立因素(P=0.077,表 2)。
| 表 1 PGK1与子宫内膜癌患者临床参数之间的关系 Table 1 Correlation between the clinicopathologic characteristics and PGK1 expression in endometrial carcinoma |
| 表 2 子宫内膜癌单因素变量和多因素变量的COX回归分析 Table 2 Summary of univariate and multivariate Cox regression analysis |
以在随访期间,患者发生复发或死亡为阳性事件,应用FIGO分期和PGK1表达情况对子宫内膜癌患者进行预后判断,根据Swets标准评估各个指标的判断价值,AUC < 0.5时,说明没有诊断价值,AUC在0.5-0.7时准确性较低,AUC在0.7-0.9时有较高的准确性,AUC在0.9以上时准确性最高。如图 3和表 3所示,应用FIGO分期对患者进行预后判断的敏感性为0.639,特异性为0.914,AUC值0.782,应用PGK1表达情况对患者进行预后判断的敏感性为0.917,特异性为0.742,AUC值0.829,联合FIGO分期和PGK1表达情况对患者预后进行判断的AUC值为0.886。
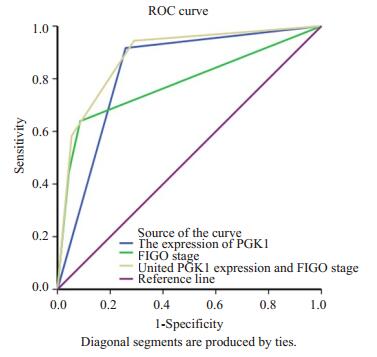
|
图 3 应用FIGO分期及PGK1表达情况对子宫内膜癌 Figure 3 ROC analysis of the predictive value of FIGO stage and PGK1 expression in patients with endometrial carcinoma. |
| 表 3 FIGO分期和PGK1表达情况的敏感性、特异性及AUC值 Table 3 Sensitivity, specificity and AUC of FIGO stage and PGK1 expression in predicting the prognosis of endometrial carcinoma |
肿瘤的发生与发展是一个在物理因素、化学因素和生物因素作用下的多步骤过程[25]。在癌变过程中,肿瘤细胞形成了一套有别于正常细胞的异常代谢模式,为其无限增殖、侵袭转移等恶性表型提供相应的生物合成所需的能量及原料[26-27]。这一特殊的细胞代谢模式涉及诸多细胞内代谢途径,其中以糖酵解增高、谷氨酰胺代谢活跃、三羧酸循环和氧化磷酸化的改变、脂肪酸氧化异常等最为显著,因此研究人员将涉及肿瘤细胞能量供给的现象定义为肿瘤细胞的能量代谢重编程[28-29]。1924年,德国著名的生物化学家Warburg博士首次发现即便是在氧气充足的情况下,肿瘤细胞中糖酵解速率是正常细胞的两百余倍,肿瘤细胞主要通过糖酵解途径获得肿瘤细胞增殖所需的大量ATP。糖酵解途径生成的丙酮酸不再进入三羧酸循环进行有氧氧化,而是在乳酸脱氢酶的催化下生成乳酸,这一现象被定义为肿瘤细胞的瓦伯格效应(Warburg effect)[30]。目前的研究已经发现了多种在癌变过程中表达失调的糖酵解相关酶及调节分子,磷酸甘油激酶1(PGK1)是其中之一。
目前,关于PGK1与子宫内膜癌之间的关系报道比较少,我们的研究发现,相对于正常子宫内膜组织,PGK1在子宫内膜癌组织中表达增高,差异具有统计学意义,这与基因雷达数据库中的报道是相符的。随着分子诊断学的发展,越来越多的肿瘤标志物成为诊断助手。生育年龄妇女诊断子宫内膜癌应慎重,从形态学上,G1级子宫内膜癌易与重度子宫内膜不典型增生相混淆,免疫组化检测肿瘤相关分子的表达情况能够为诊断提供参考。高表达的PGK1与子宫内膜癌患者的FIGO分期、组织学分级正相关,与患者的生存时间负相关,提示PGK1可能在子宫内膜癌的发生发展中发挥重要作用。已有的研究表明,有氧糖酵解是肿瘤细胞优先选择的代谢方式,活跃的糖酵解代谢有益于恶性肿瘤的增殖生存,增强癌细胞的侵袭能力[31]。肿瘤细胞受局部缺氧等微环境的影响,线粒体氧化磷酸化受到抑制,糖酵解可以补充产能,并且呈现较高的ATP/ADP比率,提高了肿瘤细胞的增殖生存能力,也是肿瘤细胞能够发生侵袭转移的基础[32-33]。Warburg效应使肿瘤微环境发生改变,重要的中间产物——乳酸明显增加,在实体瘤中乳酸的累积是恶性肿瘤发展中一个关键的早期事件,肿瘤乳酸代谢与癌侵袭性密切相关,乳酸可以促进细胞迁移和聚集,促进免疫逃逸,诱导肿瘤转移[34-36]。类似的,我们的数据显示,PGK1在淋巴结转移阳性的患者中相对高表达,提示PGK1可能在子宫内膜癌侵袭转移的过程中发挥关键作用。多因素分析显示PGK1不是子宫内膜癌患者预后的独立影响因素,可能由于它与患者的FIGO分期、组织学分级及淋巴结转移情况密切相关。在以随访过程中患者复发或死亡为阳性事件,应用FIGO分期及PGK1表达情况对子宫内膜癌患者进行预后判断的ROC分析中,FIGO分期有较高的特异性,敏感性相对较低,AUC值为0.782,应用PGK1表达情况进行判断的敏感性较高,特异性为0.742,AUC值0.829。目前FIGO分期仍是基于手术的分期,PGK1的表达情况可以从患者术前诊断性刮宫的病理标本中获得结果,可能对手术范围或治疗方案有争议的患者起到一定的指导意义。FIGO分期联合PGK1表达情况对子宫内膜癌患者预后判断的AUC值为0.886,相对于两个指标独立进行预后判断,准确性有所提高。对于FIGO分期Ⅱ期以上,同时PGK1高表达的病人,可以积极补充必要的辅助治疗,加强随访,及时发现复发迹象并积极干预。
当然,我们的研究还有许多不足之处,由于样本量的限制,仍需扩大标本量和坚持长期随访来进一步验证研究结果。本研究仅仅展现了表达相关性,进一步研究PGK1在子宫内膜癌中的作用机制,可能为子宫内膜癌的靶向药物治疗探寻新的线索。
| [1] |
Straughn JM Jr, Huh WK, Kelly FJ, et al. Conservative management of stage Ⅰ endometrial carcinoma after surgical staging[J].
Gynecol Oncol, 2002, 84(2): 194-200.
DOI: 10.1006/gyno.2001.6494. |
| [2] |
Ayakannu T, Taylor AH, Willets JM, et al. Validation of endogenous control reference genes for normalizing gene expression studies in endometrial carcinoma[J].
Mol Hum Reprod, 2015, 21(9): 723-35.
DOI: 10.1093/molehr/gav033. |
| [3] |
Ito K, Sasano H, Yabuki N, et al. Immunohistochemical study of Ki-67 and DNA topoisomerase Ⅱ in human endometrium[J].
Mod Pathol, 1997, 10(4): 289-94.
|
| [4] |
Bhanot H, Weisberg EL, Reddy MM, et al. Acute myeloid leukemia cells require 6-phosphogluconate dehydrogenase for cell growth and NADPH-dependent metabolic reprogramming[J].
Oncotarget, 2017, 8(40): 67639-50.
|
| [5] |
Shao X, Tang Y, Long H, et al. HMG-CoA synthase 2 drives brain metabolic reprogramming in cocaine exposure[J].
Neuropharmacology, 2017, pii: S0028-3908.
|
| [6] |
Sciacovelli M, Frezza C. Metabolic reprogramming and epithelialto-mesenchymal transition in cancer[J].
FEBS J, 2017, 284(19): 3132-44.
DOI: 10.1111/febs.2017.284.issue-19. |
| [7] |
Yang B, Zhang L, Cao Y, et al. Overexpression of lncRNA IGFBP4-1 reprograms energy metabolism to promote lung cancer progression[J].
Mol Cancer, 2017, 16(1): 154.
DOI: 10.1186/s12943-017-0722-8. |
| [8] |
Morales-Prieto N, Abril N. EDOX proteomics reveals energy metabolism alterations in the liver of M.spretus mice exposed to p, p'-DDE[J].
Chemosphere, 2017, 186: 848-63.
DOI: 10.1016/j.chemosphere.2017.08.057. |
| [9] |
Bernstein BE, Hol WG. Crystal structures of substrates and products bound to the phosphoglycerate kinase active site reveal the catalytic mechanism[J].
Biochemistry, 1998, 37(13): 4429-36.
DOI: 10.1021/bi9724117. |
| [10] |
Li X, Zheng Y, Lu Z. PGK1 is a new member of the protein kinome[J].
Cell Cycle, 2016, 15(14): 1803-4.
DOI: 10.1080/15384101.2016.1179037. |
| [11] |
Fujii H, Krietsch WK, Yoshida A. A single amino acid substitution (asp leads to Asn)in a phosphoglycerate kinase variant(PGK munchen)associated with enzyme deficiency[J].
J Biol Chem, 1980, 255(13): 6421-3.
|
| [12] |
Watson HC, Walker NP, Shaw PJ, et al. Sequence and structure of yeast phosphoglycerate kinase[J].
EMBO J, 1982, 1(12): 1635-40.
|
| [13] |
Banks RD, Blake CC, Evans PR, et al. Sequence, structure and activity of phosphoglycerate kinase: a possible hinge-bending enzyme[J].
Nature, 1979, 279(5716): 773-7.
DOI: 10.1038/279773a0. |
| [14] |
Hwang TL, Liang Y, Chien KY, et al. Overexpression and elevated serum levels of phosphoglycerate kinase 1 in pancreatic ductal adenocarcinoma[J].
Proteomics, 2006, 6(7): 2259-72.
DOI: 10.1002/(ISSN)1615-9861. |
| [15] |
Yan H, Yang K, Xiao H, et al. Over-Expression of cofilin-1 and phosphoglycerate kinase 1 in astrocytomas involved in pathogenesis of radioresistance[J].
CNS Neurosci Ther, 2012, 18(9): 729-36.
DOI: 10.1111/cns.2012.18.issue-9. |
| [16] |
Zieker D, Koenigsrainer I, Tritschler IA, et al. Phosphoglycerate kinase 1 a promoting enzyme for peritoneal dissemination in gastric cancer[J].
Int J Cancer, 2010, 126(6): 1513-20.
|
| [17] |
Ahmad SS, Glatzle J, Bajaeifer K, et al. Phosphoglycerate kinase 1 as a promoter of metastasis in colon cancer[J].
Int J Oncol, 2013, 43(2): 586-90.
DOI: 10.3892/ijo.2013.1971. |
| [18] |
Zhang D, Tai LK, Wong LL, et al. Proteomic study reveals that proteins involved in metabolic and detoxification pathways are highly expressed in HER-2/neu-positive breast cancer[J].
Mol Cell Proteomics, 2005, 4(11): 1686-96.
DOI: 10.1074/mcp.M400221-MCP200. |
| [19] |
Li XJ, Jiang YH, Meisenhelder J, et al. Mitochondria-Translocated PGK1 functions as a protein kinase to coordinate glycolysis and the TCA cycle in tumorigenesis[J].
Mol Cell, 2016, 61(5): 705-19.
DOI: 10.1016/j.molcel.2016.02.009. |
| [20] |
Qian X, Li XJ, Cai QS, et al. Phosphoglycerate kinase 1 phosphorylates beclin1 to induce autophagy[J].
Mol Cell, 2017, 65(5): 917.
DOI: 10.1016/j.molcel.2017.01.027. |
| [21] |
Qian X. , Li X, Lu Z, Protein kinase activity of the glycolytic enzyme PGK1 regulates autophagy to promote tumorigenesis[J].
Autophagy, 2017, 13(7): 1246-7.
DOI: 10.1080/15548627.2017.1313945. |
| [22] |
Xie HJ, Tong GH, Zhang YP, et al. PGK1 drives hepatocellular carcinoma metastasis by enhancing metabolic process[J].
Int J Mol Sci, 2017, 18(8): E1630.
DOI: 10.3390/ijms18081630. |
| [23] |
Li X, Gao Y, Tan M, et al. Expression of HE4 in endometrial cancer and its clinical significance[J].
Biomed Res Int, 2015, 2015: 437468.
|
| [24] |
Liu Z, Yang H, Luo W, et al. Loss of cytoplasmic KLF4 expression is correlated with the progression and poor prognosis of nasopharyngeal carcinoma[J].
Histopathology, 2013, 63(3): 362-70.
DOI: 10.1111/his.2013.63.issue-3. |
| [25] |
Stella GM, Benvenuti S, Gentile A, et al. Met activation and physical dynamics of the metastatic process: the paradigm of cancers of unknown primary origin[J].
EBioMedicine, 2017, 24: 34-42.
DOI: 10.1016/j.ebiom.2017.09.025. |
| [26] |
Micalizzi DS, Maheswaran S, Haber DA. A conduit to metastasis: circulating tumor cell biology[J].
Genes Dev, 2017, 31(18): 1827-40.
DOI: 10.1101/gad.305805.117. |
| [27] |
Xie H, Simon MC. Oxygen availability and metabolic reprogramming in cancer[J].
J Biol Chem, 2017, 292(41): 16825-32.
|
| [28] |
Wu D, Zhuo L, Wang X. Metabolic reprogramming of carcinomaassociated fibroblasts and its impact on metabolic heterogeneity of tumors[J].
Semin Cell Dev Biol, 2017: 125-31.
|
| [29] |
Luengo A, Gui DY, Van Heiden MG. Targeting Metabolism for Cancer Therapy[J].
Cell Chem Biol, 2017, 24(9): 1161-80.
DOI: 10.1016/j.chembiol.2017.08.028. |
| [30] |
Warburg O. On the origin of cancer cells[J].
Science, 1956, 123(3191): 309-14.
DOI: 10.1126/science.123.3191.309. |
| [31] |
Kamarajugadda S, Stemboroski L, Cai QA, et al. Glucose oxidation modulates anoikis and tumor metastasis[J].
Mol Cell Biol, 2012, 32(10): 1893-907.
DOI: 10.1128/MCB.06248-11. |
| [32] |
Deberardinis RJ, Lum JJ, Hatzivassiliou G, et al. The biology of cancer: Metabolic reprogramming fuels cell growth and proliferation[J].
Cell Metab, 2008, 7(1): 11-20.
DOI: 10.1016/j.cmet.2007.10.002. |
| [33] |
Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation[J].
Science, 2009, 324(5930): 1029-33.
DOI: 10.1126/science.1160809. |
| [34] |
Beckert S, Farrahi F, Aslam RS, et al. Lactate stimulates endothelial cell migration[J].
Wound Repair Regen, 2006, 14(3): 321-4.
DOI: 10.1111/wrr.2006.14.issue-3. |
| [35] |
Hirschhaeuser F, Sattler UG, Mueller-Klieser W. Lactate: a metabolic key player in cancer[J].
Cancer Res, 2011, 71(22): 6921-5.
DOI: 10.1158/0008-5472.CAN-11-1457. |
| [36] |
Gottfried E, Kunz-Schughart LA, Ebner S, et al. Tumor-derived lactic acid modulates dendritic cell activation and antigen expression[J].
Blood, 2006, 107(5): 2013-21.
DOI: 10.1182/blood-2005-05-1795. |
 2018, Vol. 38
2018, Vol. 38

