2. 中南大学湘雅医学院附属海口医院,海南 海口 570208
2. Haikou Hospital Affiliated to Central South University Xiangya School of Medicine, Haikou 570208, China
阿尔茨海默病(AD)是一种发病隐匿进行性发展的中枢神经退行性疾病。近年来研究认为,AD患者脑内异常沉积的β-淀粉样蛋白(Aβ)是主要的致病因素之一[1-2]。Lennart等[3]认为这与可溶性Aβ寡聚体主要损伤神经突触,并不导致神经元的丢失。Laurén和Freir等[4-5]实验证实,Aβ寡聚体与神经元胞膜上的细胞型朊蛋白(PrPC)结合,加剧了神经元的损伤。他们利用鼠单克隆抗体6D11和ICSM35封闭PrPC蛋白与Aβ结合的位点,阻止Aβ对神经元LTP的抑制。AD动物实验干预有效的最有利证据是AD转基因动物行为学缺陷的改善。但是,当前关于干预Aβ寡聚体与神经元胞膜PrPC结合位点的研究,缺乏强有力的动物行为学数据支持,并且未明确对AD转基因小鼠海马内Aβ1-42表达的影响。
海马结构与学习记忆能力密切相关。Shankar[6]等发现患者脑内提取的毒性Aβ可以直接影响海马长时程增强(LTP),进而影响学习记忆。故而,本实验首次使用APPswe/PSEN1dE9转基因小鼠海马内注射PrPC蛋白抗体,直接封闭海马神经元膜上PrPC受体,验证海马内PrPC蛋白与AD转基因动物的行为学缺陷之间的联系以及对海马内Aβ1-42表达的影响。采用旷场试验、Morris水迷宫、条件性恐惧实验、新物体识别实验及免疫组化实验,多方面验证封闭海马神经元PrPC蛋白与Aβ寡聚体结合的位点后,对AD转基因动物行为学缺陷及海马内Aβ1-42表达的影响。期望阐明脑内PrPC蛋白与AD发病机制之间的关联,为进一步寻找有效的干预措施提供依据。
1 材料和方法 1.1 材料 1.1.1 实验动物8月龄雄APPswe/PSEN1dE9转基因小鼠24只,8月龄C57Bl/6J正常小鼠12只(购自广东省医学实验动物中心),置于24~25 ℃,40%~70%湿度的房间,给予12 h光照、12 h黑暗饲养,自由摄食和饮水。
1.1.2 仪器与试剂大鼠脑立体定位仪(瑞沃德生命科技)、微量注射泵(保定兰格恒流泵)、Morris水迷宫(上海移数信息科技)、PrPC抗体EP1802Y(abcam, ab52604)、Anti-betaAmyloid 1-42抗体[mOC64](abcam, ab201060)。
1.2 实验方法 1.2.1 动物分组及给药方法APPswe/PSEN1dE9转基因小鼠24只随机分为假手术组(n=12)和实验组(n=12,EP1802Y干预组),C57Bl/6J正常小鼠(n=12)作为正常组。假手术组和实验组采用10%水合氯醛腹腔麻醉,将小鼠固定在脑立体定位仪上,参照《小鼠脑立体定位图谱》,在颅骨相应位置钻孔(前囟后2.3 mm、中线左、右侧2.0 mm、深度2.0 mm),假手术组双侧海马内注射2 μL PBS,实验组双侧注射EP1802Y 2 μL(1:100 PBS稀释抗体),注射时间持续30 min/每侧,注射后留针5 min,以保证溶液充分弥散,缝合切口。术后2月后检测小鼠行为学改变。在进行行为学检测前,小鼠均提前1 d送入行为学实验室,适应环境,减少动物紧张情绪。
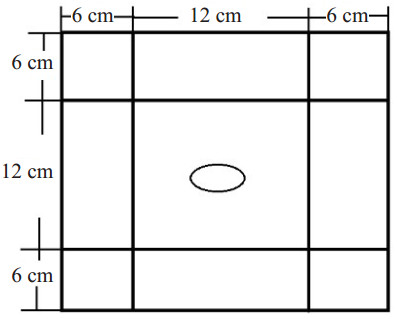
1.2.2 旷场实验旷场实验箱为25 cm×25 cm×38 cm的封闭箱子组成,箱底划出6 cm×6 cm面积的4个角,以及上、下、左、右12 cm×16 cm的4个边。箱子中央区12 cm×12 cm,箱顶中央安置摄像头,在箱内中央放置色彩鲜艳的玩具,记录小鼠在旷场中的行为,总时间30 min。实验获得数据后,利用Anymaze软件对数据进行分析,计算小鼠在中央区活动时间以及30 min内的总路程。小鼠在中央区活动时间反映对新环境的探索活动的能力,小鼠在中央区活动时间越长,焦虑水平就越低。活动总路程反映小鼠的自发活动能力。
|
图 1 旷场实验场地示意图 Figure 1 Illustration of the site for open field test. |
在旷场实验结束2 d后进行。使用黑色开放盒子(25 cm×25 cm×40 cm),将两个相同的积木对称放在盒子一端,将小鼠背向积木放入盒内,小鼠自由探索10 min。10 min后,将小鼠放回饲养鼠盒内。休息1 h后,开始测试环节。盒内一个旧积木被换成另一新积木,将小鼠背向积木放入盒内,测试2 min。记录小鼠与新旧积木碰触的次数。与新物体触碰次数记为TN,与旧物体触碰次数记为TF,并据此计算新物体识别指数,即TN/(TF+TN)。
1.2.4 Morris水迷宫行为实验装置:MWM测试中使用水迷宫为一圆形水桶,直径约1.35 m,高30 cm,水深15 cm,水温21±1 ℃,内壁为白色,水中倒入适量无毒白色颜料使水变为乳白色。在水池周边等距离地设定4个标记点作为小鼠入水点,并以这4个入水点在水池中投影将水池均等划分为四个象限。半径10 cm的白色平台置于一个象限的中央区域,平台低于水面1 cm。在水池上方2 m处安置摄像头,自动采集迷宫图像和Anymaze软件处理实验数据。房间四壁布置不同内饰。第1天将逃生平台暴露于水面之上,各只小鼠放入水迷宫中适应性游泳1 min,结束后将小鼠放在平台上停留1 min,让其熟悉周边环境。
1.2.4.1 隐匿平台实验分别从3个象限(除去平台所在象限)的入水点将小鼠面向池壁放入水中,迷宫图像采集小鼠找到并爬上隐蔽平台的时间,称为逃避潜伏期。小鼠在1 min内找到并爬上隐蔽平台后,让其在平台停留1 min。如果小鼠在1 min内没有找到平台,则引导小鼠爬上隐蔽平台,并在平台上停留1 min。3个入水点各训练1次为一组,重复三组,每组间休息15~20 min。以4次潜伏期的平均值作为这一天成绩进行统计分析。
1.2.4.2 空间搜索实验隐匿平台实验结束24 h后,进行空间搜索试验。撤走水下圆形平台,将小鼠面向池壁放入水池,记录小鼠在60 s内穿梭平台象限区域的次数,导出软件各组数据,进行统计分析。
1.2.5 条件性恐惧测试在新物体识别试验结束2 d后进行。第1天训练小鼠,预先设定电击小鼠的强度(0.4 mA),电击1次,每只小鼠总测试时间为180 s。将小鼠放入实验箱内,待时间显示60 s时,开启蜂鸣声(5 KHz),持续30 s,88 s时,实验箱底部通电(电击小鼠),持续的时间(2 s)。其后观察90 s。第2天,进行关联恐惧条件实验,将小鼠放入实验箱内10 min,但不电击小鼠。第3天,进行暗示条件恐惧实验,将小鼠放在实验箱内360 s,180 s后,开启声音,持续180 s。实验结束后分析小鼠凝滞不动的时间。
1.2.6 免疫组织化学检测取小鼠大脑冰冻切片,切片经0.01 mol/L PBS缓冲液冲洗后,5% BSA封闭1 h,Anti-beta Amyloid 1-42多克隆抗体(1:100稀释)4 ℃孵育过夜。第2天,0.01 mol/L PBS缓冲液冲洗后,加入Cy3荧光二抗,37 ℃孵育1 h,抗荧光淬灭封片剂封片,荧光显微镜下观察。
1.3 统计方法数据用Mean±SE表示,采用GraphPad Prism5.0软件进行数据分析,多组间比较采用方差分析,P<0.05表示差异有统计学意义。
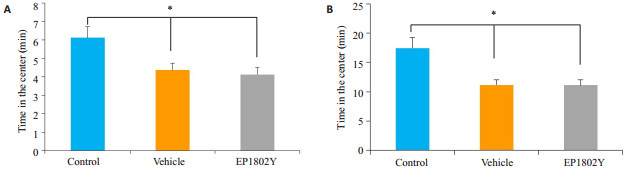
2 结果 2.1 旷场实验各组小鼠在中央区活动总时间中,假手术组与实验组相比,无明显差异(P>0.05)。假手术组和实验组与正常组相比较,具有显著性差异(图 2A,P<0.05)。试验各组小鼠活动总路程中,假手术组与实验组相比,无明显差异,但假手术组和实验组与正常组相比,具有显著性差异(图 2B,P<0.05)。旷场实验基于小鼠具有趋避性,畏惧空旷场地及探索新事物,新环境的特点,来评价实验动物的运动功能及焦虑状态。当探索活动及自发活动能力降低时,就说明小鼠对新环境存在明显的焦虑样行为。
|
图 2 旷场实验评价小鼠焦虑样行为活动情况 Figure 2 Anxiety-like behaviors of mice measured by open field test (n=12, Mean ± SE). A: Time spent in the center; B: Total distance traveled in 30 min. *P < 0.05 among the 3 groups. |
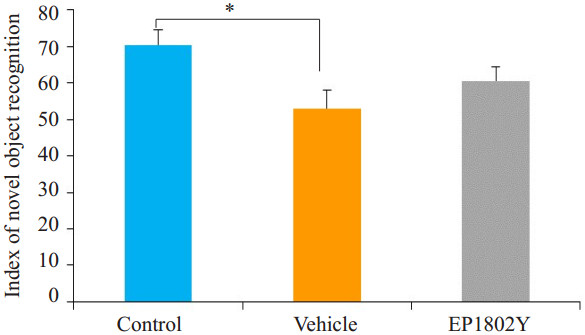
尽管实验组的分辨指数有所升高,但与假手术组小鼠相比较,分辨指数无显著性差异。假手术组的分辨指数与正常组相比,具有显著性差异(52.97%,P<0.05,图 3)。物体识别实验是通过啮齿类动物喜欢探索新的物体的本性,进而判断动物是否记住了先前识别的物体,如果动物能够记住旧物体,则动物对旧物体的探索少于新的物体。分辨指数越高表明动物的学习记忆能力越好,反之学习记忆能力差。
|
图 3 新物体识别实验评价小鼠学习记忆 Figure 3 Learning and memory capacity of the mice measured by novel object recognition test (Mean±SE). *P < 0.05. |
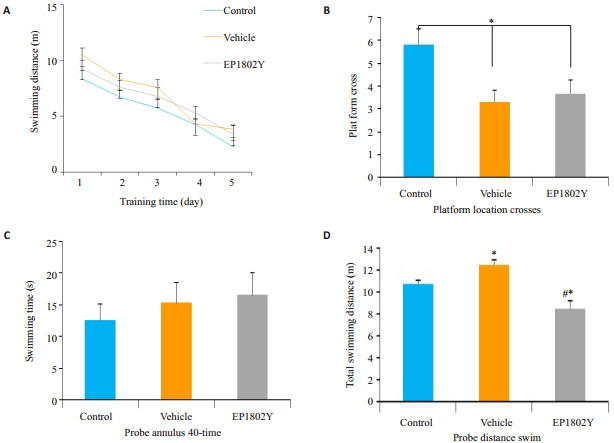
在5 d隐匿平台实验中,各组平均游泳距离均降低,而组间比较无显著性差异(P>0.05,图 4A)。在空间探索实验中,分析60 s内小鼠穿越平台区域次数,假手术组与实验组比较,无显著性差异。假手术组和实验组与正常组比较,穿越平台次数减少,具有显著性差异(P<0.05,图 4B)。同样,各组逃避潜伏期均无明显的差异(P>0.05,图 4C)。假手术组与实验组相比较,实验组游泳距离明显减少,具有显著差异(P<0.05,图 4D)。与正常组比较,假手术组和实验组游泳路程有差异,假手术组游泳路程增加,而实验组游泳路程减少。这说明8月龄APPswe/PSEN1dE9转基因小鼠已逐渐出现空间学习记忆能力障碍,EP1802Y抗体海马注射后,在一定程度上可以改善APPswe/PSEN1dE9转基因小鼠的空间学习记忆能力障碍,但并不能完全逆转学习记忆能力的受损。
|
图 4 Morris水迷宫实验评小鼠学习记忆 Figure 4 Learning and memory capacity of the mice measured by Morris water maze test. A: Mice learning the location of the hidden platform over a 5-day training period. There was no difference between the groups. B: Platform crosses during probe trials (platform removed from the pool) 24 h after the last training (Mean ± SE). *P < 0.05 among the 3 groups. C: Swimming time in Annulus-40 during probe trials 24 h after the last training; D: Total swimming distance during probe trials 24 h after the last training (Mean ± SE). *P < 0.05 between vehicle group and control mice; #P < 0.05 between EP1802Y group and control mice. |
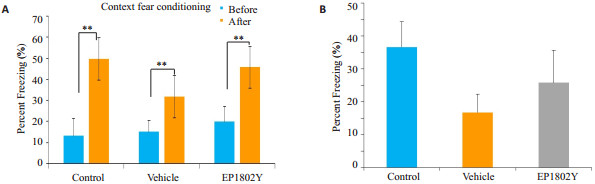
在关联恐惧条件实验中,各组的凝滞时间与实验前相比,凝滞时间明显增长,具有显著性差异(**P<0.01,图 5A)。然而,各组小鼠的凝滞时间减去各自实验前的凝滞时间后,消除小鼠个体差异后,各组间无显著性差异(P>0.05,图 5B)。条件性恐惧实验主要测定啮齿类动物学习、记忆不悦经历和环境暗示之间关联的能力。啮齿类动物在恐惧时会表现出特有的凝滞不动的状态,实验中,小鼠凝滞不动时间越长,说明小鼠学习记忆能力未受损。
|
图 5 条件性恐惧实验评价小鼠学习记忆 Figure 5 Learning and memory capacity of the mice measured by contextual fear conditioning. A: All the 3 groups showed significantly increased freezing in the conditioning chamber 24 h after training (**P < 0.01), indicating strong context memory; B: Difference scores (percent freezing after training minus percent freezing before training) revealed that the net increase in freezing was not different among the groups. |
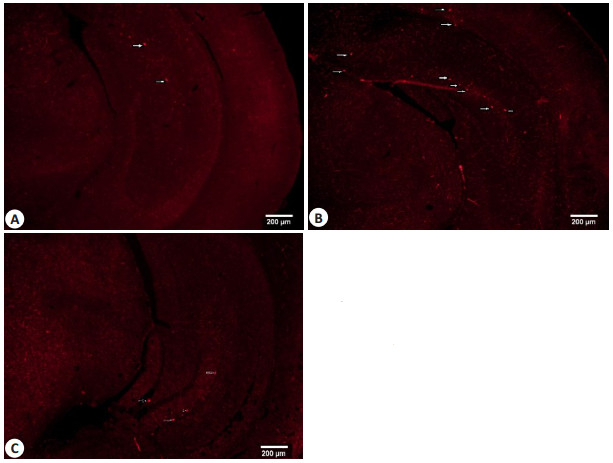
免疫组化结果显示,正常组小鼠脑内Aβ1-42的沉积很少,假手术组小鼠脑内有较多的Aβ1-42沉积,而实验组小鼠脑内Aβ1-42的沉积明显减少(图 6)。
|
图 6 APPswe/PSEN1dE9转基因小鼠海马内Aβ1-42的表达 Figure 6 Immunohistochemistry for Aβ1-42 in the hippocampus of APPswe/PSEN1dE9 transgenic mice. A: Wild-type mice; B: PBS-treated transgenic mice; C: PrPC antibody-treated transgenic mice. Arrows indicate individual plaques. Scale bar=200 μm. |
近年研究认为,PrPC蛋白参与了Aβ寡聚体所介导的AD神经元突触功能障碍及认知功能障碍[7-8]。同样,本研究发现封闭海马PrPC蛋白与Aβ寡聚体结合的位点后,在旷场实验、新物体识别实验、Morris水迷宫实验和条件性恐惧实验及免疫组化实验中,发现海马内注射PrPC抗体对APPswe/PSEN1dE9转基因小鼠行为学缺陷有所改善,能够下调APPswe/PSEN1dE9海马内Aβ1-42的表达,但并不能完全逆转APPswe/PSEN1dE9转基因小鼠的认知损害。
APPswe/PSEN1dE9转基因小鼠的学习和记忆能力是反映脑认知功能的重要指标。本试验使用通过旷场实验、新物体识别实验、Morris水迷宫实验和条件性恐惧实验,检测封闭PrPC蛋白与Aβ寡聚体结合的位点后,对APPswe/PSEN1dE9转基因小鼠空间学习记忆能力的影响。旷场实验是评价动物焦虑状态的经典行为学方法,被广泛用于精神神经药理学、神经行为学等基础研究[9]。本实验首先采用旷场实验,目的为观察海马手术损伤是否会对实验组及假手术组小鼠的精神行为有影响。结果显示,实验组及假手术组8月龄的APPswe/ PSEN1dE9转基因小鼠均存在精神焦虑症状,这也与其它实验报道结果相一致。虽然EP1802Y抗体海马注射后,不能改善APPswe/PSEN1dE9转基因小鼠的精神焦虑症状,但也证实海马注射手术损伤并不能影响实验动物的行为状态。新物体识别实验结果显示,假手术组分辨指数较正常组明显减少,而实验组分辨指数虽然有所升高,但实验组与假手术组相比,没有显著性差异,结果说明转基因小鼠学习记忆能力下降,而EP1802Y抗体干预有一定效果,但并不能完全逆转小鼠的学习记忆损害。Morris水迷宫试验结果显示,隐匿平台实验中,实验各组之间无明显的差异;空间探索实验中,实验组与假手术组相比,游泳距离存在显著性差异,实验组游泳距离明显减少。新物体识别实验结果与Morris水迷宫试验结果存在一定的差异,这可能与新物体识别实验主要观察的是小鼠对新旧物体的记忆,而非小鼠的空间记忆能力。显然,EP1802Y抗体注射无法改善模型小鼠对新旧物体的记忆有关。在条件恐惧条件测试中,关联恐惧条件实验结果显示,实验各组转基因小鼠在去除个体差异后,各组之间无显著性差异。条件恐惧条件实验包括关联恐惧条件实验和暗示恐惧条件实验两部分,关联恐惧条件实验与小鼠的海马学习记忆有关,暗示条件恐惧试验主要与小鼠杏仁核功能相关,本实验显示EP1802Y抗体注射入海马,并未影响杏仁核的功能(结果未显示)。在以上4种行为学测试中,研究发现海马注射PrPC抗体对模型小鼠空间搜索记忆有明显改善作用。空间学习记忆是人和动物生存所必需的生理功能,小鼠空间搜索记忆依赖于不同脑区间的相互作用,这些脑区组成了功能完整的神经网络,海马的功能对于空间学习记忆至关重要,被人们认为是空间记忆功能的原始基础[10-12]。可以推测,EP1802Y抗体封闭了神经元膜上PrPC蛋白与Aβ寡聚体结合的位点,很可能阻断了Aβ寡聚体对神经元的细胞毒性,从而部分恢复了APPswe/ PSEN1dE9转基因小鼠海马功能,但也同时发现,单纯通过PrPC抗体注射不足于完全逆转转基因动物的学习记忆损害。
实验使用的APPswe/PSEN1dE9双转基因小鼠模型,该模型使用小鼠Prion基因的启动子,将hAPPswe序列基因与小鼠启动子结合,构建人鼠嵌合型基因,并与含有第9个外显子突变的hPS1基因共同注射入小鼠受精卵,从而构建APPswe/PSEN1dE9双转基因小鼠模型[13]。该型具有AD的2个易感基因,更好的模拟了AD的病理特征和行为学改变。并且该转基因动物在4月龄开始出现散在的Aβ沉积,并随月龄的增加Aβ沉积逐渐增多,病理改变主要出现在大脑皮质和海马,同时,小鼠行为学的也发生改变。因此本实验选择了较理想的动物模型。实验选择术后2月进行行为学检测,是基于前期预实验的结果,分别在术后1周、2周、4周、6周、8周及12周进行行为学的测试,发现在术后8周模型动物出现行为学异常,因而实验选择8周作为时间截点,对实验各组进行行为学检测。
AD患者的主要临床表现有学习、记忆功能下降,而突触的可塑性是神经系统生长发育、神经损伤与修复、学习与记忆的生物学基础[14-15]。研究认为AD患者的学习记忆功能下降与神经突触可塑性受损有关[16-17]。研究发现,PrPC与Aβ特异性结合对长时程增强LTP有影响[18-19]。研究还发现,尽管不能排除细胞膜上存在有其它Aβ寡聚体的受体,例如糖基化终产物受体(RAGE)和a7-烟碱乙酰胆碱受体(α7 Nicotinic Receptor)[20-21],但PrPC可以与50%以上的Aβ寡聚体结合。同样有研究显示,在AD转基因小鼠模型脑内,发现PrPC蛋白的表达与小鼠的记忆损害有关[22-23]。本实验通过免疫组化证实,PrPC抗体可以下APPswe/PSEN1dE9海马内Aβ1-42的表达。在AD发病过程中,Aβ分子之间以β折叠构象相互形成纤维,不易被蛋白酶降解,由此生成老年斑。其中长片断的Aβ1-42更具纤维原性和毒性,因此阻断和延迟AD早期Aβ的积聚,消除已形成的Aβ斑块沉积为潜在的AD治疗靶点。实验结果证实,实验组小鼠海马内的Aβ1-42明显减少。由此可以进一步证实,PrPC抗体可以干预海马内Aβ1-42的聚集。
本实验尝试验证短期内使用PrPC蛋白抗体后,对APPswe/PSEN1dE9双转基因小鼠行为学及海马内Aβ1-42表达的影响,结果证实,海马内注射PrPC抗体后,对APPswe/PSEN1dE9双转基因小鼠的行为学异常有一定的改善作用,可以下调海马内Aβ1-42的表达。因而,体内通过封闭海马PrPC蛋白与Aβ寡聚体结合的位点,从而降低Aβ寡聚体神经毒性或许是一种新的AD治疗策略,但其具体的作用机制还需要进一步的探索。
| [1] |
Benilova I, Karran E, De Strooper B. The toxic Aβ oligomer and Alzheimer's disease: an emperor in need of clothes[J].
Nat Neurosci, 2012, 15(3): 349-57.
DOI: 10.1038/nn.3028. |
| [2] |
Chay KO, Nam Koong KY, Hwang S, et al. NADPH oxidase mediates β-Amyloid Peptide-Induced neuronal death in mouse cortical cultures[J].
Chonnam Med J, 2017, 53(3): 196-202.
DOI: 10.4068/cmj.2017.53.3.196. |
| [3] |
Mucke L. Neurosience alzheimer's disease[J].
Nature, 2009, 461(7266): 895-7.
DOI: 10.1038/461895a. |
| [4] |
Laurén J, Gimbel DA, Nygaard HB, et al. Cellular prion protein mediates impairment of synaptic plasticity by amyloid-beta oligomers[J].
Nature, 2009, 457(7233): 1128-32.
DOI: 10.1038/nature07761. |
| [5] |
Freir DB, Nicoll AJ, Klyubin I, et al. Interaction between prion protein and toxic amyloid β assemblies can be therapeutically targeted at multiple sites[J].
Nat Commun, 2011, 2(1): 336.
|
| [6] |
Shankar GM, Li S, Mehta TH, et al. Amyloid-beta protein dimers isolated directly from Alzheimer's brains impair synaptic plasticity and memory[J].
Nat Med, 2008, 14(8): 837-42.
DOI: 10.1038/nm1782. |
| [7] |
Salazar SV, Strittmatter SM. Cellular prion protein as a receptor for amyloid-β oligomers in Alzheimer's disease[J].
Biochem Biophys Res Commun, 2017, 483(4): 1143-7.
DOI: 10.1016/j.bbrc.2016.09.062. |
| [8] |
Falker C, Hartmann A, Guett I, et al. Exosomal cellular prion protein drives fibrillization of amyloid beta and counteracts amyloid beta-mediated neurotoxicity[J].
J Neurochem, 2016, 137(1): 88-100.
DOI: 10.1111/jnc.2016.137.issue-1. |
| [9] |
Fedotova J, Soultanov V, Nikitina T, et al. Ropren treatment reverses anxiety-like behavior and monoamines levels in gonadectomized rat model of Alzheimer's disease[J].
Biomed Pharmacother, 2016, 83: 1444-55.
DOI: 10.1016/j.biopha.2016.08.065. |
| [10] |
Sah SK, Lee C, Jang JH, et al. Effect of high-fat diet on cognitive impairment in triple-transgenic mice model of Alzheimer's disease[J].
Biochem Biophys Res Commun, 2017, 493(1): 731-6.
DOI: 10.1016/j.bbrc.2017.08.122. |
| [11] |
Burke SL, Rodriguez MJ, Barker W, et al. Relationship between Cognitive Performance and Measures of Neurodegeneration among Hispanic and White Non-Hispanic Individuals with Normal Cognition, Mild Cognitive Impairment, and Dementia[J].
J Int Neuropsychol Soc, 2018, 24(2): 176-87.
DOI: 10.1017/S1355617717000820. |
| [12] |
Norton DJ, Amariglio R, Protas H, et al. Subjective memory complaints in preclinical autosomal dominant Alzheimer disease[J].
Neurology, 2017, 89(14): 1464-70.
DOI: 10.1212/WNL.0000000000004533. |
| [13] |
高雅, 王鲁宁, 张红红. APP swe/PS1dE9双转基因阿尔茨海默病模型小鼠生物学特征[J].
中华老年心脑血管病杂志, 2015, 17(1): 106-8.
|
| [14] |
Florenzano F, Veronica C, Ciasca GA, et al. Extracellular truncated tau causes early presynaptic dysfunction associated with Alzheimer's disease and other tauopathies[J].
Oncotarget, 2017, 8(39): 64745-78.
|
| [15] |
Jeong S. Molecular and cellular basis of neurodegeneration in alzheimer'sDisease[J].
Mol Cells, 2017, 40(9): 613-20.
|
| [16] |
Shipton OA, Leitz JR, Dworzak J, et al. Tau protein is required for amyloid beta-Induced impairment of hippocampal long-term potentiation[J].
J Neurosci, 2011, 31(5): 1688-92.
DOI: 10.1523/JNEUROSCI.2610-10.2011. |
| [17] |
Liang J, Kulasiri D, Samarasinghe S. Computational investigation of Amyloid-β-induced location-and subunit-specific disturbances of NMDAR at hippocampal dendritic spine in Alzheimer's disease[J].
PLoS One, 2017, 12(8): e0182743.
DOI: 10.1371/journal.pone.0182743. |
| [18] |
Kostylev MA, Kaufman AC, Nygaard HB, et al. Prion-Proteininteracting amyloid-β oligomers of high molecular weight are tightly correlated with memory impairment in multiple alzheimer mouse models[J].
J Biol Chem, 2015, 290(28): 17415-38.
DOI: 10.1074/jbc.M115.643577. |
| [19] |
Aimi T, Suzuki K, Hoshino T, et al. Dextran sulfate Sodium inhibits amyloid-β oligomer binding to cellular prion protein[J].
J Neurochem, 2015, 134(4): 611-7.
DOI: 10.1111/jnc.2015.134.issue-4. |
| [20] |
Peters C, Espinoza MP, Gallegos S, et al. Alzheimer's Aβ interacts with cellular prion protein inducing neuronal membrane damage and synaptotoxicity[J].
Neurobiol Aging, 2015, 36(3): 1369-77.
DOI: 10.1016/j.neurobiolaging.2014.11.019. |
| [21] |
Yan SD, Chen X, Fu J, et al. RAGE and amyloid-beta peptide neurotoxicity in Alzheimer's disease[J].
Nature, 1996, 382(6593): 685-91.
DOI: 10.1038/382685a0. |
| [22] |
Toyohara J, Hashimoto K. α7 nicotinic receptor agonists: potential therapeutic drugs for treatment of cognitive impairments in schizophrenia and alzheimer's disease[J].
Open Med Chem J, 2010, 4: 37-56.
|
| [23] |
Kessels HW, Nguyen LN, Nabavi S, et al. The prion protein as a receptor for amyloid-beta[J].
Nature, 2010, 466(738): E3-4.
|
 2018, Vol. 38
2018, Vol. 38

