2. 南方医科大学 南方医院妇产科,广东 广州 510515
2. Department of Obstetrics and Gynecology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
在临床腹部或盆腔外科手术中医源性输尿管损伤,虽然较少见,一旦发生输尿管损伤,将会产生严重的并发症,如腹腔感染、输尿管瘘、肾衰竭等。据研究报道腹部或盆腔外科手术医源性输尿管损伤的发病率1%~8%[1],其中盆腔外科手术医源性输尿管损伤最为常见,特别是结直肠手术、妇科手术等[2]。
为了降低医源性输尿管损伤的风险,大量有关输尿管识别定位的成像技术不断涌现,如静脉肾盂造影术(IVP)、逆行性肾盂造影术、泌尿道计算机断层扫描(Uro-CT)、输尿管支架管置入术、运用gamma探测仪技术。过往技术手段虽然可以实现对输尿管的识别定位,但仍然存在各种缺陷与不足。尤其前3者是依靠术前对输尿管的定位,转化到术中外科医生常常凭借术前影像信息和实践经验大致判断输尿管的大致走向,缺乏实时性,而且均会对患者会产生电离辐射。输尿管支架管置入术是在术前向需要进行腹部外科手术的患者体内放置输尿管支架管(或发光的输尿管支架管),术中外科医生通过手或手术器械的触碰和眼睛观察,间接对输尿管进行识别定位,虽然一定程度上实现术中实时输尿管识别定位,但这种有创的方法不仅会额外增加病人的疼痛,并且延长手术时间,增加手术的费用,有些患者术后会产生血尿,尿路感染等症状[3-4]。而gamma探测技术是通过向患者静脉注射放射性药物(锝),再通过gamma探测以获取输尿管的位置信息,但进行该项操作需要专门安排一个放射核医师,并且会产生电离辐射,长久以往将损害医护人员的健康[5]。
然而,光学成像技术,特别是近红外荧光成像,凭借其可术中实时,无电离辐射,可视化组织解剖结构信息,得到广泛的研究。如基于吲哚菁绿光学特性的近红外荧光成像技术已经在临床上广泛应用于血管[6-7]、淋巴[8-13]、胆管[14]、肿瘤[15]等术中识别定位。但是吲哚经静脉注射后,绝大部分是经过肝代谢[16],因此较少用于泌尿系统的识别定位。但仍有少数研究人员进行相关研究,如Tanaka等[17]进行向猪泌尿系统逆行性注射10 μmol/L的ICG,结合近红外荧光成像技术,实验结果显示逆行注射后输尿管立即可视。该方法有待进一步研究实践。除了吲哚已获得FDA批准可用于临床的近红外荧光染料外,还有亚甲基蓝(MB)也获得FDA的批准[18]。与吲哚不同的是:一、其经静脉注射后绝大部分是经过肾脏代谢最终以尿液的形式排出体外;二、光学特性,如吸收与发射光谱等,MB吸收峰为665 nm,发射峰为688 nm,刚好落在近红外光(650~900 nm)波段中[19]。故MB可结合近红外荧光成像技术,实现术中实时在体、无电离辐射,可视化获取输尿管的位置信息。目前国外已有使用MB结合近红外荧光成像技术实现在动物及人体腹部术中实时在体输尿管可视化的研究报道。例如相关动物实验研究[19];2013年Verdeek等[20]进行的首次人体临床试验;2016年Yeung等[21]和Mah di Al-Taher等[22]开展的相关临床相关试验。但仍存在不足之处:临床数据量还较少,还未能对最佳成像剂量或最佳成像时间下定论,有待进一步扩充试验数据;组织穿透深度较浅,有些需部分暴露输尿管方能探测到MB的荧光信号等。即腹部术中无电离辐射、无创、实时在体输尿管可视化的研究仍在初级阶段,需要更加深入的研究与探讨。
基于MB光学特性而研制的近红外荧光成像系统是开展术中实时在体输尿管识别定位的前提。然而,目前国内外能用于MB的荧光成像系统进仅有FLARE近红外成像系统[23],虽然可以多光谱融合成像,但是集成度高、体积大、费用高、不够轻携。因此,本文针对MB的光学特性而单独研制相应的近红外荧光成像系统,一是填补国内在这方面的空白,二是为下一步深入研究做好前期准备工作。
1 系统成像原理在介绍系统成像原理之前,首先了解下MB的物理、化学、光学等性质。
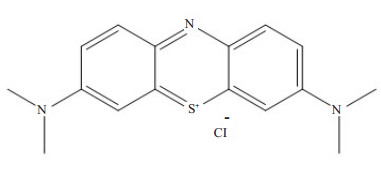
1.1 MB的性质MB是一种亲水性的吩噻嗪衍生物,净电荷-1。化学式:C16H18ClN3S;结构式:如下图 1;相对分子质量:319.85。MB在浓度较高的情况下,主要作为一种显色染料。但是当它稀释到一定程度时,在特定激发光激发下可以发射出荧光信号。其吸收峰为665 nm,发射峰为688 nm,刚好落在肉眼不可见的近红外光波段中[19]。相关研究表明影响组织穿透深度主要是组织对光的吸收与散射[24]。而在近红外波段中活体组织(主要血红蛋白、水、脂肪)对近红外光呈现低吸收、低散射、低自体荧光的特点,即有一定的组织穿透深度[25]。其在100%胎牛血清(pH=7.4)中消光系数(extinction coefficient Ɛ):71 200 M-1 cm-1,量子产率(Quantum yield):3.8%;浓度淬灭(Concentration-Dependent Quenching)值:20 μm[26]。符合在体组织荧光成像对外源荧光基团性质的要求[26]。
|
图 1 亚甲基蓝的化学结构式 Figure 1 Chemical structure of MB |
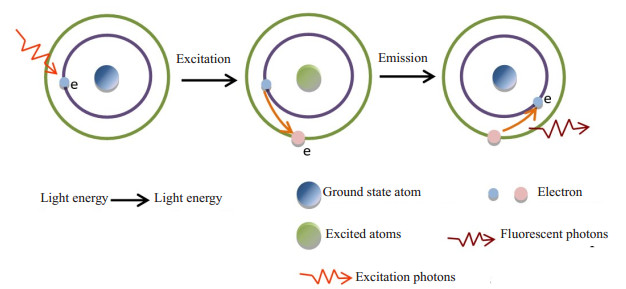
根据荧光基团的吸收光谱特性,而发射特定波长的激发光子辐照荧光基团,吸收激发光子能量的荧光基团,受激后的基态分子中电子向高能级轨道跃迁变成激发态,当激发态分子回到基态时,将释放能量,以光子的形式发射(即荧光)。整个过程是吸收光子与发射光子之间的能量转换,而引起的波长的变化(波长短能量高的吸收光谱转换成波长长能量低的荧光),即斯托克斯位移[27]。其光子吸收与荧光发射的大致过程如下图 2所示。
|
图 2 荧光基团的光子吸收与荧光发射的过程 Figure 2 Process of photon absorption and fluorescence emission of fluorophore |
近红外荧光成像是近红外激发光源发射激发光辐照目标靶区,靶区内的荧光基团受激发光激发后,发射出的荧光,部分经滤光片、透镜进入CCD相机进行光电转换及一系列的信号后处理,最终将信号强弱用灰度值表示并实时显示在荧屏上。本文是基于MB的光学特性而研制的近红外荧光成像系统,即该成像系统激发光源选用的是中心波长为670 nm的近红外LED作为激发光源,并在LED前端放置660~680 nm窄带滤光片(仅允许660~680 nm激发光光谱波段通过)。激发光源发出特定的光束辐照靶区,靶区内MB受激发光激发后,发射出的荧光经CCD前端694~720 nm窄带滤光片(滤除来自LED的激发光及外界自然光)进入CCD,进行光电转换,即将光信号转化成电信号,在经过数据采集卡进入图像后处理工作站,进行信号的增强、放大等处理,最终在终端显示器实时显示灰度图像或经伪彩处理的伪彩图像。
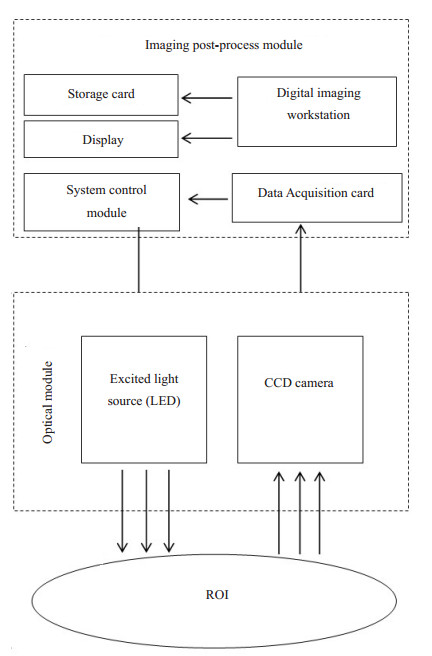
2 近红外荧光成像系统实现 2.1 系统组成结构近红外荧光成像系统主要由两大模块组成:光学模块、图像后处理模块,如图 3所示。
|
图 3 系统组成结构图 Figure 3 Diagram illustrating the working process of the system |
光学模块主要功能是激发光源的产生与发射光光信号的采集。硬件组成主要由激发光源、滤光片、CCD相机等组成。
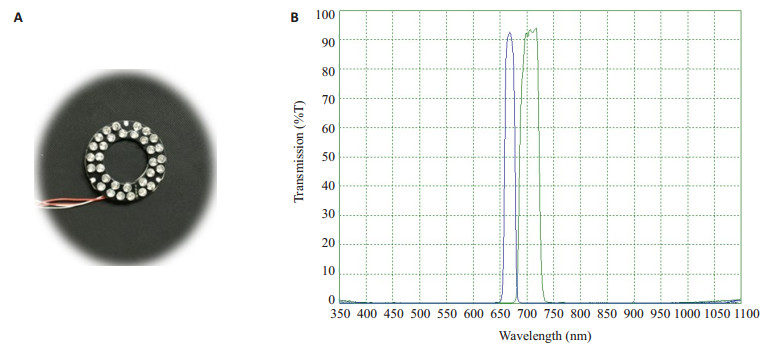
光源作为实时术中引导的近红外荧光成像系统的激发光源应满足高积分通量率、可长时间工作、可控的、并且波长能精准的控制[23]等要求。其中积分通过率也不宜太高,太高会使荧光基团发生不可逆的光漂白现象,对于有机荧光染料一般应低于50 mw/cm2[28]。相对于滤波宽带源或激光二极管,LED具有高效能、可电脑控制、可高度集成、成本低、稳定性好的特点[26],因此本成像系统选用LED作为近红外荧光成像系统产生激发光光源。LED定制于日本EPITEX,其封装直径为5 mm,中心波长670 nm,半峰宽20 nm,工作电流50 mA,输出功率123 mW。为了将激发光源集成在CCD摄像机端,32个LED集成在环形电路板(环形电路板内径34 mm,外径63 mm)上,作为近红外荧光成像系统的环形激发光源,如图 4A。
|
图 4 环形激发光源与滤光片光谱特性 Figure 4 Ring excitation light source and the spectrum characteristics of the interference filter. A: LED ring excitation light source; B: Wavelength and passing rate of the interference filter (Blue curve: excitation filter; Green curve: emission filter) |
滤光片是滤除不相关的光波段。根据MB的最大吸收光谱与发射光谱的特性,分别定制了特定波段的窄带激发光滤光片和发射光滤光片(定制于深圳市激埃特光电有限公司)。激发光滤光片波段为660~680 nm,透过率≥85%(图 4B),形状尺寸与LED环形电路板相匹配,内径为34 mm,外径为63 mm,厚度为1 mm。发射滤光片波段范围694~760 nm,透过率≥85%(如下图 4B所示),形状尺寸与CCD相机镜头直径大小相匹配,呈圆形,直径28 mm,厚度1 mm。环形激发光滤光片置于环形LED光源阵列的前端,主要是将LED发射的光谱限制在指定的光谱范围内,仅允许660~680 nm透过。而发射滤光片置于CCD相机前端,主要滤除来自外界或LED的激发光,保证仅有MB的荧光通过。
CCD相机是接收来自成像野(感兴趣区ROI)反射回来经透镜及特定干涉滤光片滤过的光束,并将光信号转换成电信号。本系统选用的是XC-EI50CE索尼近红外CCD相机。相机镜头1/2型IT CCD,光圈F1.4,直径33.5 mm;有效像素752(H)×582(V);帧率25 fps;视野面积15 cm×21 cm;视频信号传输格式PAL。
2.1.2 图像后处理模块主要处理来自成像探头输出的信号,包括信号放大、增强、输出及存储等。主要包括系统控制模块、数据采集、处理、存储等模块。硬件组成:数据采集卡、WIN7操作系统、显示器、键盘、鼠标、电源、电线等。
3 软件处理及机械加工采用Visual C++6.0语言编写软件,软件界面具有图像显示、参数设置、视频拍摄、数据保存等功能。相关机械部件加工、组装、技术性能测试等委托太原赛恩思科技有限公司加工处理及测试。近红外荧光成像系统结构示意图如下图 5所示。
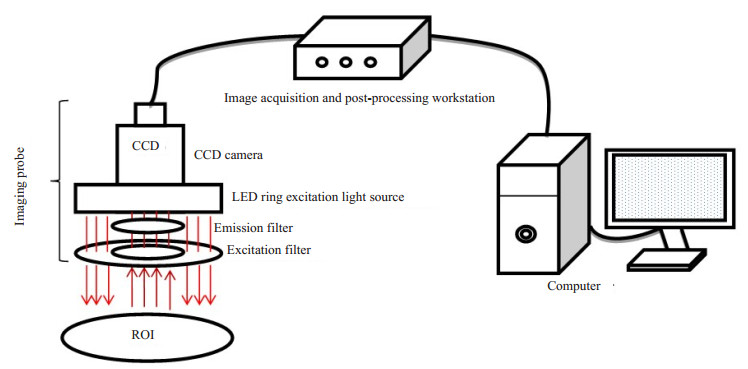
|
图 5 近红外荧光成像系统结构示意图 Figure 5 Structure of the near-infrared fluorescence imaging system |
MB(购买于LI-COR Biosciences)、缓冲液(PBS,pH=7.4)、100%胎牛血清(FBS)、羟乙基哌嗪乙硫磺酸(HEPES)、注射器、75%医用酒精、代谢笼、0.9%生理盐水、EP管、石英荧光样品池、F96PRO荧光分光光度计(F96PRO购买于上海棱光技术有限公司)、近红外成像系统。wistar大鼠15只,平均体质量约200 g,6~8周龄,由南方医科大学实验动物中心提供。
4.2 实验方法 4.2.1 亚甲基蓝荧光光谱分析分别用PBS、100%胎牛血清(其中100%胎牛血清先用羟乙基哌嗪乙硫磺酸将pH调至7.4备用)分别配置不同浓度梯度(按10-1逐级递减,即1、0. 1、0.01、0.001、0.0001 mg/mL及0 mg/mL(空白对照)的MB溶液1 mL。在近红外荧光成像之前,分别将溶液放置在石英荧光样品池,用荧光分光光度计分别测其荧光光谱,采用中心波长670 nm,半峰宽10 nm的光源照射样品池,并记录其荧光光谱。
4.2.2 亚甲基蓝近红外荧光成像在相同的条件下,用近红外成像系统对上述两组溶液不同浓度梯度的MB溶液分别进行成像,对比成像及在不同成像距离下进行激发成像,每种条件下各重复3次,观察在不同溶剂、不同浓度、不同成像距离(30、40、50 cm)下荧光强度的变化。并计算情况下MB溶液荧光的SBR(Signal-tobackground ratio)值大小,并采用SPSS 23.0对数据进行处理,计算数据采用Mean±SD表示。同时分析各个实验条件下对MB溶液的SBR值影响关系,分别采用单因素方差分析,P < 0.05为差异具有有统计学意义。(SBR计算公式:SBR=(fluorescence-background)/ background)。
4.2.3 Wistar鼠尿液收集实验15只wistar鼠随机分成5组,每组分别给予尾静脉注射不同剂量的亚甲基蓝注射液,剂量分别为2.1、1.8、1.6、1.4、0 mg/kg,其中剂量0 mg/kg为生理盐水,即空白对照。注射后立即将wistar鼠放入代谢笼中进行尿液收集,收集时长2 h。尿液收集结束后,将收集的wistar鼠尿液装置于经消毒的0.5 mL的EP管中,放置于近红外荧光成像系统成像探头下方,按注射剂量从高到低一字排开(对照放置首位),进行激发成像,并保存数据。同时分析各个剂量下wistar鼠尿液荧光信号的SBR值大小,并采用SPSS23.0对数据进行处理,计算数据采用Mean±SD表示。不同剂量与wistar鼠尿液的SBR值关系,采用单因素方差分析,P < 0.05为差异具有统计学意义。
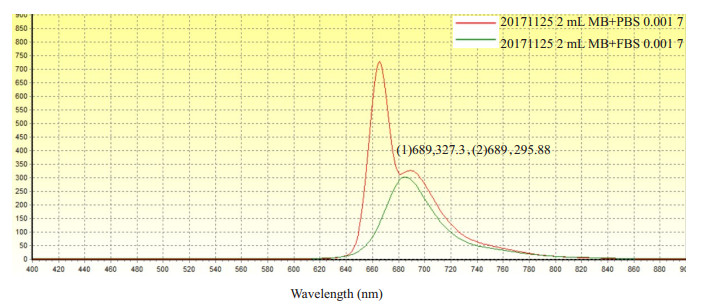
4.3 实验结果 4.3.1 亚甲基蓝荧光光谱分析MB溶液荧光图谱部分显示如下图 6所示。从测量荧光图谱的结果表明,不管是PBS或FBS溶剂稀释的MB溶液,在一定波段范围内,任意一固定波长点各浓度荧光值随浓度的递减呈现先升高后降低的变化趋势(即浓度的猝灭现象[26, 29])。在这几种浓度中,浓度为0.001 mg/mL的荧光值峰值达到最高如图 6所示,从图中可以看出在相同浓度下用FBS稀释的MB溶液荧光值略高。
|
图 6 不同溶剂稀释的MB溶液(浓度均为0.001 mg/mL)的荧光光谱。红色曲线是PBS(pH=7.4)稀释的MB溶液荧光光谱;绿色曲线是用100% FBS(pH=7.4)稀释的MB溶液的荧光光谱 Figure 6 Fluorescence spectra of MB diluted with different solvents at the same concentration of 0.001 mg/mL. Red curve is the fluorescence spectra of MB in PBS (pH 7.4); Green curve is the fluorescence spectra of MB in 100% FBS (pH 7.4) |
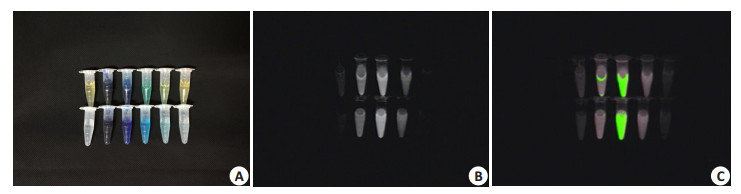
从近红外荧光成像结果图(图 7)及SBR值(表 1)分析结果显示(这里仅显示在成像距离为40 cm的实验结果),在一定溶度范围内,不管是用PBS稀释还是FBS稀释的MB溶液的SBR值均随着稀释的倍数的增加呈现先增大后减小的变化趋势(即浓度的猝灭现象[26, 29]),等价于MB的荧光强度随着稀释倍数的增加呈现先增强后减弱的变化趋势,其中浓度为0.001 mg/mL的SBR均达到最大,值分别为6.44±0.20(溶剂:PBS)和8.75±0.25(溶剂:FBS),而浓度大于0.1 mg/mL或者浓度小于0.00001 mg/mL的SBR值趋于0(即荧光极其微弱,几乎无法探测到荧光信号)。另外,从不同溶剂相同浓度对比分析显示用FBS稀释的MB溶液的SBR值略高于PBS稀释的MB溶液荧光SBR值(表 1)。在不同成像距离的实验中发现,一定溶度范围内,在这3种成像距离中均能清晰探测到MB的荧光信号。这里以FBS稀释的MB(溶度为1 mg/mL)为例,各个成像距离下SBR分析结果显示,距离越小,SBR值越大,SBR值分别为3.09±0.02(30 cm)、1.81± 0.01(40 cm)、0.82±0.04(50 cm),不同成像距离之间具有显著性差异(P < 0.05)。
|
图 7 两种不同溶剂稀释的MB溶液近红外荧光图像,成像距离40 cm Figure 7 Fluorescence imaging of gradient concentrations (from left to right: 0, 1, 0.1, 0.01, 0.001, and 0.0001 mg/mL) of MB in 100% FBS (pH 7.4; upper panel) and PBS (pH 7.4; lower panel). A: Color; B: NIR imaging; C: Pseudo-color imaging |
| 表 1 不同溶剂稀释的不同浓度梯度MB溶液荧光的SBR值 Table 1 Near-infrared fluorescent SBR value of gradient concentrations of MB solution in PBS and FBS at the imaging distance of 40 cm (Mean±SD) |
各个剂量下wistar鼠尿液近红外荧光成像相应SBR值分析结果显示,wistar鼠尿液荧光SBR值随注射剂量的减小呈现先增大后减小,SBR值分别为3.48±0.46(2 mg/kg)、7.29±0.39(1.8 mg/kg)、8.71±0.20(1.6 mg/kg)、3.02±0.35(1.4 mg/kg)、2.09± 0.73(0 mg/kg),其中1.6 mg/kg的剂量组的SBR值较其他剂量组高,即荧光较其他剂量组强。经单因素方差分析,不同剂量间具有显著性差异(P < 0.05)。
5 讨论本文对基于亚甲基蓝荧光特性而设计的近红外荧光成像系统的重要模块进行详细介绍,并进行相关实验的验证。实验分别用不同溶剂稀释的MB,并进行荧光光谱测量及近红外荧光成像。从MB的荧光值与近红外荧光的SBR结果分析显示,一定溶度范围内,不管是缓冲液稀释还是100%胎牛血清稀释的MB溶液,其荧光值(在同一波长点条件下)与SBR值均随着稀释倍数的增加呈现先增大后减小(浓度淬灭现象[26]),其中浓度为0.001 mg/mL的MB溶液的荧光峰值和SBR(荧光强度)值最高,即不同浓度MB溶液的近红外成像的SBR大小与其用荧光分光光度计测量的荧光值高低变化趋势相一致。另外在同种溶剂相同浓度的条件下不同成像距离的成像实验结果显示,在30、40、50 cm这3种成像距离下虽然均能探测到MB溶液的荧光信号,但是SBR值随着成像距离的成大而逐渐减小,因此不可无限增大或减小成像距离,因为在实际应用过程中距离太大,SBR值越小,荧光越弱,可见度越低,而成像距离越小,虽然SBR值越大,荧光越强,但越不利于操作(尤其运用于术中)。因此,从距离与SBR值大小角度考虑,在这三种成像距离中,最佳推荐成像距离为40 cm。当然在实际应用过程中应根据实际情况进行综合考虑。同时我们还初步开展离体动物实验,从收集的wistar鼠尿液的近红外荧光的SBR值结果显示,MB经尾静脉注射后部分代谢到尿液中,其中注射剂量为1.6 mg/kg的实验组SBR值较其他剂量高,该实验结果表明并不是注射剂量越高或越低SBR值就越高(荧光越强)。这将对下一步在体的动物实验成像距离与注射剂量的选择有一定的参考意义。
综上所述,从MB溶液与wistar鼠尿液的近红外荧光成像图像及SBR分析显示该系统成像效果良好,对比度高,荧光感应度较高,区分也比较明显,即该系统可用于MB荧光的探测。与已有的成像系统相比,该系统集成度低、体积小、便携、成本低,可根据实际需要选择是否与电脑主机联用。另外,尚无文献报道详细分析影响MB荧光强度(或SBR)的因素,因此,本文分别从溶剂、浓度、成像距离的角度对影响MB的荧光强度(或SBR)因素进行了详细分析。这将是下一步进行在体的动物实验和临床试验研究的必备条件。深入研究探索MB在生物体内泌尿系统光学成像的应用,加快其在临床腹部外科手术术中输尿管识别定位的应用,降低医源性输尿管损伤的风险具有重要的临床意义。
| [1] |
Redan JA, Mccarus SD. Protect the ureters[J].
JSLS, 2009, 13(2): 139-41.
|
| [2] |
Chan JK, Morrow J, Manetta A. Prevention of ureteral injuries in gynecologic surgery[J].
Am J Obstet Gynecol, 2003, 188(5): 1273-7.
DOI: 10.1067/mob.2003.269. |
| [3] |
Bothwell WN, Bleicher RJ, Dent TL. Prophylactic ureteral catheterization in colon surgery[J].
Dis Colon Rectum, 1994, 37(4): 330-4.
DOI: 10.1007/BF02053592. |
| [4] |
Chahin F, Dwivedi AJ, Paramesh A, et al. The implications of lighted ureteral stenting in laparoscopic colectomy[J].
JSLS, 2002, 6(1): 49-52.
|
| [5] |
Berland TL, Smith SL, Metzger PP, et al. Intraoperative gamma probe localization of the ureters: a novel concept[J].
J Am Coll Surg, 2007, 205(4): 608-11.
DOI: 10.1016/j.jamcollsurg.2007.04.017. |
| [6] |
Tanaka E, Chen FY, Flaumenhaft R, et al. Real-time assessment of cardiac perfusion, coronary angiography, and acute intravascular thrombi using dual-channel near-infrared fluorescence imaging[J].
J Thorac Cardiovasc Surg, 2009, 138(1): 133-40.
DOI: 10.1016/j.jtcvs.2008.09.082. |
| [7] |
Matsui A, Lee BT, Winer JH, et al. Real-time intraoperative nearinfrared fluorescenceangiography for perforator identification and flap design[J].
Plast Reconstr Surg, 2009, 123(3): 125e-7e.
DOI: 10.1097/PRS.0b013e31819a3617. |
| [8] |
Troyan SL, Kianzad V, Gibbs-Strauss SL, et al. The FLARE intraoperative near-infrared fluorescence imaging system: a first-inhuman clinical trial in breast cancer sentinel lymph node mapping[J].
Ann Surg Oncol, 2009, 16(10): 2943-52.
DOI: 10.1245/s10434-009-0594-2. |
| [9] |
Nimura H, Narimiya N, Mitsumori N, et al. Infrared ray electronic endoscopy combined with indocyanine green injection for detection of sentinel nodes of patients with gastric cancer[J].
Br J Surg, 2004, 91(5): 575-9.
DOI: 10.1002/(ISSN)1365-2168. |
| [10] |
Miyashiro I, Miyoshi N, Hiratsuka M, et al. Detection of sentinel node in gastric cancer surgery by indocyanine green fluorescence imaging: comparison with infrared imaging[J].
Ann Surg Oncol, 2008, 15(6): 1640-3.
DOI: 10.1245/s10434-008-9872-7. |
| [11] |
Kusano M, Tajima Y, Yamazaki K, et al. Sentinel node mapping guided by indocyanine green fluorescence imaging: a new method for sentinel node navigation surgery in gastrointestinal cancer[J].
Dig Surg, 2008, 25(2): 103-8.
DOI: 10.1159/000121905. |
| [12] |
Fujiwara M, Mizukami T, Suzuki A, et al. Sentinel lymph node detection in skin cancer patients using real-time fluorescence navigation with indocyanine green: preliminary experience[J].
J Plast Reconstr Aesthet Surg, 2009, 62(10): e373-8.
DOI: 10.1016/j.bjps.2007.12.074. |
| [13] |
Tsujino Y, Mizumoto K, Matsuzaka Y, et al. Fluorescence navigation with indocyanine green for detecting sentinel nodes in extramammary Paget's disease and squamous cell carcinoma[J].
J Dermatol, 2009, 36(2): 90-4.
DOI: 10.1111/jde.2009.36.issue-2. |
| [14] |
Matsui A, Tanaka E, Choi HS, et al. Real-time intraoperative nearinfrared fluorescenceidentification of the extrahepatic bile ducts using clinically-available contrast agents[J].
Surgery, 2010, 148(1): 87-95.
DOI: 10.1016/j.surg.2009.12.004. |
| [15] |
Aoki T, Yasuda D, Shimizu Y, et al. Image-guided liver mapping using fluorescence navigation system with indocyanine green for anatomical hepatic resection[J].
World J Surg, 2008, 32(8): 1763-7.
DOI: 10.1007/s00268-008-9620-y. |
| [16] |
Frangioni JV, Tanaka E, Borud LJ, et al. Intraoperative imaging methods: US Patent Application 11/899, 287[P]. 2007-9-5.
|
| [17] |
Tanaka E, Ohnishi S, Laurence RG, et al. Real-time intraoperative ureteral guidance using invisible near-infrared fluorescence[J].
J Urol, 2007, 178(5): 2197-202.
DOI: 10.1016/j.juro.2007.06.049. |
| [18] |
Fundus fluorescein and indocyanine green angiography: a textbook and atlas [M]. SLACK Incorporated, 2007.
|
| [19] |
Matsui A, Tanaka E, Choi HS, et al. Real-time, near-infrared, fluorescence-guided identification of the ureters using methylene blue[J].
Surgery, 2010, 148(1): 78-86.
DOI: 10.1016/j.surg.2009.12.003. |
| [20] |
Verbeek FP, van der Vorst JR, Schaafsma BE, et al. Intraoperative near infrared fluorescence guided identification of the ureters using low dose methylene blue: a first in human experience[J].
J Urol, 2013, 190(2): 574-9.
DOI: 10.1016/j.juro.2013.02.3187. |
| [21] |
Yeung TM, Volpi D, Tullis ID, et al. Identifying ureters in situ under fluorescence during laparoscopic and open colorectal surgery[J].
Ann Surg, 2016, 263(1): e1-2.
DOI: 10.1097/SLA.0000000000001513. |
| [22] |
Al-Taher M, van den Bos J, Schols RM, et al. Fluorescence ureteral visualization in human laparoscopic colorectal surgery using methylene blue[J].
J Laparoendosc Adv Surg Tech A, 2016, 26(11): 870-5.
DOI: 10.1089/lap.2016.0264. |
| [23] |
Gioux S, Kianzad V, Ciocan R, et al. High-power, computercontrolled, light-emitting diode-based light sources for fluorescence imaging and image-guided surgery[J].
Mol Imaging, 2009, 8(3): 156-65.
|
| [24] |
Contrast agents for optical imaging[M]//Contrast Agents Ⅱ. Springer Berlin Heidelberg, 2002: 1-29.
|
| [25] |
Frangioni JV. In vivo near-infrared fluorescence imaging[J].
Curr Opin Chem Biol, 2003, 7(5): 626-34.
DOI: 10.1016/j.cbpa.2003.08.007. |
| [26] |
Gioux S, Choi HS, Frangioni JV. Image-guided surgery using invisible near-infrared light: fundamentals of clinical translation[J].
Mol Imaging, 2010, 9(5): 237-55.
|
| [27] |
Keereweer S, Van Driel PB, Snoeks TJ, et al. Optical image-guided cancer surgery: challenges and limitations[J].
Clin Cancer Res, 2013, 19(14): 3745-54.
DOI: 10.1158/1078-0432.CCR-12-3598. |
| [28] |
Nakayama A, Bianco AC, Zhang CY, et al. Quantitation of brown adipose tissue perfusion in transgenic mice using near-infrared fluorescence imaging[J].
Mol Imaging, 2003, 2(1): 37-49.
DOI: 10.1162/153535003765276273. |
 2018, Vol. 38
2018, Vol. 38

