肝细胞癌(HCC)是高发病率的恶性肿瘤之一[1],并且其死亡率在各类型肿瘤中高居第2,可谓“癌中之王”。HCC是由多种因素诱发的,在我国主要是由于病毒性肝炎特别是HBV与HCV感染导致的。多数HCC患者发现时已发展至晚期,治疗手段匮乏,治疗效果欠佳[2]。虽然手术治疗、放射治疗、基因治疗、局部化疗、微波疗法及生物治疗等方法在治疗HCC上都取得了一定进展[3],但是依然难以攻克肿瘤治疗的难题,新的药物的出现显得尤为迫切。研究表明,新药的研制需要高昂的费用和漫长的时间成本。氯喹,常用于疟疾、自身免疫性疾病以及炎症性疾病的治疗[4]。近年来,有研究将氯喹用于抗肿瘤的研究,并且惊喜地发现,氯喹在肺癌、胃癌等肿瘤中有一定的抑制作用[5-8]。然而,氯喹抗肿瘤的机制尚未研究透彻,大多数研究认为与抑制自噬相关,氯喹可改变溶酶体的pH值,抑制溶酶体与自噬小体的融合来抑制自噬[9-11]。miRNA作为非编码的小分子RNA已被证实参与了真核细胞的增殖、凋亡、代谢等过程,肿瘤的发生发展也与其关系密切[12-13],目前氯喹的抗肿瘤机制不明确,而且尚无氯喹的作用与miRNA的关系的研究。因此,本研究将老药氯喹作用于肝癌细胞,观察氯喹对肝癌细胞凋亡的影响,检测凋亡相关指标的变化并且进一步探寻氯喹诱导的凋亡与miRNA之间的关系。以此探寻老药新用作为抗肿瘤药物的新途径,并揭示其可能的作用机制,为肝癌的治疗提供新的途径。
1 材料和方法 1.1 材料 1.1.1 试剂DMEM培养基、胰蛋白酶:Gibco;小牛血清:Hyclone.ATP检测试剂盒:碧云天生物技术研究所;氯喹、PI:Sigma;miR-26b抑制剂:吉玛制药公司。
1.1.2 细胞HepG2细胞株购自湘雅医学院,由蚌埠医学院科研中心冻存。
1.2 方法 1.2.1 细胞培养使用DMEM培养液(添加5%小牛血清)培养肝癌细胞HepG2,培养箱条件设置为37 ℃、5% CO2。
1.2.2 MTT法检测细胞存活率取对数生长期的HepG2细胞按照每孔8×103细胞接种到96孔板中,加入100 μL不含药物的培养液,培养24 h后换成含药培养液100 μL。加入的药物氯喹浓度分别为10、20、40、80、160 μmol/L,另设空白组和只加培养液的阴性对照。每组样设置5个复孔。加药24、48、72 h后,每孔加入配制后的MTT 15~20 μL,继续培养4 h后,舍弃96孔板中液体,接着加入150 μL DMSO,置于37 ℃环境中静置30 min,酶标仪测定570 nm处每孔吸光度(A)值,计算细胞存活率:以上实验均重复3次。
1.2.3 PI单染检测细胞凋亡将转染miR-26b抑制剂前后对数生长期的肝癌HepG2细胞以每孔1×105细胞接种于12孔板中,普通培养基培养24 h后,分别加入0、40、80、160 μmol/L的氯喹,另外,将转染miR-26b抑制剂前后的肝癌HepG2细胞以每孔1×105细胞接种于12孔板中,(所使用的抑制剂从上海吉玛(GenePharma)公司购买,基因的序列:miR-26b抑制剂:5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACCTATCC-3'。miR-26b抑制剂特异的靶向和敲除miR-26b分子,使细胞内miR-26b的表达量降低,从而削弱内源miR-26b的基因沉默效应),分别加入80 μmol/L的氯喹;加药培养24 h后,收集细胞,离心后上清液舍去并转移至1.5 mL离心管中。使用20 ℃冰箱保存的的75%乙醇1 mL固定细胞,置于4 ℃冰箱中过夜,7 d之内再次使用PBS清洗并离心,加入800 μL配制后的PI缓冲液,避光静置4 h后,置于流式细胞仪检测。
1.2.4 ATP检测接种对数生长期的肝癌HepG2细胞于12孔板中,接种密度为每孔1×105细胞,培养24 h分别加入0、40、80、160 μmol/L处理,5 h后收集细胞并离心,弃去上清后再将100 μL裂解液加入其中。充分裂解细胞,离心10 min保留上清液用于测定。在新96孔板加入100 μL ATP工作液(1:100)放置5 min,避光条件下每孔加入30 μL BCA蛋白定量后的样品后立即检测。重复以上实验3次。
1.2.5 q-PCR方法检测miR-26b的表达80 μmol/L氯喹作用于肝癌HepG2细胞24 h收集细胞,按照miRNeasy® Mini Kit(Qiagen)说明书提取细胞总miRNA。提取之后在RNA纯度测量仪上测量,若A260/A280比值在1.9~ 2.1之间说明纯度较高,可以进行后续实验。第一步进行逆转录合成cDNA,之后在PCR扩增仪上运行:反应:37 ℃反应60 min,灭活:95 ℃反应5 min。根据All-in One miRNA qRT-PCR Detection kit说明书在PCR仪上进行扩增,得到每孔Ct值后,计算3个复孔的平均值,取平均值按照2-△△ct相对定量计算公式得出相对表达量。以上每个样品需做3个重复孔,实验重复3次。
1.2.6 Western blot检测Mcl-1蛋白表达80 μmol/L氯喹作用于肝癌HepG2细胞24 h收集细胞,一半48 h后收集蛋白,另外一半培养24 h后按照说明书进行转染,放在37 ℃培养箱中6 h,将原液倒掉,加入新的培养基,直到48 h后再将细胞消化下来进行后续实验。所使用的模拟物和抑制剂均从上海吉玛(GenePharma)公司购买,基因的序列:miR-26b inhibitor:5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACCTATCC-3'。处理后提取蛋白并测定蛋白浓度。经过电泳,转膜;转膜后使用封闭液封闭2 h,PBS洗膜,接着一抗室温孵育2 h,洗膜后二抗孵育2 h;加入发光剂显影;最终Bin-Rad凝胶成像系统获取图像。
1.2.7 统计学方法本实验数据以均数±标准差表示,使用SPSS13.0软件对数据进行方差分析,并且用双侧Dunnett t检验做各组间比较,以P < 0.05为差异有统计学意义。
2 结果 2.1 氯喹抑制肝癌HepG2细胞增殖本实验使用不同浓度的氯喹(10、20、40、80、160 μmol/L)处理人肝癌HepG2细胞株,MTT法实验分别检测了氯喹作用24、48、72 h后细胞存活率。结果表明,氯喹对人肝癌HepG2细胞株增殖的抑制作用呈时间和浓度依赖性(图 1)。
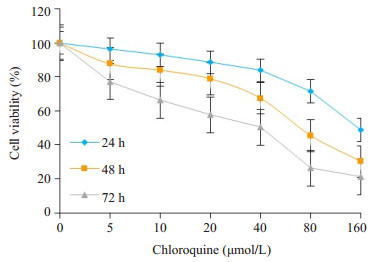
|
图 1 氯喹对人肝癌HepG2细胞增殖的抑制作用 Figure 1 Chloroquine induced growth inhibition in human liver cancer HepG2 cells |
MTT结果计算IC50,根据IC50值分别使用40、80、160 mol/L 3个不同浓度的氯喹处理HepG2细胞,作用24 h后PI缓冲液染色,并用流式细胞仪检测细胞凋亡率。结果显示,40、80、160 μmol/L的氯喹诱导HepG2细胞的凋亡率分别为16.8%,56.3%,64.3%,随着浓度增加而增加,结果表明氯喹能够诱导肝癌细胞HepG2的凋亡(图 2)。
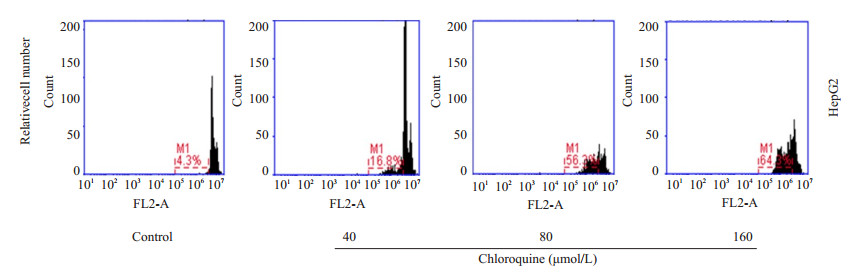
|
图 2 氯喹诱导肝癌细胞HepG2凋亡 Figure 2 Chloroquine induced apoptosis in HepG2 cells |
使用40、80、160 μmol/L的氯喹处理肝癌细胞HepG2细胞株后酶标仪检测ATP含量,与对照组相比,40、80、160 μmol/L的氯喹处理后细胞内ATP的相对含量分别为87.80%、71.29%、38.02%,随着氯喹的浓度升高呈下降趋势,差异具有统计学意义(P < 0.05,图 3)。结果表明,氯喹能够抑制HepG2细胞内ATP的产生。
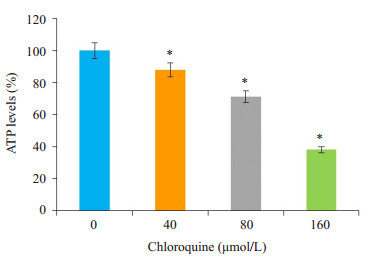
|
图 3 氯喹诱导HepG2细胞内ATP含量降低 Figure 3 Chloroquine concentration-dependently reduced ATP levels in HepG2 cells (*P < 0.05 vs control) |
小分子miRNA在生物体发育、细胞增殖与分化、激素分泌、肿瘤形成等过程中扮演者重要角色。为了探究氯喹诱导的细胞死亡是否与miRNA有关,我们选择了miR-26b为检测指标。用80 μmol/L氯喹处理HepG2细胞24 h。结果显示,药物处理后的HepG2细胞检测出的ΔCT Mean值为1.39,对照组ΔCT Mean值为0.045,根据2-ΔΔCT法计算出2-ΔΔCT值为2.55。表明80 μmol/L氯喹处理后的HepG2细胞的miR-26b的表达量是对照组的2.55倍。
2.5 抑制miR-26b表达对氯喹诱导肝癌HepG2细胞凋亡的影响为了探究抑制miR-26b的表达对氯喹诱导细胞凋亡的影响,使用80 μmol/L氯喹作用于转染miR-26b抑制剂(anti-miR-26b)的HepG2细胞,同时作用于未做处理的HepG2细胞,不使用药物的HepG2细胞作为对照,24 h后PI缓冲液染色,并用流式细胞仪检测细胞凋亡率。结果显示:转染miR-26b抑制剂后的细胞PI单染检测凋亡率为25.0%,而未转染抑制剂组凋亡率为45.9%,结果表明抑制miR-26b表达可以降低氯喹诱导的肝细胞凋亡(图 4)。
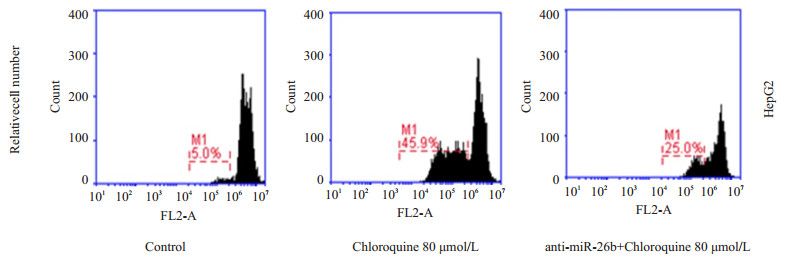
|
图 4 转染miR-26b抑制剂后氯喹诱导肝癌细胞HepG2凋亡 Figure 4 Chloroquine induced apoptosis in HepG2 cells treated with or without miR-26b inhibitor |
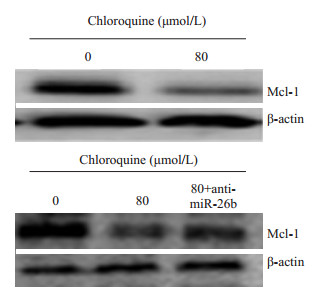
为了探究miRNA在鼻咽癌细胞凋亡的调控中所起到的作用以及其可能作用的靶点,我们进一步采用Western blot检测了给药前后与凋亡有关的蛋白Mcl-1的表达,结果显示,80 mol/L氯喹作用于肝癌细胞HepG2后,与miR-26b升高相反,Mcl-1的表达降低了;当转染了miR-26b的抑制剂(anti-miR-26b)后,80 mol/L氯喹作用肝癌细胞HepG2 Mcl-1的表达又升高了(图 5),由此也表明,氯喹诱导的肝癌细胞的凋亡可能是miR-26b作用于靶点Mcl-1实现的。
|
图 5 80 mol/L氯喹使HepG2细胞Mcl-1蛋白表达降低,转染miR-26b抑制剂后表达升高 Figure 5 Mcl-1 expression was down-regulated by chloroquine (80 mol/L) and up-regulated by miR-26b inhibitor in HepG2 cells |
氯喹除了用于治疗疟疾,有研究报道,在黑色素瘤、肺癌、乳腺癌等恶性肿瘤中也有一定的抗肿瘤作用[14-16]。本实验观察了氯喹对人肝癌细胞HepG2增殖、凋亡和ATP的影响,并且进一步检测了氯喹作用后miR-26b以及其可能的作用靶点Mcl-1的表达情况。结果表明,氯喹对人肝癌细胞HepG2具有明显的的增殖抑制作用,也能够诱导其凋亡。
miRNA是一类在动物和植物中广泛表达,并且是非编码的由18-25个核苷酸组成的小分子RNA。miRNA的作用机制是和靶mRNA3’UTR通过不完全互补配对,在转录后水平,阻遏翻译或引导引导沉默复合体(RISC)降解mRNA[17]。据统计,超过60%的蛋白质编码基因的翻译受到miRNA的调节,从而影响细胞的增殖、分化、凋亡和发育[18-19],并且miRNA在许多疾病中出现异常表达,这其中就包括癌症[20]。miRNA可作为癌基因或肿瘤抑制基因,在肿瘤发生发展过程中起关键作用[21]。因此,我们猜想氯喹诱导的肝癌细胞的凋亡是否与miRNA相关。miR-26b被认为在细胞中有着广泛的生物学作用,并且近来的研究表明miR-26b在多种肿瘤中的表达都是下调的[22]。Li等人的研究指出,miR-26b通过作用于靶点CD8在乳腺癌细胞中作为肿瘤抑制因子[23]。同样的,miR-26b在肝癌细胞中得表达也是降低的并且能够抑制细胞上皮-间质转化和细胞的增殖[24]。本实验检测了80 mol/L浓度的氯喹作用后肝癌细胞中miR-26b的表达,结果同对照组相比,miR-26b明显升高。这也提示我们氯喹诱导的凋亡可能与miRNA存在一定的关系。
Mcl-1是Bcl-2家族中参与调控细胞凋亡过程的成员之一,在多种肿瘤细胞的凋亡中有着重要作用。Sieghar等人的研究证实与正常肝组织相比,肝癌患者的癌组织标本中Mcl-1的表达也是显著升高的,而相邻的癌旁组织中Mcl-1的表达未见异常[25]。胰腺癌细胞中Mcl-1的表达也是升高的,通过小干扰技术敲除Mcl-1的表达能够增加胰腺癌细胞对吉西他滨的化疗敏感性[26]。以上研究都提示Mcl-1可能成为癌症治疗的潜在靶点。本实验检测了氯喹作用后肝癌细胞中Mcl-1的表达,结果显示Mcl-1蛋白的表达明显下降,转染了miR-26b抑制剂后Mcl-1的表达却升高了。而Jiang等人的研究通过荧光素酶基因报告实验证实了miR-26b其中的一个作用靶点就是Mcl-1。
综上所述,本研究结果证实了氯喹对人肝癌细胞HepG2具有明显的增殖抑制作用,诱导的凋亡也呈浓度依赖性,而机制可能是miR-26b通过作用于潜在靶点Mcl-1实现。目前,一种抗肿瘤新药从研发到临床应用周期长且费用昂贵,体外实验证实氯喹能够促进肝癌细胞的凋亡,这提示我们肿瘤的治疗或许可以将研究方向转向已有的药物。然而,我们在体外实验中所使用的药物浓度要高于氯喹治疗疟疾在体内达到的血药浓度,因此,氯喹能否在临床用于肝癌及其他肿瘤的治疗,还有待进一步的研究。
| [1] |
Zampino R, Marrone A, Restivo L, et al. Chronic HCV infection and inflammation: Clinical impact on hepatic and extra-hepatic manifestations[J].
World J Hepatol, 2013, 5(10): 528-40.
DOI: 10.4254/wjh.v5.i10.528. |
| [2] |
Park IY, Sohn BH, Yu E, et al. Aberrant epigenetic modifications in hepatocarcinogenesis induced by hepatitis B virus X protein[J].
Gastroenterology, 2007, 132(4): 1476-94.
DOI: 10.1053/j.gastro.2007.01.034. |
| [3] |
Liu M, Jiang L, Guan XY. The genetic and epigenetic alterations in human hepatocellular carcinoma: a recent update[J].
Protein Cell, 2014, 5(9): 673-91.
DOI: 10.1007/s13238-014-0065-9. |
| [4] |
Doumbo S, Ongoiba OA, Doumtabé D, et al. Prevalence of Plasmodium falciparum, anemia and molecular markers of chloroquine and sulfadoxine-pyriméthamine resistance in delivered women in Fana, Mali[J].
Bull Soc Pathol Exot, 2013, 106(3): 188-92.
DOI: 10.1007/s13149-013-0301-1. |
| [5] |
Zinn RL, Gardner EE, Dobromilskaya I, et al. Combination treatment with ABT-737 and chloroquine in preclinical models of small cell lung cancer[J].
Mol Cancer, 2013, 12: 16.
|
| [6] |
Mediavilla C, Cabello V, Risco S. SB-334867-A, a selective orexin-1 receptor antagonist, enhances taste aversion learning and blocks taste preference learning in rats[J].
Pharmacol Biochem Behav, 2011, 98(3): 385-91.
DOI: 10.1016/j.pbb.2011.01.021. |
| [7] |
Yamada H, Takahashi N, Tanno S, et al. A selective orexin-1 receptor antagonist, SB334867, blocks 2-DG-induced gastric acid secretion in rats[J].
Neurosci Lett, 2005, 376(2): 137-42.
DOI: 10.1016/j.neulet.2004.11.043. |
| [8] |
张浩轩, 孙小锦, 孙一鸣, 等. 氯喹逆转人鼻咽癌细胞HNE1/DDP的耐药作用[J].
南方医科大学学报, 2015, 35(5): 687-91.
|
| [9] |
Peng PL, Kuo WH, Tseng HC, et al. Synergistic tumor-killing effect of radiation and berberine combined treatment in lung cancer: the contribution of autophagic cell death[J].
Int J Radiat Oncol Biol Phys, 2008, 70(2): 529-42.
DOI: 10.1016/j.ijrobp.2007.08.034. |
| [10] |
He Y, Xu Y, Zhang C, et al. Identification of a lysosomal pathway that modulates glucocorticoid signaling and the inflammatory response[J].
Sci Signal, 2011, 4(180): ra44.
|
| [11] |
张倩雯, 张媛媛, 晁振华, 等. 羟氯喹对人乳腺癌MDA-MB-435细胞增殖及凋亡的影响[J].
中国药理学通报, 2013, 29(11): 1549-53.
DOI: 10.3969/j.issn.1001-1978.2013.11.018. |
| [12] |
Zhang Z, Shen S. Combined low miRNA-29s is an Independent risk factor in predicting prognosis of patients with hepatocellular carcinoma after hepatectomy: a Chinese population-based study[J].
Medicine (Baltimore), 2017, 96(48): e8795.
DOI: 10.1097/MD.0000000000008795. |
| [13] |
Guan H, Li W, Li Y, et al. MicroRNA-93 promotes proliferation and metastasis of gastric cancer via targeting TIMP2[J].
PLoS One, 2017, 12(12): e0189490.
DOI: 10.1371/journal.pone.0189490. |
| [14] |
Chen Q, Ye L, Fan J, et al. Autophagy suppression potentiates the anti-glioblastoma effect of asparaginasein vitroand in vivo[J].
Oncotarget, 2017, 8(53): 91052-66.
|
| [15] |
Kim YS, Lee HJ, Park JM, et al. Targeted molecular ablation of cancer stem cells for curing gastrointestinal cancers[J].
Expert Rev Gastroenterol Hepatol, 2017, 11(11): 1059-70.
DOI: 10.1080/17474124.2017.1356224. |
| [16] |
Xu Z, Yan Y, Zeng S, et al. Reducing autophagy and inducing G1 phase arrest by aloperine enhances radio-sensitivity in lung cancer cells[J]. Oncol Rep, 2017 Jun 19. doi: 10.3892/or.2017.5732.[Epubaheadofprint].
|
| [17] |
Acha-Orbea H, Scarpellino L, Hertig S, et al. Inhibition of lymphocyte mediated cytotoxicity by perforin antisense oligonucleotides[J].
EMBO J, 1990, 9(12): 3815-9.
|
| [18] |
Baffa R, Fassan M, Volinia S, et al. MicroRNA expression profiling of human metastatic cancers identifies cancer gene targets[J].
J Pathol, 2009, 219(2): 214-21.
DOI: 10.1002/path.v219:2. |
| [19] |
Ambros V. MicroRNA pathways in flies and worms: growth, death, fat, stress, and timing[J].
Cell, 2003, 113(6): 673-6.
DOI: 10.1016/S0092-8674(03)00428-8. |
| [20] |
Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers[J].
Nature, 2005, 435(743): 834-8.
|
| [21] |
Braicu OL, Budisan L, Buiga R, et al. miRNA expression profiling in formalin-fixed paraffin-embedded endometriosis and ovarian cancer samples[J].
Onco Targets Ther, 2017, 10: 4225-38.
DOI: 10.2147/OTT. |
| [22] |
Liu H, Chu W, Gong L, et al. MicroRNA-26b is upregulated in a double transgenic mouse model of Alzheimer's disease and promotes the expression of amyloid-β by targeting insulin-like growth factor 1[J].
Mol Med Rep, 2016, 13(3): 2809-14.
DOI: 10.3892/mmr.2016.4860. |
| [23] |
Li J, Li X, Kong X, et al. MiRNA-26b inhibits cellular proliferation by targeting CDK8 in breast cancer[J].
Int J Clin Exp Med, 2014, 7(3): 558-65.
|
| [24] |
Dong N, Xu B, Benya SR, et al. MiRNA-26b inhibits the proliferation, migration, and epithelial-mesenchymal transition of lens epithelial cells[J].
Mol Cell Biochem, 2014, 396(1/2): 229-38.
|
| [25] |
Sieghart W, Losert D, Strommer S, et al. Mcl-1 overexpression in hepatocellular carcinoma: a potential target for antisense therapy[J].
J Hepatol, 2006, 44(1): 151-7.
DOI: 10.1016/j.jhep.2005.09.010. |
| [26] |
Wei SH, Dong K, Lin F, et al. Inducing apoptosis and enhancing chemosensitivity to gemcitabine via RNA interference targeting Mcl-1 gene in pancreatic carcinoma cell[J].
Cancer Chemother Pharmacol, 2008, 62(6): 1055-64.
DOI: 10.1007/s00280-008-0697-7. |
 2018, Vol. 38
2018, Vol. 38

