2. 广州军区广州总医院泌尿外科,广东 广州 510010
2. Department of Urology, General Hospital of Guangzhou Military Area, Guangzhou 510010, China
绝经后骨质疏松是老年妇女常见的骨退行性疾病,主要表现为全身骨量减少,骨的显微结构紊乱导致骨的脆性增加,容易发生骨折,严重影响绝经后妇女的生活质量。雌激素缺乏是导致绝经后骨质疏松的重要因素[1-3]。正常骨量的维持有赖于成骨细胞的骨形成与破骨细胞的骨吸收之间的动态平衡,雌激素缺乏引发骨质疏松的机制多认为是破骨细胞的骨吸收增加,大于骨形成,使骨量丢失,形成高转换型的骨质疏松。雌激素对破骨细胞的作用主要通过雌激素受体介导,增加破骨细胞的凋亡、降低破骨细胞的存活时间以及抑制破骨细胞的分化,雌激素缺乏后对这些破骨细胞的抑制作用减低,因此促进破骨细胞的骨吸收功能[4]。近些年,研究者发现雌激素缺乏还可以降低破骨细胞内抗氧化酶水平,增加活性氧的水平,进而促进炎症因子TNF-α、IL-6等分子表达,从而促进破骨细胞的骨吸收,形成高转换型骨质疏松[5]。然而,关于雌激素对成骨细胞内抗氧化酶表达的影响以及在绝经后骨质疏松中的作用未见报道,因此,本文利用去卵巢骨质疏松模型、体外培养的成骨细胞系和原代成骨细胞等,研究雌激素对成骨细胞内抗氧化酶表达的影响及其在绝经后骨质疏松中的作用,期望为绝经后骨质疏松的发病机制提供新内容。
1 材料和方法 1.1 材料动物:2月龄SPF级雌性SD大鼠24只,体质量180~220 g,未曾交配,购于南方医科大学实验动物中心,实验动物使用许可证号为SYXK粤2006-0015。细胞来源:MC3T3-E1、MG63为本实验室保存,原代成骨细胞(OB)的分离培养参照文献[6-11]进行。主要药品:雌二醇(金耀氨基酸有限公司),ALP试剂盒(碧云天公司),RNA提取试剂盒(Qiagen, Germany),RT-PCR试剂盒(Takara,日本),γ-GCS抗体、β-actin抗体(Santa cruz, CA);鼠二抗(1:3000)、兔二抗(1:3000)抗体购自Cell Signaling Technology;qPCR引物序列的合成于上海Invitrogen Trading(Shanghai)、细胞培养用品(Gaithersburg, MD, USA)。
1.2 方法 1.2.1 造模方法动物适应饲养1周后,随机分为对照组(SHAM组)、去卵巢手术组(OVX组,雌二醇缺乏组)和去卵巢手术+雌二醇治疗组(OVX+E2组),每组8只,模型组和实验组行双侧卵巢切除术,对照组行假手术。以3%戊巴比妥钠按1 mL/kg剂量进行麻醉大鼠,俯卧固定,于髂嵴左右两侧外上方1 cm处切开皮肤,打开腹膜,找到卵巢后结扎,然后完整摘除双侧卵巢,彻底止血后,关腹。对照组打开腹膜后,找到卵巢,不切除,只切除旁边的一小团脂肪。术后,OVX+E2组给予0.2 mg/(kg·3 d)皮下注射苯甲酸雌二醇,连续12周。Sham组和OVX组相应时间皮下注射等量蓖麻油[12-14]。
1.2.2 原代成骨细胞的分离与纯化无菌条件下取出新生鼠的颅盖骨,置入冷PBS中,剔除附着的结缔组织。用PBS液清洗3次,将其置入盛有DMEM培养基的培养皿中,剪成0.5 mm×0.5 mm大小碎块,加入0.25%胰蛋白酶5 mL,置入孵箱中消化20 min,血清终止消化,弃上清液,加入1.0 g/L Ⅰ型胶原酶10 mL,置于孵箱中消化90 min,1000 r/min离心10 min,使细胞沉淀,用PBS洗涤细胞2次,200目滤网过滤去除骨碎片。所沉淀物以含10%胎牛血清、1%双抗的DMEM培养液重悬细胞,吹打均匀,接种到新的培养皿中,于37 ℃,含体积分数5% CO2培养箱培养。48 h后换液,以后隔日换液1次。在原代培养过程中,每48 h换液1次至细胞融合成单层,密度长至80%时,按1:3的比例进行传代培养。将原代培养细胞用0.25%胰酶消化,制成细胞悬液,采用差速贴壁法进行成骨细胞的纯化。
1.2.3 荧光相对定量PCR检测用雌二醇处理MC3T3-E1、MG63及原代成骨细胞(OB)24 h后,用荧光相对定量PCR检测相关基因mRNA水平的变化。先用试剂盒提取RNA,随后用RT-PCR试剂盒进行RT-PCR。PCR程序为:95 ℃ 3 min预变性;95 ℃ 10 s,58 ℃ 30 s,72 ℃ 5 min进行扩增,45个循环;95 ℃ 1 min,58 ℃ 30 s,95 ℃ 30 s,溶解曲线分析。引物序列见表 1。
| 表 1 荧光相对定量PCR引物序列 Table 1 Real-time PCR primer sequences and amplification products |
用雌二醇处理MC3T3-E1、OB 48 h后、MG63细胞24 h后,用Western blot检测γ-GCS蛋白表达。细胞与蛋白裂解液(1:1)混匀。裂解5 min后于96 ℃金属浴裂解30 min,离心取上清进行SDS-聚丙烯酰胺凝胶电泳1.5~2 h(恒流,每块胶16 mA)。将SDS-聚丙烯酰胺凝胶上的蛋白质用Bio-Rad微型电转移系统于4 ℃电转移至硝酸纤维素膜上(NC膜)上。根据蛋白marker的指示将目标蛋白所在范围的膜剪下来,NC膜用去离子水漂洗1次,加入20 mL封闭缓冲液(含0.1% Tween-20的1×TBS和5% w/v脱脂奶粉),室温下封闭1 h,取出用TBST漂洗1次即可进行一抗孵育;一抗孵育过夜,取出用TBST振荡洗膜3次,5 min/次;二抗孵育室温下孵育1 h;25 mL TBST振荡洗膜3次,5 min/次。膜稍沥干后加入化学发光试剂(200 μL /条膜,即A液、B液各100 μL,用前5 min将A、B液混合,利用化学发光仪或者曝光机进行曝光。
1.3 统计学处理实验数据均用SPSS20.0统计软件处理,实验所有数据均用均数±标准差表示。如果方差齐,采用方差分析法进行多组间比较,然后采用LSD法进行两两比较,如果方差不齐,采用Welch法进行多组间比较,然后采用Dunnet's T3法进行两两比较,P < 0.05为差异有统计学意义。
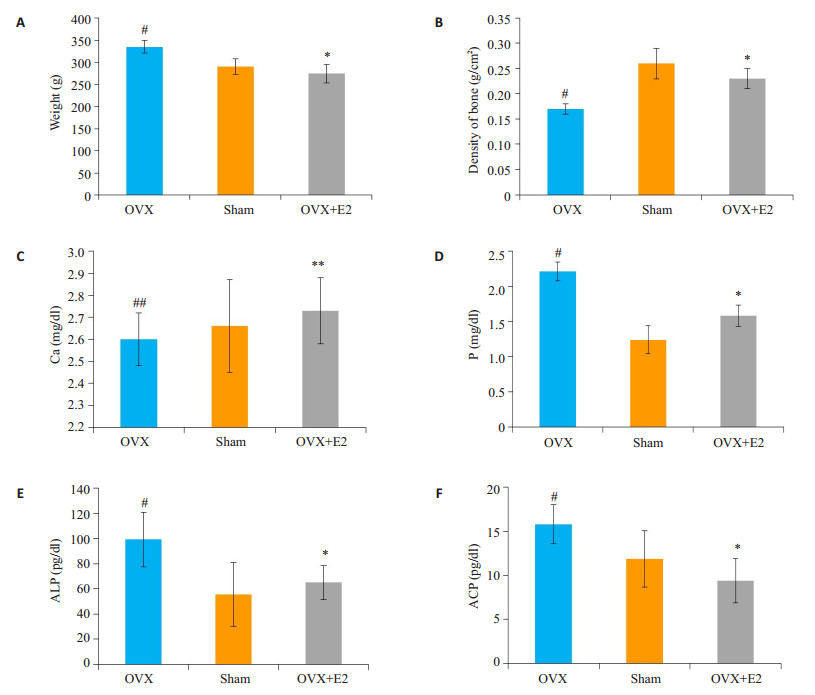
2 结果 2.1 雌二醇外源补充预防去卵巢大鼠骨质疏松造模12周后,用双能X-线吸收仪(SD-1000;Maifu Inc,Beijing)检测骨密度,并收集血清,用生化仪(AU600,Olympous)检测血清生化指标。结果显示,去卵巢手术后大鼠体质量明显增加,骨密度显著降低,血清P、碱性磷酸酶(ALP)、酸性磷酸酶(ACP)显著升高,表明骨质疏松模型构建成功。雌二醇预防性治疗组则逆转这一骨质疏松表型(图 1)。
|
图 1 雌二醇可有效预防去卵巢大鼠骨质疏松发生 Figure 1 Estradiol prevented osteoporosis in ovariectomied rats. A: Body weight; B: Bone density; C: Serum Ca2+; D: Serum P level; E:ALP; F: ACP. (*P < 0.05, OVX+E2 vs OVX; #P < 0.05, OVX vs SHAM; **P>0.05, OVX+E2 vs OVX; ##P>0.05 OVX vs SHAM) |
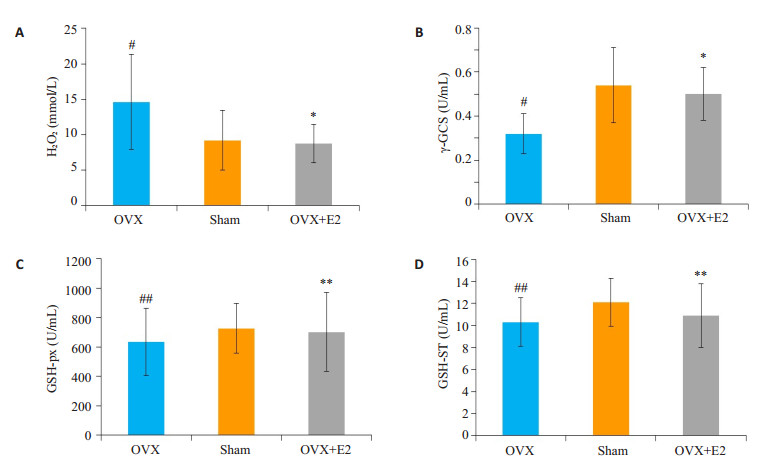
利用南京建成生物有限公司的活性氧及抗氧化酶检测试剂盒(JIAN CHENG,Nanjing,China)检测发现,去卵巢模型组大鼠血清中活性氧H2O2显著升高,抗氧化酶γ-GCS水平显著下降,而GSH-px、GSH-ST水平尽管无显著变化(P>0.05),但都表现出下降趋势。雌二醇预防性治疗后则显著抑制活性氧H2O2水平,升高抗氧化酶γ-GCS水平(图 2)。
|
图 2 雌二醇抑制去卵巢大鼠血清活性氧水平,升高抗氧化酶水平 Figure 2 Estradiol decresed serum H2O2 level and incresed γ-GCS in ovariectomied rats. A:H2O2; B: γ-GCS; C: GSHpx; D: GSH-ST. (*P < 0.05, OVX+E2 vs OVX; #P < 0.05, OVX vs SHAM; **P>0.05, OVX+E2 vs OVX; ##P>0.05, OVX vs SHAM) |
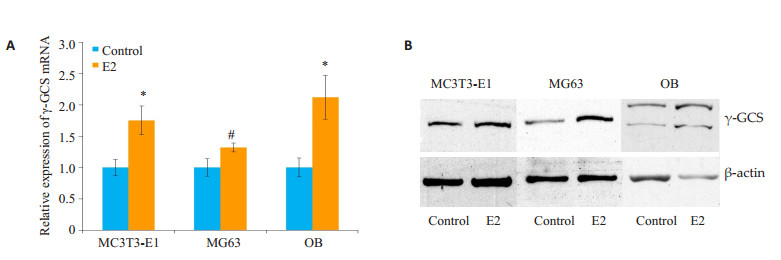
用雌二醇处理MC3T3-E1、MG63及原代成骨细胞(OB)24 h后,用荧光相对定量PCR检测γ-GCS mRNA水平的变化,结果显示,在雌二醇作用后,mRNA的表达显著升高。用雌二醇处理MC3T3-E1和原代成骨细胞(OB)48 h,MG63细胞24 h后用Western blot检测γ-GCS蛋白表达,结果显示,γ-GCS蛋白表达显著升高(P < 0.05,图 3)。
|
图 3 雌二醇上调MC3T3-E1细胞、MG63细胞和OB细胞中γ-GCS的表达 Figure 3 Estradiol up-regulated the expression of γ-GCS mRNA (A) and protein (B) in MC3T3-E1, MG63 and OB cells. *P < 0.01, #P < 0.05 vs control |
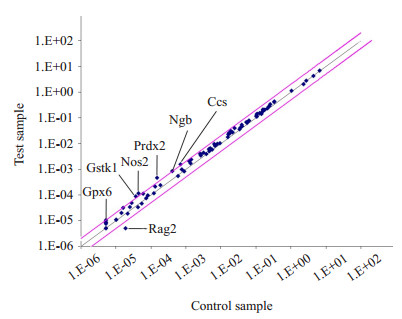
E2处理MC3T3-E1细胞24 h后,用SABiosciences Oxidative Stress and Antioxidant Defense PCR Array(PAMM-065A)筛查MC3T3-E1细胞内84种内源性巯醇抗氧化剂的酶的mRNA水平的变化。结果发现在雌二醇作用后,6种抗氧化酶Gpx6、Gstk1、Nos2、Prdx2、Ngb和Ccs的mRNA表达显著升高(P < 0.05,图 4)。
|
图 4 成骨细胞前体MC3T3-E1细胞利用E2处理后,用SABiosciences芯片筛查细胞内84种氧化应激相关基因的变化 Figure 4 Changes of expressions of 84 oxidative stress related genes detected by SABiosciences microarray in osteoblast precursor MC3T3-E1 cells following treatment with E2 |
雌二醇处理MC3T3-E1、MG63及原代成骨细胞(OB)24 h后,用荧光定量PCR检测Prdx2、Rag2、Ccs、Ngb和Gstk1的mRNA水平的变化。结果显示雌二醇处理后,MC3T3-E1、MG63及原代成骨细胞(OB)内Ccs及Ngb基因均出现显著升高(P < 0.05,图 5)。
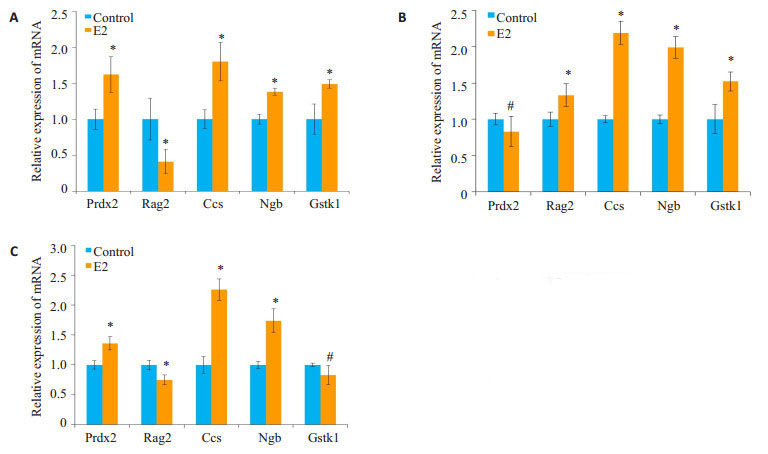
|
图 5 雌二醇对MC3T3-E1、MG63及原代成骨细胞内抗氧化酶表达的影响 Figure 5 Effects of estradiol on the expression of antioxidant enzymes in MC3T3-E1 (A), MG63 (B) and OB (C) cells.*P < 0.05, #P>0.05 vs control |
利用雌二醇(1 nmol/L)和NAC(2 mmol/L)处理MC3T3-E1细胞24、48、72 h后,分别加入CCK8孵育2 h,进行检测。结果显示,雌二醇和NAC均显著促进成骨细胞MC3T3-E1的增殖(P < 0.05,图 6)。
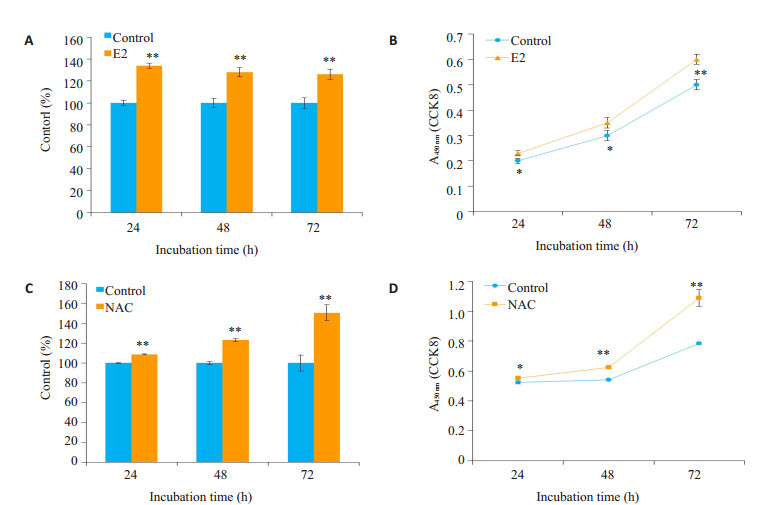
|
图 6 雌二醇及NAC促进成骨细胞前体MC3T3-E1的增殖 Figure 6 Estradiol (A, B) and NAC (C, D) promote the proliferation of MC3T3-E1 cells in vitro. *P < 0.05, **P < 0.01 vs control |
雌激素在绝经后骨质疏松的发病中起到关键的作用。研究表明,在绝经期间,血清雌二醇水平下降率达到85%~90%[15],而给予雌激素替代疗法的绝经后妇女,发生骨质疏松症引起的骨折概率明显下降。雌激素参与骨质疏松的机制并不清楚,但有研究表明,雌激素可通过多种途径参与骨代谢:(1)结合破骨细胞表面受体,下调破骨细胞溶酶体酶活性,抑制骨吸收、降低骨切片凹陷风险;(2)作用于破骨细胞前体,抑制破骨细胞生长、分化,延缓骨量减少进程;(3)结合成骨细胞表面受体,上调胶原酶、细胞因子及生长因子的释放,调节成骨代谢,诱导骨重建等;(4)激活Notch信号通路发挥促进成骨分化、抑制成脂分化的作用;(5)通过促进破骨细胞内抗氧化酶表达,抑制破骨细胞的骨吸收功能[16-21]。然而雌激素对成骨细胞内抗氧化酶表达的影响及其在绝经后骨质疏松中的机制少见报道。
本文首次利用mRNA芯片筛查了雌二醇对成骨细胞前体细胞MC3T3-E1中84种抗氧化酶表达的影响,并利用PCR在多种成骨样细胞进行验证,发现雌二醇能显著上调MC3T3-E1、MG63及原代培养的成骨细胞中抗氧化酶Ccs和Ngb mRNA水平,以及γ-GCS mRNA和蛋白水平。去卵巢骨质疏松动物模型也发现,大鼠血清中活性氧增加,抗氧化酶γ-GCS水平显著下降。造模的同时给予雌激素,则可预防骨质疏松的发生,且显著降低血清活性氧水平,提高抗氧化酶γ-GCS水平。
抗氧化酶具有将体内形成的过氧化物转换为毒害较低或无害的物质的功效,人体代谢会生成抗氧化剂:谷胱甘肽过氧化酶(GSH-PX)、超氧化歧化酶(SOD)等内源性酶系或非酶系。在成长期,这些抗氧化物质在体内合成旺盛,GSH-PX和SOD等抗氧化剂含量很高,能抑制氧自由基产生,平衡人体的代谢,预防眼疾病及各种慢性病[22-25]。γ-GCS,即谷氨酰半胱氨酸合成酶,谷胱氨肽酶(GSH)是细胞内最重要的抗氧化剂,而γ-GCS是其合成的关键酶,是机体重要的抗氧化酶,在氧化还原平衡中起重要作用。GSH-Px,谷胱甘肽过氧化物酶是机体内广泛存在的一种重要的过氧化物分解酶。它能催化GSH生成GSSG,使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2的分解,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。Gstk1基因,编码的蛋白为GSTK1,即谷胱甘肽S-转移酶,属于胱甘肽S-转移酶(GST)超家族,负责脂质过氧化物的解毒[26-27]。Prdx2基因,编码的蛋白为PRDX2,为过氧化物酶2,是抗氧化酶peroxiredoxin家族的一个成员,作用是降低细胞内过氧化氢和烷基氢过氧化物的水平。研究表明PRDX2蛋白可能在细胞中起抗氧化保护作用,可能有助于提高CD8+ T细胞的抗病毒活性,同时具有增殖作用,在癌症的发生发展中起到重要作用[28]。Ccs基因编码的CCS蛋白即铜伴侣超氧化物歧化酶,是一种金属蛋白酶,与铜超氧化物歧化酶(SOD)密切相关[29]。
本文筛选出的这些抗氧化酶究竟在绝经后骨质疏松中起到什么样的作用?在体外的细胞实验中,我们发现雌二醇和抗氧化剂NAC都能显著促进成骨细胞的增殖,因此,绝经后妇女雌激素的缺乏,导致成骨细胞内活性氧水平到升高,降低γ-GCS等抗氧化酶的水平,启动氧化应激信号级联反应,最终抑制成骨细胞的增殖,从而加速骨质疏松的形成。那么哪些信号分子介导了这一反应?这些信号分子对于成骨细胞的分化是否有影响?还需要进一步的实验证实。
综上所述,本文的实验研究表明,绝经后骨质疏松的发生与机体内活性氧水平的升高,抗氧化酶水平的下降密切相关。雌激素可促进成骨细胞内抗氧化酶的表达,促进成骨细胞增殖。雌激素缺乏后,可能通过升高成骨细胞内活性氧水平,降低抗氧化酶水平,启动氧化应激级联反应,进而抑制成骨细胞增殖,从而促进绝经后骨质疏松的发生。这一研究结果对于绝经后骨质疏松发生机制的研究是一个有力的补充。
| [1] |
Rossi F, Perrotta S, Bellini G, et al. Iron overload causes osteoporosis in thalassemia major patients through interaction with transient receptor potential vanilloid type 1 (TRPV1) channels[J].
Haematologica, 2014, 99(12): 1876-84.
DOI: 10.3324/haematol.2014.104463. |
| [2] |
Chen B, Yan YL, Liu C, et al. Therapeutic effect of deferoxamineoniron overload-induced inhibit ion of osteogenesis in a zebrafish model[J].
Calcif Tissue Int, 2014, 94(3): 353-60.
DOI: 10.1007/s00223-013-9817-4. |
| [3] |
Møller AR. Microvascular decompression surgery for disabling positional vertigo and tinnitus[M]. Microvascular Decompression Surgery. Springer Netherlands, 2016: 95-101.
|
| [4] |
李微, 张博, 张雨薇, 等. 雌激素调节骨代谢作用的研究进展[J].
中国骨质疏松杂志, 2017, 23(2): 262-6.
|
| [5] |
Lean JM, Davies JT, Fuller K, et al. A crucial role for thiol antioxidants in estrogen-deficiency bone loss[J].
J Clin Invest, 2003, 112(6): 915-23.
DOI: 10.1172/JCI200318859. |
| [6] |
Yang Y, Zheng X, Li B, et al. Increased activity of osteocyte autophagy in ovariectomized rats and its correlation with oxidative stress status and bone loss[J].
Biochem Biophys Res Commun, 2014, 451(1): 86-92.
DOI: 10.1016/j.bbrc.2014.07.069. |
| [7] |
Chen JR, Shankar K, Nagarajan S, et al. Protective effects of estradiol on ethanol-induced bone loss involve inhibition of reactive oxygen species generation in osteoblasts and downstream activation of the extracellular signal-regulated kinase/signal transducer and activator of transcription 3/receptor activator of nuclear factor-kappa B ligand signaling cascade[J].
J Pharmac Exp Therap, 2008, 324(1): 50-9.
|
| [8] |
Mann V, Huber C, Kogianni G, et al. The antioxidant effect of estrogen and selective estrogen receptor modulators in the inhibition of osteocyte apoptosis in vitro[J].
Bone, 2007, 40(3): 674-84.
DOI: 10.1016/j.bone.2006.10.014. |
| [9] |
Clarke BL, Khosla S. Physiology of bone loss[J].
Radiol Clin North Am, 2010, 48(3): 483.
DOI: 10.1016/j.rcl.2010.02.014. |
| [10] |
Murakami K, Kobayashi Y, Uehara S, et al. A Jak1/2 inhibitor, baricitinib, inhibits osteoclastogenesis by suppressing RANKL expression in osteoblasts in vitro[J].
PLoS One, 2017, 12(7): e0181126.
DOI: 10.1371/journal.pone.0181126. |
| [11] |
Mattinzoli D, Messa P, Corbelli AA, et al. Application of retinoic acid to obtain osteocytes cultures from primary mouse osteoblasts[J].
J Visualized Exp, 2014, 47(87): e51465.
|
| [12] |
黄国钧, 黄勤挽.
医药实验动物模型:制作与应用[M]. 北京: 化学工业出版社, 2008.
|
| [13] |
Dabbaghmanesh MH, Noorafshan A, Talezadeh P, et al. Stereological investigation of the effect of Elaeagnus angustifolia fruit hydroalcoholic extract on osteoporosis in ovariectomized rats[J].
Avicenna J Phytomed, 2017, 7(3): 261-74.
|
| [14] |
Zhang Z, Liu J, Veldhuis-Vlug AG, et al. Effects of chronic estrogen administration in the ventromedial nucleus of the hypothalamus (VMH) on fat and bone metabolism in ovariectomized rats[J].
Endocrinology, 2016, 157(12): 4930-42.
DOI: 10.1210/en.2016-1481. |
| [15] |
范金柱, 杨柳, 罗卓荆, 等. 雌激素对绝经后骨质疏松患者骨髓间充质干细胞Notch信号通路的影响[J].
中华骨质疏松和骨矿盐疾病杂志, 2013, 6(3): 232-9.
|
| [16] |
Prestwood KM, Pilbeam CC, Burleson JA, et al. The short-term effects of conjugated estrogen on bone turnover in older women[J].
Clin Endocrinol Metab, 1994, 79(8): 366-71.
|
| [17] |
Foundation NO. Clinician's guide to prevention and treatment of osteoporosis[J].
National Osteoporosis Foundation, Washington, DC, USA, 2014.
|
| [18] |
Melton IL, Chrischilles EA, Cooper C, et al. Perspective:how many women have osteoporosis[J].
Bone Miner.Res, 1992, 7(4): 1005-10.
|
| [19] |
Vega D, Maalouf NM, et al. The role of receptor activator of nuclear factor-kappa B(RANK)/RANK ligand/osteoprogerin:clinical implications[J].
Clin Endocrinol Metab, 2007, 92(4): 4514-21.
|
| [20] |
Cruccu G, Finnerup NB, Jensen TS, et al. Trigeminal neuralgia New classifcation and diagnostic grading for practice and research[J].
Neurology, 2016, 87(2): 220-8.
DOI: 10.1212/WNL.0000000000002840. |
| [21] |
Huang H, Wang Z, Ma Y, et al. Analysis of magnetic resonance tomographic angiography false negatives intrigeminal neuralgia before microvascular decompression[J].
Oral Radiol, 2017, 33(1): 45-50.
DOI: 10.1007/s11282-016-0247-7. |
| [22] |
宋健, 吴超然, 赵强, 等. 去卵巢小鼠骨质疏松症与骨内血管关系研究[J].
现代仪器与医疗, 2017, 23(4): 12-13.
|
| [23] |
张笑天, 郑晓瑛. 氧化自由基清除剂超氧化物歧化酶与疾病[J].
中国公共卫生, 2014, 30(10): 1349-52.
DOI: 10.11847/zgggws2014-30-10-38. |
| [24] |
周亚军, 殷冬梅, 沙宝熙, 等. 雌二醇β-estradiol促进鼠纤维肝及氧化压力下培养的肝细胞中GPx的活性[J].
南通医学院学报, 2003, 23(4): 363-4.
|
| [25] |
Morel F, Rauch C, Petit E, et al. Gene and protein characterization of the human glutathione S-transferase kappa and evidence for a peroxisomal localization[J].
J Biol Chem, , 279(16): 16246-53.
DOI: 10.1074/jbc.M313357200. |
| [26] |
Li J, Xia ZX, Ding JP. Thioredoxin-like domain of human kappa class glutathione transferase reveals sequence homology and structure similarity to the theta class enzyme[J].
Protein Science, 2005, 14(9): 2361-9.
DOI: 10.1110/(ISSN)1469-896X. |
| [27] |
Liu ML, Chen HZ, Wei L, et al. Endoplasmic reticulum (ER) localization is critical for DsbA-L protein to suppress ER stress and adiponectin down-regulation in adipocytes[J].
J Biol Chem, 2015, 290(16): 10143-8.
DOI: 10.1074/jbc.M115.645416. |
| [28] |
Pahl P, Berger R, Hart I, et al. Localization of TDPX1, a human homologue of the yeast thioredoxin-dependent peroxide reductase gene(TPX), to chromosome 13q12[J].
Genomics, 2015, 26(3): 602-6.
|
| [29] |
Fukai T, Ushio-Fukai M. Superoxide dismutases: role in redox signaling, vascular function, and diseases[J].
Antioxid Redox Signal, 2011, 15(6): 1583-606.
DOI: 10.1089/ars.2011.3999. |
 2018, Vol. 38
2018, Vol. 38

