胶质细胞瘤(Glioma)是最常见的中枢神经系统肿瘤,具有增殖速度快、复发率高的特点[1],高级别胶质瘤综合治疗后平均生存期仍只有14个月[2]。促红细胞生成素(EPO)是一种调节红细胞生成的糖蛋白激素[3]。近二十年,研究发现EPO不仅存在于血液系统,在神经系统、心、乳腺等组织器官中也有表达[4-5]。国内外研究学者最新研究发现,EPO及其受体也表达于胶质瘤、乳腺癌、结肠癌等恶性肿瘤组织中,对肿瘤的发生与发展发挥着促进作用[6]。本课题组前期研究也发现,EPO具有促进胶质母细胞瘤增殖的作用[7],但目前其具体的机制尚不明确。Akt是一种在细胞存活和凋亡中起重要作用的蛋白激酶,Akt信号通路是体内重要的细胞生存通路之一,该通路与胶质瘤细胞的增殖和存活相关[8-9]。其下游靶蛋白细胞周期素D1(cyclinD1)是细胞周期中最为关键的调控蛋白之一,在肿瘤增殖的调节中发挥重要作用[10]。本文旨在研究Akt通路及下游cyclinD1蛋白在促进胶质瘤增殖过程中发挥的作用,探讨EPO促进胶质瘤快速增殖的潜在机制,为基于EPO肿瘤生物化学作用的药物的开发与临床应用提供基础依据。
1 材料和方法 1.1 材料BALB/c-nu小鼠(中国华阜康),EPO(中国金坦),Akt抑制剂(美国SIGMA),SABC免疫组化试剂盒(博士德),CCK-8试剂盒(美国VAzyme),Western blot试剂(碧云天),p-Akt抗体、cyclinD1抗体、EPO抗体(美国abcam)。
1.2 HE染色随机选取术后病理检验结果为WHO分级Ⅰ、Ⅱ、Ⅲ、Ⅳ级的新发病例各10例,肿瘤标本制成石蜡切片,常规二甲苯脱蜡,酒精梯度水化,苏木素液染色,盐酸酒精分化,氨水返蓝,伊红液染色,酒精脱水后中性树脂封片。
1.3 免疫组化法检测蛋白表达使用所选WHO分级为Ⅰ、Ⅱ、Ⅲ、Ⅳ级的切片各10例,采用免疫组化试剂盒,常规二甲苯脱蜡,酒精梯度水化,内源性过氧化物酶灭活,抗原修复,Triton-100增加细胞通透性,山羊血清封闭,一抗4 ℃孵育过夜,酶标二抗37 ℃孵育1 h,DAB显色,苏木素复染,盐酸酒精分化,氨水返蓝,酒精梯度脱水后中性树脂封片。
1.4 建立裸鼠皮下移植瘤模型并观察记录数据SPF条件下裸鼠适应性饲养两周后,于裸鼠后颈部行皮下注射107/mL细胞悬液150 μL,将裸鼠编号并随机分为对照组和EPO处理组,每组10只,分别每隔1 d采用腹腔注射方式给予生理盐水或5000 U/kg的EPO处理。从注射后第5天起每隔5 d对裸鼠称重并测量记录肿瘤长径(a)和短径(b),根据公式V=ab2/2计算肿瘤体积,25 d后处死裸鼠,剥取肿瘤,测瘤质量。
1.5 细胞培养及分组U87细胞用含10%胎牛血清DMEM高糖培养基,加入双抗(青霉素-链霉素溶液100:1)在37 ℃、5% CO2湿润孵育箱培养。对照组:在细胞培养基中加入PBS液20 μL;EPO处理组:在细胞培养基中加入PBS配制的EPO(0.1 U/mL,20 μL)处理;EPO+Akt抑制剂组:细胞培养基中加入EPO(0.1 U/mL,10 μL)及PBS配制的Akt抑制剂(100 μmol,10 μL)处理,连续处理5 d后,显微镜下观察,取光镜下照片。
1.6 Western blot检测蛋白表达采用WB试剂盒,分别提取分组处理5 d的各组皮下成瘤瘤体及体外实验细胞的总蛋白,每泳道上样50 µg凝胶电泳,PVDF膜转膜,室温封闭2 h,一抗4 ℃孵育过夜,HRP标记的二抗于37 ℃孵育2 h,ECL显色拍照[11]。
1.7 CCK8法测细胞生长曲线采用CCK-8试剂盒,接种2000/100 μL细胞悬液于5个96孔板,每孔体积100 μL,按上述分组处理5 d,每孔加入10 μL CCK-8溶液处理1 h,酶标仪检测各孔吸光度(A450)。
1.8 克隆形成实验测细胞克隆速度接种500/mL细胞悬液于6孔板,每孔体积1 mL,同上分组处理5 d,培养10~14 d。当肉眼可见细胞克隆团块时停止培养,多聚甲醛固定,结晶紫染色,肉眼在带网格的透明胶片下计克隆数。
1.9 流式细胞术检测细胞周期接种10 000/mL细胞于6孔板,每孔体积1 mL,同前分组处理5 d。-20 ℃预冷的70%乙醇1 mL固定,4 ℃过夜。500 μL PBS液重悬细胞后加入PI和RNase A使浓度为50 μg/mL,37 ℃培养15 min。流式细胞仪检测细胞增殖周期。
1.10 统计学分析计量数据以均数±标准差表示,采用SPSS 19.0统计软件进行单因素方差分析,组间比较采用LSD-t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 免疫组化法检测EPO在人各级别胶质瘤标本中的表达WHOⅠ级胶质瘤有少量EPO表达,WHOⅡ级有一定量EPO表达,WHOⅢ级中EPO表达较WHOⅡ级有所增多,WHO Ⅳ级中EPO表达量最高。根据EPO染色阳性百分比和强度进行评分(IHS),低级别组(WHOⅠ级和WHOⅡ级各10例)和高级别组(WHOⅢ级和WHOⅣ级各10例)胶质瘤之间EPO的表达量差异有统计学意义(P=0.0002,图 1)。
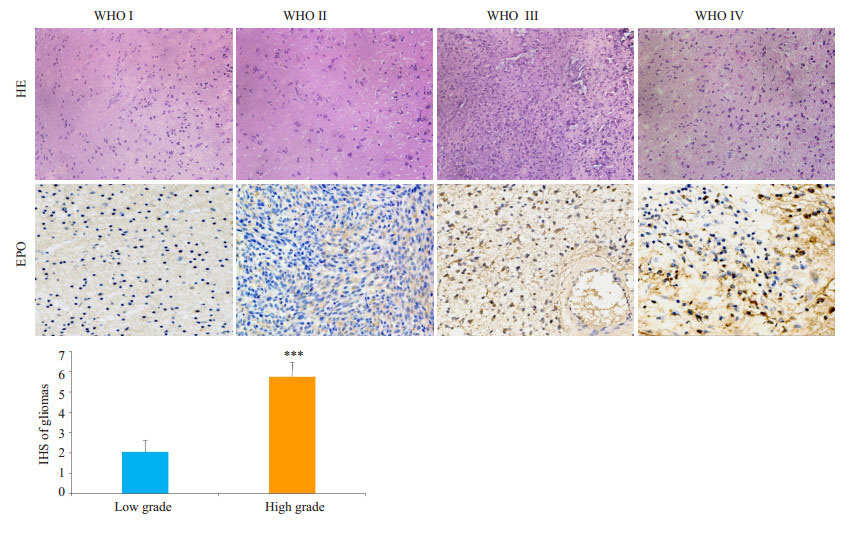
|
图 1 免疫组化检测各级别胶质瘤EPO表达量 Figure 1 Immunohistochemistry for detecting the levels of EPO in different gliomas (Original magnification: × 200). ***P < 0.001 vs low grade. |
对照组肿瘤体积为0.974±0.081 cm3,质量为1.242± 0.158 g,EPO处理组瘤体生长速度明显快于对照组,肿瘤体积为2.234±0.161 cm3(P < 0.0001),质量为2.650± 1.722 g;差异均有统计学意义(P=0.0003,图 2)。
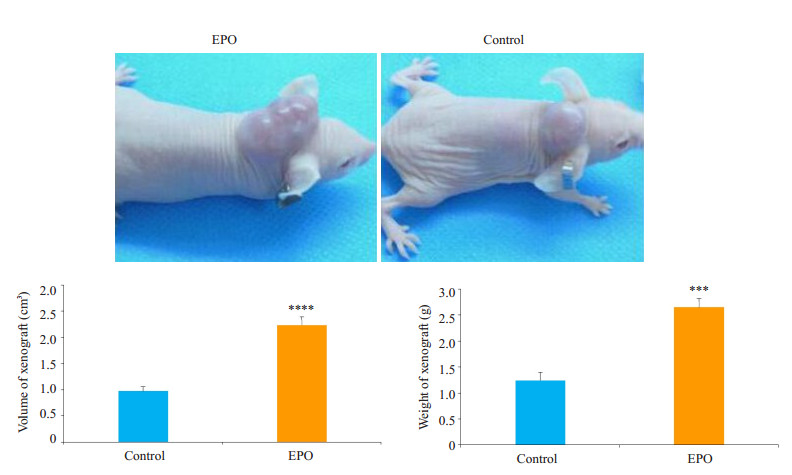
|
图 2 裸鼠成瘤示意图及移植瘤体积和质量的变化 Figure 2 Changes in volume and weight of xenografts in nude mice. ****P < 0.0001 vs control, ***P < 0.001 vs control. |
对照组瘤体中有一定量的EPO蛋白表达;与对照组比较,EPO处理组移植瘤中的EPO蛋白表达明显升高,差异有统计学意义(P=0.0006,图 3)。
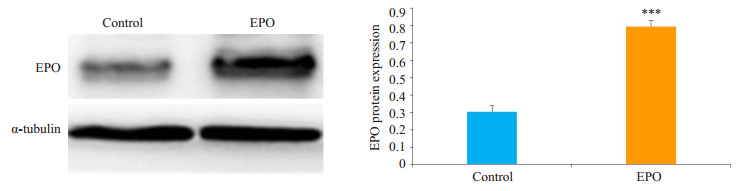
|
图 3 WB方法检测各组移植瘤中EPO的蛋白表达量 Figure 3 Western blotting for detecting EPO expression in the tumor tissue in nude mice. ***P < 0.001 vs control. |
对照组瘤体中有一定量的p-Akt蛋白表达;与对照组比较,EPO处理组中的p-Akt蛋白表达显著升高,差异有统计学意义(P=0.0003,图 4)。
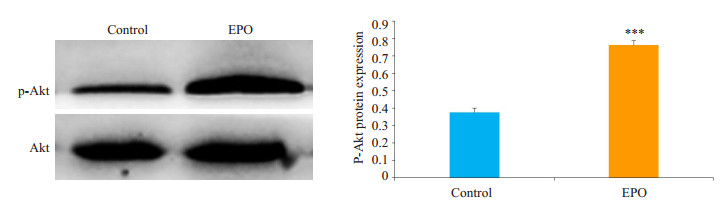
|
图 4 WB方法检测各组移植瘤中p-Akt的蛋白表达量 Figure 4 Western blotting for detecting p-Akt expression in the tumor tissue in nude mice. ***P < 0.001 vs control. |
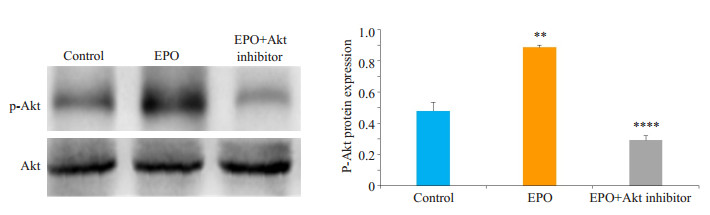
对照组细胞有一定量的p-Akt蛋白表达;EPO处理组较对照组的p-Akt蛋白表达明显升高,差异有统计学意义(P=0.0020);EPO+Akt抑制剂组较EPO处理组p-Akt蛋白表达显著降低,差异有统计学意义(P < 0.0001,图 5)。
|
图 5 WB方法检测各组细胞的p-Akt的蛋白表达量 Figure 5 Western blotting for detecting p-Akt expression in U87 cells. **P < 0.01 vs control, ****P < 0.0001 vs EPO. |
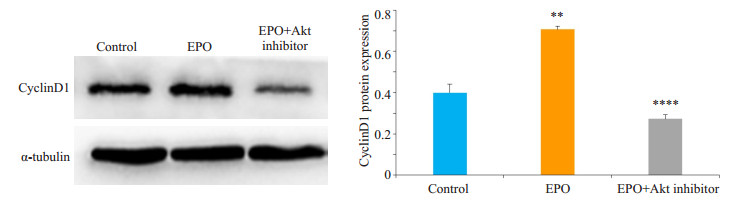
对照组细胞有少量的cyclinD1蛋白表达;与对照组比较,EPO处理组的cyclinD1蛋白表达明显升高并具有统计学意义(P=0.0022);EPO+Akt抑制剂组较EPO处理组cyclinD1蛋白表达显著降低,差异有统计学意义(P < 0.0001,图 6)。
|
图 6 WB方法检测各组细胞的cyclinD1的蛋白表达量 Figure 6 Western blotting for detecting cyclin D1 expression in U87 cells. **P < 0.01 vs control, ****P < 0.0001 vs EPO. |
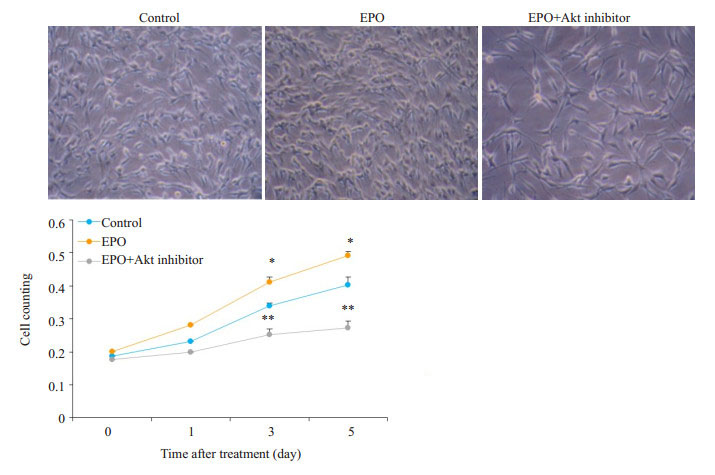
光镜下见,对照组细胞状态良好,分布均匀,贴壁覆盖率约为70%,EPO处理组较对照组细胞数量明显增多,贴壁覆盖率达90%以上,EPO+Akt抑制剂组较EPO组细胞数量明显下降,密度稀疏,贴壁覆盖率不足50%;CCK8法:实验第3天EPO处理组A值较对照组升高,EPO+Akt抑制剂组A值较EPO组下降,差异有统计学意义(PControl-EPO=0.020,PEPO-inhibitor=0.003),第5天此差异进一步扩大,有统计学意义(PControl-EPO=0.028,PEPO-inhibitor=0.001,图 7)。
|
图 7 各组细胞光镜照片及CCK-8法检测各组细胞的生长曲线 Figure 7 Optical microscopy of U87 cells and cell growth curve drawn based on cell counting kit-8 assay (× 200). *P < 0.05 vs control, **P < 0.01 vs EPO. |
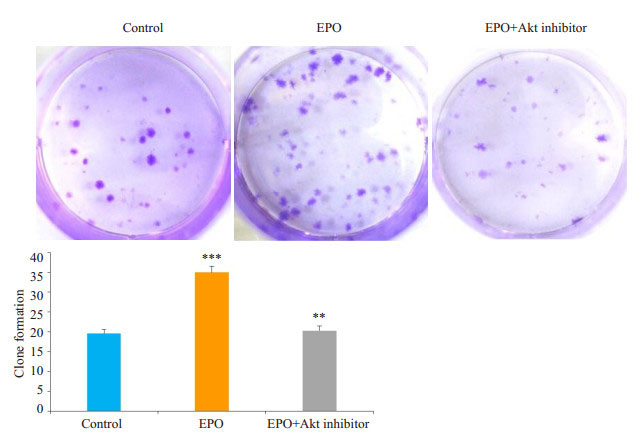
对照组细胞克隆数为19.67±0.88;EPO处理组细胞较对照组明显克隆集落增大、数量增多,为35.00±1.53 (P=0.0010);EPO+Akt抑制剂组形成的集落克隆数较EPO处理组显著减少至20.33±1.20,差异有统计学意义(P=0.0017,图 8)。
|
图 8 各组细胞的平板克隆图及计数比较 Figure 8 Clone formation in U87 cell cultures. ***P < 0.001 vs control, **P < 0.01 vs EPO. |
对照组细胞处于G1期的百分率为79.79%,增殖指数为0.2021±0.9757;EPO处理组G1期的细胞百分率为66.27%,增殖指数为0.3373±1.821,与对照组相比,增殖指数显著升高,差异有统计学意义(P=0.0028);EPO+ Akt抑制剂组处于G1期的细胞百分率为86.34%,增殖指数为0.1931±1.487,与EPO处理组相比增殖指数明显降低并有统计学意义(P=0.0036,图 9)。
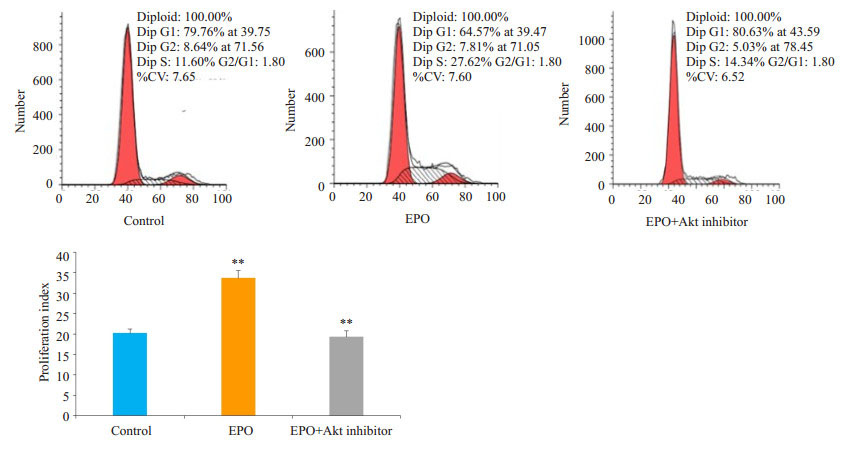
|
图 9 流式细胞仪检测各组细胞的细胞周期变化 Figure 9 Flow cytometric analysis of cell cycle changes in U87 cells. ***P < 0.001 vs control, **P < 0.01 vs EPO. |
胶质细胞瘤是最常见的原发性颅内肿瘤,然而高度恶性的胶质细胞瘤预后极差,胶质母细胞瘤患者的平均生存期只有9~12个月[12-13],因此,有效的胶质母细胞瘤的治疗方法急待研究。EPO首先是作为调节红细胞生成的一种糖蛋白激素为大家所熟知,目前已经发现EPO不仅在肾脏产生,在神经系统组织也有局部的分泌,主要由星形胶质细胞表达和分泌,通过旁分泌和自分泌的形式,发挥着促进细胞增殖、对抗凋亡等重要作用[14-15]。Akt即蛋白激酶B,又称PKB或Rac,在细胞存活和凋亡中起重要作用[16]。Akt信号通路与人类肿瘤的发生发展密切相关,被视为癌细胞存活的首要通路[17]。
在本研究临床实验中,随着标本病理级别的升高,EPO的表达也逐渐升高,尤其在高病理级别组中EPO表达明显高于低级别组,提示EPO与胶质瘤的恶性程度及增殖速度显著相关,但EPO参与胶质瘤恶性生物学特征的分子机制尚不清楚。已有研究指出,EPO通过多种途径及Akt等相关信号通路参与调控肿瘤细胞的生物学行为,促进肿瘤进展[18-19]。在肾脏中EPO通过JAK2和ERK1/2的磷酸化可使肾癌细胞的细胞周期加快,增殖能力提高[20]。Todaro等[21]在乳腺癌的类干细胞(BCSC)中研究发现EPO可以使p-Akt的表达增加,促使BCSC的增殖、转移和耐药,进而提高BCSC细胞的生存。本研究通过进一步的实验,探讨了EPO在胶质瘤的快速增殖过程中发挥的积极促进作用及具体的信号通路和受体原件。在动物实验中,EPO处理组瘤体中EPO及磷酸化Akt表达显著增高,其瘤体体积、质量也较对照组显著增高,这提示Akt在EPO促进胶质瘤增殖的过程中发挥了重要作用。在体外的细胞生长曲线、克隆形成实验中也发现EPO处理组细胞生长及克隆速度均明显高于对照组,证实了EPO对胶质瘤快速增殖的明显促进作用。体外实验中,在EPO处理组细胞中pAkt蛋白的表达显著高于对照组;而在Akt抑制剂组,不仅p-Akt的表达较EPO组下降,细胞生长速度及克隆速率也明显下降,进一步提示Akt是EPO下游的关键信号通路,EPO促进胶质瘤增殖的作用是通过调节Akt磷酸化水平实现的。
最新研究发现,Akt通过磷酸化作用激活或抑制其下游靶蛋白cyclinD1、NF-κB和p27 Kip1等, 进而调节细胞的增殖、分化、凋亡以及迁移等[23-25]。但在神经系统中,Akt是否受EPO调节,通过其下游靶蛋白cyclinD1,调节细胞的增殖能力,国内外尚未见文献报道。本研究体外实验中,与对照组相比,EPO处理组细胞明显高表达cyclinD1蛋白,增殖周期发现处于G1期的细胞比例减少,S期比例增高,增殖指数显著增高。CyclinD1作为细胞周期中最为关键的调控蛋白,其表达量增高可使细胞从G1期加快进入S期,缩短细胞增殖周期,提高细胞增殖能力,Makito等人研究发现缺氧环境中,EPO能够通过上调cyclinD1加快细胞从G1期进入S期刺激人肾细胞的增殖[22]。在本研究中,Akt抑制剂有效阻断了cyclinD1高表达,增殖指数较EPO处理组明显降低,说明阻断Akt,抑制肿瘤增殖的同时也抑制了EPO对cyclinD1的上调,提示cyclinD1是EPO通过Akt通路促进胶质瘤快速增殖的关键靶点。
综上所述,EPO可通过激活Akt信号通路的磷酸化水平,上调cyclinD1的表达,加速细胞周期,显著促进胶质瘤快速增殖。本研究为进一步探索EPO促进胶质细胞瘤增殖的机制及胶质细胞瘤的治疗提供坚实的理论与实验的依据。
| [1] |
Paw I, Carpenter RC, Watabe K, et al. Mechanisms regulating glioma invasion[J].
Cancer Lett, 2015, 362(1): 1-7.
DOI: 10.1016/j.canlet.2015.03.015. |
| [2] |
Ostrom QT, Gittleman H, Fulop J, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2008-2012[J].
Neuro Oncol, 2015, 17(4): 1-62.
|
| [3] |
Kwon MS, Kim MH, Kim SH, et al. Erythropoietin exerts cell protective effect by activating PI3K/Akt and MAPK pathways in C6 Cells[J].
Neurol Res, 2014, 36(3): 215-23.
DOI: 10.1179/1743132813Y.0000000284. |
| [4] |
Pradeep S, Huang J, Mora EM, et al. Erythropoietin stimulates tumor growth via EphB4[J].
Cancer Cell, 2015, 28(5): 610-22.
DOI: 10.1016/j.ccell.2015.09.008. |
| [5] |
Cohen AL, Colman H. Glioma biology and molecular markers[J].
Cancer Treat Res, 2015, 163: 15-30.
DOI: 10.1007/978-3-319-12048-5. |
| [6] |
Morais C, Johnson DW, Vesey DA, et al. Functional significance of erythropoietin in renal cell carcinoma[J].
BMC Cancer, 2013, 13(1): 14.
DOI: 10.1186/1471-2407-13-14. |
| [7] |
Tang ZH, Sun XC, Huo G, et al. Protective effects of erythropoietin on astrocytic swelling after oxygen-glucose deprivation and reoxygenation: Mediation through AQP4 expression and MAPK pathway[J].
Neuropharmacology, 2013, 67: 8-15.
DOI: 10.1016/j.neuropharm.2012.10.017. |
| [8] |
Gu XE, Yao LF, Ma GD, et al. TCTP promotes glioma cell proliferation in vitro and in vivo via enhanced beta-catenin/TCF-4 transcription[J].
Neuro Oncol, 2014, 16(2): 217-27.
DOI: 10.1093/neuonc/not194. |
| [9] |
Fang M, Wei JL, Tang B, et al. Neuroligin-1 knockdown suppresses seizure activity by regulating neuronal hyperexcitability[J].
Mol Neurobiol, 2016, 53(1): 270-84.
DOI: 10.1007/s12035-014-8999-8. |
| [10] |
Ma JF, Cui B, Ding XL, et al. Over-Expression of cyclin D1 promotes NSCs proliferation and induces the differentiation into astrocytes via Jak-STAT3 pathways[J].
Neurochem Res, 2015, 40(8): 1681-90.
DOI: 10.1007/s11064-015-1635-9. |
| [11] |
唐兆华, 廖正步, 石全红, 等. p38信号通路对大鼠脑创伤后MMP-9的表达及脑水肿形成的影响[J].
南方医科大学学报, 2012, 32(7): 928-31.
|
| [12] |
唐兆华, 廖正步, 谢延风, 等. P38信号通路在星形胶质细胞氧糖剥夺/复氧后水通道蛋白4表达及细胞水肿形成中的作用[J].
南方医科大学学报, 2012, 32(2): 141-5.
|
| [13] |
Cui Y, Yang F, He L. Cytokine-induced killer cells induce apoptosis and inhibit the Akt/nuclear factor-κB signaling pathway in cisplatinresistant human glioma U87MG cells[J].
Mol Med Rep, 2015, 12(5): 7027-32.
DOI: 10.3892/mmr.2015.4236. |
| [14] |
Pérès EA, Gérault AN, Valable S, et al. Silencing erythropoietin receptor on glioma cells reinforces efficacy of temozolomide and Xrays through senescence and mitotic catastrophe[J].
Oncotarget, 2015, 6(4): 2101-19.
|
| [15] |
Lamanuzzi A, Saltarella I, Ferrucci A, et al. Role of erythropoietin in the angiogenic activity of bone marrow endothelial cells of MGUS and multiple myeloma patients[J].
Oncotarget, 2016, 7(12): 14510-21.
|
| [16] |
Balca-Silva J, Matias D, Do Carmo A, et al. Tamoxifen in combination with temozolomide induce a synergistic inhibition of PKC-pan in GBM cell lines[J].
Biochim Biophys Acta, 2015, 1850(4): 722-32.
DOI: 10.1016/j.bbagen.2014.12.022. |
| [17] |
Zhao L, Wang Y, Xue Y, et al. Critical roles of chemokine receptor CCR5 in regulating glioblastoma proliferation and invasion[J].
Acta Biochim Biophys Sin (Shanghai), 2015, 47(11): 890-8.
DOI: 10.1093/abbs/gmv095. |
| [18] |
Chen X, Wang CC, Song SM, et al. The administration of erythropoietin attenuates kidney injury induced by ischemia/ reperfusion with increased activation of Wnt/beta-catenin signaling[J].
J Formos Med Assoc, 2015, 114(5): 430-7.
|
| [19] |
Shi L, Fei X, Wang Z, et al. PI3K inhibitor combined with miR-125b inhibitor sensitize TMZ-induced anti-glioma stem cancer effects through inactivation of Wnt/β-catenin signaling pathway[J].
In Vitro Cell Dev Biol Anim, 2015, 51(10): 1047-55.
DOI: 10.1007/s11626-015-9931-x. |
| [20] |
Miller JL, Church TJ, Leonoudakis DA, et al. Discovery and characterization of nonpeptidyl agonists of the Tissue-Protective erythropoietin receptor[J].
Mol Pharmacol, 2015, 88(2): 357-67.
DOI: 10.1124/mol.115.098400. |
| [21] |
Todaro M, Turdo A, Bartucci M, et al. Erythropoietin activates cell survival pathways in breast cancer stem-like cells to protect them from chemotherapy[J].
Cancer Res, 2013, 73(21): 6393-400.
DOI: 10.1158/0008-5472.CAN-13-0248. |
| [22] |
Miyake M, Goodison S, Lawton A, et al. Erythropoietin is a JAK2 and ERK1/2 effector that can promote renal tumor cell proliferation under hypoxic conditions[J].
J Hematol Oncol, 2013, 6: 65.
DOI: 10.1186/1756-8722-6-65. |
| [23] |
Lee JY, Lee NK. Up-regulation of cyclinD1 and Bcl2A1 by insulin is involved in osteoclast proliferation[J].
Life Sci, 2014, 114(2): 57-61.
DOI: 10.1016/j.lfs.2014.07.006. |
| [24] |
Ni WM, Fang Y, Tong L, et al. Girdin regulates the migration and invasion of glioma cells via the PI3K-Akt signaling pathway[J].
Mol Med Rep, 2015, 12(4, A): 5086-92.
DOI: 10.3892/mmr.2015.4049. |
| [25] |
Zhang MJ, Liu YH, Gao Y, et al. Silibinin-induced glioma cell apoptosis by PI3K-mediated but Akt-independent downregulation of FoxM1 expression[J].
Eur J Pharmacol, 2015, 765: 346-54.
DOI: 10.1016/j.ejphar.2015.08.057. |
 2018, Vol. 38
2018, Vol. 38

