口腔鳞状细胞癌是头部癌症中高发的肿瘤之一,目前治疗的方式主要包括放疗、化疗或手术等,但治疗效果仍然不佳,特别是舌癌,5年生存率仅为50%左右[1-2]。由于舌癌处于特殊的位置,导致手术困难,放疗和化疗毒副作用较大且易复发,因此我们需要寻找一种更加有效的药物或治疗策略去弥补或改善现有治疗的不足。
虫草素(又名3′-脱氧腺苷)是一种从虫草属真菌中分离的中药单体,具有抗菌消炎、提高免疫力、抗肿瘤、抗衰老等多种功能,同时作为植物源药物,具有低毒、低残留等优点。近年来,虫草素的抗肿瘤作用很受关注,国内外的实验研究发现虫草素参与多种分子生化过程,比如:肿瘤细胞凋亡[3], 增殖[4]和侵袭[5]以及炎症反应[6]等。虫草素已被验证对舌癌细胞有一定促凋亡作用[7],但其机制尚未阐明。因此,本实验主要探索虫草素对舌癌TCA-8113细胞的影响及相关机制。
1 材料和方法 1.1 材料人舌癌细胞株TCA-8113,购自上海美轩生物科技有限公司。虫草素(大连美伦),胎牛血清、RPMI 1640培养基(Gibco),CCK-8、Annexin V-FITC/PI试剂盒、凋亡及周期检测试剂盒(碧云天),PCR引物(上海生工),active caspase-3,Cleaved caspase-9,Bcl-2、Bax、LC-3β,P62,p-mTOR, AMPK(abcam)。
CO2培养箱(Thermo),MultiSkan3酶标仪(thermo),普通光学倒置显微镜(Nikon),FACS Calibur流式细胞仪(BD),荧光定量PCR仪(ABI)。
1.2 方法 1.2.1 细胞培养舌癌细胞株TCA-8113在含10%胎牛血清的RPMI 1640培养液中培养,每1~2 d进行细胞传代,后续实验均取对数生长期细胞进行实验。
1.2.2 CCK-8法细胞增殖检测将TCA-8113细胞,经胰酶消化、重悬,按照每孔5×103细胞接种于96孔板中,设置5个复孔,贴壁后加入含虫草素的培养基,浓度分别为0.125、0.25、0.5、1、2、4、8、16 mg/mL,另设置不加药物的阴性对照组和只加培养基的空白对照组。加药后分别继续培养24 h、48 h,每孔加入10 μL CCK-8溶液,培养箱内孵育2 h,用酶标仪在A450 nm处测定吸光度。计算细胞抑制率:
抑制率=(阴性对照组A450 nm-实验组A450 nm)(/阴性对照组A450 nm-空白对照组A450 nm)×100%。用SPSS17.0统计软件计算IC50值。
1.2.3 Annexin V-FITC/PI双染色法细胞凋亡检测取Tca8113细胞按每孔含5×105细胞接种于6孔板中,细胞贴壁后,更换含虫草素培养基,浓度分别为0.25、1、4 mg/mL,同时设置不含药的阴性对照,继续培养48 h。将细胞制成单细胞悬液,用Annexin V-PI双染试剂盒染色,上流式细胞仪检测。实验重复至少3次。
1.2.4 流式细胞仪细胞周期检测分组及加药情况同1.2.3,培养48 h后收集细胞,用预冷的70%乙醇固定细胞过夜,PBS洗1次后加入PI的染色液(含RNase A) 0.5 mL,37 ℃避光温浴30 min随后冰浴放置,上流式细胞仪检测。实验重复3次。
1.2.5 实时荧光定量PCR检测 1.2.5.1 引物合成引物由生工生物工程(上海)股份有限公司合成,引物序列见表 1。
| 表 1 待测基因引物序列 Table 1 Primer sequences of the target genes in RT-PCR |
分组及加药情况同1.2.3,抽提各组细胞总RNA。按照TaKaRa的逆转录试剂盒说明书将提取的RNA反转录成cDNA,用SYBR Green Ⅰ染料法在7300仪器(ABI)中反应,引物见上表。设置GAPDH基因为内参对照,以2-△△Ct法分析细胞中相关基因的mRNA表达水平。
1.2.6 Western blot检测分组及加药情况同1.2.3,提取各组细胞的总蛋白,采用BCA蛋白定量试剂盒(索莱宝)测定蛋白浓度。SDS-PAGE电泳,转膜,封闭1 h后,按照1:1000的稀释比例加入一抗(caspase-3,caspase-9,Bcl-2或Bax),4 ℃孵育过夜;洗膜后加二抗,室温孵育2 h;洗膜、曝光显影。采用IPP6.0软件分析目标蛋白表达水平。
1.2.7 免疫组化检测分组及加药情况同1.2.3,铺板前将无菌盖片放入6孔板内,将细胞接种生长,加含药培养基培养48 h后,用4%多聚甲醛固定。羊血清封闭切片,37 ℃约20 min,按照1:100稀释比例加入一抗(LC-3β,P62,p-mTOR, AMPK),4 ℃过夜。洗片后加入HRP标记的二抗,37 ℃ 40 min。DAB显色,苏木素复染,封片。光镜下观察,采用image Pro图像分析处理系统进行分析。
1.2.8 统计学处理统计数据皆采用均数±标准差表示,统计学分析采用SPSS 17.0软件,采用单因素方差分析法进行组间比较,采用SNK法进行两两比较。P < 0.05为差异有统计学意义。
2 结果 2.1 虫草素抑制TCA-8113细胞增殖CCK-8结果表明虫草素可明显抑制TCA-8113细胞增殖,并呈现剂量、时间依赖性(图 1)。虫草素对TCA-8113细胞作用24 h时IC50(半数抑制浓度)为3.548 mg/mL;48H时IC50为1.185 mg/mL。
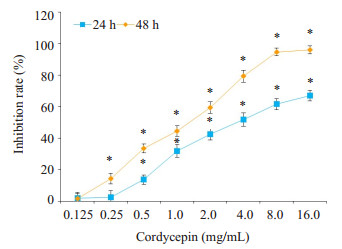
|
图 1 虫草素对TCA-8113细胞增殖的影响 Figure 1 Effect of cordycepin at different concentrations on the proliferation of TCA-8113 cells (CCK-8 assay). *P < 0.05 vs 0 mol/L. |
流式细胞仪检测结果表明,随着虫草素浓度的升高,G2/M期的细胞比例逐渐减少,而S期的细胞比例逐渐增多,差异有统计学意义(P < 0.05,表 2)。
| 表 2 不同浓度虫草素对TCA-8113细胞周期的影响 Table 2 Cell cycle changes of the cells following treatment with different concentrations of cordycepin |
TCA-8113细胞分别经不同浓度虫草素处理48 h后,通过Annexin V-FITC/PI双染法测定细胞凋亡率,结果显示:浓度为0.25、1、4 mg/mL的虫草素作用于TCA-8113细胞48 h后,早期凋亡与晚期凋亡的细胞总和分别为(17.2±0.75)%、(40.52±3.84)%、(47.03±0.90)%,与对照组(3.43±0.38)%相比,差异具有统计学意义(P < 0.05)。由此可见,虫草素浓度为0~4 mg/mL时,虫草素有显著的促进舌癌细胞凋亡的作用,其诱导作用呈浓度依赖性(图 2)。
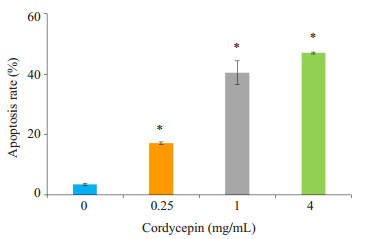
|
图 2 虫草素对TCA-8113细胞凋亡的影响 Figure 2 Effect of cordycepin on apoptosis of TCA-8113 cells analyzed by flow cytometry. *P < 0.05 vs 0 mol/L. |
实时荧光定量PCR和Western blot结果显示,相比较对照组,不同浓度的虫草素促进凋亡相关蛋白Bax的表达量明显升高(P < 0.05),而抗凋亡蛋白Bcl-2的表达量显著降低(P < 0.05);凋亡关键蛋白酶active caspase3和Cleaved caspase9的表达水平均明显高于对照组的表达水平(P < 0.01,图 3)。
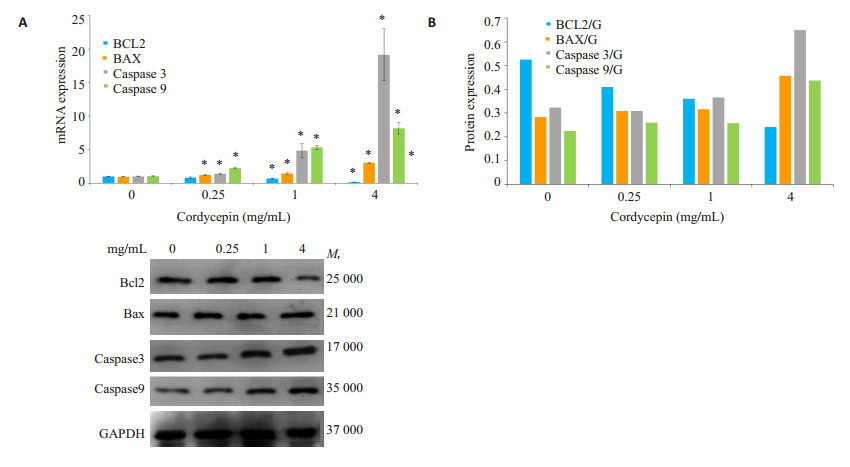
|
图 3 虫草素对TCA-8113细胞Bcl-2、Bax、caspase 3和caspase 9 mRNA和蛋白表达量的影响 Figure 3 Effect of cordycepin on expressions of Bcl-2, Bax, caspase-3 and caspase-9 genes in TCA-8113 cells. A: Analysis of relative expression of mRNA by qRT-PCR (*P < 0.05 vs 0 mg/mL); B: Analysis of the protein expressions by Western blotting. |
免疫组化的实验结果显示虫草素处理细胞48 h后,随浓度增加LC-3β表达呈显著上升趋势(P < 0.05),P62表达呈显著下降趋势(P < 0.05)。同时,相比较对照组,虫草素处理组p-mTOR明显降低(P < 0.05),而AMPK的表达量却显著增加(P < 0.05)。综上所述,结果表明虫草素通过AMPK/mTOR信号通路诱导TCA-8113细胞产生自噬(图 4)。
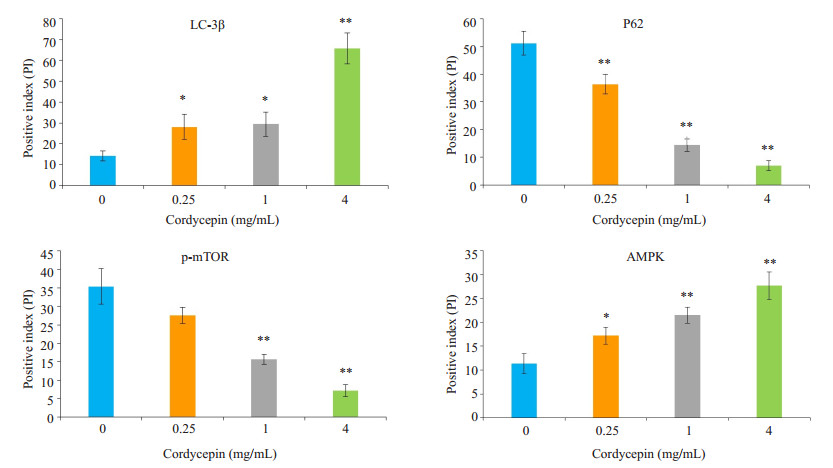
|
图 4 虫草素对TCA-8113细胞LC-3β,P62,p-mTOR和AMPK蛋白表达量的影响 Figure 4 Effect of cordycepin on expressions of LC-3β, P62, p-mTOR and AMPK proteins in TCA-8113 cells detected with immunohistochemistry. *P < 0.05 vs 0 mg/mL; **P < 0.01 vs 0 mg/mL. |
虫草素作为一种活性小分子,抗肿瘤作用已经被广泛报道。研究发现虫草素能抑制舌癌细胞的增殖,促进其凋亡[7],但是虫草素作用舌癌的机制仍然不是很清楚。
本实验室采用CCK-8的方法观察虫草素对TCA-8113细胞的抑制情况,结果发现虫草素对人舌癌细胞TCA-8113有明显的抑制作用,且呈浓度依赖性,提示虫草素有明显的抗肿瘤作用,一致于虫草素对多种肿瘤细胞的研究结果[8-9]。同时,采用流式细胞检测细胞周期,发现细胞周期分布也发生了明显变化,停滞于S期细胞比例明显增加,而进入G2期细胞比例明显减少,且这种阻滞效应呈剂量依赖性,说明虫草素对TCA-8113细胞的抑制作用可能是由于虫草素阻止细胞向G2期转化,从而阻止细胞正常有丝分裂而产生的。
我们采用Annexin V/PI双染的方法检测虫草素作用TCA-8113细胞后的凋亡率,结果说明虫草素对TCA-8113细胞有促进凋亡作用,且伴有剂量依赖性。细胞凋亡即Ⅰ型细胞程序性细胞死亡,是多种基因参与调控的一个复杂过程,主要有两大途径,即线粒体介导的内源性途径和死亡受体介导的外源性途径。研究发现,许多抗肿瘤药物通过线粒体介导的内源性途径诱导细胞凋亡,如氯化两面针碱诱导人骨肉瘤细胞凋亡[10],原花青素诱导人结肠癌细胞凋亡[11]。线粒体介导的内源性途径包括:抑制凋亡因子Bcl-2表达减少,促凋亡因子Bax向线粒体转位,导致线粒体膜的通透性改变,细胞色素C释放至胞浆中,从而激活caspase-9,然后召集并激活caspase-3,进而引发caspases级联反应,激活下游的底物剪切完成而导致细胞凋亡[12-17]。抑制凋亡基因Bcl-2和促凋亡基因Bax之间的比例对维持体内平衡起着重要作用。我们通过PCR和Western blot方法测定BCL-2,BAX,caspase-3和caspase-9表达量,发现虫草素作用于TCA-8113细胞后,Bax基因表达增强,而Bcl-2基因表达减弱,因此使Bax/Bcl-2比例明显增高;caspase-9、caspase-3表达量也明显增多,提示虫草素可以诱导舌癌细胞的凋亡。根据以上实验结果,我们推测虫草素可以促进Bax等促凋亡基因的表达,抑制Bcl-2等抑凋亡基因的表达,激活caspase-9,继而进一步激活caspase-3,引发caspases的级联反应,导致细胞凋亡的发生。虫草素对LNCaP细胞研究也表明虫草素可以诱导肿瘤细胞凋亡[18],与我们的研究结果相似。
自噬又称为Ⅱ型程序性细胞死亡,是将细胞内受损、变形、衰老或失去功能的蛋白质或细胞器以及有毒成分运输到溶酶体,并进行消化和降解的过程。自噬与凋亡之间的关系密切而复杂,外界因素诱导细胞自噬增强,从而促进细胞存活,减少细胞凋亡;当自噬程度超过一定阈值,又可抑制细胞生长,促进细胞凋亡[19-21],二者间的平衡决定了细胞的生长情况,因此寻找自噬和凋亡的动态关系对细胞机制研究有重要意义。
LC3是唯一定位于自噬泡内膜的蛋白,能够与线粒体受体蛋白的区域(LIR)结合,导致线粒体被自噬体囊泡包裹而被降解掉[22-23];P62是评价自噬体降解的指标,能够与LC3相互作用,泛素化过程中引导自噬体进行降解,若自噬发生障碍,聚集在自噬体上的P62不能被降解,P62蛋白水平出现增高[24]。本实验发现虫草素处理舌癌细胞TCA-8113后,随着浓度的增加LC3表达量增加,P62表达量降低,结果提示虫草素可诱导舌癌细胞自噬。
在自噬的信号传导过程中,mTOR作为生长因子信号、应激等传感器,在自噬过程中具有重要作用[25]。Gosner研究发现,mTOR诱导的自噬,可能是通过激活AMPK,磷酸化TCS2,从而抑制mTOR激活因子RHEB,进而抑制mTOR激活[26]。本研究发现虫草素作用TCA-8113细胞后,相比较对照组,实验组AMPK表达量明显升高,mTOR表达量明显降低。据文献报道,在细胞信号通路中AMPK的磷酸化位点在Thr172时对细胞自噬具有促进作用,在一些特定的环境中,AMPK在Ser317和Ser77位点的磷酸化后可直接通过Unc-51样激酶促进自噬的发生[27]。虫草素在诱导自噬的同时促进凋亡的发生,抑制自噬是否可以进一步增敏虫草素对舌癌细胞的杀伤作用,也是未来的一个研究方向。
综上所述,虫草素可抑制TCA-8113细胞增殖,激活内源性凋亡通路,并诱导细胞自噬来发挥抗癌作用,为虫草素应用于舌癌的治疗提供理论基础。
| [1] |
Parkin DM, Bray F, Ferlay J, et al. Global Cancer statistics, 2002[J].
CA Cancer J Clin, 2005, 55(2): 74-108.
DOI: 10.3322/canjclin.55.2.74. |
| [2] |
Sano D, Myers JN. Metastasis of squamous cell carcinoma of the oral tongue[J].
Cancer Metastasis Rev, 2007, 26(3/4): 645-62.
|
| [3] |
Yu XH, Ling JY, Liu XF, et al. Cordycepin induces autophagymediated c-FLIPL degradation and leads to apoptosis in human nonsmall cell lung cancer cells[J].
Oncotarget, 2017, 8(4): 6691-9.
|
| [4] |
Jeong MH, Lee CM, Lee SW, et al. Cordycepin-enriched cordyceps militaris induces immunomodulation and tumor growth delay in mouse-derived breast cancer[J].
Oncol Rep, 2013, 30(4): 1996-2002.
DOI: 10.3892/or.2013.2660. |
| [5] |
Lu H, Li X, Zhang J, et al. Effects of cordycepin on HepG2 and EA. hy926 cells: Potential antiproliferative, antimetastatic and antiangiogenic effects on hepatocellular carcinoma[J].
Oncol Lett, 2014, 7(5): 1556-62.
DOI: 10.3892/ol.2014.1965. |
| [6] |
Park ES, Kang DH, Yang MK, et al. Cordycepin, 3'-deoxyadenosine, prevents rat hearts from ischemia/reperfusion injury via activation of Akt/GSK-3β/p70S6K signaling pathway and HO-1 expression[J].
Cardio Toxic, 2014, 14(1): 1-9.
DOI: 10.1007/s12012-013-9232-0. |
| [7] |
田忠林. 虫草素对舌癌TCA-8113细胞周期和凋亡的影响[J].
中华中医药学刊, 2017, 35(5): 1322-4.
|
| [8] |
Wang D, Zhang Y, Lu J, et al. Cordycepin, a natural antineoplastic agent, induces apoptosis of breast cancer cells via caspasedependent pathways[J].
Nat Prod Commun, 2016, 11(1): 63-8.
|
| [9] |
Shao LW, Huang LH, Yan S, et al. Cordycepin induces apoptosis in human liver cancer HepG2 cells through extrinsic and intrinsic signaling pathways[J].
Oncol Lett, 2016, 12(2): 995-1000.
DOI: 10.3892/ol.2016.4706. |
| [10] |
徐强, 李朝旭, 叶招明. 氯化两面针碱对人骨肉瘤细胞的诱导凋亡作用及其机制[J].
南方医科大学学报, 2011, 31(2): 361-4.
|
| [11] |
Youn-Jung Y, Kim, Hae-Jeong H, et al. Anticancer effects of oligomeric proanthocyanidins on human colorectal cancer cell line, SNU-C4[J].
World J Gastroenterol, 2005, 11(30): 4674-8.
DOI: 10.3748/wjg.v11.i30.4674. |
| [12] |
Chipuk JE, Kuwana T, Bouchier-Hayes L, et al. Direct activation of Bax by p53 mediates mitochondrial membrane permeabilization and apoptosis[J].
Science, 2004, 303(5660): 1010-4.
DOI: 10.1126/science.1092734. |
| [13] |
Adams JM, Cory S. The Bcl-2 apoptotic Switch in cancer development and therapy[J].
Oncogene, 2007, 26(9): 1324-37.
DOI: 10.1038/sj.onc.1210220. |
| [14] |
Fan J, Li R, Zhang R, et al. Effect of Bcl-2 and Bax on survival of side population cells from hepatocellular carcinoma cells[J].
World J Gastroenterol, 2007, 13(45): 6053-9.
DOI: 10.3748/wjg.v13.45.6053. |
| [15] |
周萍, 董晓先, 汤平. 桑根酮C通过激活caspase 3及caspase 9诱导前列腺癌PC3细胞凋亡[J].
南方医科大学学报, 2017, 37(9): 1206-10.
|
| [16] |
Derakhshan A, Chen Z, Van Waes C. Therapeutic small molecules target inhibitor of apoptosis proteins in cancers with deregulation of extrinsic and intrinsic cell death pathways[J].
Clin Cancer Res, 2017, 23(6): 1379-87.
DOI: 10.1158/1078-0432.CCR-16-2172. |
| [17] |
Patmanathan SN, Wang W, Yap LF, et al. Mechanisms of sphingosine 1-phosphate receptor signalling in cancer[J].
Cell Signal, 2017, 34(34): 66-75.
|
| [18] |
Lee HH, Kim SO, Kim GY, et al. Involvement of autophagy in cordycepin-induced apoptosis in human prostate carcinoma LNCaP cells[J].
Environ Toxicol Pharmacol, 2014, 38(1): 239-50.
DOI: 10.1016/j.etap.2014.06.003. |
| [19] |
Rubinstein AD, Kimchi A. Life in the balance -a mechanistic view of the crosstalk between autophagy and apoptosis[J].
J Cell Sci, 2012, 125(Pt 22): 5259-68.
|
| [20] |
Ding WX, Yin XM. Mitophagy: mechanisms, pathophysiological roles, and analysis[J].
Biol Chem, 2012, 393(7): 547-64.
|
| [21] |
李丹, 李翀, 蒋敬庭. 自噬在肿瘤发生与发展中的调控机制[J].
临床肿瘤学杂志, 2013, 18(6): 561-4.
|
| [22] |
Lemasters JJ. Selective mitochondrial autophagy, or mitophagy, as a targeted defense against oxidative stress, mitochondrial dysfunction, and aging[J].
Rejuve Res, 2005, 8(1): 3-5.
DOI: 10.1089/rej.2005.8.3. |
| [23] |
张创杰, 张连峰, 周琳. 自噬相关蛋白Beclin1、LC3和P62在进展期胰腺癌中的表达及临床意义[J].
世界华人消化杂志, 2015, 23(2): 318-23.
|
| [24] |
Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J].
J Biol Chem, 2007, 282(33): 24131-45.
DOI: 10.1074/jbc.M702824200. |
| [25] |
Jung CH, Ro SH, Cao J, et al. mTOR regulation of autophagy[J].
FEBS Lett, 2010, 584(7): 1287-95.
DOI: 10.1016/j.febslet.2010.01.017. |
| [26] |
Gosner KL. A simplified table for staging anuran embryos and larvae with notes on identification[J].
Herpetologica, 1960, 16(3): 183-90.
|
| [27] |
Kim J, Guan KL. Regulation of the autophagy initiating kinase ULK1 by nutrients: roles of mTORC1 and AMPK[J].
Cell Cycle, 2011, 10(9): 1337-8.
DOI: 10.4161/cc.10.9.15291. |
 2018, Vol. 38
2018, Vol. 38

