2. 西安交通大学医学部 临床医学系,陕西 西安 710061
2. Department of Clinical Medicine, Xi'an Jiaotong University Health Science Center, Xi'an 710061, China
糖尿病可导致中枢神经系统并发症,造成认知功能障碍。糖尿病患者中约60%~70%存在轻、中度认知功能障碍[1],主要表现为学习和记忆能力下降,注意力不集中,推理能力下降等症状[2-3]。糖尿病认知功能障碍的发病机制尚未完全明确,但有研究者通过总结发现糖尿病认知功能障碍与高血糖症、胰岛素信号通路异常、氧化应激、电生理缺陷和突触可塑性改变等因素有关[4-5]。
尼可地尔是首个用于临床的ATP敏感性钾通道(KATP通道)开放剂,还具有类硝酸酯和药物预适应的作用[6-7]。KATP通道对调节神经元兴奋性,细胞存活和凋亡具有重要作用。药理性激活KATP通道具有神经保护和抗炎症作用,Gupta等[8]发现尼可地尔能够改善慢性脑灌注不足诱导的血管性痴呆,他们也发现尼可地尔能改善3-硝基丙酸诱导的亨廷顿病,降低学习记忆损伤[9],另有报道表明尼可地尔能通过激活PI3K/Akt信号通路抑制凋亡,从而对深低温低流量诱导的缺血再灌注损伤起到神经保护作用[10]。关于尼可地尔在糖尿病中的应用已有相关研究报道[11-13],但其对糖尿病认知功能障碍是否有保护作用,目前国内外尚未见报道。本研究采用链脲佐菌素(STZ)诱导1型糖尿病小鼠模型,通过Morris水迷宫进行行为学测试,透射电镜观察胰腺和海马超微结构,检测海马中葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)的含量,检测脑组织中超氧化物歧化酶(SOD)活力和丙二醛(MDA)含量,研究尼可地尔是否对STZ诱导的糖尿病认知功能障碍具有保护作用及其相关机制,以期为糖尿病认知功能障碍的防治提供新的靶点。
1 材料和方法 1.1 实验动物18~22 g雄性C57BL/6J小鼠由西安交通大学实验动物中心提供。
1.2 试剂与仪器STZ(sigma-aldrich);柠檬酸和柠檬酸钠(红岩试剂)。尼可地尔片(喜格迈,中外制药);2.5%戊二醛(西安交通大学电镜室);Milliplex MAP试剂盒(Mouse Metabolic Magnetic Bead Panel Milliplex,默克密理博);总超氧化物歧化酶(T-SOD)测试盒和丙二醛(MDA)测试盒(南京建成);血糖以及血糖试纸(瑞迪恩);Morris水迷宫视频分析系统(泰盟科技);H-7650透射电子显微镜(Hitachi)。
1.3 1型糖尿病模型的构建及分组模型的诱导采用多次注射STZ给药法[65 mg/ (kg·d),连续5 d],小鼠选用C57BL/6J雄性小鼠。自由摄食饮水喂养1周,然后随机分为:(1)模型组:禁食不禁水6 h,腹腔注射STZ-柠檬酸缓冲液,1次/d,连续5 d;(2)对照组:禁食不禁水6 h,腹腔注射等量柠檬酸缓冲液,1次/d,连续5 d。
于全部STZ处理后第7天禁食6 h测小鼠血糖,如果空腹血糖高于16.7 mmol/L,则认为造模成功。成模后将模型组分为:(1)模型组(生理盐水灌胃4周。n=10);(2)尼可地尔组[15 mg/ (kg·d),灌胃4周。n=9]。每周最后1 d禁食6 h测小鼠空腹血糖。
1.4 检测指标及方法 1.4.1 行为学测试(Morris水迷宫)由Morris水迷宫评价小鼠的认知功能。该测试历时5 d,4次/d,第1天为适应期。正式实验时将平台置于水池中间,位于水面下2 cm。每次测试的检测时间为90 s,每只小鼠分别从不同象限面朝池壁入水,在平台上停留超过3 s判为成功。小鼠入水至寻台成功的时程记为逃避潜伏期。如果小鼠在此期间未找到平台,将它们放置在平台上10 s,潜伏期记为90 s。逃逸距离,逃避潜伏期和游泳速度由水迷宫软件进行分析。
1.4.2 透射电镜将海马组织及胰腺尾部取下后,切成1 mm×1 mm×1 mm大小的小块,用2.5%戊二醛和2%四氧化锇混合溶液固定。将组织进行梯度脱水,然后用环氧树脂固定。将超薄切片过200目筛。将过筛的切片用醋酸双氧铀和醋酸铅染色,用透射电镜观察并且拍照。
1.4.3 海马组织代谢指标检测检测指标为GIP和GLP-1。按默克密理博Milliplex MAP(Mouse Metabolic Maganetic Bead Panel)试剂盒说明书制备质控品,标准品,洗液和磁珠。在96孔板中设置背景孔、标准品孔、质控品孔和样品孔,每孔加入10 μL缓冲液后分别加入10 μL分析缓冲液、标准品、质控品和样品。每孔加入25 μL磁珠,4 ℃摇床孵育过夜。倒掉孔内的内容物,每孔加入200 μL洗液洗板3次。每孔加入50 μL检测抗体,室温孵育30 min后每孔加入50 μL链霉抗生物素蛋白,继续室温孵育30 min。倒掉孔内的内容物,每孔加入200 μL洗液洗板3次。每孔加入100 μL鞘液,然后在Luminex系统上读板。
1.4.4 脑组织SOD活力和MDA含量检测具体操作参照南京建成T-SOD测试盒(羟胺法)说明书和MDA测试盒(TBA法)说明书。
1.5 统计分析数据统计与分析采用IBM SPSS Statistics 20.0软件,数据用均数±标准误表示。多重比较采用单因素方差分析,水迷宫结果采用重复测量的多因素方差分析,P < 0.05表示差异有统计学意义。
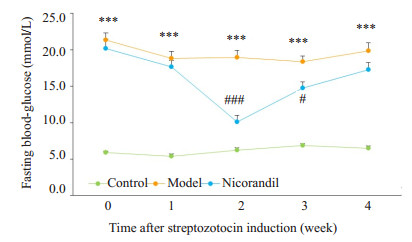
2 结果 2.1 空腹血糖变化情况1型糖尿病小鼠造模成功后,每周监测小鼠血糖变化情况。正常组小鼠空腹血糖维持在正常范围,模型组小鼠空腹血糖显著升高(P < 0.001,与正常组比较)。而尼可地尔组小鼠空腹血糖起伏较大,给药2周后可见空腹血糖降低,但4周后空腹血糖与模型组比较无明显差异,提示尼可地尔对STZ诱导的糖尿病小鼠的空腹血糖影响不大(图 1)。
|
图 1 尼可地尔对STZ诱导的糖尿病小鼠空腹血糖的影响 Figure 1 Effect of nicorandil on fasting blood glucose in mice with STZ-induced diabetes. ***P < 0.001 vs control group; compared with model group, #P < 0.05, ###P < 0.001 vs model group. Control group, n=10; model group, n=10; nicorandil group, n=9. |
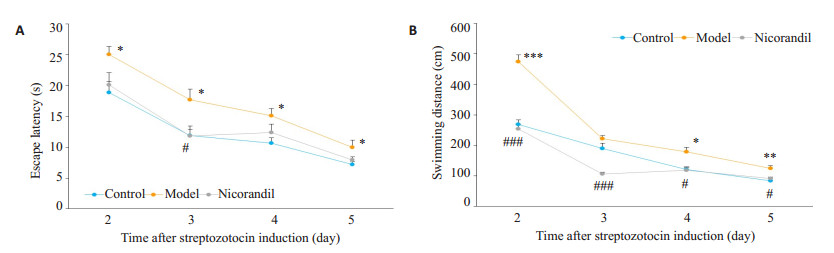
在定向航行实验中,与正常组相比,模型组的逃避潜伏期(P < 0.05)、游泳距离(P < 0.01)均明显增加。提示STZ诱导的糖尿病小鼠出现学习记忆障碍。与模型组相比,尼可地尔组游泳距离明显缩短(P < 0.05),逃避潜伏期有降低趋势,但差异无统计学意义(图 2)。
|
图 2 尼可地尔对STZ诱导的糖尿病小鼠学习记忆的影响 Figure 2 Effect of nicorandil on learning and memory ability of STZ-induced diabetic mice. *P < 0.05 vs control group, **P < 0.01, ***P < 0.001, #P < 0.05, ##P < 0.01, ###P < 0.001 vs model group. Control group, n=10; model group, n=10; Nicorandil group, n=9. |
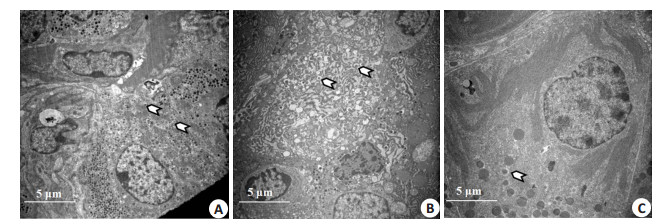
在8000倍电镜下观察(图 3),正常的β细胞包含丰富的胰岛素分泌颗粒,这些颗粒中心具有一个电子致密核,在核周围有一圈清晰的光晕。与正常组相比,模型组胰岛素分泌颗粒降低,且空泡现象增多;与模型组相比,尼可地尔组胰岛β细胞超微结构无明显改善。
|
图 3 尼可地尔对胰岛β细胞超微结构的影响 Figure 3 Effect of nicorandil on ultrastructures of pancreatic β cells (Original magnification: × 8000). The white arrows indicate the insulin secretory granules. A: Control; B: Model; C: Nicorandil. |
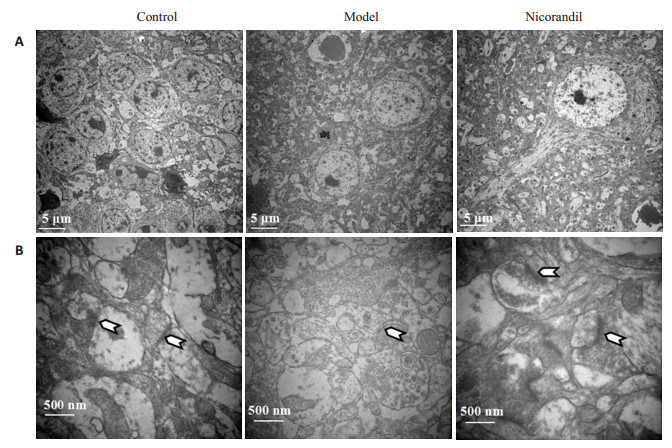
在电镜4000倍和40 000倍下分别观察海马神经元和突触(图 4),与正常组相比,模型组神经元数目减少以及突触数量减少,且突触后致密区(图 4B白色箭头所指部分)变薄;与模型组相比,尼可地尔组神经元结构清晰,可观察到完整的胞体和轴突结构,突触数目增加,突触后致密区变厚。
|
图 4 尼可地尔对海马神经元超微结构的影响 Figure 4 Effect of nicorandil on ultrastructures of the hippocampus. A: Hippocampal neurons (× 4000); B: Hippocampal synapses (×40 000). The white arrows indicate the hippocampal synapses. |
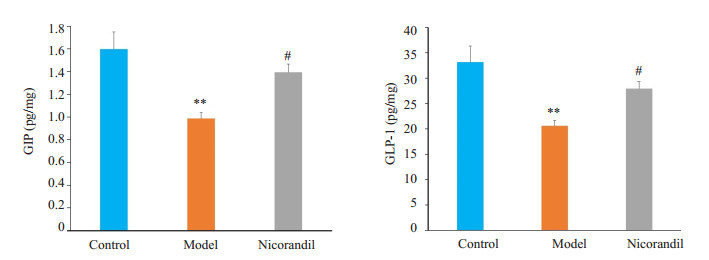
取小鼠海马组织并匀浆后检测GIP和GLP-1的含量。与正常组相比,模型组小鼠海马组织中GIP和GLP-1含量明显降低(P < 0.01)。与模型组相比,尼可地尔组GIP和GLP-1含量显著升高(P < 0.05,图 5)。
|
图 5 尼可地尔对STZ诱导的糖尿病小鼠海马组织中GIP和GLP-1含量的影响 Figure 5 Effect of nicorandil on GIP and GLP-1 contents in the hippocampus of STZ-induced diabetic mice. **P < 0.01 vs control group; #P < 0.05 vs model group. n=6 in each group. |
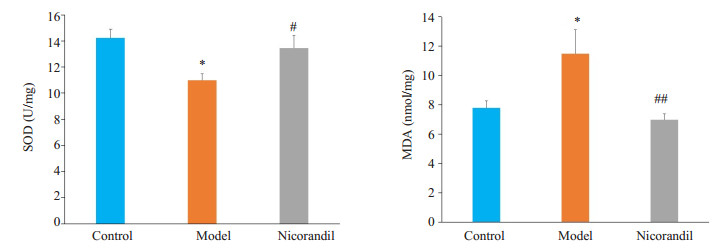
取小鼠脑组织匀浆后检测SOD活力和MDA含量。与正常组相比,模型组脑组织SOD活力下降(P < 0.05),MDA含量升高(P < 0.05)。表明STZ诱导的糖尿病小鼠脑组织氧化应激程度较正常组加深。与模型组相比,尼可地尔显著增强SOD活力(P < 0.05),降低MDA含量(P < 0.01)。提示尼可地尔可改善STZ诱导的糖尿病小鼠脑组织的氧化应激(图 6)。
|
图 6 尼可地尔对STZ诱导的糖尿病小鼠海马组织中SOD活力和MDA含量的影响 Figure 6 Effect of nicorandil on SOD activities and MDA level in the brain tissue of STZ-induced diabetic mice. *P < 0.05 vs control group; #P < 0.05, ##P < 0.01 vs model group. n=5 in each group. |
糖尿病认知功能障碍发病率高,正逐渐成为国内外研究热点。尼可地尔是首个应用于临床的KATP通道开放剂,具有类硝酸酯和药物预适应的作用,临床上主要用于抗心绞痛和相关的心血管保护。关于尼可地尔在糖尿病中的应用已见相关报道[11-15],但目前国内外尚无关于尼可地尔在糖尿病认知功能障碍上的应用的报道。本研究中血糖检测结果和透射电镜观察胰腺的结果显示,尼可地尔并未改善或加剧STZ诱导的糖尿病小鼠的高血糖状态,这可能与不同种类的KATP通道对不同的钾通道开放剂敏感性不同有关。KATP通道由钾通道亚单位Kir6.x(Kir6.1和Kir6.2)和磺酸类调节受体SUR(S包括SUR1、SUR2A和SUR2B)组成,每种组织中Kir6.x和SURs的组合各有特点,其中胰腺为Kir6.2/SUR1的组合[16]。而尼可地尔是SUR2的选择性激活剂,可能并不作用于胰腺β细胞上的钾通道。
本研究中Morris水迷宫结果显示STZ诱导1型糖尿病小鼠模型在Morris水迷宫的学习记忆能力显著降低,主要表现为逃避潜伏期增长和游泳距离延长,显示STZ诱导的糖尿病小鼠出现了认知功能障碍,该结果也与其他相关的报道一致[17-19]。而经尼可地尔干预后的糖尿病小鼠游泳距离明显降低,提示尼可地尔可在一定程度上缓解糖尿病认知功能障碍。海马与学习记忆密切相关,海马结构和功能的完整性对于学习记忆的巩固至关重要。海马主要由齿状回和海马角(CA1区和CA3区)组成。信息由大脑皮层传递到海马齿状回颗粒细胞,然后经轴突传递给CA3锥体细胞,再经轴突投射到CA1锥体细胞,后者将信息发送回内嗅皮质深处,完成海马结构的神经回路[20]。然而海马很容易受到各种病理状态的影响,海马的严重损伤通常会影响记忆的形成。海马的病理改变,包括神经元和突触改变,与认知衰退相关的神经退行性变存在密切联系[21-22]。本研究结果显示,STZ诱导的T1DM糖尿病小鼠海马超微结构受损,突触数目降低且突触后致密区变薄;而尼可地尔可改善STZ诱导的糖尿病小鼠的海马超微结构,增加突触数目,使突触后致密区变厚。
GIP和GLP-1是两个主要的肠促胰岛素,在进食后,这类激素能够葡萄糖浓度依赖性的刺激β-细胞分泌胰岛素[23-24]。在与学习记忆密切相关的海马中广泛分布着GIP和GLP-1受体。GIP和GLP-1在突触可塑性的控制和记忆形成中发挥着重要作用,GIP和GLP-1类似物能够抑制阿尔兹海默症患者的记忆障碍,以及其他神经退行性变中的认知功能障碍[25-26]。本研究检测海马组织中GIP和GLP-1含量,结果显示,与正常组相比,STZ诱导的1型糖尿病小鼠海马组织中GIP和GLP-1的含量显著降低,而尼可地尔可明显增加GIP和GLP-1的含量,但具体机制尚不清楚。胃肠肽GIP和GLP-1的合成与分泌受到KATP通道的调控[24],然而目前只有关于组合为Kir6.2/SUR1的KATP通道调控GIP和GLP-1分泌的报道[25],是否有组合为Kir6.2/SUR2的KATP通道也参与了GIP和GLP-1的合成与分泌尚未可知。尼可地尔是否能通过开放KATP通道,从而影响海马组织中GLP-1和GIP的含量有待进一步研究。
诸多研究已经表明,尼可地尔具有抗氧化作用,这一作用也在糖尿病中得以体现[11-13]。氧化应激导致细胞内氧自由基和氮自由基增加,破坏神经元结构和功能的完整性[27],并损害线粒体功能,降低ATP的生成,从而影响β细胞分泌胰岛素[28-29]。研究结果表明,STZ诱导的糖尿病小鼠脑组织氧化应激程度增加,具体表现为SOD活力下降,MDA含量上升。而尼可地尔可通过降低STZ诱导的糖尿病小鼠脑组织氧化应激的程度,改善海马神经元超微结构。尼可地尔的抗氧化作用可能是由于其能通过激活线粒体中的KATP通道,预防钙超载以及保持膜的完整性起到改善线粒体功能的作用[30],从而抑制线粒体NADPH氧化酶的活性,进而抑制ROS的生成[31]。
综上所述,尼可地尔对STZ诱导的T1DM小鼠空腹血糖无影响,显著降低游泳距离,并可改善海马神经元以及突触的超微结构;增加糖尿病小鼠脑组织中GIP和GLP-1的含量;增强脑组织中的SOD活力,降低MDA含量。结果提示,尼可地尔可通过提高海马组织GIP和GLP-1含量,及其抗氧化作用,缓解STZ诱导的糖尿病小鼠的海马结构损伤,从而改善STZ诱导的糖尿病认知功能障碍。
| [1] |
Biessels GJ. Sweet memories: 20 years of progress in research on cognitive functioning in diabetes[J].
Eur J Pharmacol, 2013, 719(1-3): 153-60.
DOI: 10.1016/j.ejphar.2013.04.055. |
| [2] |
Chen Y, Liu Z, Zhang J, et al. Selectively disrupted functional connectivity networks in type 2 diabetes mellitus[J].
Front Aging Neurosci, 2015, 7: 233.
|
| [3] |
Koekkoek PS, Kappelle L J, van den Berg E, et al. Cognitive function in patients with diabetes mellitus: guidance for daily care[J].
Lancet Neurol, 2015, 14(3): 329-40.
DOI: 10.1016/S1474-4422(14)70249-2. |
| [4] |
Gaspar JM, Baptista FI, Macedo MP, et al. Inside the diabetic brain: role of different players involved in cognitive decline[J].
ACS Chem Neurosci, 2016, 7(2): 131-42.
DOI: 10.1021/acschemneuro.5b00240. |
| [5] |
Saedi E, Gheini MR, Faiz F, et al. Diabetes mellitus and cognitive impairments[J].
World J Diabetes, 2016, 7(17): 412-22.
DOI: 10.4239/wjd.v7.i17.412. |
| [6] |
刘丽华, 戚本玲. 钾离子通道开放剂尼可地尔与糖尿病研究进展[J].
心血管病学进展, 2012, 33(5): 632-4.
|
| [7] |
Ishii H, Ichimiya S, Kanashiro M, et al. Effects of intravenous nicorandil before reperfusion for acute myocardial infarction in patients with stress hyperglycemia[J].
Diabetes Care, 2006, 29(2): 202-6.
DOI: 10.2337/diacare.29.02.06.dc05-1588. |
| [8] |
Gupta S, Singh P, Sharma B. Neuroprotective effects of nicorandil in chronic cerebral hypoperfusion-induced vascular dementia[J].
J Stroke Cerebrovasc Dis, 2016, 25(11): 2717-28.
DOI: 10.1016/j.jstrokecerebrovasdis.2016.07.023. |
| [9] |
Gupta S, Sharma B. Protective effects of phosphodiesterase-1 (PDE1) and ATP sensitive potassium (KATP) channel modulators against 3-nitropropionic acid induced behavioral and biochemical toxicities in experimental Huntingtons disease[J].
Eur J Pharmacol, 2014, 732: 111-22.
DOI: 10.1016/j.ejphar.2014.03.032. |
| [10] |
Kong J, Ren G, Jia N, et al. Effects of nicorandil in neuroprotective activation of PI3K/AKT pathways in a cellular model of Alzheimer's disease[J].
Eur Neurol, 2013, 70(3-4): 233-41.
DOI: 10.1159/000351247. |
| [11] |
Liu LH, Liu Y, Qi BL, et al. Nicorandil attenuates endothelial VCAM-1 expression via thioredoxin production in diabetic rats induced by streptozotocin[J].
Mol Med Rep, 2014, 9(6): 2227-32.
DOI: 10.3892/mmr.2014.2066. |
| [12] |
Tanabe K, Lanaspa MA, Kitagawa W, et al. Nicorandil as a novel therapy for advanced diabetic nephropathy in the eNOS-deficient mouse[J].
Am J Physiol Renal Physiol, 2012, 302(9): F1151-60.
DOI: 10.1152/ajprenal.00596.2011. |
| [13] |
Serizawa K, Yogo K, Aizawa K, et al. Nicorandil prevents endothelial dysfunction due to antioxidative effects via normalisation of NADPH oxidase and nitric oxide synthase in streptozotocin diabetic rats[J].
Cardiovasc Diabetol, 2011, 10: 105.
DOI: 10.1186/1475-2840-10-105. |
| [14] |
Zhang YQ, Tian F, Zhou Y, et al. Nicorandil attenuates carotid intimal hyperplasia after balloon catheter injury in diabetic rats[J].
Cardiovasc Diabetol, 2016, 15: 62.
DOI: 10.1186/s12933-016-0377-6. |
| [15] |
Shehata M. Cardioprotective effects of oral nicorandil use in diabetic patients undergoing elective percutaneous coronary intervention[J].
J Interv Cardiol, 2014, 27(5): 472-81.
DOI: 10.1111/joic.v27.5. |
| [16] |
Foster MN, Coetzee WA. KATP channels in the cardiovascular System[J].
Physiol Rev, 2016, 96(1): 177-252.
DOI: 10.1152/physrev.00003.2015. |
| [17] |
Liu LP, Yan TH, Jiang LY, et al. Pioglitazone ameliorates memory deficits in streptozotocin-induced diabetic mice by reducing brain beta-amyloid through PPARgamma activation[J].
Acta Pharmacol Sin, 2013, 34(4): 455-63.
DOI: 10.1038/aps.2013.11. |
| [18] |
Zou W, Yuan J, Tang ZJ, et al. Hydrogen sulfide ameliorates cognitive dysfunction in streptozotocin-induced diabetic rats: involving suppression in hippocampal endoplasmic reticulum stress[J].
Oncotarget, 2017, 8(38): 64203-16.
|
| [19] |
Ghasemi M, Zendehbad B, Zabihi H, et al. Beneficial effect of leptin on spatial learning and memory in streptozotocin-induced diabetic rats[J].
Balkan Med J, 2016, 33(1): 102-7.
DOI: 10.5152/balkanmedj.. |
| [20] |
Huang TT, Leu D, Zou Y. Oxidative stress and redox regulation on hippocampal-dependent cognitive functions[J].
Arch Biochem Biophys, 2015, 576: 2-7.
DOI: 10.1016/j.abb.2015.03.014. |
| [21] |
Sadeghi A, Hami J, Razavi S, et al. The effect of diabetes mellitus on apoptosis in hippocampus: cellular and molecular aspects[J].
Int J Prev Med, 2016, 7: 57.
DOI: 10.4103/2008-7802.178531. |
| [22] |
Bettio L, Rajendran L, Gil-Mohapel J. The effects of aging in the hippocampus and cognitive decline[J].
Neurosci Biobehav Rev, 2017, 79: 66-86.
DOI: 10.1016/j.neubiorev.2017.04.030. |
| [23] |
Hansen M, Tencerova M, Frolich J, et al. Effects of gastric inhibitory polypeptide, glucagon-like peptide-1 and glucagon-like peptide-1 receptor agonists on bone cell metabolism[J].
Basic Clin Pharmacol Toxicol, 2018, 122(1): 25-37.
DOI: 10.1111/bcpt.12850. |
| [24] |
Psichas A, Reimann F, Gribble F. M. Gut chemosensing mechanisms[J].
J Clin Invest, 2015, 125(3): 908-17.
DOI: 10.1172/JCI76309. |
| [25] |
Seino Y, Yabe D. Glucose-dependent insulinotropic polypeptide and glucagon-like peptide-1: Incretin actions beyond the pancreas[J].
J Diabetes Investig, 2013, 4(2): 108-30.
DOI: 10.1111/jdi.2013.4.issue-2. |
| [26] |
Irwin N, Flatt PR. New perspectives on exploitation of incretin peptides for the treatment of diabetes and related disorders[J].
World J Diabetes, 2015, 6(15): 1285-95.
DOI: 10.4239/wjd.v6.i15.1285. |
| [27] |
王萌, 纪汶君, 陈莉娜. 糖尿病性认知功能障碍研究进展[J].
基础医学与临床, 2015, 35(2): 240-3.
|
| [28] |
Verdile G, Keane KN, Cruzat VF, et al. Inflammation and oxidative stress: the molecular connectivity between insulin resistance, obesity, and Alzheimer's disease[J].
Mediators Inflamm, 2015, 2015: 105828.
|
| [29] |
Wang J, Wang H. Oxidative stress in pancreatic beta cell regeneration[J].
Oxid Med Cell Longev, 2017, 2017: 1930261.
|
| [30] |
Ravindran S, Swaminathan K, Ramesh A, et al. Nicorandil attenuates neuronal mitochondrial dysfunction and oxidative stress associated with murine model of vascular calcification[J].
Acta Neurobiol Exp (Wars), 2017, 77(1): 57-67.
|
| [31] |
Asensio-Lopez MC, Soler F, Pascual-Figal D, et al. Doxorubicininduced oxidative stress: The protective effect of nicorandil on HL-1 cardiomyocytes[J].
PLoS One, 2017, 12(2): e172803.
|
 2018, Vol. 38
2018, Vol. 38

