2. 南方医科大学 南方医院神经外科,广东 广州 510515
2. First Clinical College, Southern Medical University, Guangzhou 510515, China
脑膜瘤是最常见的颅内肿瘤之一,好发于脑表面、鞍结节、大脑凸面等部位[1-2],多见于成人,发病率约占颅内原发肿瘤的20% [3]。2016年WHO中枢神经系统脑膜瘤病理分Ⅰ、Ⅱ、Ⅲ级,其中Ⅲ级定义为恶性脑膜瘤,约占10%[4]。Ⅰ级脑膜瘤显微外科手术全切除后(Simposon Ⅰ~Ⅲ级)可治愈,然Ⅲ级恶性脑膜瘤临床治疗效果不佳,术后复发率高达39%~79% [5-7],患者5年生存率极低[8-10]。因此,寻找手术之外的综合治疗方法,对提高恶性脑膜瘤治疗效果,具有重要意义。恶性肿瘤的细胞功能、机制等体外研究以及动物模型的体内研究,是寻求恶性肿瘤新的治疗方法的重要手段,也是基础研究转化为临床应用的重要依据。目前,国内外对恶性脑膜瘤原代培养报道较少[11],而恶性脑膜瘤原代细胞的颅内原位成瘤模型尚未见文献报道。本研究对恶性脑膜瘤细胞原代培养做了深入探讨,并建立了恶性脑膜瘤小鼠颅内移植留瘤模型,为恶性脑膜瘤的基础研究提供了良好的模型。
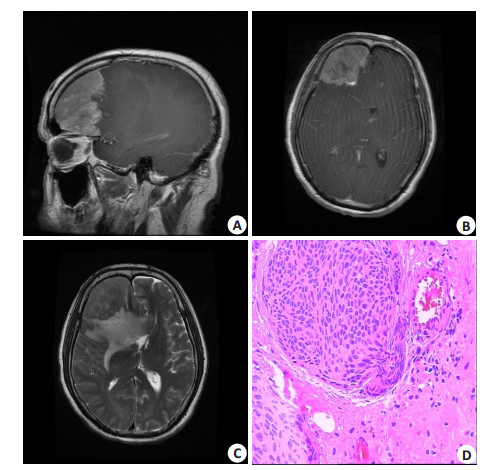
1 材料和方法 1.1 标本来源肿瘤组织取自2016年6月~2017年5月南方医科大学南方医院神经外科手术切除的新鲜标本,根据术前影像学检查,对10例高度可疑恶性脑膜瘤进行选择性培养,术后本院病理确诊(图 1),累计培养3例间变型脑膜瘤原代细胞。
|
图 1 脑膜瘤患者MR图像及病理图片 Figure 1 Magnetic resonance images (MRI) and pathological examination of meningioma. A: Sagittal MRI scan of the brain; B, C: coronal MRI scan of the brain; D: Pathology of anaplastic meningioma (HE staining, original magnification: ×400). |
裸鼠(BALB/c)12只,由南方医科大学南方医院实验动物中心提供和饲养,雌雄不限,鼠龄4周,体质量20~25 g,饲养环境:无特定病原体SPF级。鼠笼、垫料、饮用水和食料均经灭菌处理,按标准方式给予。
1.3 仪器和试剂RPMI Medium 1640培养基(Gibco,美国)、0.25%胰蛋白酶和0.05%乙二胺四乙酸(EDTA)(Gibco,美国)、胎牛血清(FBS)(Gibco,美国)、PBS缓冲溶液(Gibco,美国)、CO2恒温孵育箱(美国Thermo公司)、倒置相差显微镜(Leica M icrosystem s CM S GmbH)、台式离心机(TD5A-WS)、流式细胞仪(Attune NxT,北京鑫磊众森生物科技有限公司)、立体定向仪(深圳市瑞沃德生命科技有限公司)、Annexin V-FITC/PI细胞凋亡检测试剂盒(凯基生物有限公司)、鼠抗人波形蛋白(vimentin)单抗、鼠抗人上皮膜抗原(EMA)单抗、细胞增殖核抗原(Ki-67)单抗(北京中杉金桥技术有限公司)。
1.4 细胞分离、培养与鉴定 1.4.1 细胞分离、培养与纯化取手术中切除的新鲜脑膜瘤组织标本,放入含双抗磷酸盐缓冲液(PBS)中反复冲洗,眼科剪剪去硬脑膜、烧焦组织、血凝块、蛛网膜等,用眼科剪在无菌条件下剪成1 mm3;37 ℃孵箱内用0.25%胰蛋白酶消化10 min,70 µm滤网过滤,滤液以1000 r/min离心3 min,去上清;加入3 mL红细胞裂解液,吹打混匀3 min后,加入6 mL PBS稀释,离心后去上清,用含10%血清的1640培养基(含青霉素105 U/L、链霉素100 mg/L)混悬细胞沉淀,种植于25 cm2培养瓶中,置于37 ℃、5% CO2细胞孵箱中培养,首次隔天换液,以后每2~3 d细胞密度大于90%进行传代培养;细胞胰酶消化传代后采用差速贴壁法进行纯化肿瘤细胞。
1.4.2 细胞生长曲线以及流式细胞术检测取第3代原代细胞胰酶消化传代后调整细胞密度为5×103,种植于96孔板,对应天数复孔5个。每隔24 h采用CCK-8法检测对应天数的吸光度(A),去除最大、最小值,取剩下3个复孔平均值,连续7 d后绘制生长曲线。另取第3代原代细胞用不含EDTA的胰酶消化,磷酸盐缓冲液(PBS)洗涤细胞2次(2000 r/min离心5 min)收集1×105细胞,加入500 μL的Binding Buffer,悬浮细胞,加5 μL Annexin V-FITC混匀,加5 μL Propidium Iodide混匀,室温、避光、反应15 min。FITC流式细胞仪检测细胞凋亡情况,细胞生物学重复3次。
1.4.3 细胞免疫荧光检测Vimentin、EMA的表达将脑膜瘤细胞按1×105/mL密度铺到35 mm的共聚焦皿。培养24 h后,PBS漂洗3次,用4%多聚甲醛固定细胞10 min,PBS漂洗5 min×3次,0.2% Triton X-100细胞膜通透处理10 min,PBS漂洗5 min×3次,用含5% BSA室温封闭1 h,添加一抗后4 ℃冰箱孵育过夜。去除一抗,PBS漂洗5 min×3次,避光条件下滴加荧光二抗(1: 1000),室温孵育1 h,PBS漂洗5 min×3次,DAPI避光染色5 min,PBS漂洗5 min×3次。倒置荧光显微镜(OLYMPUS)暗室下拍照检测波形蛋白Vimentin、EMA的表达情况。
1.5 裸鼠成瘤模型的建立 1.5.1 颅内原位成瘤模型的建立 1.5.1.1 裸鼠麻醉、立体定向仪固定取6只裸鼠,腹部皮肤消毒后腹腔注射135 μL 1%戊巴比妥钠,立体定向仪对裸鼠头部进行固定,两耳针对称地固定裸鼠两侧耳稍前方骨性部位。
1.5.1.2 裸鼠定位在裸鼠内眦连线与头部矢状中线交点后5 mm处纵向切开头部皮肤约长0.6 cm,镊子钝性分离切口两侧皮肤、筋膜,充分暴露颅骨。根据头部立体定向解剖图谱确定钻孔的位置:冠状缝与矢状缝交点后方0.5 mm、中线右方2.5 mm处。用电钻在此定位处钻一孔径约为1 mm小孔。
1.5.1.3 细胞接种取第3代对数生长期细胞,消化离心去上清后,用10 μL微量注射器吸取细胞悬液,调整立体定向仪X、Y、Z轴,使注射器头定位于小孔,调节Z轴,垂直缓慢进针,进针深度约为1.5 mm,以1 μL/min的速度缓慢推注细胞悬液,注射完后针头停留2 min再缓慢退针。术后在裸鼠耳部打耳钉标记。
1.5.2 皮下成瘤模型的建立取第3代对数生长期细胞,经0.25%胰蛋白酶消化,离心去上清液,用1.0 mL注射器吸取细胞悬液0.1 mL,向裸鼠皮下缓慢注射,形成皮下小皮丘,平均每个点接种5×106细胞,在裸鼠耳部打耳钉标记。
1.6 裸鼠体质量变化及皮下肿瘤体积曲线图每日定时检查裸鼠生命状态,每周称量原位成瘤组裸鼠的体质量变化,绘制出裸鼠体重变化曲线图;皮下成瘤组每周定时测量裸鼠皮下肿瘤长径和宽径,计算肿瘤的体积(体积=长×宽×1/2),并绘制皮下肿瘤体积变化曲线图。
1.7 病理组织学检查 1.7.1 病理组织HE染色接种6周后处死全部裸鼠,取出颅内全脑组织和皮下肿瘤组织,用4%多聚甲醛固定、脱水、蜡块包埋后切片,厚度为4 mm,二甲苯脱蜡,梯度乙醇水化。
1.7.2 免疫组织化学检测Ki-67的表达将裸鼠原位成瘤切片和皮下成瘤切片进行常规脱蜡,梯度乙醇水化,磷酸盐缓冲液(PBS)漂洗10 min×3次,3% H2O2孵育10 min,磷酸盐缓冲液(PBS)漂洗10 min×3次,枸橼酸钠缓冲液(PH6.0)微波炉热修复15 min,待自然冷却后,磷酸盐缓冲液(PBS)漂洗10 min×3次,一抗4 ℃冰箱孵育过夜;去除一抗后,PBS漂洗10 min×3次,滴加二抗,室温下孵育40 min,PBS漂洗10 min×3次,滴加DAB显色剂,蒸馏水终止反应,苏木素复染,中性树脂封片。
1.8 统计学处理全部资料采用SPSS 19.0软件进行统计分析。计量资料以平均值±标准差表示。
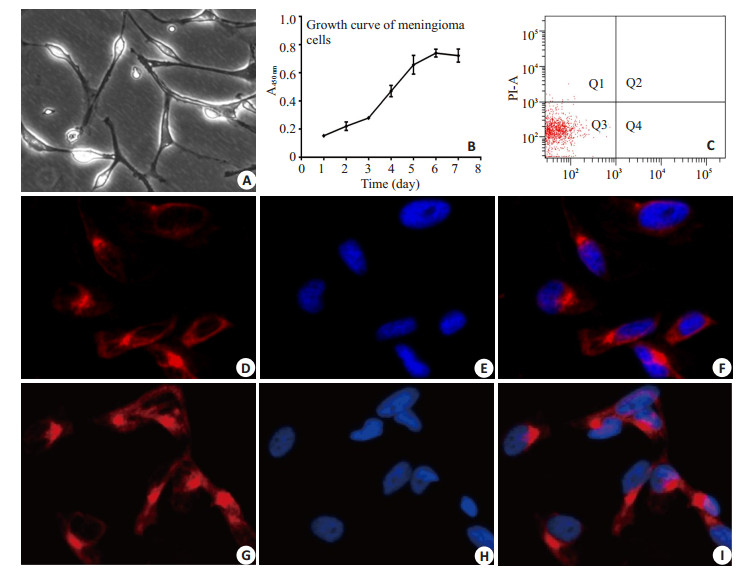
2 结果 2.1 原代细胞培养恶性脑膜瘤原代细胞在培养4~6 h后贴壁,而肿瘤相关成纤维细胞在培养1~2 h后贴壁,采用差速贴壁法进行纯化肿瘤细胞;肿瘤细胞传代后形态呈长梭形,细胞透亮,折光性好,细胞增殖较快,一般2~3 d可达80%~ 90%密度,进行细胞传代。目前3例肿瘤细胞分别已传16代、21代、23代,细胞形态均未发生明显改变(图 2A)。
|
图 2 脑膜瘤细胞原代培养及Vimentin、EMA的表达 Figure 2 Primary culture of meningioma cells and the expression of vimentin and EMA in the cells. A: Primary culture of meningioma cells (×400); B: Growth curve of meningioma cells; C: Apoptosis of meningioma cells; D-F: Meningioma cells highly expressing vimentin (×400); G-I: Meningioma cells highly expressing EMA (×400). |
在细胞生长曲线中,0~2 d为潜伏期,2~3 d为细胞增殖期,3~5 d为对数生长期,5~7 d为稳定期,整体呈“S”型生长(图 2B)。经AnnexinV/PI双染后流式检测细胞凋亡的结果显示细胞的生长状态良好,Q3区域细胞所占比例约为(95.99±2.58)%(图 2C)。
2.3 细胞免疫荧光鉴定肿瘤细胞免疫荧光染色结果显示Vimentin、EMA染色均表达阳性,Vimentin、EMA荧光染色定位于胞膜、胞浆,可鉴定所培养的细胞为脑膜瘤细胞(图 2D-I)。
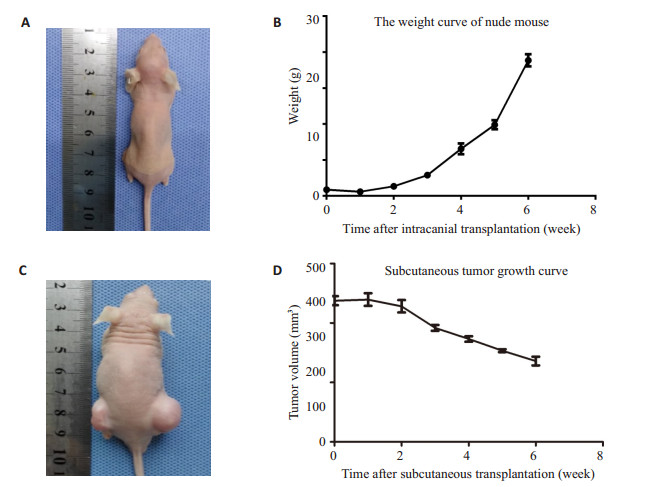
2.4 裸鼠体质量及皮下肿瘤体积观察颅内成瘤组裸鼠在接种1周后开始出现体重逐渐下降,接种6周后裸鼠明显消瘦;皮下成瘤组接种2周左右出现肉眼可见的结节,裸鼠体质量无减轻,6周后形成明显的肿瘤结节(图 3)。
|
图 3 脑膜瘤原位移植动物模型以及皮下成瘤 Figure 3 Nude mouse models bearing in situ and subcutaneous meningiomas. A: Volume of orthotopically transplanted tumor in nude mice; B. Curve of body weight changes of nude mouse after intracranial tumor transplantation; C: Volume of subcutaneous tumor in nude mice; D: Curve of tumor volume changes in nude mice after subcutaneous tumor transplantation. |
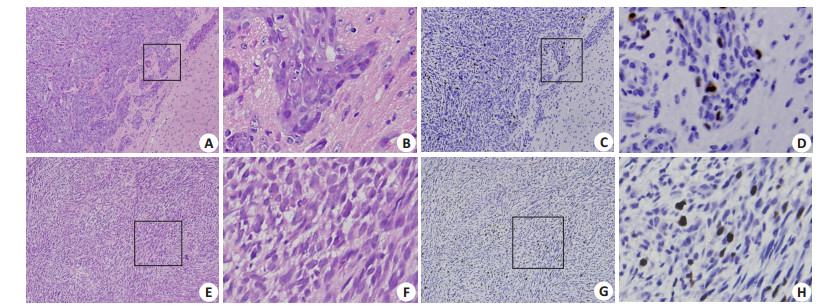
裸鼠原位成瘤和皮下成瘤的脑膜瘤细胞在HE染色后均呈梭形,细胞体积大小不一,核大、深染,核分裂相多见,细胞生长活跃,密集成群,排列紊乱。肿瘤细胞呈浸润性生长,侵犯周围正常组织(图 4)。
|
图 4 脑膜瘤细胞HE染色及Ki-67高表达 Figure 4 HE staining and Ki-67 expression in meningioma xenografts. A: HE staining of orthotropic tumor in nude mice (× 40); B: Orthotropic tumor highly expressing Ki-67 (×400); C: HE staining of subcutaneous tumor in nude mice (×40); D: Subcutaneous tumor highly expressing Ki-67 (×400). |
颅内成瘤组和皮下成瘤组切片中Ki-67均呈高表达,胞核出现棕黄色颗粒,Ki-67阳性率约为(36±5.35)%(图 4)。
3 讨论脑膜瘤是最常见的颅内肿瘤之一,而恶性脑膜瘤因其术后反复复发,更是脑膜瘤治疗中的难题[12-14]。因此,寻求手术之外新的综合治疗方式,对提高恶性脑膜瘤治疗效果具有重要意义[15-18]。目前,脑膜瘤基础研究进展缓慢,原因之一是缺乏良好的细胞以及动物模型。国外学者进行过建立有效脑膜瘤异位移植动物模型的探索:Rana等[19]首次成功将恶性脑膜瘤原代细胞接种于裸鼠皮下;1978年Ueyama等[20]成功将纤维型脑膜瘤接种于裸鼠皮下。肿瘤皮下移植法可操作性强,且易于动态观察实验中肿瘤的体积变化,但肿瘤皮下移植模型只能反映脑膜瘤的增殖情况,不能真实反映肿瘤所处的微环境[21],与脑膜瘤在颅内实际情况具有一定的差异性。然而,目前美国ATCC细胞库尚无脑膜瘤细胞系的报道,且无建立人脑膜瘤颅内原位成瘤动物模型。
脑膜瘤是来源于蛛网膜帽状细胞的颅内常见肿瘤,肿瘤微环境,如缺氧、肿瘤相关成纤维细胞对肿瘤的发生发展具有重要作用[22-24]。颅内原位成瘤,有助于实现肿瘤与周边微环境相互作用的研究,能够最大限度的模拟肿瘤在颅内的真实情况[25-26]。因此,建立恶性脑膜瘤小鼠原位成瘤模型对脑膜瘤基础研究具有重要的意义。
本研究成功建立恶性脑膜瘤小鼠原位成瘤模型。首先我们对恶性脑膜瘤原代培养方法进行了改良,采用差速贴壁法,对恶性脑膜瘤细胞进行了纯化,减少了混杂的成纤维细胞,通过对原代细胞进行生长曲线和细胞周期测定,发现细胞状态良好,证实了这种培养方法的可靠性;其次,我们在建立小鼠原位成瘤模型的同时,也建立了小鼠皮下移植瘤模型,对两种模型所成的肿瘤的病理特征进行了对比,发现与皮下移植成瘤模型相比,原位成瘤模型所形成的肿瘤并没有改变其固有的病理学特征。同时,原位成瘤模型形成的肿瘤中,可以明显看到肿瘤侵犯脑组织的现象,这对研究肿瘤恶性生物学行为,提供了较好的体内模型[27]。
本实验建立的颅内原位成瘤动物模型,使用立体定向法对恶性脑膜瘤细胞的接种部位进行精确定位,能避开脑组织重要的功能区域,减少对裸鼠生理状态的影响。本实验颅内原位成瘤组6例中有5例长出肿瘤组织,成瘤率为80%;而皮下成瘤组6例均有肿瘤生长,成瘤率100%。分析前者成瘤率未达100%的原因,可能是由于:(1)本实验操作过程可能造成颅内感染,影响局部微环境;(2)接种过程中部分细胞漏出,导致接种的肿瘤细胞数量减少;(3)裸鼠自身免疫反应对肿瘤生长产生一定影响。再者,接种脑膜瘤细胞后肿瘤组织的生长状况与裸鼠体内生理因素关系密切[28]。
总之,我们首次报道了成功利用人恶性脑膜瘤原代细胞构建小鼠颅内成瘤模型。对研究肿瘤微环境对恶性脑膜瘤的发生,发展以及肿瘤对周边组织侵袭提供了可靠的研究模型。
| [1] |
Domingues PH, Sousa P, Otero Á, et al. Proposal for a new risk stratification classification for meningioma based on patient age, WHO tumor grade, size, localization, and karyotype[J].
Neuro Oncol, 2014, 16(5): 735-47.
DOI: 10.1093/neuonc/not325. |
| [2] |
车树圣, 焦迎斌, 闫志勇, 等. 颅内脑膜瘤病理学性质与其发生部位的关系[J].
中国临床神经外科杂志, 2014, 12(12): 723-5.
|
| [3] |
刘忆, 漆松涛. "脑膜尾征"与脑膜瘤部位及其病理类型的关系[J].
中国临床神经外科杂志, 2010, 15(6): 321-3, 241.
|
| [4] |
Banan R, Hartmann C. The new WHO 2016 classification of brain tumors-what neurosurgeons need to know[J].
Acta Neurochir (Wien), 2017, 159(3): 403-18.
DOI: 10.1007/s00701-016-3062-3. |
| [5] |
许益民, 漆松涛, 潘军, 等. 双额底前纵裂入路显微切除巨大型鞍结节脑膜瘤[J].
南方医科大学学报, 2010, 30(7): 1688-90.
|
| [6] |
刘忆, 漆松涛, 张喜安, 等. 不同病理类型脑膜瘤对周围组织侵袭性的研究[J].
中华神经外科杂志, 2011, 27(3): 275-80.
|
| [7] |
Linsler S, Kraemer D, Driess C, et al. Molecular biological determinations of meningioma progression and recurrence[J].
PLoS One, 2014, 9(4): e94987.
DOI: 10.1371/journal.pone.0094987. |
| [8] |
Shakir SI, Souhami L, Petrecca K, et al. Prognostic factors for progression in atypical meningioma[J].
J Neurosurg, 2018, 19(1): 1-9.
|
| [9] |
Zhang D, Yu J, Guo Y, et al. An intraventricular meningioma and recurrent astrocytoma collision tumor: a case report and literature review[J].
World J Surg Oncol, 2015, 13(12): 37.
|
| [10] |
Sun SQ, Cai CY, Murphy RK, et al. Radiation therapy for residual or recurrent atypical meningioma: the effects of modality, timing, and tumor pathology on Long-Term outcomes[J].
Neurosurgery, 2016, 79(1): 23-32.
DOI: 10.1227/NEU.0000000000001160. |
| [11] |
Peterson DL, Sheridan PJ, Brown WE. Animal models for brain tumors: historical perspectives and future directions[J].
J Neurosurg, 1994, 80(5): 865-76.
DOI: 10.3171/jns.1994.80.5.0865. |
| [12] |
Kaley T, Barani I, Chamberlain M, et al. Historical benchmarks for medical therapy trials in surgery-and radiation-refractory meningioma: a RANO review[J].
Neuro Oncol, 2014, 16(6): 829-40.
DOI: 10.1093/neuonc/not330. |
| [13] |
Chamberlain MC. Adjuvant combined modality therapy for malignant meningiomas[J].
J Neurosurg, 1996, 84(5): 733-6.
DOI: 10.3171/jns.1996.84.5.0733. |
| [14] |
Durand A, Labrousse F, Jouvet A, et al. WHO grade Ⅱ and Ⅲ meningiomas: a study of prognostic factors[J].
J Neurooncol, 2009, 95(3): 367-75.
DOI: 10.1007/s11060-009-9934-0. |
| [15] |
Choy W, Kim W, Nagasawa D, et al. The molecular genetics and tumor pathogenesis of meningiomas and the future directions of meningioma treatments[J].
Neurosurg Focus, 2011, 30(5): E6.
DOI: 10.3171/2011.2.FOCUS1116. |
| [16] |
Sughrue ME, Rutkowski MJ, Aranda D, et al. Treatment decision making based on the published natural history and growth rate of small meningiomas[J].
J Neurosurg, 2010, 113(5): 1036-42.
DOI: 10.3171/2010.3.JNS091966. |
| [17] |
Nowosielski M, Galldiks N, Iglseder S, et al. Diagnostic challenges in meningioma[J].
Neuro Oncol, 2017, 19(12): 1588-98.
DOI: 10.1093/neuonc/nox101. |
| [18] |
Gupta A, P SM, Jyotisureka GC, et al. Role of diffusion weighted MRI in differentiating typical from atypical meningiomas at 1.5 and 3T MRI[J].
Egy J Radiol Nucle Med, 2013, 44(3): 635-40.
DOI: 10.1016/j.ejrnm.2013.04.005. |
| [19] |
Rana MW, Pinkerton H, Thornton H, et al. Heterotransplantation of human glioblastoma multiforme and meningioma to nude mice[J].
Proc Soc Exp Biol Med, 1977, 155(1): 85-8.
DOI: 10.3181/00379727-155-39750. |
| [20] |
Ueyama Y, Morita K, Ochiai C, et al. Xenotransplantation of a human meningioma and its lung metastasis in nude mice[J].
Br J Cancer, 1978, 37(4): 644-7.
DOI: 10.1038/bjc.1978.95. |
| [21] |
Olson JJ, Beck DW, Schlechte J, et al. Hormonal manipulation of meningiomas in vitro[J].
J Neurosurg, 1986, 65(1): 99-107.
DOI: 10.3171/jns.1986.65.1.0099. |
| [22] |
Wu Y, Lucia K, Lange M, et al. Hypoxia inducible factor-1 is involved in growth factor, glucocorticoid and hypoxia mediated regulation of vascular endothelial growth factor-A in human meningiomas[J].
J Neurooncol, 2014, 119(2): 263-73.
DOI: 10.1007/s11060-014-1503-5. |
| [23] |
Reszec J, Hermanowicz A, Rutkowski R, et al. Evaluation of mast cells and hypoxia inducible factor-1 expression in meningiomas of various grades in correlation with peritumoral brain edema[J].
J Neurooncol, 2013, 115(1): 119-25.
DOI: 10.1007/s11060-013-1208-1. |
| [24] |
Reszec J, Rutkowski R, Chyczewski L. The expression of hypoxiainducible factor-1 in primary brain tumors[J].
Int J Neurosci, 2013, 123(9): 657-62.
DOI: 10.3109/00207454.2013.789874. |
| [25] |
Ooba H, Abe T, Wakabayashi Y, et al. Unique infiltrating morphology of a meningioma-a case report[J].
Surg Neurol, 2007, 68(1): 99-102; discussion 102.
DOI: 10.1016/j.surneu.2006.08.086. |
| [26] |
Alvarez F, Roda JM, Pérez Romero M, et al. Malignant and atypical meningiomas: a reappraisal of clinical, histological, and computed tomographic features[J].
Neurosurgery, 1987, 20(5): 688-94.
DOI: 10.1227/00006123-198705000-00003. |
| [27] |
Malham GM, Thomsen RJ, Synek BJ, et al. Establishment of primary human meningiomas as subcutaneous xenografts in mice[J].
Br J Neurosurg, 2001, 15(4): 328-34.
DOI: 10.1080/02688690120072487. |
| [28] |
Friedrich S, Schwabe K, Klein R, et al. Comparative morphological and immunohistochemical study of human meningioma after intracranial transplantation into nude mice[J].
J Neurosci Methods, 2012, 205(1): 1-9.
|
 2018, Vol. 38
2018, Vol. 38

