2. 西安医学院第一附属医院 呼吸内科,陕西 西安 710061;
3. 西安医学院第一附属医院 科研科,陕西 西安 710061
2. Department of Respiratory Medicine, First Affiliated Hospital of Xi'an Medical University, Xi'an 710061, China;
3. Department of Scientific Research, First Affiliated Hospital of Xi'an Medical University, Xi'an 710061, China
目前,美国癌症协会最新统计数据显示,肺癌依然是发病率占据前3的恶性肿瘤,且死亡率位居第一[1]。而在我国,肺癌的发病率和死亡率均占据各类恶性肿瘤的首位[2],患者5年的生存率仅为15.4% [3],且复发率很高[4],已严重威胁人类健康,因此寻找肺癌新的分子标记物以及潜在的治疗靶点,非常有必要。细胞迁移或侵袭是肿瘤发生、发展的关键因素[5]。CHCHD2(coiled-coilhelixcoiled-coil-helix domain-containing protein 2)目前又称为MNRR1(mitochondria nuclear retrograde regulator 1),是一种新型的促细胞迁移因子,可能与Akt,RhoA/ROCK及Jnk信号通路有关,可以促进细胞迁移,改变细胞粘附[6]。CHCHD2属于双细胞器蛋白,定位于线粒体和细胞核中,是双CX9C蛋白组成的含有CHCH结构域的蛋白家族成员之一[7-8],而含有此结构域的蛋白与肿瘤发生有关[9]。研究发现CHCHD2在某些类型的肿瘤组织中高表达,可能与肿瘤发生密切相关[10-11]。目前在非小细胞肺癌中已有CHCHD2研究的相关报道[12],但非小细胞肺癌中CHCHD2的表达与肿瘤的发生、转移以及预后的关系目前研究并不充分。本研究通过免疫组化的方法检测非小细胞肺癌(NSCLC)及癌旁组织中CHCHD2的表达,分析其与非小细胞肺癌发生、转移及预后的关系,为非小细胞肺癌的早期诊断以及患者生存预后的判断提供依据。
1 资料和方法 1.1 标本来源收集选择2011年1月~2015年1月来自西安医学院第一附属医院病理科NSCLC组织标本60例为研究对象,所有病例均为保存完整的石蜡标本,且术前均未行辅助治疗,且术后病理证实均为NSCLC。其中男性36例,女性24例,年龄36~78岁,同时选取癌旁正常组织35例作为对照组。组织学类型为鳞癌40例,腺癌20例;按照TNM分期标准Ⅰ/Ⅱ期38例,Ⅲ/Ⅳ期22例,有淋巴结转移组36例,无淋巴结转移组24例。所有标本均经过经验丰富的病理科医师审核及筛选,并经过医院伦理委员会批准,符合医学伦理规定。
1.2 主要试剂兔多克隆抗体CHCHD2(HPA027407)购自SigmaAldrich公司(工作浓度1:100),免疫组化S-P试剂盒(购自北京中杉生物技术公司)。
1.3 方法 1.3.1 免疫组化检测CHCHD2蛋白在NSCLC中的表达用10%甲醛固定NSCLC组织标本,石蜡包埋,厚度4 μm连续切片。切片于60 ℃烘烤过夜,进行脱蜡,冲洗水化;微波抗原修复后置于室温自然冷却,3%双氧水孵育10 min消除内源性过氧化物酶活性,加一抗CHCHD2,4 ℃孵育过夜,0.01 mol/L磷酸盐缓冲溶液清洗,DAB显色,苏木精复染,封片。用磷酸盐缓冲溶液代替一抗作为阴性对照。阳性结果判断:由两位资深病理医师采用双盲法进行观察,每张切片随机选取10个高倍视野,用阳性细胞百分比和染色强度分值综合评定。阳性细胞百分比判定:0分阳性细胞≤5%;1分阳性细胞6%~ 25%;2分阳性细胞26%~50%;3分阳性细胞51%~75%;4分阳性细胞≥75%。染色强度:0分未着色,1分浅黄色,2分黄色,3分棕黄色;两者相乘≥1为阳性表达。
1.3.2 Oncomine基因芯片数据库分析CHCHD2mRNA的表达通过Oncomine数据库(www.oncomine.org)查询CHCHD2基因,先输入“CHCHD2 Gene”,再限定“Analysis Type:non-small cell lung cancer”,分析参数为P-value<0.05,Fold change=all,Gene rank=top 10%,检索获得非小细胞肺癌相关数据集。
1.3.3 随访通过定期门诊复诊或电话联系等方式对60例患者进行随访,随访时间自手术日起至2016年10月1日,或以患者死亡为随访终点。术后1年内每3个月进行一次随访,并督促患者常规复查头颅CT、胸CT、腹部B超或CT,手术后1年,可每半年进行一次随访。观察两组病例CHCHD2的表达情况及其与预后的可能关系。
1.3.4 网络在线生存分析软件Kaplan-Meier plotter(KM-plotter)利用Kaplan-Meier plotter数据库对肺癌数据集进行在线生存分析,筛选条件如下:lung cancer;Gene:CHCHD2;survival:OS。
1.3.5 统计分析采用SPSS 20.0和Graphpad prism5.0软件进行数据统计学分析。NSCLC组和癌旁正常组的CHCHD2阳性表达率以及NSCLC组的临床病理参数分组间的比较均采用χ2检验;使用Graphpad prism制作生存曲线,组间比较使用log-rank法进行生存分析检验,P<0.05为差异有统计学意义。
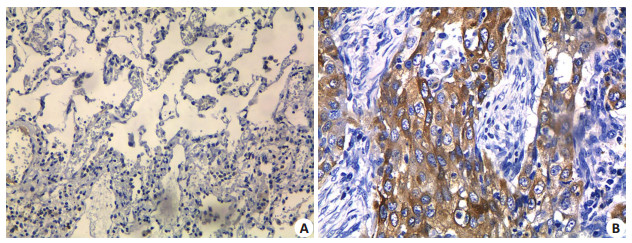
2 结果 2.1 CHCHD2蛋白在NSCLC、癌旁正常组织中的表达免疫组化结果显示:CHCHD2蛋白在癌旁正常组织中呈微弱表达或无表达,阳性表达率为(17.1%);而NSCLC中阳性染色主要定位于细胞膜和细胞浆,呈棕黄色颗粒,阳性表达率为(75.0%)。两组比较差异有统计学意义(P<0.001,表 1,图 1)。
| 表 1 CHCHD2在NSCLC和癌旁正常组织中的表达 Table 1 Expression of CHCHD2 in NSCLC and adjacent tissues |
|
图 1 CHCHD2在NSCLC中的阳性表达 Figure 1 CHCHD2 expression in NSCLC. A: Negative staining of CHCHD2 in adjacent tissue; B: Positive staining in NSCLC tissue (Original magnification: ×200). |
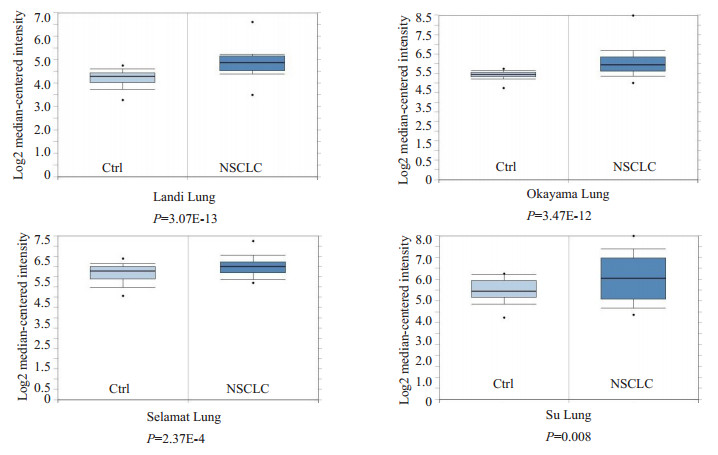
为了明确CHCHD2在NSCLC中的表达情况,应用公共数据平台oncomine数据库进行检测NSCLC组织和正常对照组织中CHCHD2mRNA水平差异表达并进行箱式图比较分析,4个研究中CHCHD2mRNA表达水平在NSCLC组织中均明显高于配对的正常组织(图 2)。
|
图 2 Oncomine数据库中CHCHD2 mRNA在NSCLC中的表达 Figure 2 Analysis of data of CHCHD2 mRNA Expressions in NSCLC and normal lung tissues in Oncomine database. |
CHCHD2蛋白阳性表达率与NSCLC患者的年龄、性别及组织学类型无关(P>0.05),而与肿瘤分化程度、TNM分期及淋巴结转移有关,分析发现,NSCLC组织分化程度越差,CHCHD2蛋白的阳性率表达越高,差异有统计学意义;CHCHD2在有淋巴结转移的NSCLC组的阳性表达率明显高于无淋巴结转移组;Ⅲ/Ⅳ期中CHCHD2阳性表达率明显高于Ⅰ/Ⅱ期组,差异具有显著性(P<0.05,表 2)。
| 表 2 NSCLC中CHCHD2的表达与临床病理参数的关系 Table 2 Correlation of the CHCHD2 expression with the clinicopathological characteristics of patients with NSCLC |
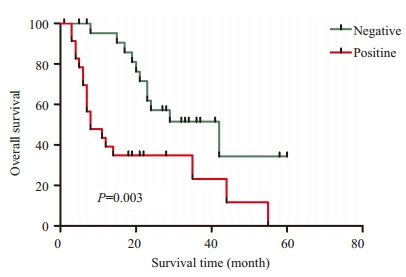
选取其中的60例生存资料完整NSCLC患者进行5年生存期随访并进行单因素的预后分析,Kaplan-Meier结果分析显示,CHCHD2阳性表达组患者术后总的生存时间明显低于阴性表达组,差异有统计学意义(P= 0.003,图 3)。
|
图 3 CHCHD2表达与NSCLC患者生存的关系(Kaplan-Meier曲线) Figure 3 Relationship between CHCHD2 expression and overall survival time in NSCLC patients in this study. |
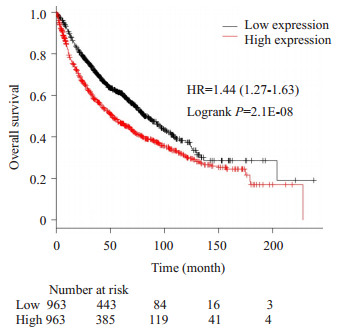
Kaplan-Meier plotter分析了1926例非小细胞肺癌患者中CHCHD2的表达与总生存期(overall survival,OS)的关系。结果显示,CHCHD2高表达的患者生存期短,预后差(P<0.001,图 4)。
|
图 4 公共数据库中CHCHD2与肺癌患者生存预后的关系(Kaplan Meier plotter网络在线生存分析) Figure 4 Relationship between CHCHD2 expression and overall survival time of lung cancer patients based on data from publicly available database. |
CHCHD2是我们前期通过基因芯片技术筛选出来的一个乙肝相关性肝癌差异表达基因,目前在人类肿瘤组织中的表达及其与肿瘤临床病理关系的研究尚未见相关报道。CHCHD2由N末端线粒体定位序列和高度保守的C末端CHCH结构域组成[12],是一个含有CHCH域的蛋白家族成员[6, 13],位于人类7p11.2染色体区域,由456个碱基对编码151个氨基酸,是一种定位于细胞核和线粒体的双细胞器蛋白。人类蛋白质图谱分析显示[14],CHCHD2基因表达产物相对分子质量为16.7 000,在肺癌中表达上调。报道显示,在不同肿瘤中CHCHD2表达各异,在非小细胞肺癌、胶质瘤及肝细胞肝癌[12, 15-16]等肿瘤中CHCHD2均发挥不同的作用。
近年来也有关于CHCHD2与非小细胞肺癌的研究,但仅仅局限在细胞水平。本研究率先在NSCLC组织中探究CHCHD2的表达水平,并且首次在NSCLC组织中检测CHCHD2蛋白的表达情况以及生存预后。免疫组化分析结果证实了NSCLC中CHCHD2蛋白表达水平相对于癌旁组织明显升高,这一结果与CHCHD2在肝癌中的表达较一致,该研究发现CHCHD2在肝癌中的表达明显高于正常组织[16]。CHCHD2可以引起细胞迁移,改变细胞粘附[6],也可以导致细胞代谢失调[17-19],而肿瘤发生发展的关键因素是细胞迁移或者侵袭[5]。有研究者发现在异种移植来源的肺原代细胞系LPC43中敲除CHCHD2可以显著降低细胞增殖率,而在NSCLC细胞系HCC827中敲除CHCHD2可明显降低细胞迁移[12]。这均表明CHCHD2和肿瘤细胞的增殖及迁移有一定的关系,异常表达的CHCHD2和肺癌的发生、发展密切相关。为了进一步探讨CHCHD2与肿瘤侵袭、转移的关系,我们通过对临床病理资料分析表明,NSCLC肿瘤组织分化程度越差,CHCHD2蛋白阳性表达率越高;有淋巴结转移组中CHCHD2阳性表达率明显高于无淋巴结转移组;TNM分期越高,CHCHD2阳性表达率越高,差异具有显著性(P<0.05),这均提示异常表达的CHCHD2有可能参与了NSCLC的发生和进展。但与性别、年龄、组织学分型无关, 这可能与研究所选用的样本量限制有关。同时通过蛋白质-蛋白质相互作用的检测阐明了CHCHD2与C1QBP和YBX1蛋白的相互作用,发现他们作为枢纽中心在CHCHD2相互作用组内呈现[12]。C1QBP是一种线粒体蛋白,其在肿瘤细胞中表达上调,并促进细胞活化和细胞增殖,抑制细胞凋亡[20-21]。YBX1是一个致癌转录因子,与细胞增殖、侵袭、转移以及能量代谢有关,其激活有助于卵巢癌细胞的侵袭[22],这表明CHCHD2的功能至少部分是通过与C1QBP和YBX1相互作用来实现的。
有报道显示CHCHD2与表皮生长因子受体(EGFR)在NSCLC中共扩增,且两者表达水平呈正相关[12, 23],而表皮生长因子受体(EGFR)是肿瘤生长的驱动因素,是多种恶性肿瘤发生时增高的标志物[24]。Liu [25]等研究显示CHCHD2通过与Bcl-xL结合调节Bax聚集从而抑制细胞凋亡,而敲除CHCHD2可以增加肿瘤细胞对化疗药物的敏感性。CHCHD2能够调整NSCLC细胞生长、迁移及线粒体功[10],蛋白质组学分析表明在11例NSCLC患者异种移植瘤中发现CHCHD2蛋白表达持续升高明显高于正常肺组织[23]。到目前为止,CHCHD2与NSCLC发生、发展的具体机制仍然不明确,而且关于CHCHD2表达的免疫组化分析尚未在人类肿瘤中进行大规模的研究。我们的研究通过免疫组化证实了CHCHD2在NSCLC和癌旁正常组织的差异表达,但是由于单个独立研究中样本数较小,抽样误差大等原因,难以得到准确可靠的结果。Oncomine数据库是目前世界上最大的癌基因芯片数据库和整合数据挖掘平台,内含超过4700个微阵列实验,可以对比基因表达情况进行更加精确可靠的分析。因此我们通过Oncomine数据库对NSCLC中CHCHD2mRNA检测,进一步证实了我们的实验结果,这些均表明CHCHD2蛋白有望成为NSCLC早期诊断的生物学指标。
目前关于CHCHD2与肿瘤生存预后的关系尚无相关报道,我们通过生存分析结果显示:与CHCHD2表达阴性的患者相比,CHCHD2表达阳性的患者生存时间明显缩短。同时我们利用网络在线生存分析软件Kaplan-Meier plotter验证我们的实验,提示CHCHD2有望成为判断NSCLC预后的标志物。
综上,CHCHD2可能作为一种潜在的肿瘤标记物促进非小细胞肺癌发生发展、侵袭与转移。异常增高的CHCHD2蛋白提示患者预后差,可作为NSCLC患者预后不良的指标,但具体机制有待进一步研究。在临床上是否能作为NSCLC早期诊断或判断预后不良的指标,以及是否可以作为NSCLC的分子靶向治疗的相关靶点,为临床治疗提供一定的理论依据,需要我们持续的探索。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J].
CA Cancer J Clin, 2018, 68(1): 7-30.
DOI: 10.3322/caac.v68.1. |
| [2] |
2017中国城市癌症最新数据报告[J]. 记者观察月刊, 2017, 2017(5): 62-3.
http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gcjz201705019&dbname=CJFD&dbcode=CJFQ
|
| [3] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J].
CA Cancer J Clin, 2016, 66(2): 115-32.
|
| [4] |
Miller YE. Pathogenesis of lung cancer[J].
Am J Respir Cell Mol Biol, 2005, 33(3): 216-23.
|
| [5] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J].
Cell, 2011, 144(5): 646-74.
DOI: 10.1016/j.cell.2011.02.013. |
| [6] |
Seo M, Lee WH, Suk K. Identification of novel cell migrationpromoting genes by a functional genetic screen[J].
FASEB J, 2010, 24(2): 464-78.
DOI: 10.1096/fj.09-137562. |
| [7] |
Aras S, Bai MB, Lee I, et al. MNRR1 (formerly CHCHD2) is a biorganellar regulator of mitochondrial metabolism[J].
Mitochondrion, 2015, 20(1): 43-51.
|
| [8] |
Grossman LI, Purandare N, Arshad R, et al. MNRR1, a biorganellar regulator of mitochondria[J].
Oxid Med Cell Longev, 2017, 2017: 6739236.
|
| [9] |
Modjtahedi N, Tokatlidis K, Dessen PA. Mitochondrial proteins containing Coiled-Coil-Helix-Coiled-Coil-Helix (CHCH) domains in health and disease[J].
Trends Biochem Sci, 2016, 41(3, SI): 245-60.
DOI: 10.1016/j.tibs.2015.12.004. |
| [10] |
Yanai I, Benjamin H, Shmoish M, et al. Genome-wide midrange transcription profiles reveal expression level relationships in human tissue specification[J].
Bioinformatics, 2005, 21(5): 650-9.
DOI: 10.1093/bioinformatics/bti042. |
| [11] |
Shmueli O, Horn-Saban S, Chalifa-Caspi V, et al. GeneNote: whole genome expression profiles in normal human tissues[J].
C R Biol, 2003, 326(10/11): 1067-72.
|
| [12] |
Wei YH, Vellanki RN, Coyaud E, et al. CHCHD2 is coamplified with EGFR in NSCLC and regulates mitochondrial function and cell migration[J].
Mol Cancer Res, 2015, 13(7): 1119-29.
DOI: 10.1158/1541-7786.MCR-14-0165-T. |
| [13] |
Zhang LY, Cheng J, Deng H, et al. Cloning and identification of gene NS2TP transregulated by non-structural protein 2 of hepatitis C virus[J].
World Chi J Digestol, 2005, 13(13): 1700.
DOI: 10.11569/wcjd.v13.i14.1700. |
| [14] |
Uhlen M, Oksvold P, Fagerberg L, et al. Towards a knowledgebased Human Protein Atlas[J].
Nat Biotechnol, 2010, 28(12): 1248-50.
|
| [15] |
Lumibao J, Chen E, Harley BA, et al. Regulation of bi-organellar CHCHD2 in response to hypoxia is dependent upon EGFR molecular subtype in glioblastoma[J].
FASEB J, 2017, 31(1): 183-7.
|
| [16] |
Song R, Yang B, Gao XE, et al. Cyclic adenosine monophosphate response element-binding protein transcriptionally regulates CHCHD2 associated with the molecular pathogenesis of hepatocellular carcinoma[J].
Mol Med Rep, 2015, 11(6): 4053-62.
DOI: 10.3892/mmr.2015.3256. |
| [17] |
Liu Y, Zhang YP. CHCHD2 connects mitochondrial metabolism to apoptosis[J].
Mol Cell Oncol, 2015, 2(4): e1004964.
DOI: 10.1080/23723556.2015.1004964. |
| [18] |
Shimojima K, Okumura A, Hayashi M, et al. CHCHD2 is downregulated in neuronal cells differentiated from iPS cells derived from patients with lissencephaly[J].
Genomics, 2015, 106(4): 196-203.
DOI: 10.1016/j.ygeno.2015.07.001. |
| [19] |
Seifeddine R, Dreiem A, Tomkiewicz CA, et al. Hypoxia and estrogen co-operate to regulate gene expression in T-47D human breast cancer cells[J].
J Steroid Biochem Mol Biol, 2007, 104(3/5): 169-79.
|
| [20] |
Zhang XF, Zhang F, Guo L, et al. Interactome analysis reveals that C1QBP (complement component 1, q subcomponent binding protein) is associated with cancer cell chemotaxis and metastasis[J].
Mol Cell Proteomics, 2013, 12(11): 3199-209.
DOI: 10.1074/mcp.M113.029413. |
| [21] |
Mcgee AM, Douglas DL, Liang YY, et al. The mitochondrial protein C1qbp promotes cell proliferation, migration and resistance to cell death[J].
Cell Cycle, 2011, 10(23): 4119-27.
|
| [22] |
Panupinthu N, Yu S, Zhang D, et al. Self-reinforcing loop of amphiregulin and Y-box binding protein-1 contributes to poor outcomes in ovarian cancer[J].
Oncogene, 2014, 33(22): 2846-56.
DOI: 10.1038/onc.2013.259. |
| [23] |
Li L, Wei YH, To C, et al. Integrated Omic analysis of lung cancer reveals metabolism proteome signatures with prognostic impact[J].
Nat Commun, 2014, 5(15 Suppl): 5469.
|
| [24] |
李婧宜, 谢芳, 徐晓平, 等. Claudin-3在结直肠癌中的表达及意义[J].
南方医科大学学报, 2017, 37(1): 63-7.
|
| [25] |
Liu Y, Clegg HV, Leslie PL, et al. CHCHD2 inhibits apoptosis by interacting with Bcl-x L to regulate Bax activation[J].
Cell Death Differ, 2015, 22(6): 1035-46.
DOI: 10.1038/cdd.2014.194. |
 2018, Vol. 38
2018, Vol. 38

