2. 暨南大学细胞生物学系//暨南大学生物医药研究院,广东 广州 510632
2. Department of Cellular Biology, Institute of Biological Medicine, Jinan University, Guangzhou 510632, China
按照世界卫生组织第5版的标准,弱精子症是指精液中的前向运动精子总数(PR)小于32%的病症[1]。据报道,男性不育患者中有80%与精子活动障碍相关,20%与精子活动力下降直接相关[2-3]。弱精子症形成的病因多样[4],基因突变是导致弱精子症发生的复杂且难以避免的原因之一[5]。虽然辅助生殖技术使得绝大部分弱精子症患者的生育需求都能得到满足[6],但由于治疗费用高、耗时耗力,且出生子代携带同样遗传或表观遗传学异常后代的风险升高,男性生殖健康难以得到一个良性循环[7]。因此,要从根本上治疗弱精子症,就必须阐明弱精子症发生的分子机制,研制更好的治疗方案。
精子顶体相关基因DKKL1定位人染色体19q13.33,通过选择性剪接产生3种不同的亚型。Kohn等[8]研究发现DKKL1主要定位在小鼠精母细胞和成熟精子的顶体中,在精-卵结合的顶体反应中扮演着重要角色。DKKL1还可以调节青春期小鼠精母细胞的凋亡和睾酮生成[9]。我们前期研究表明,DKKL1特异性表达于睾丸组织,主要定位在睾丸精母细胞和圆形精子细胞,DKKL1在无精子症患者睾丸组织中较正常人睾组织表达下降甚至消失,体外受精实验也显示,DKKL1与其外源性抗体结合导致小鼠精子的受精率下降,推测DKKL1的表达水平与男性不育密切相关[10]。鉴于国内外对于DKKL1与弱子精症的关系尚未见报道,本研究从基因和蛋白水平对DKKL1与弱精子症的相关性进行了研究,以期为男性不育症的诊断、治疗及预后判断提供充分的实验依据。
1 资料和方法 1.1 试剂RNA提取试剂Triozol购自Invitrogen Life Technology公司。反转录试剂盒Bestar®qPCR RT Kit (gDNA Remover)和荧光定量PCR试剂盒Bestar®SYBR Green qPCRmastermix均购自德国DBI。兔抗DKKL1一抗(ab38588)购自美国Abcam,内参GAPDH一抗(10494-1-AP)购自ProteinTech,HRP-羊抗兔IgG二抗(31460)购自Thermo fisher。其它试剂均为分析纯。
1.2 精液标本收集精液标本来自2015年11月~2016年1月广东省清远市人民医院生殖中心就诊的男性患者,入选标准:年龄20~40岁;近期无生殖道感染和炎症,无精索静脉曲张,无腮腺炎、附睾炎和睾丸炎史;精浆中性α-糖苷酶、精浆果糖、精浆锌等精浆生化指标检查均正常;常规体格检查正常。排除标准:精液不液化和高度粘稠等精浆异常;血清性激素(FSH、LH、T、PRL、E2)异常者;近期接触过放射线、有毒有害物质和服用过可能影响精液质量的药物;白细胞数目>1×106/ mL。按照第5版世界卫生组织标准[1]正常对照组精液分析,禁欲2~7 d,精液量1.5~6 mL,颜色为灰白色或淡黄色,pH值为7.2~7.8,液化时间小于60 min,精子浓度≥15×106/mL,活力为PR级的精子≥32%,正常精子形态≥4%;弱精子症患者的精液分析,精子浓度≥15×106/mL,活力为PR级的精子<32%。正常对照组和弱精子症组各收集40例。精液标本收集前均充分告知患者并取得患者的知情同意,全部临床精液收集均得到清远市人民医院伦理委员会的批准。
1.3 Percoll法分离精液为避免生精细胞和白细胞对结果的影响,按文献方法[11]液化后的精液经95%,76%,57%和47.5%这4个梯度的Percoll离心300 g离心20 min,收集正常组中95% Percoll以下的精子为活力正常组,收集弱精子症组57%与76% Percoll层之间的精子为弱精子症组。镜下确认纯化效果并计数精子浓度,分离纯化后的精子经PBS洗涤2次(200×g离心5 min),储存于-80 ℃冰箱。
1.4 精子总RNA提取和逆转录精子总RNA的提取按照Invitrogen life technology公司提供的Trizol使用说明进行,取2×106个精子加入1 mL Trizol,反复吹打混匀,室温放置5 min,加入200 μL的氯仿混匀至溶液乳化呈乳白色,室温放置5 min后于4 ℃、12 000×g离心15 min,取无色透明上清液,加1 mL异丙醇,室温放置10 min沉淀RNA,4 ℃、12 000×g 10 min后弃上清,用1 mL 75%的乙醇洗涤RNA沉淀,4 ℃、7500×g离心5 min后小心弃去上清,20~30 μL DEPC水溶解RNA,测定RNA浓度和纯度。
1.5 实时荧光定量PCR (Real-time PCR)按照逆转录试剂盒操作说明合成cDNA第一条链,用该cDNA为模板,GAPDH为内参,用相应引物对其进Real-time PCR,引物由Invitrogen life technology公司合成(表 1),整个实验操作流程在ABI7500荧光定量PCR仪上进行。PCR反应体系共20 μL,按照德国DBI试剂盒的要求在冰上操作:上游引物(20 μmol/L) 0.2 μL,下游引物(20 μmol/L) 0.2 μL,cDNA (500 ng/20 μL) 5 μL,50×ROX 0.04 μL,Bestar® SybrGreenqPCRmastermix 10 μL,DEPC-treated water 4.56 μL。反应条件采用3步法:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,完成35个循环。每个样本3个复孔,取Ct的平均值。本研究采用2-△△ct相对定量来检测DKKL1 mRNA在正常精液精子和弱精子症精液精子的表达差异。△Ct值=待测基因Ct值-内参基因Ct值,△△ Ct=实验组目的基因△Ct值-对照组目的基因△Ct值。以Fold-change=2-△△ct表示弱精子症和正常精液精子中DKKL1 mRNA的倍比关系。
| 表 1 引物信息 Table 1 Primer sequence information |
将纯化精子重悬于细胞裂解液RIPA,同时按1:100的比例加入蛋白酶抑制剂PMSF (100 mg/mL),超声裂解10 s×5次,放置冰上0.5 h。接着,4 ℃、12 000×g离心15 min,上清即为精子总蛋白。用Pierce公司的BCA蛋白定量试剂盒检测蛋白浓度,并调整蛋白浓度为2 mg/mL,加入5×SDS Loading buffer,100 ℃煮5 min。配置10%的SDS-PAGE胶,每孔上样20 µL蛋白,常规电泳和转膜,用含5% BSA的PBST室温封闭1 h,兔抗DKKL1一抗4 ℃孵育过夜。次日,PBST洗膜3次,每次10 min。然后用HRP-羊抗兔IgG二抗室温孵育1 h,PBST洗膜3次,每次10 min,用化学发光法(ECL)显影。采用Quantity One图像分析软件测定每条带的灰度值,用样本与相对应内参GAPDH的灰度值比值作为该样本蛋白的相对表达量。
1.7 统计学分析采用SPSS 20.0软件进行统计分析,实验数据以均数±标准差表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果 2.1 精液常规分析结果80例精液常规分析结果显示,弱精子症和正常人两组之间的年龄、精液体积、精子浓度和正常精子形态比例均没有统计学差异(P>0.05)。与正常组相比,弱精子症组的PR和PR+NP精子比例显著降低(P<0.01)。两组精液常规分析结果(表 2)。
| 表 2 两组精液分析的主要参数比较 Table 2 Comparison of semen parameters between the two groups (n=40, Mean±SD) |
采用实时荧光定量PCR方法检测正常组和弱精子症组精子细胞内DKKL1的表达情况。DKKL1为目的基因,GAPDH作为内参基因,数据作标准化处理后,正常组和弱精子症组的△Ct值分别为7.11±0.75和11.58± 1.59。与正常组精子比较,DKKL1在弱精子症组中的表达显著下降(P<0.01)(2-△△ct对应值分别为1和0.09),降低了11.1倍,而GAPDH在两组之间的表达无显著性差异。成熟精子细胞主要为细胞核,RNA含量很少,而睾丸生精细胞以及白细胞等圆形细胞的RNA含量比较高,排除生精细胞和白细胞的污染,才能保证结果的准确性。因此,我们设计引物C-kit (生精细胞标志物)和CD45 (白细胞标志物)的引物,同时进行PCR扩增,结果未能检测到C-kit和CD45在精液标本中表达,排除了生精细胞和白细胞的污染。
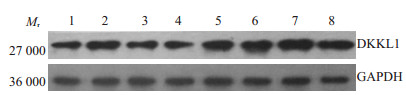
2.3 弱精子症精液精子中DKKL1蛋白表达水平下降为了进一步探讨DKKL1蛋白在弱精子症精液精子中的表达情况,我们采用Western blot技术检测了4例弱精子症精子样本和4例正常精子样本中DKKL1蛋白的表达水平。正常组和弱精子症组均在27 000相对分子质量处出现DKKL1条带,同时在相对分子质量为36 000处检测到内参蛋白GAPDH,两组样本GAPDH条带颜色深浅相近,表明各组蛋白上样量基本一致,实验结果准确可靠(图 1)。Western blot结果显示弱精子症精子中DKKL1蛋白的表达量明显低于正常对照组。采用Quantity One图像分析软件进行灰度值分析,弱精子症组DKKL1蛋白表达与正常对照组相比,降低了2.4倍,差异具有统计学意义(P<0.01)。
|
图 1 Western blot检测DKKL1蛋白在正常对照组和弱精子症患者精子中的表达 Figure 1 DKKL1 protein in semen from normal or asthenozoospermia males by Western blotting. 1-4: Asthenospermia; 5-8: Normal. |
我们前期研究发现包括DKKL1/Dkkl1在内的一系列与哺乳动物精子发生相关的基因[12-16],均呈睾丸特异性表达,尚缺乏DKKL1与弱精子症关系的研究。本实验严格按照入选标准选取了40例正常对照组和40例弱精子症精液作为研究对象,排除生殖道炎症、精索静脉曲张、腮腺炎史、血清性激素异常者、近期接触过放射线和有毒有害物质等可能影响精液质量的因素,保证结果的可靠性[17]。精液质量作为影响男性生育力的主要因素,除了与精子活动力密切相关外,还与年龄、精液体积、精子浓度和正常精子形态比例有关。年龄增长导致男性睾丸、输精管、前列腺和附睾等生殖器官器质性改变,会影响整个生精过程和精液质量指标[18];正常精液体积为1.5~6 mL,过少或过多都会导致男性不育;精子浓度是评价男性生育能力的重要指标之一,轻、中、重度少精子症患者自然受孕几率下降,极度少精子症患者只能通过卵胞浆内单精子注射技术来实现生育需求[19];精子形态被认为是衡量男性生育能力的较好指标,形态正常精子比例与睾丸生理功能密切相关,该比例下降直接反映出睾丸的生理功能下降,进而影响男性的生育能力[20]。本实验的80例精液常规分析结果显示,弱精子症和正常人两组之间的年龄、精液体积、精子浓度和正常精子形态比例均没有统计学差异(P>0.05),从而排除由年龄、精液体积、精子浓度和正常精子形态比例的异常引起的男性不育。相反,与正常组相比,弱精子症组的PR和PR+NP精子比例显著降低(P<0.01),说明DKKL1mRNA和蛋白在两组中的表达差异主要与精子的活动力有关。
哺乳动物成熟精子是高度特化的单倍体细胞,仅含微量RNA,是精子发生过程中的转录产物,可以间接反映哺乳动物精子形成过程中的转录情况,与精子发生和男性不育相关。由于成熟精子较睾丸组织更加容易获得,因此成熟精子mRNA可以用来反映男性生育力的新途径[21]。然而,精液中的睾丸生精细胞以及白细胞等圆形细胞的RNA含量比较高[22]。为了排除生精细胞和白细胞的污染,保证结果的准确性,本研究采用4个梯度的Percoll法离心分离和纯化精子,收集正常组中95% Percoll以下的精子为活力正常组,收集弱精子症组57%与76% Percoll层之间的精子为弱精子症组,设计引物C-kit (生精细胞标志物)和CD45 (白细胞标志物)的引物,同时进行PCR扩增,结果未能检测到C-kit和CD45在精液标本中表达,与许祥[23-24]等的实验结果相符。该结果证实4个梯度的Percoll非连续密度梯度离心法能迅速有效地分离不同活力的精子,并且能同时纯化精子和排除其他生精细胞和白细胞的影响,该方法有助于发现精子运动相关的关键基因。
分离纯化到所需精子后,我们采用实时荧光定量PCR方法检测DKKL1 mRNA在正常人和弱精子症患者精子中的表达特征,结果显示与正常对照组相比,DKKL1 mRNA在弱精子症患者中表达下降了约11.1倍,表达差异具有统计学意义(P<0.01)。然而,生物体内mRNA的表达量和蛋白质的表达丰度往往是不一致的,蛋白质才是真正生物学功能的执行者,因此,采用Western blot技术进一步检测DKKL1的蛋白表达水平,结果发现DKKL1蛋白在弱精子症组的相对表达量与正常对照组相比下降了2.4倍,两种方法结果一致。有研究表明DKKL1在男性不育患者睾丸组织较正常成人睾丸组织中表达降低,而在唯支持细胞综合征(SCOS)和隐睾患者睾丸组织中不表达[25],推测DKKL1 mRNA和蛋白的表达水平异常是影响精子活力和男性生育力的一个主要因素。Kohn等[26]还发现,与野生型小鼠精子相比,在体内外Dkkl1-/-小鼠精子穿透小鼠卵子透明带的能力下降,严重影响精子和卵子的受精作用,导致生育能力下降,提示Dkkl1与精子的获能、受精以及精子的活动力密切相关。本研究结果同样表明,DKKL1 mRNA和蛋白在弱精子症患者中的表达水平明显低于正常生育男性,由此可见DKKL1在精子运动及调控机制中发挥着重要作用,然而目前具体机制尚不明确。
综上所述,DKKL1在弱精子症患者精子中的表达是下调的。然而,到底是弱精子症导致DKKL1表达下调?还是由于DKKL1基因转录和蛋白翻译出现异常,使DKKL1功能低下或者功能丧失,从而导致弱精子症的形成?目前还没定论。尚需对DKKL1的表达调控机制、在细胞内的信号转导通路以及DKKL1相互作用蛋白等,再做进一步的深入研究。
| [1] |
World Health Organization.
WHO laboratory manual for the examination and processing of human semen[M]. Switzerland: WHO Press, 2011: 224-6.
|
| [2] |
Harton GL, Tempest HG. Chromosomal disorders and male infertility[J].
Asian J Androl, 2012, 14(1): 32-9.
DOI: 10.1038/aja.2011.66. |
| [3] |
Curi SM, Ariagno JI, Chenlo PH, et al. Asthenozoospermia: analysis of a large population[J].
Arch Androl, 2003, 49(5): 343-9.
DOI: 10.1080/01485010390219656. |
| [4] |
周俊豪. CRISP2蛋白在弱精症精液精子中表达下调的分子机制及其临床意义[D]. 广州: 南方医科大学, 2015.
http://cdmd.cnki.com.cn/Article/CDMD-12121-1016004080.htm
|
| [5] |
Visser L, Westerveld GH, Xie F, et al. A comprehensive gene mutation screen in men with asthenozoospermia[J].
Fertil Steril, 2011, 95(3): U213-1020.
|
| [6] |
Mitchell V, Sigala J, Jumeau F, et al. ICSI treatment in severe asthenozoospermia[J].
Gynecol Obstet Fertil, 2012, 40(12): 776-9.
DOI: 10.1016/j.gyobfe.2012.10.003. |
| [7] |
Ortega C, Verheyen G, Raick D, et al. Absolute asthenozoospermia and ICSI: what are the options?[J].
Hum Reprod Update, 2011, 17(5): 684-92.
DOI: 10.1093/humupd/dmr018. |
| [8] |
Kohn MJ, Kaneko KJ, Depamphilis ML. DkkL1 (soggy), a dickkopf family member, localizes to the acrosome during mammalian spermatogenesis[J].
Mol Reprod Dev, 2005, 71(4): 516-22.
DOI: 10.1002/mrd.v71:4. |
| [9] |
Dakhova O, O'day D, Kinet N, et al. Dkkl1 regulates post-pubertal spermatocyte apoptosis and testosterone production[J].
Endocrinology, 2009, 150(1): 404-12.
DOI: 10.1210/en.2008-0673. |
| [10] |
Yan Q, Wu X, Chen C, et al. Developmental expression and function of DKKL1/Dkkl1 in humans and mice[J].
Reprod Biol Endocrinol, 2012, 10(51): 1-9.
|
| [11] |
Lambard S, Galeraud-Denis I, Martin G, et al. Analysis and significance of mRNA in human ejaculated sperm from normozoospermic donors: relationship to sperm motility and capacitation[J].
Mol Hum Reprod, 2004, 10(7): 535-41.
DOI: 10.1093/molehr/gah064. |
| [12] |
Yan QX, Guo XY, Chen CR, et al. Expression of dickkopf-like1 protein(Dkkl1)in mouse testis[J].
J Reprod Contr, 2015, 26(1): 6-13.
|
| [13] |
Zhou Y, Qin D, Tang A, et al. Developmental expression pattern of a novel gene, TSG23/Tsg23, suggests a role in spermatogenesis[J].
Mol Hum Reprod, 2009, 15(4): 223-30.
DOI: 10.1093/molehr/gap015. |
| [14] |
Zhang XY, Yan QX, Guo XY, et al. Expression profile of SPACA5/ Spaca5 in spermatogenesis and transitional cell carcinoma of the bladder[J].
Oncol Lett, 2016, 12(5): 3731-8.
DOI: 10.3892/ol.2016.5164. |
| [15] |
Tang A., Yan Q, Sun L, et al. Developmental expression of ACRV1 in humans and mice[J].
Andrologia, 2012, 44(1): 16-22.
DOI: 10.1111/and.2012.44.issue-1. |
| [16] |
颜秋霞, 唐爱发, 葛颂, 等. 精子顶体小泡蛋白-1(ACRV1)在小鼠睾丸组织中的表达与定位[J].
生殖与避孕, 2011, 31(9): 582-6.
|
| [17] |
武文斌, 李玉山, 冯晓霞, 等. CATSPER1蛋白与特发性弱精子症关系的研究[J].
中华男科学杂志, 2011, 17(2): 110-4.
|
| [18] |
龙云, 朱辉, 崔永言, 等. 改良阴茎延长术的解剖学研究和临床应用[J].
中华整形外科杂志, 2010, 26(2): 116-9.
|
| [19] |
Javed M, Esfandiari N, Casper RF. Failed fertilization after clinical intracytoplasmic sperm injection[J].
Reprod Biomed Online, 2010, 20(1): 56-67.
DOI: 10.1016/j.rbmo.2009.10.010. |
| [20] |
Sallam HN, Ezzeldin F, Sallam A, et al. Sperm velocity and morphology, female characteristics, and the hypo-osmotic swelling testas predictors of fertilization potential: experience from the IVF model[J].
Int J Fertil Women Med, 2003, 48(2): 88-95.
|
| [21] |
Miller D, Ostermeier GC. Towards a better understanding of RNA carriage by ejaculate spermatozoa[J].
Hum Reprod Update, 2006, 12(6): 757-67.
DOI: 10.1093/humupd/dml037. |
| [22] |
Lambard S, Galeraud-Denis G, Bouraima H, et al. Expression of aromatase in human ejaculated spermatozoa:a putative marker of motility[J].
Mol Hum Reprod, 2003, 9(3): 117-24.
DOI: 10.1093/molehr/gag020. |
| [23] |
许祥, 易翔, 廖苏才, 等. Tektin 2在弱精症患者精子中的表达特征及临床意义[J].
临床泌尿外科杂志, 2017, 32(5): 378-82.
|
| [24] |
颜秋霞, 漆正宇, 赵晓英, 等. ACRV1在正常男性和弱精子症患者精液精子中的表达差异[J].
中国男科学杂志, 2015, 29(2): 12-6.
|
| [25] |
颜秋霞, 唐爱发, 来永庆, 等. 精子顶体相关基因DKKL1在正常人和男性不育患者睾丸组织中的表达差异[J].
实用医学杂志, 2014, 30(1): 36-9.
|
| [26] |
Kohn MJ, Sztein J, Yagi R, et al. The acrosomal protein Dickkopflike 1 (DKKL1) facilitates sperm penetration of the zona pellucida[J].
Fertil Steril, 2010, 93(5): 1533-7.
DOI: 10.1016/j.fertnstert.2009.06.010. |
 2018, Vol. 38
2018, Vol. 38

