目前很多研究表明,在诸如帕金森(PD) [1-2]、老年痴呆症(AD) [3-5]等神经退行性疾病[6]中,基底节中的铁沉积会增加,并且可能导致神经元死亡。因此,脑铁沉积的定量分析对于神经退行性疾病的诊断与预防具有临床意义。
磁共振成像(MRI)作为一种无创伤、无辐射的成像技术,在铁沉积定量测量方面具有不可比拟的优势。铁离子是顺磁性物质,会导致磁场的不均匀性,缩短氢质子的横向弛豫时间(T2*),使得磁共振信号快速衰减,在T2*加权的幅度图中表现为低信号。可以利用多回波的梯度回波序列采集MRI数据,然后对回波时间与对应的幅度信号强度进行指数衰减模型拟合,得到每个像素点的横向磁化率值(R2*)。R2*成像作为一种传统的磁共振铁定量分析方法[7-12],在肝[13-16]、脾[17]、心脏[18-19]、大脑[20]等解剖部位铁测量方面有着很广泛的临床应用。
传统的R2*成像仅使用到磁共振信号的幅度信息,而忽略掉相位信息。相位信息包含组织很多丰富信息,并能够反映组织间由于磁化率的差异引起的磁场变化。磁化率是物质本身内在性质,所以早在21世纪初,就有学者提出对磁敏感性物质做磁化率定量分析的概念[21-22],即定量磁化率成像(QSM)。近年来,随着相关算法技术的改进与完善,很好的克服了QSM面临的两大基本问题:去除背景场[23-28];场到源的逆问题[29-37]。因此,目前QSM已经广泛应用到与铁沉积相关的神经退行性疾病的临床研究上[1-6]。
R2*与QSM两种定量分析铁沉积的方法都已经成功应用到帕金森患者上[1-2],多项研究表明帕金森患者大脑的黑质区域存在铁沉积的异常升高,并且得到尸检的病理学证明[38]。但是该病的发病机制尚未明确,因此借助小鼠模型对探索发病机制意义重大,而小鼠脑铁含量远远低于人脑中的铁含量,这要求MR铁定量分析方法必须有优越的准确度与敏感性。本文旨在通过超顺磁性氧化铁(SPIO)体模实验比较QSM与R2*两项成像技术在铁沉积定量分析中的准确度,并且将这两种方法应用到MPTP致帕金森病小鼠模型中,对小鼠黑质区域的铁沉积进行定量分析,是否能够检测出模型组与对照组的铁沉积差异,比较QSM与R2*两项成像技术在铁沉积定量分析中的敏感度。
1 材料和方法 1.1 超顺磁性氧化铁(SPIO)体模稀释1 mg/mL的SPIO溶液,配制5个浓度梯度:30、15、7.5、3.75、1.875 μg/mL,分别装在小气球里面,防止溶液扩散,再依次把5个浓度梯度的气球放到50 mL的试管中,用1%的琼脂糖溶液待其凝固后起固定气球作用。
1.2 MPTP致帕金森病小鼠模型 1.2.1 实验动物C57BL/6J小鼠(雄性,8周龄,体质量20~23 g),购于南方医科大学实验动物中心提供。实验动物的使用获得南方医科大学南方医院动物实验伦理会批准。
1.2.2 试剂材料1-甲基-4-苯基-l,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahy-dropyridine, MPTP),为Sigma产品。过氧化氢、甲醇、山羊血清、羊抗兔IgG二抗、乙醇、4%多聚甲醛溶液、戊巴比妥粉末、PBS缓冲液和生理盐水购自广州辰迩生物技术有限公司。
1.2.3 实验组与对照组待小鼠适应环境1周后,按简单随机原则将符合标准的小鼠随机分为实验组和对照组。实验组:5只C57BL小鼠,采用腹腔注射,注射剂量为25 mg/kg MPTP,每周注射2次,连续注射5周。另外5只对照组小鼠同一时间注射等体积0.9%生理盐水。
1.2.4 行为学观察自注射药物开始,每天观察每只小鼠是否有震颤、竖毛、前腿抬高、竖尾、动作缓慢、减少等异常行为。
行为学实验(Rotarod实验):参照实验方法[39-41],进行行为学评分,最后一次MPTP注射后过1周正式开始行为学实验,以不同的转棒旋转速度下小鼠在转棒上停留的时问来反映小鼠的行为学表现。实验开始前,先分别进行3次行为学训练。选择5个递增的旋转速度(16、18、20、2、24 r/min),每两个转速之间让动物至少休息5 min,每个速度的测量时间为150 s。记录动物在转棒上停留的时间。注药结束后的第1,3,4周进行系统行为学观察和评分。所有观察指标由经过专业训练且不知道实验分组的人员进行观察并记录,确保所有指标客观准确。
1.2.5 动物灌流固定腹腔注射1%戊巴比妥0.1 mL进行深度麻醉后,迅速左心插管,同时剪开右心耳使回心血液流出,并夹闭降主动脉以保证对头部的灌流,先用50 mL生理盐水快速左心灌注直至肝脏等部位颜色变白,确保血液冲洗充分,5~10 min后,用4 ℃的4%多聚甲醛溶液50 mL灌流固定,先快后慢,持续20~30 min。完整取出脑组织,固定于4%多聚甲醛溶液中,放置于4 ℃冰箱24 h以固定标本。后用PBS缓冲液清洗表面的多聚甲醛,准备对离体标本进行磁共振检查。
1.2.6 免疫组织化学检测小鼠黑质内酪氨酸脱氢酶(TH)的表达从冰箱中取出切片,室温放置1 h,放入丙酮中固定10 min,使用PBS清洗3次,每次5 min。3%的过氧化氢+60%甲醇孵育5 min,再用PBS清洗3次,每次5 min;使用免疫组化笔画圈防止抗体外溢;5% (v/v)山羊血清室温封闭30 min;甩掉玻片上残余的液体,滴加1:200稀释的兔抗鼠TH多克隆抗体,37 ℃孵育2 h;除去玻片上的一抗液体,使用PBS洗3次,5 min/次。滴加羊抗兔IgG二抗,37 ℃孵育1 h;PBS洗3次,5 min/次,滴加辣根酶HRP标记的工作液,37 ℃孵育30 min,使用PBS洗3次,5 min/次;弱光下进行室温DAB显色,使用显微镜来控制显程度,纯水轻轻冲洗;使用不同浓度的乙醇进行脱水,然后二甲苯透明和中性树胶封片。
阴性对照组除使用山羊血清代替一抗外,其它步骤不变。正常情况下阴性对照组不显色,出现棕黄色为阳性。
1.3 磁共振扫描采用7.0T Bruker (70/16)小动物磁共振成像设备,扫描序列为多回波3D梯度回波,扫描参数如下:
SPIO体模:QSM与R2*的FOV与分辨率都相同,分别为90 mm×30 mm×30 mm,各向同性0.5 mm;(1) R2*扫描参数:TE1/△TE/TR=2.4 ms/10 ms/207 ms;20个回波;翻转角FA=50°;(2) QSM扫描参数:TE1/△TE/ TR=1.6 ms/1.37 ms/25 ms;8个回波;翻转角FA=15°;小鼠离体标本R2*与QSM扫描参数相同:TE1/△TE/TR= 5.37 ms/8.07 ms/250 ms;8个回波;翻转角FA=35°;分辨率为各向同性0.05 mm。
1.4 磁共振图像后处理在MATLAB 2014b 64位平台上对MR数据计算QSM和R2*。
1.4.1 QSM重建基于STISuite [24]软件包(Duke University, http://people.duke.edu/~cl160/)对采集得到的数据进行后处理得到QSM,其中对相位图采用拉普拉斯(Laplacian)方法[32]进行解缠绕,采用可变球核的复杂谐波伪影去除法[34](VSHARP)去除背景场,最后通过条形伪影减少法[37](STAR-QSM)对组织场进行场到源的反演,得到最终的定量磁化率图像。由于QSM得到的每个像素点的磁化率并不是绝对磁化率值,而是相对磁化率,所以需要选取一个参考值用于磁化率校正,根据已有的研究[4, 42],本文采用整个大脑的磁化率平均值作为一个参考值。
1.4.2 R2*重建对多回波的幅度图,基于线性运算自回归方法[6],逐点进行单指数拟合,可以快速准确得到R2*图。
1.5 勾选感兴趣区(ROI)采用ITK-SNAP [43]软件选取3D ROI,其中SPIO体模的ROI为每个气球里面的SPIO溶液;小鼠ROI为大脑黑质区域,由一名经验丰富的影像科医生依照小鼠脑立体定位图谱(第2版)从黑质最大层面开始依次逐层手动勾画,并交由另一名影像科医生进行检查。
1.6 数据统计分析 1.6.1 SPIO体模数据分析在MATLAB 2014b 64位平台上分别对R2*值、QSM值与SPIO溶液浓度做线性回归分析,通过比较R2,评估R2*、QSM与SPIO浓度的相关性。
1.6.2 动物实验数据分析采用SPSS 22.0软件,首先对实验组(n=5)与对照组(n=5)的行为学评分、R2*值、QSM值分别进行K-S检验以验证数据是否符合正态分布,再进行独立样本t检验。P<0.05表示差异有统计学意义。
2 结果 2.1 SPIO体模实验结果从图 1中可以看出随着SPIO浓度的增加,QSM和R2*越亮,两种方法都能反应铁含量大小。图 1分别给出了SPIO浓度与QSM (图 1C)、R2* (图 1D)线性回归图,R2*与SPIO浓度的R2约为0.89,说明R2*能在一定程度上定量分析出铁含量,而QSM与SPIO浓度的R2高达0.98,并且同一浓度的QSM值方差比R2*的方差要小,说明QSM对铁含量的定量分析比R2*更精准。
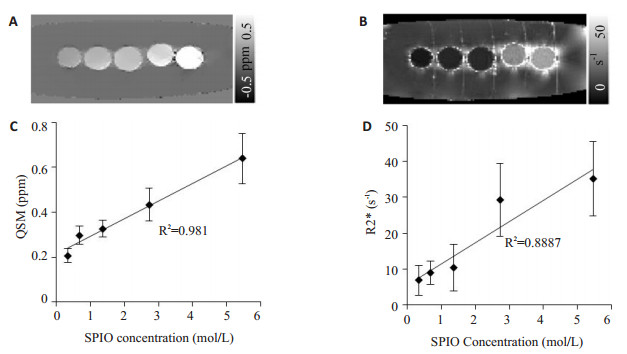
|
图 1 SPIO体模实验结果 Figure 1 Results in SPIO phantoms. A: QSM; B: R2*; C, D: Linear regression between SPIO concentration and susceptibility and between SPIO concentration and R2*, respectively. |
图 2为实验组(n=5)与对照组(n=5)的小鼠在rotarod行为学实验中,5个转速下对应的转轴上停留平均时间。当转速为16 r/min时,两组小鼠的转轴停留时间没有显著差异,随着转速的增加,小鼠只有通过跑动才能停留在转轴上,当小鼠运动功能受到损害时,则在转速高的情况下,停留在转轴上的时间会减少。通过图 2可知,当转速达到18 r/min时,实验组的小鼠在转轴上的停留时间开始极显著降低(P<0.001),并且在转速为20 r/min时,两组小鼠在转轴上的停留时间相差最大,这一行为学结果说明实验组小鼠运动功能受损,符合MPTP模型的临床表现[39]。
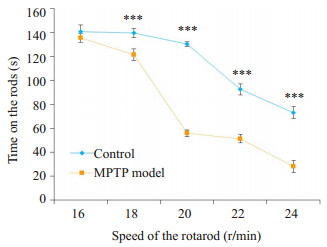
|
图 2 不同转速下2组小数在转轴上平均停留时间的曲线 Figure 2 Average time of the two groups of mice staying on the rod at different revolving speeds. ***P < 0.001. |
对照组(图 3A)可见大量TH阳性神经元和纤维,且阳性染色强,而实验组的TH阳性神经元数量明显减少,且阳性染色比较弱,说明实验组(图 3B)中的多巴胺神经元明显减少。符合MPTP模型的黑质多巴胺神经元变性坏死这一病理特征[44-45],证明实验组模型建立成功。
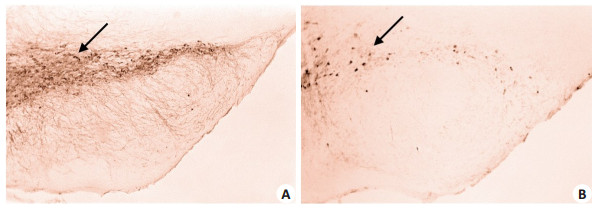
|
图 3 40倍镜下黑质部位TH免疫组化染色结果 Figure 3 TH cells stained by immunohistochemistry in the substantia nigra (Original magnification: × 40). A: Control group; B: MPTP group. |
图 4给出对照组与实验组的QSM (图 4A和B)、R2* (图 4D和E)以及两组小鼠QSM (图 4C)和R2* (图 4F)统计结果。从QSM图中的黑质区域,可以看出实验组(图 4B)比对照组(图 4A) QSM值高,实验组的黑质磁化率为5.19±1.58 (均值±标准差,n=5),对照组为2.98±0.88 (n= 5),图 4C显示数理统计结果具有显著性差异(P<0.05);而在R2*图中,实验组的黑质横向弛豫率为20.22±0.94 (n=5,图 4E)与对照组的19.74±1.75 (n=5,图 4D),图 4F的统计结果显示两组间没有显著差异(P=0.60)。结果表明QSM在铁沉积定量分析中比R2*具有更高的敏感性,可以检测出实验组与对照组之间铁沉积的差异。
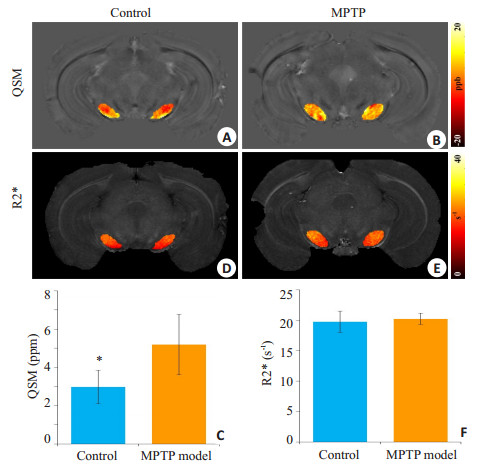
|
图 4 QSM与R2*定量分析两组小鼠黑质部位铁沉积结果 Figure 4 Quantitative brain iron deposition of QSM (A, B) and R2* (D, E) in the substantia nigra of the mice. C, F: Statistic results of QSM and R2*, respectively. *P < 0.05. |
铁是人体内非常重要的一种微量元素,在机体的氧气运输和细胞的有氧代谢、电子传递过程发挥着巨大的作用。正常脑内铁的含量受到严格精密调控,当机体铁代谢机制出现紊乱时,铁负荷过重将诱导氧自由基产生并介导氧化应激损伤,从而导致神经细胞的凋亡,并进一步导致脑萎缩。很多研究已证实[1-6],一些中枢神经系统疾病的进程中会出现铁代谢异常,并可能导致大脑中铁离子的过度沉积现象,如帕金森病[1-2]、阿尔茨海默病[3-5]、多发性硬化[46]、亨廷顿病[47]等。因此,非侵入性地对脑内铁沉积精确定量分析,对了解疾病发病机制、发展过程、诊断以及评估治疗效果具有重要意义。
磁共振作为一种非侵入性、无辐射、分辨率高的前沿技术,在人体内铁的定量分析中具有无可比拟的优越性。脑内铁多以非血红素的形式存储在铁血黄素和铁蛋白中,是一种强顺磁性物质,影响磁化率的变化,可缩短质子横向弛豫时间(T2*),很多学者利用这一属性,通过梯度回波序列,对多回波的幅度信号进行单指数拟合,得到R2*(1/T2*)值,对组织内的铁含量做定量分析。R2*作为磁共振中铁定量分析的热门领域,国内外很多科研工作[7-12]不断对信号模型和拟合方法改进以提高R2*的精准度以及获取R2*的速度。然而在磁化率差异较大的组织界面附近(如空气与软组织、颅底骨气交界处等),R2*受影响较大,因此R2*反映的是总的磁敏感的变化,不能准确反映铁的浓度。
随着算法技术的改进,学者们开始利用包含组织磁化率变化丰富信息的相位图,一项新的铁定量分析方法——QSM [48]。QSM通过场到源的反演,能得到每个体素点的磁化率值,而磁化率值是物质特有的本质属性,从而准确反映组织内的铁含量。在得到磁化率分布图之前,QSM技术要先对解缠绕后的相位图去除不均匀的背景场,得到反映组织内部磁化率变化的组织场,其中可变球核的复杂谐波伪影去除法[34]和偶极场投影法[23]等方法能得到准确的局部场图。这一步骤理论上表明QSM方法去除了也能影响磁场变化的外源物质,因此比R2*能更精确地对铁含量进行定量分析。
目前QSM与R2*两种定量方法都成功应用于人类的脑铁含量研究[1-6, 20, 38, 46-47]中,但是应用在动物模型铁沉积的研究甚少,因为小鼠脑铁含量[49]比人类的脑铁含量[38]低很多,这对脑铁定量方法的准确性与敏感度要求更高。与现有研究不同,本文的研究工作是QSM与R2*首次在MPTP小鼠模型的应用,定量分析黑质区域铁含量的变化,比较两种铁定量分析方法的敏感度,为与铁沉积相关的动物模型提供一个准确、灵敏的生物学标记。
本文的实验结果能很好地体现了QSM在铁定量分析上较R2*优越,与上述理论讨论的结果一致。在SPIO体模实验中,磁化率值与SPIO浓度的线性回归R2高达0.98,非常接近1,比R2*更准确反映出铁含量。在MPTP小鼠模型实验中,QSM也成功地检测到实验组与对照组在黑质的磁化率有显著差异(P<0.05),与You等[50]在MPTP小鼠模型通过同步辐射X荧光检测到黑质区域过量铁沉积的结果一致,而R2*未能检测出这一差异(P=0.60),表明QSM比R2*成像在铁定量分析方面敏感度更高,更容易检测出铁含量的微小差异。
目前,MPTP是使用最广泛的重要PD动物模型产生物,能特异性地损耗多巴胺神经元的结构,其诱导产生的症状与人类PD非常相似,因此MPTP诱导的小鼠模型是研究PD疾病发生发展过程和发病机制的重要工具。笔者在比较QSM与R2*两种铁定量分析方法的精准度与敏感度时,首次将QSM应用到MPTP模型中,并且成功地检测到MPTP模型与对照组的磁化率有显著差异,表明QSM在铁定量分析中比R2*准确性和敏感性越高,提示QSM可以作为一个非常有潜力的研究PD疾病的生物学标记。
本研究的实验组与对照组各5只小鼠,样本量有限,接下来的研究中将加大样本量,更充分地证明QSM在铁定量分析中的精准度与敏感性,并且将通过QSM进一步研究铁沉积与PD病期的关系以及评估治疗效果。
| [1] |
Acosta-Cabronero J, Cardenas-Blanco A, Betts MJ, et al. The whole-brain pattern of magnetic susceptibility perturbations in Parkinson's disease[J].
Brain, 2017, 140(1): 118-31.
DOI: 10.1093/brain/aww278. |
| [2] |
Langkammer C, Pirpamer L, Seiler SA, et al. Quantitative susceptibility mapping in parkinson's disease[J].
PLoS One, 2016, 11(9): e0162460.
DOI: 10.1371/journal.pone.0162460. |
| [3] |
Acosta-Cabronero J, Williams GB, Cardenas-Blanco A, et al. In vivo quantitative susceptibility mapping (QSM) in alzheimer's disease[J].
PLoS One, 2013, 8(11): e81093.
DOI: 10.1371/journal.pone.0081093. |
| [4] |
O'callaghan J, Holmes H, Powell N, et al. Tissue magnetic susceptibility mapping as a marker of tau pathology in Alzheimer's disease[J].
Neuroimage, 2017, 159(6): 334-45.
|
| [5] |
van Bergen JM, Li X, Hua J, et al. Colocalization of cerebral iron with amyloid beta in mild cognitive impairment[J].
Sci Rep, 2016, 6(5): 35514.
|
| [6] |
Yao S, Zhong Y, Xu YH, et al. Quantitative susceptibility mapping reveals an association between brain Iron load and depression severity[J].
Front Hum Neurosci, 2017, 11(3): 442.
|
| [7] |
Raya JG, Dietrich O, Horng A, et al. T(2) measurement in articular cartilage: impact of the fitting method on accuracy and precision at low Snr[J].
Magn Reson Med, 2010, 63(1): 181-93.
|
| [8] |
Feng YQ, He TG, Gatehouse PD, et al. Improved MRI R-2* relaxometry of iron-loaded liver with noise correction[J].
Magn Reson Med, 2013, 70(6): 1765-74.
DOI: 10.1002/mrm.v70.6. |
| [9] |
Ben-Eliezer N, Sodickson DK, Block KT. Rapid and accurate T-2 mapping from Multi-Spin-Echo data using Bloch-simulation-based reconstruction[J].
Magn Reson Med, 2015, 73(2): 809-17.
DOI: 10.1002/mrm.25156. |
| [10] |
Yokoo T, Yuan Q, Senegas J, et al. Quantitative R2* MRI of the liver with rician noise models for evaluation of hepatic iron overload: Simulation, phantom, and early clinical experience[J].
J Magn Reson Imaging, 2015, 42(6): 1544-59.
DOI: 10.1002/jmri.24948. |
| [11] |
Pei MC, Nguyen TD, Thimmappa ND, et al. Algorithm for fast monoexponential fitting based on Auto-Regression on linear operations (ARLO) of data[J].
Magn Reson Med, 2015, 73(2): 843-50.
DOI: 10.1002/mrm.25137. |
| [12] |
Song RT, Loeffler RB, Holtrop JL, et al. Fast quantitative parameter maps without fitting: Integration yields accurate mono xponential signal decay rates[J].
Magn Reson Med, 2017, 58(4): 45-6.
|
| [13] |
Wood JC, Enriquez C, Ghugre N, et al. MRI R2 and R2* mapping accurately estimates hepatic iron concentration in transfusiondependent thalassemia and sickle cell disease patients[J].
Blood, 2005, 106(4): 1460-5.
DOI: 10.1182/blood-2004-10-3982. |
| [14] |
Hankins JS, Mccarville MB, Loeffler RB, et al. R2* magnetic resonance imaging of the liver in patients with Iron overload[J].
Blood, 2009, 113(20): 4853-5.
DOI: 10.1182/blood-2008-12-191643. |
| [15] |
Henninger B, Zoller H, Rauch S, et al. R2* relaxometry for the quantification of hepatic Iron overload: biopsy-based calibration and comparison with the literature[J].
R Fo-Fortschritte auf dem Gebiet der R ntgenstrahlen und der bildgebenden verfahren, 2015, 187(06): 472-9.
DOI: 10.1055/s-00000066. |
| [16] |
Hernando D, Levin YS, Sirlin CB, et al. Quantification of liver Iron with MRI: state of the art and remaining challenges[J].
J Magn Reson Imaging, 2014, 40(5): 1003-21.
DOI: 10.1002/jmri.v40.5. |
| [17] |
Brewer CJ, Coates TD, Wood JC. Spleen R2 and R2* in Ironoverloaded patients with sickle cell disease and thalassemia major[J].
J Magn Reson Imaging, 2009, 29(2): 357-64.
DOI: 10.1002/jmri.v29:2. |
| [18] |
Anderson LJ, Holden S, Davis B, et al. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial Iron overload[J].
Eur Heart J, 2001, 22(23): 2171-9.
DOI: 10.1053/euhj.2001.2822. |
| [19] |
Song RT, Cohen AR, Song HK. Improved transverse relaxation rate measurement techniques for the assessment of hepatic and myocardial Iron content[J].
J Magn Reson Imaging, 2007, 26(1): 208-14.
DOI: 10.1002/(ISSN)1522-2586. |
| [20] |
Gelman N, Gorell JM, Barker PB, et al. Mr imaging of human brain at 3.0 T: Preliminary report on transverse relaxation rates and relation to estimated iron content[J].
Radiology, 1999, 210(3): 759-67.
DOI: 10.1148/radiology.210.3.r99fe41759. |
| [21] |
Li L, Leigh JS. Quantifying arbitrary magnetic susceptibility distributions with Mr[J].
Magn Reson Med, 2004, 51(5): 1077-82.
DOI: 10.1002/(ISSN)1522-2594. |
| [22] |
Salomir R, De Senneville BD, Moonen CT. A fast calculation method for magnetic field inhomogeneity due to an arbitrary distribution of bulk susceptibility[J].
Concepts Magn Reson Part B Magn Reson Eng, 2003, 19B(1): 26-34.
DOI: 10.1002/(ISSN)1099-0534. |
| [23] |
Liu T, Khalidov I, de Rochefort LA, et al. A novel background field removal method for MRI using projection onto dipole fields (PDF)[J].
NMR Biomed, 2011, 24(9): 1129-36.
DOI: 10.1002/nbm.v24.9. |
| [24] |
Li W, Avram AV, Wu B, et al. Integrated laplacian-based phase unwrapping and background phase removal for quantitative susceptibility mapping[J].
NMR Biomed, 2014, 27(2): 219-27.
DOI: 10.1002/nbm.3056. |
| [25] |
Sun HF, Wilman AH. Background field removal using spherical mean value filtering and tikhonov regularization[J].
Magn Reson Med, 2014, 71(3): 1151-7.
DOI: 10.1002/mrm.v71.3. |
| [26] |
Zhou D, Liu T, Spincemaille P, et al. Background field removal by solving the laplacian boundary value problem[J].
NMR Biomed, 2014, 27(3): 312-9.
DOI: 10.1002/nbm.v27.3. |
| [27] |
Kan H, Kasai H, Arai N, et al. Background field removal technique using regularization enabled sophisticated harmonic artifact reduction for phase data with varying kernel sizes[J].
J Magn Reson Imaging, 2016, 34(7): 1026-33.
DOI: 10.1016/j.mri.2016.04.019. |
| [28] |
Schweser F, Robinson SD, de Rochefort L, et al. An illustrated comparison of processing methods for phase MRI and QSM: removal of background field contributions from sources outside the region of interest[J].
NMR Biomed, 2017, 30(4): 85.
|
| [29] |
Liu T, Spincemaille P, de Rochefort LA, et al. Calculation of susceptibility through multiple orientation sampling (COSMOS): A method for conditioning the inverse problem from measured magnetic field map to susceptibility source image in MRI[J].
Magn Reson Med, 2009, 61(1): 196-204.
DOI: 10.1002/mrm.v61:1. |
| [30] |
Kressler B, de Rochefort L, Liu TA, et al. Nonlinear regularization for per voxel estimation of magnetic susceptibility distributions from MRI field Maps[J].
IEEE Trans Med Imaging, 2010, 29(2): 273-81.
DOI: 10.1109/TMI.2009.2023787. |
| [31] |
Wharton S, Schaefer A, Bowtell R. Susceptibility mapping in the human brain using threshold-Based k-Space division[J].
Magn Reson Med, 2010, 63(5): 1292-304.
DOI: 10.1002/mrm.22334. |
| [32] |
Li W, Wu B, Liu CL. Quantitative susceptibility mapping of human brain reflects spatial variation in tissue composition[J].
Neuroimage, 2011, 55(4): 1645-56.
DOI: 10.1016/j.neuroimage.2010.11.088. |
| [33] |
Liu J, Liu T, de Rochefort L, et al. Morphology enabled dipole inversion for quantitative susceptibility mapping using structural consistency between the magnitude image and the susceptibility map[J].
Neuroimage, 2012, 59(3): 2560-8.
DOI: 10.1016/j.neuroimage.2011.08.082. |
| [34] |
Wu B, Li W, Guidon A, et al. Whole brain susceptibility mapping using compressed sensing[J].
Magn Reson Med, 2012, 67(1): 137-47.
DOI: 10.1002/mrm.23000. |
| [35] |
Liu T, Wisnieff C, Lou M, et al. Nonlinear formulation of the magnetic field to source relationship for robust quantitative susceptibility mapping[J].
Magn Reson Med, 2013, 69(2): 467-76.
DOI: 10.1002/mrm.24272. |
| [36] |
Liu Z, Kee Y, Zhou D, et al. Preconditioned total field inversion (TFI) method for quantitative susceptibility mapping[J].
Magn Reson Med, 2017, 78(1): 303-15.
DOI: 10.1002/mrm.v78.1. |
| [37] |
Wei HJ, Dibb R, Zhou Y, et al. Streaking artifact reduction for quantitative susceptibility mapping of sources with large dynamic range[J].
NMR Biomed, 2015, 28(10): 1294-303.
DOI: 10.1002/nbm.3383. |
| [38] |
Langkammer C, Schweser F, Krebs NA, et al. Quantitative susceptibility mapping (QSM) as a means to measure brain iron? A post mortem validation study[J].
Neuroimage, 2012, 62(3): 1593-9.
DOI: 10.1016/j.neuroimage.2012.05.049. |
| [39] |
Petroske E, Meredith GE, Callen S, et al. Mouse model of Parkinsonism: a comparison between subacute MPTP and chronic MPTP/ probenecid treatment[J].
Neuroscience, 2001, 106(3): 589-601.
DOI: 10.1016/S0306-4522(01)00295-0. |
| [40] |
白跃宗, 夏宗勤, 胡雅儿. 慢性帕金森病小鼠模型的建立及其行为学稳定性研究[J].
中国行为医学科学, 2007, 16(6): 56.
|
| [41] |
丁铭, 尹榕, 张志银. 慢性帕金森病模型小鼠的行为学表现_省略_巴胺能神经细胞及转运体的数量变化[J].
神经解剖学杂志, 2014, 30(5): 546-50.
|
| [42] |
Argyridis I, Li W, Johnson GA, et al. Quantitative magnetic susceptibility of the developing mouse brain reveals microstructural changes in the white matter[J].
Neuroimage, 2014, 88(13): 134-42.
|
| [43] |
Yushkevich PA, Piven J, Hazlett HC, et al. User-guided 3D active contour segmentation of anatomical structures: significantly improved efficiency and reliability[J].
Neuroimage, 2006, 31(3): 1116-28.
DOI: 10.1016/j.neuroimage.2006.01.015. |
| [44] |
Rekha KR, Selvakumar GP, Santha K, et al. Geraniol attenuates α-synuclein expression and neuromuscular impairment through increase dopamine content in MPTP intoxicated mice by dose dependent manner[J].
Biochem Biophys Res Commun, 2013, 440(4): 664-70.
DOI: 10.1016/j.bbrc.2013.09.122. |
| [45] |
Lazzarini M, Martin S, Mitkovski M, et al. Doxycycline restrains glia and confers neuroprotection in a 6-OHDA Parkinson model[J].
Glia, 2013, 61(7): 1084-100.
DOI: 10.1002/glia.v61.7. |
| [46] |
Langkammer C, Liu T, Khalil M, et al. Quantitative susceptibility mapping in multiple sclerosis[J].
Radiology, 2013, 267(2): 551-9.
DOI: 10.1148/radiol.12120707. |
| [47] |
van Bergen JM, Hua J, Unschuld PG, et al. Quantitative susceptibility mapping suggests altered brain iron in premanifest huntington disease[J].
AJNR Am J Neuroradiol, 2016, 37(5): 789-96.
DOI: 10.3174/ajnr.A4617. |
| [48] |
de Rochefort L, Liu T, Kressler B, et al. Quantitative susceptibility map reconstruction from Mr phase data using bayesian regularization: validation and application to brain imaging[J].
Magn Reson Med, 2010, 63(1): 194-206.
|
| [49] |
Grishchuk Y, Pena KA, Coblentz J, et al. Impaired myelination and reduced brain ferric Iron in the mouse model of mucolipidosis Ⅳ[J].
Dis Model Mech, 2015, 8(12): 1591-601.
DOI: 10.1242/dmm.021154. |
| [50] |
You LH, Li F, Wang L, et al. Brain iron accumulation exacerbates the pathogenesis of mptp-induced parkinson's disease[J].
Neuroscience, 2015, 284(12): 234-46.
|
 2018, Vol. 38
2018, Vol. 38

