2. 西安交通大学第二附属医院 内分泌科,陕西 西安 710004;
3. 西安医学院第一附属医院内分泌科,陕西 西安 710077
2. Department of Endocrinology, The Second Affiliated Hospital of Xi'an Jiao Tong University, Xi'an 710004, China;
3. Department of Endocrinology, The First Affiliated Hospital of Xi'an Medical University, Xi'an 710077, China
足细胞是肾小球滤过膜的重要组成部分,其结构的损伤和功能的改变都会影响肾小球滤过膜的通透性,对糖尿病肾病蛋白尿的出现有着非常重要的作用[1]。Nephrin(足细胞裂孔隔膜上的一种跨膜蛋白,于1998年被发现命名)是调节足细胞裂孔隔膜结构和功能的重要蛋白,可影响肾小球滤过膜的通透性及蛋白尿的产生,被作为肾脏疾病早期足细胞损伤的重要的标志物之一[2]。瞬时受体电位阳离子通道蛋白6(TRPC6)是在家族性局灶性节段性肾小球硬化病病人中发现的一种新的基因,在肾小球表达并且定位于足细胞裂孔隔膜上[3]。在一项针对人类非遗传性蛋白尿肾脏疾病的研究中发现TRPC6的超表达与蛋白尿的形成有一定关系,并推测阻断功能性TRPC6的表达可能会对蛋白尿肾脏疾病的治疗有效[4]。结合以上研究可得知,TRPC6在人类遗传性及非遗传性肾小球疾病中都出现异常表达,并与蛋白尿的出现有关。在Nephrin基因缺陷的大鼠实验中发现TRPC6过表达及重新分布,同时伴有蛋白尿的出现[5]。TRPC6的发现为我们对糖尿病肾病足细胞损伤及蛋白尿出现机制的研究提供了新的靶点[6-9]。在对TRPC6的进一步研究中,发现血管内皮生长因子(VEGF)可激动TRPC6及TRPC3离子通道,从而增加细胞内钙离子内流,导致蛋白尿出现,并指出TRPC6可能是VEGF的下游信号转导分子[10-11]。有研究指出VEGF亚型VEGF165可诱导足细胞中Nephrin及VEGFR2酪氨酸磷酸化,导致足细胞足突融合[12-13]。于是我们提出假设:VEGF可能调节Nephrin进而调节TRPC6的表达,这种调节可能是通过PI3K/Akt通路完成的,从而损伤足细胞导致蛋白尿。目前关于VEGF调节足细胞TRPC6的表达的研究仅限于体外细胞培养实验[6],为进一步明确糖尿病大鼠足细胞损伤及其体内VEGF、TRPC6的表达情况,探讨VEGF与TRPC6有无相关性及其相互作用的可能机制,本实验拟采用STZ诱导的糖尿病肾病大鼠模型研究VEGF、TRPC6与足细胞损伤之间的关系,为临床上糖尿病肾病用药新靶点提供理论依据。
1 材料和方法 1.1 材料介绍SD大鼠购买于西安交通大学医学院实验动物中心。链脲佐菌素(STZ)购于美国Sigma公司。SU5416(VEGF自身受体VEGFR-2抑制剂)及LY294002(PI3K/Akt信号通路阻滞剂)购于武汉瀚香生物科技有限公司。免疫组化所用Nephrin、VEGF、TRPC6兔抗大鼠多克隆抗体购于北京博奥森生物有限公司。RealTime PCR所用TRPC6、VEGF、Nephrin、GAPDH引物购于上海捷瑞生物公司。Westerm blot所用兔抗鼠TRPC6单抗、兔抗鼠VEGF单抗、兔抗鼠Nehrin单抗购于美国Proteintech公司,鼠抗b-actin单抗、羊抗鼠IgG、羊抗兔IgG购于美国Santa公司。实验中所使用全自动生化分析仪源于日本日立公司,实时荧光定量PCR仪、Western-Light化学发光检测系统源于Applied Biosystems公司,核酸蛋白定量仪(Nanodrop1000)源于美国Thermo公司,培清JS-680B全自动凝胶成像分析仪源于上海培清科技有限公司。
1.2 动物模型的建立和分组8周龄雄性SD大鼠58只,随机选取8只作为正常对照组(NC组,n=8),其余大鼠腹腔注射STZ后检测大鼠空腹血糖(FBG),FBG3 16.7 mmol/L(300 mg/dL)视为糖尿病造模成功,以注射STZ起为0周,4周后记录大鼠体质量,代谢笼内收集24 h尿液检测尿蛋白,并尾静脉取血检测空腹血糖(FBG)和血肌酐(Scr)及尿素氮(BUN)。造模过程中实验组大鼠死亡4只,FBG不达标6只,造模成功40只。将造模成功的40只大鼠随机分为糖尿病肾病组(DN组,n=8)及SU5416高剂量干预组(DN+SU5416高剂量组,n=8,腹腔注射SU5416 10 mg/kg,2次/周)、SU5416低剂量干预组(DN+SU5416低剂量组,n=8,腹腔注射SU5416 5mg/kg,2次/周)、LY294002高剂量干预组(DN+LY294002高剂量组,n=8,腹腔注射LY294002 2 mg/kg,1次/d)和LY294002低剂量干预组(DN+LY294002低剂量组,n=8,腹腔注射LY294002 1 mg/kg,1次/d),从第4周起开始干预,共干预8周。第12周时再次检测大鼠24 h尿蛋白、FBG、BUN及Scr。干预过程中,DN+SU高剂量组大鼠第7周和第12周时各死亡1只,DN+SU低剂量组及DN+LY高剂量组大鼠第11周时各死亡1只,最终共有44只大鼠完成全部实验。
1.3 石蜡切片制备及免疫组化12周后大鼠腹腔注射10%水合氯醛麻醉,经心脏生理盐水灌注后取出肾脏。将大鼠左肾沿横截面切开后置于10%福尔马林溶液中固定保存,石蜡包埋切片后进行HE染色和PAS染色以观察肾脏组织的病理变化,并通过免疫组化观察大鼠肾脏组织中Nephrin、VEGF、TRPC6的表达变化。
1.4 Real-time PCR将大鼠右肾放入冻存管中置于液氮中保存,采用Real-time PCR测定大鼠肾脏组织中Nephrin、VEGF、TRPC6 mRNA表达的变化。以Trizol法提取细胞总RNA。参照RT-PCR试剂盒说明书操作,PCR扩增反应条件:预变性94 ℃ 3 min,94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,共35个循环,72 ℃再延伸5 min。产物用2%琼脂糖凝胶电泳,凝胶成像分析系统进行结果扫描,以GAPDH为内参照。引物序列见表 1。
| 表 1 RT-PCR中内参及目的基因引物序列 Table 1 Primers and probes used for real-time PCR |
采用Western blot测定大鼠肾脏组织中Nephrin、VEGF、TRPC6蛋白质表达的变化。提取大鼠足细胞全蛋白,BCA法测定蛋白浓度,变性后进行SDS-PAGE凝胶电泳,转膜后封闭,分别加入一抗、二抗孵育,洗膜后加入发光液,通过化学发光检测系统曝光记录图片并分析条带灰度值。以β-actin为内参照。
1.6 统计学分析所有资料使用SPSS17.0统计软件进行分析,实验数据以均数±标准差表示,计量资料的组间比较分析采用方差分析或者t检验,当P < 0.05认为差异有统计学意义。线性相关分析采用Spearman两变量的相关性分析法,当P < 0.05认为差异有统计学意义。
2 结果 2.1 大鼠体质量及尿量变化结果实验期间,NC组大鼠体质量随时间逐渐增加(P < 0.05),尿量则无明显改变(P>0.05);DN组大鼠体质量较NC组明显减轻,且随时间逐渐减轻(P < 0.05),尿量较NC组明显增加(P < 0.05);药物干预后各组大鼠体质量及尿量较给药前无明显改变(P>0.05,图 1)。
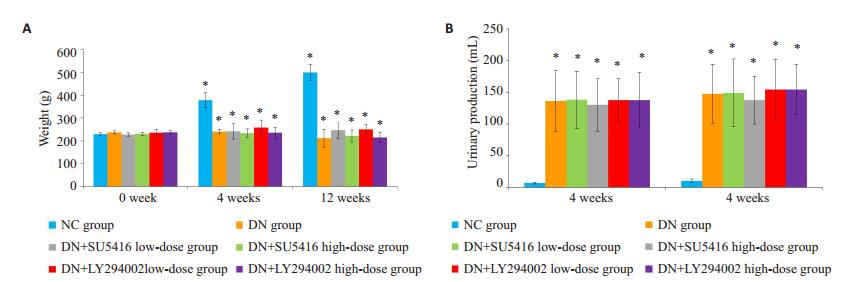
|
图 1 实验中各组大鼠体质量及尿量情况 Figure 1 Body weight changes (A) and urinary production (B) in different groups during the experiment. *P < 0.05 vs normal control (NC) group |
|
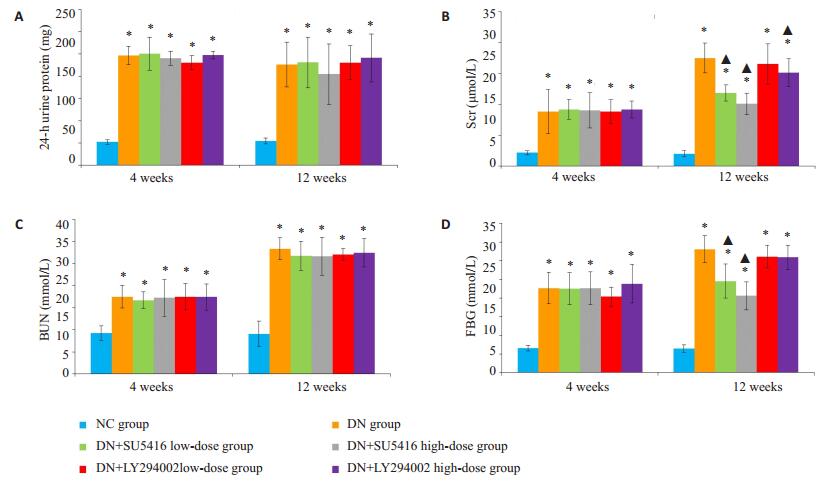
图 2 各组大鼠相关指标情况 Figure 2 Changes in fasting blood glucose (FBG; A), 24-h urine protein (B), Scr (C) and BUN (D) in the rats at 4 and 8 weeks. *P < 0.05 vs NC group; ▲P < 0.05 vs diabetic nephropathy (DN) group |
(1)FBG:实验期间NC组大鼠FBG无明显变化(P> 0.05);DN组大鼠腹腔注射STZ后FBG较NC组明显升高(P < 0.05),直至12周FBG水平相对稳定;药物干预后各组大鼠FBG较前无明显改变(P>0.05,图 2A)。
(2)24 h尿蛋白:实验期间NC组大鼠24 h尿蛋白无明显变化(P>0.05);DN组大鼠4周时24 h尿蛋白水平较NC组明显升高(P < 0.05),12周时24 h尿蛋白水平高于其4周时水平(P < 0.05);药物干预后DN+SU5416高剂量组、DN+SU5416低剂量组及DN+LY294002高剂量组大鼠24 h尿蛋白水平较DN组明显下降(P < 0.05),DN+LY294002低剂量组大鼠24 h尿蛋白水平未见明显改变(P>0.05,图 2B)。
(3)Scr:实验期间NC组大鼠Scr无明显变化(P> 0.05);DN组大鼠4周时Scr水平较NC组明显升高(P < 0.05),12周时Scr水平高于其4周时水平(P < 0.05);药物干预后各组大鼠Scr较前无明显改变(P>0.05,图 2C)。
(4)BUN:实验期间NC组大鼠BUN无明显变化(P>0.05);DN组大鼠4周时BUN水平较NC组明显升高(P < 0.05),12周时BUN水平高于其4周时水平(P < 0.05);药物干预后DN+SU5416高剂量组及DN+SU5416低剂量组大鼠BUN水平较DN组明显下降(P < 0.05),DN+ LY294002高剂量组及DN+LY294002低剂量组大鼠BUN水平未见明显改变(P>0.05,图 2D)。
2.3 肾脏组织HE染色及PAS染色结果NC组大鼠肾脏组织结构清晰可见,球囊壁光滑,毛细血管及系膜细胞、系膜基质分布正常,基底膜未见增厚;DN组及DN+SU5416高剂量组、DN+SU5416低剂量组、DN+LY294002高剂量组、DN+LY294002低剂量组大鼠肾脏组织可见不同程度的基底膜增厚,系膜基质的增加,部分大鼠肾脏组织还可见到肾小球内毛细血管的扩张、肾小球硬化、肾小囊裂隙样改变以及肾小管上皮细胞的颗粒样变性和空泡样改变。DN+SU5416高剂量组肾小球基底膜增厚及系膜基质增加的程度较DN组减轻(图 3、4)。
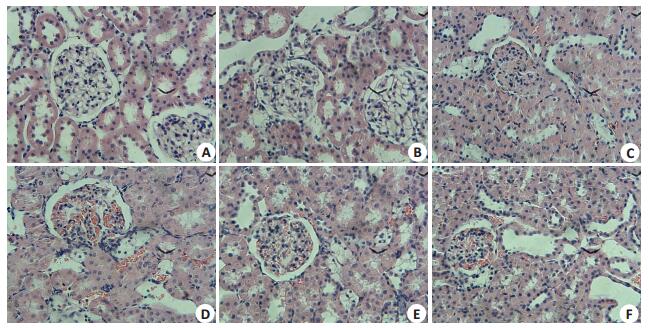
|
图 3 各组大鼠肾脏组织病理 Figure 3 Renal histopathology of the rats in each group (HE staining, × 400). A: NC group; B: DN group; C: DN+SU5416 high-dose group; D: DN+SU5416 low-dose group; E: DN+LY294002 high-dose group; F: DN+ LY294002 low-dose group |
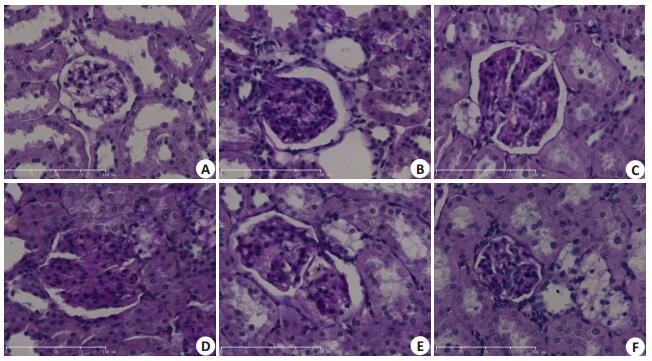
|
图 4 各组大鼠肾脏组织病理 Figure 4 Renal histopathology of the rats in each group (PAS staining, × 400). A: NC group; B: DNgroup; C: DN+SU5416 high-dose group; D: DN+SU5416 low-dose group; E: DN+LY294002 high-dose group; F: DN+ LY294002 low-dose group |
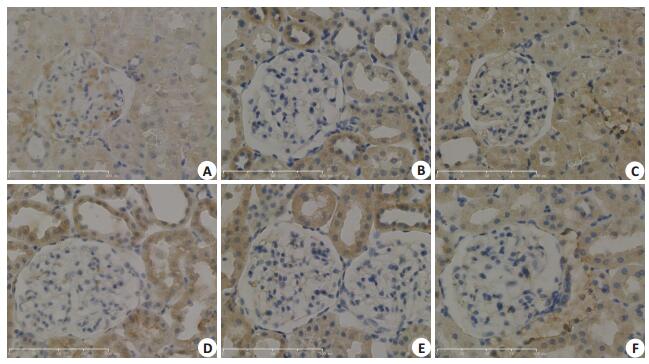
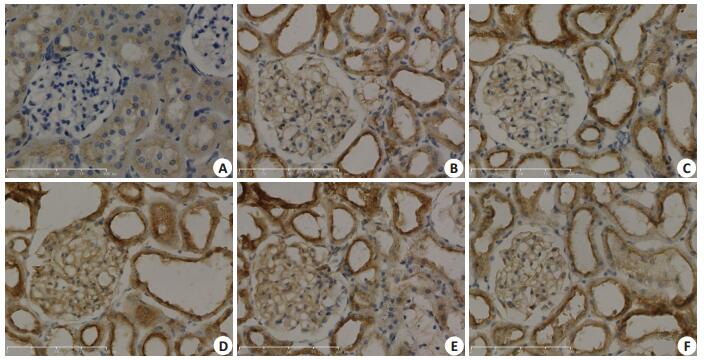
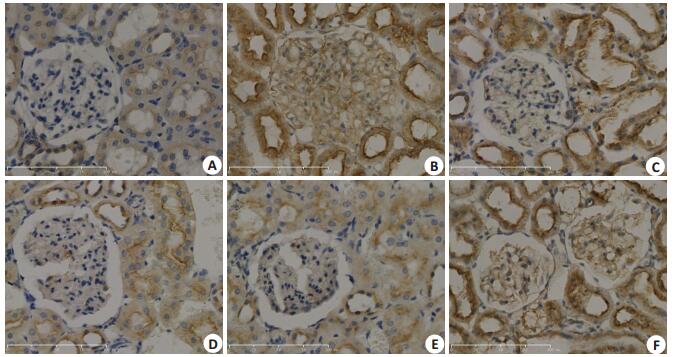
Nephrin免疫组化染色结果为DN组阳性染色较NC组弱,药物干预后DN+SU高剂量组较DN组略强。VEGF免疫组化染色结果为DN组较NC组阳性染色明显增强,药物干预后其余各组阳性染色较DN组无明显差异。TRPC6免疫组化染色结果为DN组阳性染色较NC组强,药物干预后DN+SU5416高剂量组、DN+ SU5416低剂量组、DN+LY294002高剂量组阳性染色较DN组略弱,DN+LY294002低剂量组无明显改变(图 5~7)。
|
图 5 各组大鼠肾脏组织Nephrin免疫组化染色 Figure 5 Nephrin immunohistochemical staining of kidney tissue in each group (× 400). A: NC group; B: DNgroup; C: DN+SU5416 high-dose group; D: DN+SU5416 low-dose group; E: DN+LY294002 high-dose group; F: DN+LY294002 low-dose group |
|
图 6 各组大鼠肾脏组织VEGF免疫组化染色 Figure 6 VEGF immunohistochemical staining of the kidney tissue in each group(× 400). A: NC group; B: DNgroup; C: DN+SU5416 high-dose group; D: DN+SU5416 low-dose group; E: DN+LY294002 high-dose group; F: DN+LY294002 low-dose group |
|
图 7 各组大鼠肾脏组织TRPC6免疫组化染色 Figure 7 TRPC6 immunohistochemical staining of the kidney tissue in each group (× 400). A: NC group; B: DNgroup; C: DN + SU5416 high-dose group; D: DN + SU5416 low-dose group; E: DN + LY294002 high-dose group; F: DN+LY294002low-dose group |
|
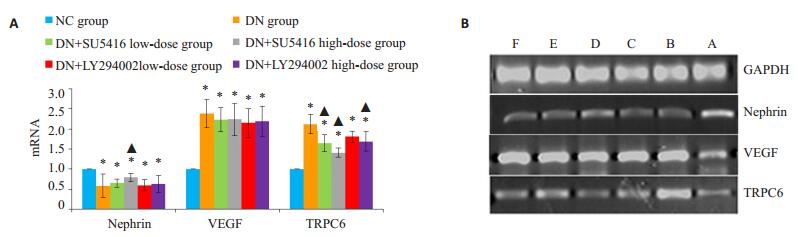
图 8 各组大鼠肾脏组织相关mRNA表达情况 Figure 8 Expressions of nephrin, VEGF and TRPC6 mRNAs in kidney tissues of the rats in each group. A: Expression levels of Nephrin VEGF TRPC6 in kidney tissue of rats in each group. *P < 0.05 versus NC group; ▲ P < 0.05 versus DN group. B: Electrophoresis results of PCR products of the 3 mRNAs in each group (A: NC group; B: DNgroup; C: DN+SU5416 low-dose group; D: DN+SU5416 high-dose group; E: DN+LY294002 low-dose group; F: DN+LY294002 high-dose group) |
(1)Nephrin的表达:DN组较NC组降低(P < 0.05),药物干预后DN+SU5416高剂量组较DN组升高(P < 0.05),其余干预组较DN组无明显改变(P>0.05)。
(2)VEGF的表达:DN组较NC组升高(P < 0.05),药物干预后各组较DN组无明显差异(P>0.05)。
(3)TRPC6的表达:DN组较NC组升高(P < 0.05),药物干预后DN+SU5416高剂量组、DN+SU5416低剂量组、DN+LY294002高剂量组较DN组明显下降(P < 0.05),DN+LY294002低剂量组较DN组无明显改变(P>0.05)。
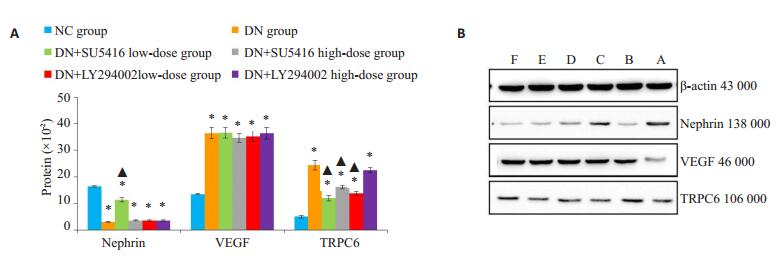
2.6 Western blotting结果(图 9)
|
图 9 各组大鼠肾脏组织相关蛋白表达情况 Figure 9 Expression of nephrin, VEGF and TRPC6 proteins in kidney tissue of the rats in each group. A: Expression levels of nephrin, VEGF and TRPC6 in each group. *P < 0.05 versus NC group; ▲P < 0.05 versus DN group. B: Western blots of the 3 proteins in each group (A: NC group; B: DNgroup; C: DN+SU5416 high-dose group; D: DN+SU5416 low-dose group; E: DN+LY294002 high-dose group; F: DN+LY294002 low-dose group) |
(1)Nephrin的表达:DN组较NC组降低(P < 0.05),药物干预后DN+SU5416高剂量组较DN组升高(P < 0.05),其余干预组较DN组无明显改变(P>0.05)。
(2)VEGF的表达:DN组较NC组升高(P < 0.05),药物干预后各组间无明显差异(P>0.05)。
(3)TRPC6的表达:DN组较NC组升高(P < 0.05),药物干预后DN+SU5416高剂量组、DN+SU5416低剂量组、DN+LY294002高剂量组较DN组明显下降(P < 0.05),DN+LY294002低剂量组较DN组无明显改变(P>0.05)。
3 讨论 3.1 关于DN大鼠模型的建立本研究中的DN大鼠模型选用了8周龄的雄性SD大鼠共50只,给予单次大剂量STZ(65 mg/kg)腹腔注射,血糖不达标者6只,死亡4只,成功率为80%。该造模方法及所使用STZ药物剂量参照参考文献[14]并进行了预实验。实验大鼠肾脏组织病理改变与文献报道情况一致[15-19],成功建立了DN大鼠模型,大鼠肾脏病理改变满足AMDCC提出的DN动物模型肾脏组织学改变要求。
3.2 Nephrin与DN大鼠足细胞损伤越来越多证据表明肾小球足细胞损伤在糖尿病肾病的发生发展中起着重要作用[1, 20-22],Nephrin被作为肾脏蛋白尿疾病早期足细胞损伤的重要的标志物之一。Nephrin的表达与FBG、Scr、BUN以及24 h尿蛋白呈负相关,推测足细胞损伤与DN大鼠24 h尿蛋白的升高以及肾功能的减退有一定的相关性。本实验中DN大鼠出现足细胞损伤,给予SU5416干预后DN大鼠的足细胞损伤减轻,肾小球病理损伤程度减轻,给予LY294002干预后DN大鼠的24 h尿蛋白减少,推测SU5416及LY294002的干预对足细胞损伤均有一定的改善作用。
3.3 VEGF的表达与足细胞损伤的相关性VEGF主要是通路与其受体VEGFR-2结合来传递信号发挥生物学效应[23-24]。SU5416是一种高效且高选择性的VEGFR-2抑制剂[25],可阻断VEGF的信号传递[26-27]。结合各项指标改变情况可发现DN大鼠肾小球VEGF的表达明显增多,SU5416只是阻断了VEGF的信号传导,并不影响DN大鼠肾小球VEGF的表达,可上调Nephrin,下调TRPC6,减轻足细胞损伤,同时降低DN大鼠24 h尿蛋白及血清BUN。大鼠相同指标的组间差异推测可能是SU5416药物浓度不足或者作用时间不够所致。FBG水平可能与SU5416对DN大鼠足细胞损伤及肾脏功能的改善的机制无关。DN大鼠给予SU5416干预后其血清Scr水平虽略有下降,但未达统计学意义,这与文献报道中结果一致[28-29],但其原因目前尚未见阐述及研究,有待进一步研究探讨。
结合上述讨论我们可推测,DN大鼠VEGF表达可明显升高,抑制DN大鼠升高的VEGF与其受体VEGFR-2的结合,可升高Nephrin的表达和降低TRPC6的表达,改善大鼠足细胞损伤,降低DN大鼠24 h尿蛋白及血清BUN水平。
3.4 TRPC6的表达与足细胞损伤相关性目前研究提示PI3K/Akt通路与糖尿病肾病有关[30-31],LY294002是PI3K/Akt信号通路阻滞剂[32-33]。结合实验大鼠各项指标改变情况可发现LY294002不影响DN大鼠VEGF及Nephrin的表达,但可降低TRPC6的表达,同时减少DN大鼠24 h尿蛋白的排泄。大鼠相同指标的组间差异可能与药物浓度不够或者作用时间不足有关,LY294002对DN大鼠无降糖作用,其对DN大鼠TRPC6表达降低、24 h尿蛋白减少的作用与血糖水平无关。
结合上述讨论我们可推测,DN大鼠TRPC6表达的上调可能与DN大鼠蛋白尿的形成、肾功能的减退及足细胞损伤相关,LY294002虽然不影响VEGF及Nephrin的表达,但可通过阻断PI3K/Akt通路,降低TRPC6的表达,减少DN大鼠24 h尿蛋白排泄,对足细胞损伤也有一定的改善作用。
通过本实验可知,STZ单次大剂量腹腔注射后可成功建立DN大鼠模型,DN大鼠肾脏病理改变主要为不同程度的基底膜增厚,系膜基质的增加,部分肾小球内毛细血管的扩张、肾小球硬化、肾小囊裂隙样改变以及肾小管上皮细胞的颗粒样变性和空泡样改变。DN大鼠VEGF表达增多,VEGF通过与自身受体VEGFR-2结合调控Nephrin的表达,使用SU5416抑制VEGF与其自身受体VEGFR-2的结合可上调Nephrin的表达,下调TRPC6的表达,减轻DN大鼠足细胞的损伤。LY294002(PI3K/Akt信号通路阻滞剂)可下调TRPC6的表达,降低DN大鼠24 h尿蛋白,对足细胞损伤也有一定的改善作用。SU5416及LY294002对DN大鼠均无降糖作用,其对DN大鼠Nephrin和TRPC6表达的影响、足细胞损伤的减轻作用与血糖水平无关。
综上所述,我们推测VEGF对TRPC6的调控作用可能是通过PI3K/Akt通路实现的。抑制VEGFR-2或阻断PI3K/Akt信号通路可阻断VEGF对TRPC6的这种调控作用。
| [1] |
Shankland SJ. The podocyte's response to injury: role in proteinuria and glomerulosclerosis[J].
Kidney Int, 2006, 69(12): 2131-47.
DOI: 10.1038/sj.ki.5000410. |
| [2] |
Chen S, Chen H, Liu Q, et al. Effect of simvastatin on the expression of nephrin, podocin, and vascular endothelial growth factor (VEGF) in podocytes of diabetic rat[J].
Int J Clin Exp Med, 2015, 8(10): 18225-34.
|
| [3] |
Winn MP, Conlon PJ, Lynn KL, et al. A mutation in the TRPC6 cation channel causes familial focal segmental glomerulosclerosis[J].
Science, 2005, 308(5729): 1801-4.
DOI: 10.1126/science.1106215. |
| [4] |
Moeller CC, Wei CL, Altintas MM, et al. Induction of TRPC6 channel in acquired forms of proteinuric kidney disease[J].
J Am Soc Nephrol, 2007, 18(1): 29-36.
DOI: 10.1681/ASN.2006091010. |
| [5] |
Schlondorff JS, Pollak MR. TRPC6 in glomerular health and disease: what we know and what we believe[J].
Semin Cell Dev Biol, 2006, 17(6): 667-74.
DOI: 10.1016/j.semcdb.2006.11.003. |
| [6] |
Thilo F, Liu Y, Loddenkemper C, et al. VEGF regulates TRPC6 channels in podocytes[J].
Nephrol Dial Transplant, 2012, 27(3): 921-9.
DOI: 10.1093/ndt/gfr457. |
| [7] |
Liu BC, Song X, Lu XY, et al. High glucose induces podocyte apoptosis by stimulating TRPC6 via elevation of reactive oxygen species[J].
Biochim Biophys Acta, 2013, 1833(6): 1434-42.
DOI: 10.1016/j.bbamcr.2013.02.031. |
| [8] |
Huang HT, Lin X, You YW, et al. Inhibition of TRPC6 signal pathway alleviates podocyte injury induced by TGF-beta 1[J].
Cell Physiol Biochem, 2017, 41(1): 163-72.
DOI: 10.1159/000455985. |
| [9] |
Yang H, Zhao B, Liao C, et al. High glucose-induced apoptosis in cultured podocytes involves TRPC6-dependent calcium entry via the RhoA/ROCK pathway[J].
Biochem Biophys Res Commun, 2013, 434(2): 394-400.
|
| [10] |
Eijkelkamp N, Quick K, Wood JN. Transient receptor potential channels and mechanosensation[J].
Annu Rev Neurosci, 2013, 36: 519-46.
DOI: 10.1146/annurev-neuro-062012-170412. |
| [11] |
Tufro A, Norwood VF, Carey RM, et al. Vascular endothelial growth factor induces nephrogenesis and vasculogenesis[J].
J Am Soc Nephrol, 1999, 10(10): 2125-34.
|
| [12] |
Nakagawa T. Uncoupling of the VEGF-endothelial nitric oxide axis in diabetic nephropathy:an explanation for the paradoxical effects of VEGF in renal disease[J].
Am J Physiol Renal Physiol, 2007, 292(6): F1665-72.
DOI: 10.1152/ajprenal.00495.2006. |
| [13] |
Bus P, Scharpfenecker M, van der Wilk PA, et al. The VEGF-A inhibitor sFLT-1 improves renal function by reducing endothelial activation and inflammation in a mouse model of type 1 diabetes[J].
Diabetologia, 2017, 60(9): 1813-21.
DOI: 10.1007/s00125-017-4322-3. |
| [14] |
Gu JW, Manning J, Young E, et al. Vascular endothelial growth factor receptor inhibitor enhances dietary salt-induced hypertension in Sprague-Dawley rats[J].
Am J Physiol Regul Integr Comp Physiol, 2009, 297(1): R142-8.
DOI: 10.1152/ajpregu.90972.2008. |
| [15] |
Al-Malki Al. Oat protects against diabetic nephropathy in rats via attenuating advanced[J].
Evid Based Complement Alternat Med, 2013, 2013: 609745.
|
| [16] |
Pandya KG, Budhram R, Clark G, et al. Comparative evaluation of taurine and thiotaurine as protectants against diabetes-induced nephropathy in a rat model[J].
Adv Exp Med Biol, 2013, 775: 371-94.
DOI: 10.1007/978-1-4614-6130-2. |
| [17] |
Si X, Li P, Zhang Y, et al. Renoprotective effects of olmesartanmedoxomil on diabetic nephropathy in streptozotocin-induced diabetes in rats[J].
Biomed Rep, 2014, 2(1): 24-8.
DOI: 10.3892/br.2013.183. |
| [18] |
Cruzado JM, Lloberas N, Torras J, et al. Regression of advanced diabetic nephropathy by hepatocyte growth factor gene therapy in rats[J].
Diabetes, 2004, 53(4): 1119-27.
DOI: 10.2337/diabetes.53.4.1119. |
| [19] |
Mega C, De Lemos ET, Vala H, et al. Diabetic nephropathy amelioration by a low-dose sitagliptin in an animal model of type 2 diabetes (Zucker diabetic fatty rat)[J].
Exp Diabetes Res, 2011, 2011: 162092.
|
| [20] |
Kriz W, Gretz N, Lemley KV. Progression of glomerular diseases: is the podocyte the culprit?[J].
Kidney Int, 1998, 54(3): 687-97.
DOI: 10.1046/j.1523-1755.1998.00044.x. |
| [21] |
Butt A, Riaz S. Study of protein profiling of human urine in diabetic hypertensive nephropathy versus normal healthy controls[J].
Diabetes Technol Ther, 2010, 12(5): 379-86.
DOI: 10.1089/dia.2009.0170. |
| [22] |
Liu G, Sun Y, Li Z, et al. Apoptosis induced by endoplasmic reticulum stress involved in diabetic kidney disease[J].
Biochem Biophys Res Commun, 2008, 370(4): 651-6.
DOI: 10.1016/j.bbrc.2008.04.031. |
| [23] |
Majumder S, Advani A. VEGF and the diabetic kidney: More than too much of a good thing[J].
J Diabetes Complications, 2017, 31(1): 273-9.
DOI: 10.1016/j.jdiacomp.2016.10.020. |
| [24] |
Carranza K, Veron D, Cercado A, et al. Cellular and molecular aspects of diabetic nephropathy and the role of VEGF-A[J].
Nefrologia, 2015, 35(2): 131-8.
|
| [25] |
Keskin U, Totan Y, Karadag R, et al. Inhibitory effects of SU5416, a selective vascular endothelial growth factor receptor tyrosine kinase inhibitor, on experimental corneal neovascularization[J].
Ophthalmic Res, 2012, 47(1): 13-8.
DOI: 10.1159/000324994. |
| [26] |
Fong T, Shawver LK, Sun L, et al. SU5416 is a potent and selective inhibitor of the vascular endothelial growth factor receptor (Flk-1/ KDR)that inhibits tyrosine kinase catalysis, tumor vascularization, and growth of multiple tumor types[J].
Cancer Res, 1999, 59(1): 99-106.
|
| [27] |
Mendel DB, Schreck RE, West DC, et al. The angiogenesis inhibitor SU5416 has long-lasting effects on vascular endothelial growth factor receptor phosphorylation and function[J].
Clin Cancer Res, 2000, 6(12): 4848-58.
|
| [28] |
Sung SH, Ziyadeh FN, Wang A, et al. Blockade of vascular endothelial growth factor signaling ameliorates diabetic albuminuria in mice[J].
J Am Soc Nephrol, 2006, 17(11): 3093-104.
DOI: 10.1681/ASN.2006010064. |
| [29] |
王帅, 李艺, 黄云剑. VEGF受体抑制剂对I型糖尿病肾病大鼠足细胞病的治疗作用[J].
细胞与分子免疫学杂志, 2011, 27(9): 1003-6.
|
| [30] |
Rane MJ, Song Y, Jin SY, et al. Interplay between Akt and p38 MAPK pathways in the regulation of renal tubular cell apoptosis associated with diabetic nephropathy[J].
Am J Physiol Renal Physiol, 2010, 298(1): F49-61.
DOI: 10.1152/ajprenal.00032.2009. |
| [31] |
Faour WH, Thibodeau JF, Kennedy CR. Mechanical stretch and prostaglandin E2 modulate critical signaling pathways in mouse podocytes[J].
Cell Signal, 2010, 22(8): 1222-30.
DOI: 10.1016/j.cellsig.2010.03.014. |
| [32] |
Cheng CY, Hsieh HL, Hsiao LD, et al. PI3-K/Akt/JNIUNF-kappa B is essential for MMP-9 expression and outgrowth in human limbal epithelial cells on intact amniotic membrane[J].
Stem Cell Res, 2012, 9(1): 9-23.
|
| [33] |
Han Y, Li Y, Xiao X, et al. Formaldehyde up-regulates TRPV1 through MAPK and PI3K signaling pathways in a rat model of bone cancer pain[J].
Neurosci Bull, 2012, 28(2, SI): 165-72.
DOI: 10.1007/s12264-012-1211-0. |
 2018, Vol. 38
2018, Vol. 38

