阿尔茨海默病(AD)分为家族性AD和散发性AD,家族性AD呈常染色体显性遗传,其发病与淀粉样前体蛋白(APP)、PS1、PS2基因突变导致β淀粉样蛋白(Aβ)产生过多有关,仅占10%以下;而占AD 90%以上的散发性AD的发病可能与环境因素和遗传因素共同作用导致神经细胞结构和功能的变化、Aβ的清除能力下降有关[1-2]。以往常用的APP/PSE1双转基因鼠或直接向活体鼠脑组织内注射Aβ诱导的AD动物模型应只贴近家族性AD模型,而散发性AD动物模型应先是神经细胞结构和功能变化,然后导致Aβ的异常沉积,进而加重了AD的进程。因此,制备更贴近散发性AD发病原因的动物模型对更好开展AD的基础研究尤为重要。2004年Scherzer [3]首次提出AD发病与分拣蛋白相关受体1(SORL1)缺乏有关;进一步的研究发现SORL1可能通过影响海马的容积或导致脑组织结构的改变,从而增加AD的发病风险或增加其AD的易感性[4-5];近年的全基因组关联分析也发现SORL1可能为散发性AD的风险基因之一[6-9]。之前的研究认为SORL1作为分拣蛋白参与APP的转运,当SORL1减少时,Aβ生成增多,从而增加AD发病的风险[10],但近年研究发现SORL1还可能通过影响tau相关蛋白[11]、炎症相关物质[12]及神经营养因子[13]等多种物质的代谢或转运参与AD的发生和发展。因此,SORL1减少导致散发性AD的机制是复杂的、多样的。最近本研究通过RNA干扰敲低N2a细胞内SORL1的表达,建立了与Aβ诱导的AD细胞模型相似作用的AD细胞模型,即:细胞活力下降、细胞凋亡率增加、细胞内炎症物质TNF-α和IL-1β表达增加[14],因此敲低细胞内SORL1的表达可导致细胞发生AD样的病理改变。而国内外尚未见散发性AD动物模型的研究报道。本研究拟通过Crispr/Case9技术、DNA序列等方法建立SORL1基因敲除小鼠,并分别与正常小鼠、APP/ PSE1双转基因AD小鼠在行为学和AD相关病理学改变等方面比较,试图构建一种散发性AD的小鼠模型,为进一步研究SORL1在散发性AD中的作用及其机制提供工具。
1 材料和方法 1.1 实验动物SORL1基因敲除(SORL1-/-)小鼠的制备:在中南大学生命科学学院遗传学系指导下,采用Crispr/Case9技术对同源小鼠受精卵SORL1基因进行编辑,第1代获得3只(2雌1雄)SORL1嵌合体(SORL1-/+)小鼠、然后分别与同源的C57BL/6J野生型小鼠(1雌2雄)分笼饲养、繁殖,第2代小鼠于3周时剪趾用于标记、剪尾用于碱裂解法提取鼠尾基因组DNA进行Sanger测序,分别行Western blot检测小鼠脑组织中SORL1,鉴定和识别SORL1-/+小鼠;再将第2代SORL1-/+小鼠雌雄合笼、繁殖并按相同方法鉴定出SORL1-/-小鼠。APP/PSE1双转基因AD小鼠购于北京华阜康生物科技有限公司,C57BL/6J野生型小鼠由中南大学湘雅三医院动物实验中心代购。
1.2 实验小鼠分组及饲养实验分组:对照组、SORL1-/-组、APP/PSE1组,均为雄性,每组5只。所有小鼠均来源于C57BL/6J系,4周龄时开始饲养于中南大学湘雅三医院动物实验中心,常规饮食和摄水,待小鼠生长至7月龄时开始实验。
1.3 主要试剂和设备兔抗Aβ42购自Abcam,兔抗SORL1、兔抗APP均购自武汉三鹰,ACTIN购自Servicebio,包埋机(武汉俊杰电子有限公司),涡旋混合器(Servicebio),掌上离心机(Servicebio),Morris水迷宫(TSE),扫描仪(EPSON),电泳仪(北京六一仪器厂),酶标检测仪(Rayto)等。
1.4 Morris水迷宫检测水迷宫直径120 cm,水深30 cm,水温20±3 ℃,水中加入奶粉,水面平均分成4个象限。根据Vorhees等方法:(1)定位航行实验:每只小鼠训练4次/d,1 min/次,共6 d,平台放置在任意象限,平台位于水下1.5 cm,选取平台的邻象限和对象限作为入水点,对于60 s未找到平台者,将小鼠引导至平台,停留15 s,记录逃避潜伏期,计算每天潜伏期平均值,以评价小鼠空间记忆的获得能力。(2)空间探索实验:第7天撤除平台,小鼠于原平台对侧象限入水,观察其60 s内穿越平台所在位置的次数(穿台次数)来评价动物的空间记忆能力。测试时室内安静,物品陈设、照明度一致。
1.5 免疫组化检测免疫组化的标本制备:每组随机挑选2只小鼠,腹腔注射10%水合氯醛(4 mL/kg)麻醉动物后,开胸进行心尖灌注0.9%氯化钠溶液,至肝脏变白后停止灌注,4%(质量分数)多聚甲醛(pH=7.4)100 mL灌注固定,至动物四肢僵直,开颅取脑,常规石蜡切片制备、备用。石蜡切片脱蜡至水、抗原修复、血清封闭、加一抗、加二抗后将玻片置于PBS(pH7.4)中在脱色摇床上晃动洗涤,再滴加与一抗相应种属的二抗(HRP标记)并覆盖组织,室温孵育50 min。DAB显色、复染细胞核、脱水封片、显微镜镜检,图像采集分析。
1.6 Western blot检测每组3只小鼠,断头处死,取大脑组织行蛋白提取、变性、SDS-PAGE电泳、转膜、将转好的膜于室温下脱色摇床上用5%的脱脂牛奶(0.5% TBST配),封闭1 h。稀释一抗,二抗加入混合好的ECL溶液充分反应,1~2 min后开始曝光。曝光后的胶片用显影、定影试剂进行显影和定影。根据不同的发光强度调整曝光条件。将胶片进行扫描存档,Photoshop整理去色,ImageJ软件处理系统分析目的条带的灰度值。
1.7 统计学分析统计分析结果均以均数±标准差表示,采用SPSS 22.0统计软件。水迷宫实验数据平均逃避潜伏期及穿越平台次数使用单因素的方差分析,应用于多组间的比较,若方差齐用LSD检验各组间差异显著性,方差不齐用Tambane's法,以P < 0.05为差异有统计学意义。蛋白印迹结果采用ImageJ软件作图分析。
2 结果 2.1 SORL1-/-组小鼠的鉴定 2.1.1 DNA序列检测对照组小鼠SORL1基因无CAAT碱基的缺失,SORL1-/-组小鼠两条染色体SORL1基因CAAT碱基均缺失(图 1)。以上基因改变均遵循孟德尔遗传定律,可以稳定遗传给下一代。
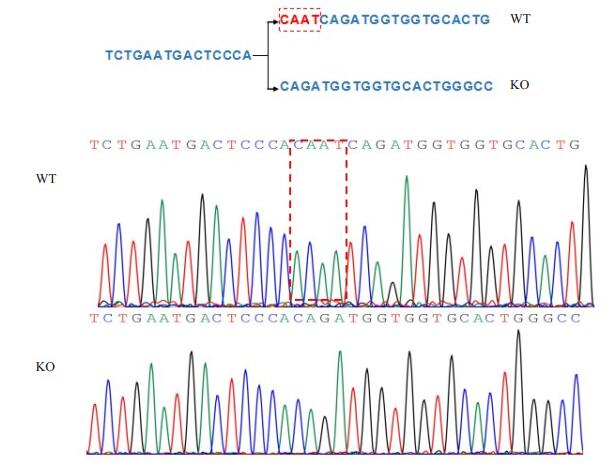
|
图 1 对照小鼠、SORL1-/-小鼠部分DNA测序图 Figure 1 Partial DNA sequencing result of normal mice and SORL1-/- mice |
3组小鼠脑组织SORL1蛋白定量检测结果:SORL1-/-组小鼠脑组织SORL1条带显影不明显,几乎无SORL1蛋白表达,而对照组及APP/PSE1组可见明显SORL1条带,差异有统计学意义(P < 0.05,图 2)。

|
图 2 各组小鼠脑组织SORL1蛋白的相对表达量 Figure 2 Western blots (A) and quantitative analysis (B) of SORL1 protein in the brain tissue of different mice. *P < 0.05 vs control group; ▲P < 0.05 vs APP/PSE1 group |
各组小鼠的每天定位航行训练的检测结果见表 1,在6 d训练期中,各组小鼠的平均逃避潜伏期时间呈逐渐下降趋势,寻找平台的学习能力均得到提高。与对照组相比,SORL1-/-组和APP/PSE1组小鼠平均逃避潜伏期时间均较长,差异有统计学意义(P < 0.05);SORL1-/-组和APP/PSE1组小鼠的平均逃避潜伏期时间差异无统计学意义(P>0.05,表 1)。SORL1-/-小鼠学习记忆能力下降并与APP/PSE1小鼠相似。
| 表 1 各组小鼠平均逃避潜伏期时间比较 Table 1 Average avoidance latency period in each group (Mean±SD, n=5) |
SORL1-/-组、对照组和APP/PSE1组小鼠平均穿越平台次数分别为0.6±0.5、3.0±1.6、0.8±0.8次,与对照组比较,SORL1-/-组和APP/ PSE1组小鼠穿越平台次数均减少,差异有统计学意义(P < 0.05),而SORL1-/-组与APP/PSE1组比较,小鼠穿越平台次数差异无统计学意义(P>0.05,图 3)。SORL1-/-小鼠空间探索能力下降并与APP/PSE1小鼠相似。
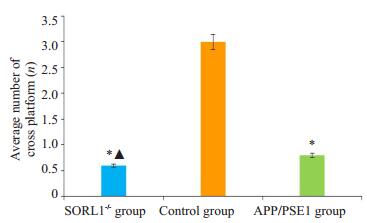
|
图 3 各组小鼠平均穿越平台次数比较 Figure 3 Average number of platform crossing of mice in each group. *P < 0.05 vs control group; ▲P>0.05 vs APP/ PSE1 group |
各组小鼠海马组织中APP、Aβ的表达分别见图 4~5。与对照组相比,SORL1-/-组和APP/PSE1组小鼠海马组织中APP及Aβ表达较明显;SORL1-/-组与APP/PSE1组的小鼠海马组织中的APP及Aβ表达差异不明显。
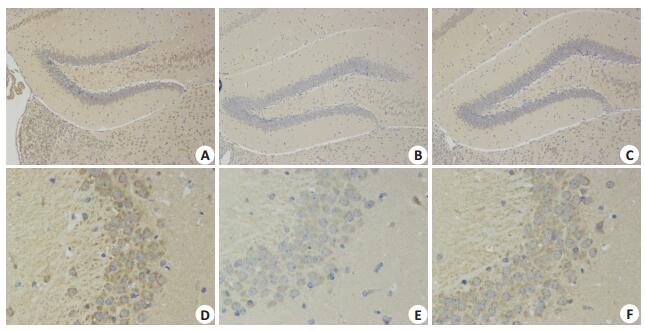
|
图 4 各组小鼠海马组织APP的表达 Figure 4 Expression of APP in the hippocampus of the mice in each group. a (× 100) and d (× 400) are expression of APP in hippocampus in SORL1-/- group; b (×100) and e (×400) are expression of APP in hippocampus in control group; c(×100) and f (×400) are expression of APP in hippocampus in APP/PSE1 group |
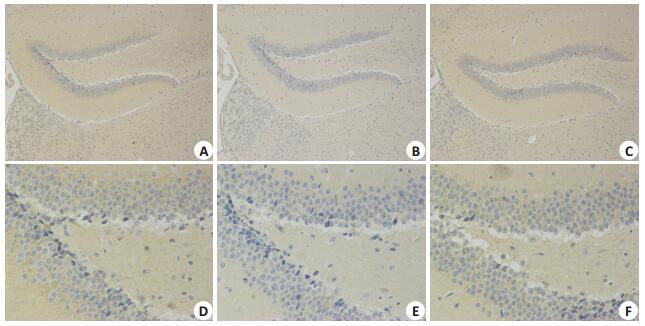
|
图 5 各组小鼠海马组织Aβ的表达 Figure 5 Expression of Aβ in the hippocampus of the mice in each group. a (×100) and d (×400) are expression of Aβ in hippocampus in SORL1-/- group; b (×100) and e (×400) are expression of Aβ in hippocampus in control group; c (×100) and f (×400) are expression of Aβ in hippocampus in APP/PSE1 group |
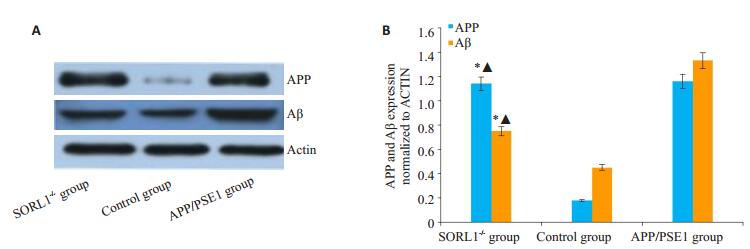
各组小鼠脑组织APP、Aβ蛋白定量检测结果见图 6。与对照组比较,SORL1-/-组APP、Aβ表达较明显;SORL1-/-组与APP/PSE1组比较差异无统计学意义(P>0.05)。
|
图 6 各组小鼠脑组织APP、Aβ蛋白相对表达量 Figure 6 Western blots (A) and quantitative analysis (B) of APP and Aβ protein in the brain tissue of different mice. *P < 0.05 vs control group; ▲P>0.05 vs APP/PSE1 group |
SORL1基因位于11q23.2~q24.2,其编码的蛋白在中枢神经系统中普遍表达,主要分布于大脑皮层、海马和小脑。SORL1基因编码的蛋白主要由7个区域构成,分别是NH2-末端的350个氨基酸区域、VPS10同源片段区域、5个低密度脂蛋白受体“YWTD”的串联重复序列区域、11个互补型重复序列(CR)区域、6个纤维连接蛋白(FN)Ⅲ重复序列区域、跨膜区域、-COOH末端的54个氨基酸区域,SORL1基因编码氨基酸序列由6648个碱基组成,共编码2216个氨基酸,SORL1的CDs序列见https://www.ncbi.nlm.nih.gov/nuccore/74181134。本研究采用Crispr/Case9技术对SORL1基因编码氨基酸序列中第306~309位的CAAT碱基敲除时,该CDS提前终止,其编码的氨基酸仅为114个,SORL1蛋白因此丧失了正常结构和功能。通过DNA测序和Western blot检测方法分别对SORL1-/-小鼠进行SORL1基因水平和蛋白水平的检测和鉴定,结果均显示SORL1基因和蛋白的缺失,从而证明了该小鼠即为实验所设计的SORL1-/-小鼠。
由于SORL1结构和功能的复杂性,决定了其可能在细胞内参与了多种物质的转运,SORL1缺乏除导致Aβ沉积加重外,可能还导致脑组织和细胞功能的异常,这些均为认知功能改变的病理基础。有研究对1609例瑞士非痴呆老年人16年的随访研究发现:SORL1基因3’端位点rs7105365、rs11820794、rs2070045与情景记忆相关,其中rs2070045 T/T基因型,T等位基因具有显著增加迟发性阿尔茨海默病的患病风险[15];有研究对1689例澳大利亚非痴呆老人认知功能(情景记忆、工作记忆、语言能力、知觉速度)与AD发病相关单核苷酸多态位点的关系研究发现:SORL1基因5’端位点rs668387与基线状态点-词测试评分(语言能力)相关,T等位基因携带者评分高,该基因型可能起保护作用[16];也有研究对780例中国汉族非痴呆老年人SORL1基因3’端位点rs1699102检测和神经心理学评估的关系发现:T等位基因携带者的听觉词语学习测验、ReyOsterrieth复杂图形测验等情景记忆功能评分下降[17];此外,SORL1基因3’端位点rs2070045和rs1699102与连线试验、Stroop评分等执行功能指标显著相关,表现为风险基因携带者执行功能下降[18]。以上说明SORL1基因突变的位点可能决定了认知改变的类型。本研究通过Morris水迷宫实验,分析和比较了3组小鼠的学习能力和记忆能力,结果显示正常组、SORL1-/-组、APP/PSE1组均有一定的学习记忆能力,但与对照组小鼠比较,SORL1-/-组和APP/PSE1组小鼠表现不同程度学习和记忆能力障碍,表现为平均逃避潜伏期(P < 0.05)和成功穿越平台次数减少(P < 0.05);而SORL1-/-组和APP/ PSE1组之间的比较在平均逃避潜伏期和成功穿越平台次数上的差异均无统计学意义(P>0.05)。这表明SORL1基因敲除可导致小鼠学习和记忆能力的下降,其程度与APP/PSE1双转鼠相似,SORL1-/-小鼠有AD的基本行为学改变。
AD病理学改变的核心是Aβ沉积,APP是一种包括神经元在内的许多细胞均能表达的1型跨膜蛋白,内源性APP的淀粉样变性过程在核内体和高尔基体中进行,其中β-分泌酶切割APP的氨基末端,然后γ-分泌酶切割APP的羧基末端,这一过程产生的主要是40~42个氨基酸的Aβ肽、sAPPβ和AICD [19]。Aβ42是导致神经细胞变性、凋亡的主要物质,表现为神经元纤维缠结和老年斑,这正是AD患者神经元功能障碍和细胞受损的病理特征[20]。最早的研究表明:SORL1通过结合Aβ的底物APP而发挥抑制Aβ形成的作用,而不是直接抑制分泌酶活性,并且SORL1与APP的相互作用主要发生在TGN中[21];SORL1作为APP的分选受体将细胞内的APP从核内体穿梭回反面高尔基体以减少Aβ的产生[22-24];除了通过分选APP,SORL1被证明还可以通过分选新产生的Aβ肽至溶酶体进行分解代谢来减少Aβ的量[25]。但也有研究发现:SORL1的表达减少只发生在散发性AD患者中,家族性AD脑组织的SORL1的表达并不减少[26];年轻时(未出现AD症状前)的SORL基因突变已经导致了脑组织结构的改变,并决定了以后几十年AD的易感[27-28]。因此,SORL1减少导致AD的机制可能是多重的,一方面通过影响APP的代谢直接导致Aβ沉积,另一方面因脑细胞结构和功能的损害导致对Aβ的清除能力下降间接导致Aβ沉积。APP/PSE1双转小鼠被公认为AD模型的基础是APP和PSE1过表达可导致Aβ的增加。为了检验SORL1-/-小鼠是否符合AD病理基础,本研究分别对正常小鼠、SORL1-/-小鼠和APP/PSE1小鼠进行免疫组化染色和Western Blot检测,结果显示:与对照组比较,SORL1-/-组和APP/PSE1组APP、Aβ表达明显增多,而SORL1-/-组小鼠和APP/PSE1组小鼠APP、Aβ表达相似。由于本研究只观察了7月龄SORL1-/-小鼠行为学及病理学上的改变,缺乏对不同年龄的SORL1-/-小鼠的动态观察,很难说明SORL1-/-小鼠脑组织中APP、Aβ表达增加是SORL1减少的直接作用或是因细胞结构改变后清除Aβ能力下降所致,因此值得进一步研究。
本研究构建的SORL1-/-小鼠在行为学表现和相关病理学改变等方面均符合AD的改变,可以作为一种散发性AD的动物模型。
| [1] |
Masters CL, Bateman R, Blennow K, et al. Alzheimer's disease[J].
Nat Rev Dis Primers, 2015, 10(1): 15056-8.
|
| [2] |
Sagare AP, Bell RD, Zlokovic BV. Neurovascular dysfunction and faulty amyloid beta-Peptide clearance in alzheimer disease[J].
Cold Spring Harb Perspect Med, 2012, 2(10): a011452-8.
|
| [3] |
Scherzer CR, Offe K, Gearing M, et al. Loss of apolipoprotein E recepter LR11 in Alzheimer disease[J].
Arch Neurol, 2004, 61(8): 1200-5.
|
| [4] |
Shen JL, Zhang P, Liu HG, et al. Modulation effect of the SORL1 gene on functional connectivity density in healthy young adults[J].
Brain Struct Funct, 2016, 221(8): 4103-10.
DOI: 10.1007/s00429-015-1149-x. |
| [5] |
Bralten J, Arias-Vasquez A, Makkinje RA, et al. Association of the alzheimer's gene SORL1 with hippocampal volume in young, healthy adults[J].
Am J Psychiatry, 2011, 168(10): 1083-9.
|
| [6] |
Rosenthal SL, Kamboh MI. Late-Onset alzheimer's disease genes and the potentially implicated pathways[J].
Curr Genet Med Rep, 2014, 22(2): 85-101.
|
| [7] |
Karch CM, Goate AM. Alzheimer's disease risk genes and mechanisms of disease pathogenesis[J].
Biol Psychiatry, 2015, 77(1): 43-51.
DOI: 10.1016/j.biopsych.2014.05.006. |
| [8] |
Xiao QY, Liu ZJ, Tao S, et al. Risk prediction for sporadic Alzheimer's disease using genetic risk score in the Han Chinese population[J].
Oncotarget, 2015, 6(35): 36955-64.
|
| [9] |
Li JQ, Wang HF, Zhu XC, et al. GWAS-Linked loci and neuroimaging measures in alzheimer's disease[J].
Mol Neurobiol, 2017, 54(1): 146-53.
DOI: 10.1007/s12035-015-9669-1. |
| [10] |
Rogaeva E, Meng Y, Lee JH, et al. The neuronal sortilin-related receptor SORL1 is genetically associated with Alzheimer disease[J].
Nat Genet, 2007, 39(2): 168-77.
DOI: 10.1038/ng1943. |
| [11] |
Yu L, Chibnik LB, Srivastava GP, et al. Association of brain DNA methylation in SORL1, ABCA7, HLA-DRBS, SLC24A4, and BIN1 with pathological diagnosis of Alzheimer disease[J].
JAMA Neurol, 2015, 72(1): 15-24.
DOI: 10.1001/jamaneurol.2014.3049. |
| [12] |
Larsen JV, Petersen CM. SorLA in interleukin-6 signaling and turnover[J].
Mol Cell Biol, 2017, 37(11): 16-23.
|
| [13] |
Geng Z, Xu FY, Huang SH, et al. Sorting protein-related receptor SorLA controls regulated secretion of glial cell line-derived neurotrophic factor[J].
J Biol Chem, 2011, 286(48): 41871-82.
DOI: 10.1074/jbc.M111.246413. |
| [14] |
罗静, 赵艳, 谢婧雯, 等. 敲低SORL1表达构建一种类似的阿尔茨海默病细胞模型[J].
南方医科大学学报, 2018, 38(1): 8-13.
|
| [15] |
Reynolds CA, Zavala C, Gatz M, et al. Sortilin receptor 1 predictslongitudinal cognitive change[J].
Neurobiol Aging, 2013, 34(1701): e11-8.
|
| [16] |
Andrews SJ, Das D, Cherbuin N, et al. Association of genetic riskfactors with cognitive decline: the PATH through Life project[J].
Neurobiol Aging, 2016, 41(12): 150-8.
|
| [17] |
Li H, Lv CL, Yang CS, et al. SORL1 rs1699102 polymorphism modulates age-related cognitive decline and gray matter volume reduction in non-demented individuals[J].
Eur J Neurol, 2017, 24(1): 187-94.
DOI: 10.1111/ene.2017.24.issue-1. |
| [18] |
Liang Y, Li H, Lv C, et al. Sex moderates the effects of the Sorl1gene rs2070045 polymorphism on cognitive impairment and disruption of the cingulum integrity in healthy elderly[J].
Neuropsychopharmacology, 2015, 40(8): 2487-95.
|
| [19] |
Willnow TE, Andersen OM. Sorting receptor SORLA -a trafficking path to avoid Alzheimer disease[J].
J Cell Sci, 2013, 126(13): 2751-60.
|
| [20] |
Haass C, Selkoe DJ. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide[J].
Nat Rev Mol Cell Biol, 2007, 8(2): 101-12.
|
| [21] |
Mehmedbasic A, Christensen SK, Nilsson J, et al. SorLA complement-type repeat domainsprotect the amyloid precursor protein against processing[J].
J Biol Chem, 2015, 290(6): 3359-76.
DOI: 10.1074/jbc.M114.619940. |
| [22] |
Schmidt V, Sporbert A, Rohe M, et al. SorLA/LR11 regulates processing of amyloid precursor protein via interaction with adaptors GGA and PACS-1[J].
J Biol Chem, 2007, 282(45): 32956-64.
|
| [23] |
Andersen OM, Reiche J, Schmidt V, et al. Neuronal sorting proteinrelated receptor sorLA/LR11 regulates processing of the amyloid precursor protein[J].
Proc Natl Acad Sci USA, 2005, 102(38): 13461-6.
DOI: 10.1073/pnas.0503689102. |
| [24] |
Offe K, Dodson SE, Shoemaker JT, et al. The lipoprotein receptor LR11 regulates amyloid beta production and amyloid precursor protein traffic in endosomal compartments[J].
J Neurosci, 2006, 26(5): 1596-603.
DOI: 10.1523/JNEUROSCI.4946-05.2006. |
| [25] |
Caglayan S, Takagi-Niidome S, Liao F, et al. Lysosomal sorting of amyloid-beta by the SORLA receptor is impaired by a familial alzheimer's disease mutation[J].
Sci Transl Med, 2014, 6(223): 11-26.
|
| [26] |
Dodson SE, Gearing M, Lippa CF, et al. LR11/SorlA expression in reduced in sporadic Alzheimer disease but not in familial Alzheimer disease[J].
J Neuropathol Exp Neurol, 2006, 65(9): 866-72.
|
| [27] |
Felsky D, Szeszko P, Yu L, et al. The SORL1 gene and convergent neural risk for Alzheimer's disease across the human lifespan[J].
Mol Psychiatry, 2014, 19(10): 1125-32.
DOI: 10.1038/mp.2013.142. |
| [28] |
Shen J, Zhang P, Liu H, et al. Modulation effect of the SORL1 gene on functional connectivity density in healthy young adults[J].
Brain Struct Funct, 2016, 221(8): 4103-10.
DOI: 10.1007/s00429-015-1149-x. |
 2018, Vol. 38
2018, Vol. 38

