2. 南方医科大学南方医院肿瘤科,广东 广州 510515
2. Department of Oncology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
胎肺的形态和功能发育依赖源于内胚层的上皮细胞和中胚层的间质细胞之间的相互作用[1-3],受到不同信号通路的调控,这些信号分子有着各自的时空表达特异性,有些分子仅表达与上皮细胞,有些仅表达于间质细胞,有些分子在上皮细胞及间质细胞均有表达,有些分子仅表达于特定的时期,有些分子在某一时期表达于上皮与间质细胞,而随时间发展仅表达于间质细胞。信号分子在不同时期的上皮与间质之间的作用对呼吸系统的正常发育非常关键,不同表达部位基因的异常激活或缺失,将会导致一系列的后果,包括引起肺发育异常的疾病,甚至死亡[4-6]。正确认识肺发育过程中不同信号通路之间的关系,了解其作用机制,对理解导致人类肺先天发育异常相关疾病有帮助。
Hedgehog(Hh)信号通路在胚胎时期的细胞分化、组织与器官发育中扮演着重要的角色,主要由3种分泌型糖蛋白配体Shh、Ihh和Dhh,两个跨膜蛋白受体Ptch1、Smo,3个核转录因子Gli1、Gli2、Gli3及下游的靶基因等组成[7-9]。在Shh存在的情况下,Shh与Ptch1结合,解除了Ptch1对Smo的抑制,Smo进入细胞内,使Gli1和Gli2入核激活下游靶基因的表达。Shh在胎肺中表达于上皮细胞,不但促进间质增殖分化以及气道的形成,还起到联系气道上皮和间质细胞之间起通讯的作用,而Shh下游两种受体Ptch1和Smo大多在气道周围间质细胞膜上表达[8-9]。一些保守的信号通路被证明参与胎肺的发育过程之中,其中,FGF、BMP、hedgehog/ Gli、EGF和WNT家族在胎肺的形态发生及上皮分化中的作用被部分阐明。研究表明,Hh信号通路中任何成分的突变都会导致肺的先天性缺陷和疾病[6]。其中,Smo表达模式在间质中的作用仍未知,Smo缺失小鼠模型研究较少,因此,本研究通过建立基因敲除小鼠模型来探索肺发育过程中Shh通路在上皮间质细胞中的作用。
Pdgf最初发现于血小板的α颗粒,目前已发现的亚型有4种,Pdgfr分为Pdgfr-α和Pdgfr-β,Pdgfr-α可与所有Pdgf相结合。文献报道,Pdgfr-α主要在肺间质(如成纤维细胞)中表达[10-11],根据Pdgfr-α间质表达的特点,我们利用cre重组酶原理,在Pdgfr-α表达的肺间质中敲除Shh通路关键信号分子Smo,达到在间质中失活Shh通路的目的,从而观察不同发育时间上皮细胞中Shh信号分子对间质细胞的作用特点。尽管鼠与人类的肺的发育有所不同,但肺发育早期的分子信号通路是相对保守的。胚胎肺的发育可以分为结构差异明显的5个时期[12-13],其中发育最明显的时期是假腺期(pseudoglandular Stage,E12.5-E16.5),该时期支气管进一步分支,在左边形成1个次级芽,右边形成4个,同时在间充质中形成软骨和血管[14-16],因此我们将研究重点放在这个时期。
综上,本文利用基因敲除小鼠模型来探索假腺期经典Shh信号通路对小鼠胚胎肺发育过程中上皮、间质(支气管软骨、平滑肌)发育的调控作用。
1 材料和方法 1.1 材料 1.1.1 实验动物实验中所用到的转基因小鼠由美国南加州大学/洛杉矶县儿童医院馈赠,其余普通实验动物为无特定病原体(SPF)级雄性和雌性Balb/c小鼠(体质量21~28 g,6周龄,南方医科大学实验动物中心提供,动物许可证号:SCXK(粤)2011-0015)。动物均饲养在南方医科大学实验动物中心,环境温度为22+1 ℃,12 h明暗交替(光照自8:00-20:00),自由饮水摄食。
1.1.2 试剂与仪器免疫组化试剂盒SP-9000/9001/ 9002 SPlink Detection Kits(Biotin-Streptavidin HRP Detection Systems),生物素-链霉卵白素免疫组化检测试剂盒(中杉金桥公司);免疫荧光染色试剂盒-抗兔Alexa Fluor 488(碧云天);免疫荧光染色试剂盒-抗兔Alexa Fluor 594(碧云天公司);标准阿利新蓝染色液试剂盒(Solarbio);脱水机、包埋机、切片机(卡仪器);光学显微镜、正置显微镜(欧林巴斯)。
1.2 方法 1.2.1 组织收集在E12.5、E14.5、E16.5,利用颈椎脱臼法处死孕鼠,从子宫中剥离胎盘,用PBS清洗,10%中性福尔马林固定,4 ℃过夜。常规石蜡包埋切片,连续切片(4 μm/片)备用。
1.2.2 免疫组化切片经脱蜡、水化,高压抗原修复,3% H2O2室温孵育10 min,PBS浸洗3 min×3次;5%~10%正常山羊血清封闭,室温孵育10 min,滴加1:100 Smo一抗(Santa Cruz,Sc-13943)、1:150 Pdgfr-α一抗(Abcam,Ab3174),4 ℃孵育过夜;次日孵育完后,吸水纸吸去多余一抗,PBS浸洗3 min×3次;滴加第2代生物素标记二抗工作液,室温孵育20 min;PBS浸洗3 min×3次;第二代辣根酶标记链霉卵白素工作液,37 ℃或室温孵育20 min;PBS浸洗3 min×3次;DAB显色剂显色;苏木精轻度复染,脱水,透明,封片,阴性对照以PBS替代一抗,余步骤相同。每例随机抽取切片5张,光学显微镜下观察,结果判定以细胞浆有棕黄色颗粒沉着为阳性细胞。
1.2.3 免疫荧光切片经脱蜡、水化,高压抗原修复,用固定液固定10 min;去固定液,洗涤液洗3次;封闭液封闭60 min,在摇床上轻轻摇动;去封闭液,兔抗鼠P63单克隆抗体(SAB-202059)体积比1:150稀释,兔抗鼠α-Sma单克隆抗体(Sigma,A-5228),体积比1: 500稀释,4 C过夜,FITC荧光标记山羊抗小鼠IgG(中山生物技术公司)体积比1:75稀释,37 ℃孵育30 min,碘化丙啶(Sigma)染核,甘油封片,荧光显微镜下观察。每次实验均设PBS代替一抗的阴性对照组。
1.2.4 阿利新蓝染色切片经脱蜡、水化;Alcian酸化液浸泡3 min;Alcian染色液染色30 min;流水冲洗;核固红染色液复染5 min;流水冲洗1 min;梯度乙醇脱水,二甲苯透明,中性树胶封片。酸性黏蛋白(硫酸黏蛋白和唾液黏蛋白)显示蓝色,蛋白多糖和透明质酸显示蓝色,细胞核显示红色。
1.3 统计学方法采用SPSS 19.0统计软件,服从正态分布的计量资料两间比较采用两组独立样本t检验,P < 0.05表示差异具有统计学意义。
2 结果 2.1 小鼠胚胎肺假腺期Shh信号通路、Pdgfr-α的表达特点Smo免疫组化结果显示:(1)在小鼠胚胎肺的假腺期早期E12.5左右,近端及远端气道上皮,以及肺间质都表达Smo,阴性对照(-);(2)随着假腺期的发展,在E14.5时,Smo的表达主要集中在肺间质,而上皮的表达量明显下调;(3)在微管期,Smo的表达量迅速下降,E16.5几乎没有检测到Smo的表达。Pdgfr-α免疫组化结果显示:(1)在小鼠胚胎发育的E12.5,Pdgfr-α在远端肺上皮细胞,以及部分包绕着气管、支气管、细支气管周围的间质细胞表达;(2)E14.5,Pdgfr-α的表达严格限制在大支气管周围,与支气管平滑肌细胞毗邻的间质细胞表达Pdgfr-α,但在远端肺中未被发现有Pdgfr-α的表达;(3)微管期,Pdgfr-α出现在更近端的肺间质(图 1)。
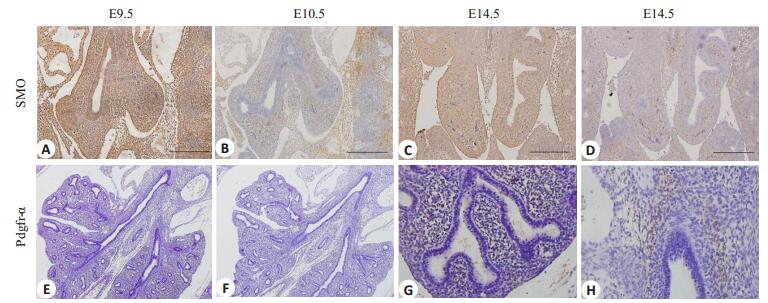
|
图 1 Smo、Pdgfr-α在小鼠胚胎肺发育过程中的表达特点 Figure 1 Expressions of Smo and Pdgfr-α during fetal lung development in mice (A, B, E, F: ×100, C, D, G, H: ×200). A, B: E9.5; C, D: E10.5; E、F、G、H: E14.5 |
我们首次利用Pdgfr-α-Cre系统在间质细胞中特异性敲除Smo。Smoko/ko mTmG(+);Cre(+);GFP(+)代表实验组,为表达Cre重组酶,GFP阳性的基因敲除小鼠;Smofl/fl mTmG(+);Cre(-);GFP(-)代表对照组,为不表达Cre重组酶,GFP阴性的对照小鼠。
2.3 小鼠及肺的大体形态缩小,支气管分支形成减少从大体形态上观察,E12.5-E15.5实验组与对照组小鼠胚胎相比,小鼠胚胎体积及质量均减小,胚胎轻度水肿,E16.5d实验组与对照组胎肺,支气管直径变小,双侧肺叶横径减少(图 2)。E12.5对照组可见右肺四芽结构,而实验组仅有两个肺芽发育,肺芽发育明显滞后;E13.5实验组远端支气管囊泡的形态大小明显小于对照组,提示发育不良;E14.5实验组肺泡远端分子数目较少,远端支气管囊发育不全,间质比例较大;E15.5形态观察发现,实验组远端支气管数目较对照组减少,间质比例较对照组增多;E16.5实验组管状支气管分支较少,分支数目大多为两个及以下,对照组可见更多较为成熟的管状结构,分支数可达5个(图 3)。
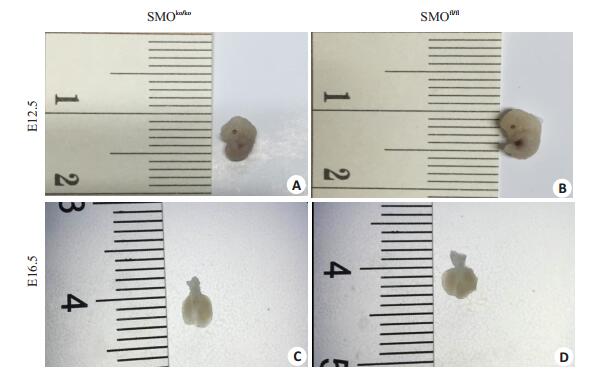
|
图 2 实验组与对照组大体形态比较 Figure 2 Gross observation of normal and transgenic mouse fetuses. A, B: E12.5; C, D: E16.5 |
|
图 3 实验组与对照组肺分支发育的差异 Figure 3 Differences in the development of lung branches in normal and transgenic mice. (E12.5, E13.5: ×100; E14.5, E15.5, E16.5: ×200) |
E12.5-E16.5,实验组的气管长度较对照组明显缩小。E12.5,气管已初具雏形,对照组气管已较多表达硫酸软骨素,而实验组较对照组的软骨素含量明显减少(图 4A);E13.5,对照组可见清晰的气管环状结构,环状结构的发育较实验组更成熟(图 4B);E14.5,两组之间硫酸软骨素的表达未见明显差异(图 4C);E15.5,实验组与对照组均有完整的气管软骨环存在,但与对照组相比气管官腔较窄,AB染色黏蛋白含量下降(图 5)。在间质中特异性敲除Smo基因之后,间质产生软骨基质硫酸软骨素的量下调,直接引起气管发育的异常,气管环形成滞后,气管狭窄。随着支气管的发育,在假腺晚期实验组仍能形成完整的气管软骨环,但与正常对照组相比,其气道周径明显变小。
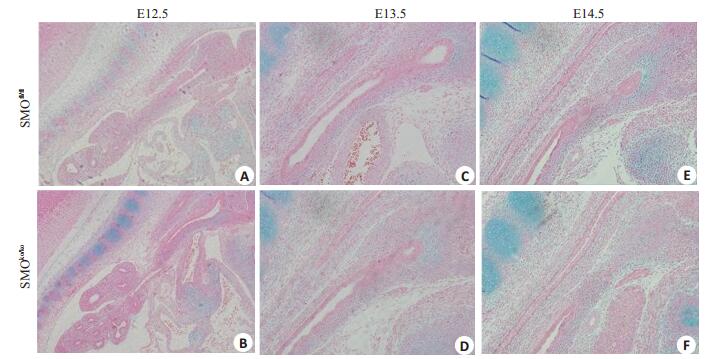
|
图 4 E12.5-E14.5支气管阿利新蓝染色 Figure 4 AB staining of E12.5-E14.5 mouse bronchus (A, B: ×100, C, D, E, F: ×200). A, B: E12.5; C, D: E13.5; E, F: E14.5 |
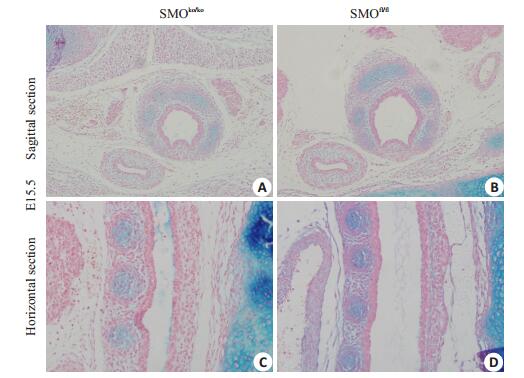
|
图 5 E15.5支气管阿利新蓝染色 Figure 5 AB staining of E15.5 mouse bronchus (×400). A, B, C, D: E15.5 |
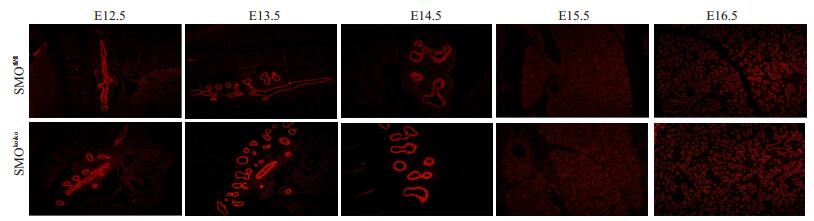
E12.5未观察到P63的阳性表达。E13.5-E15.5,实验组呼吸道上皮P63的表达量较对照组的E16.5,实验组与对照组呼吸道上皮P63的表达量下降改变不明显(图 6)。
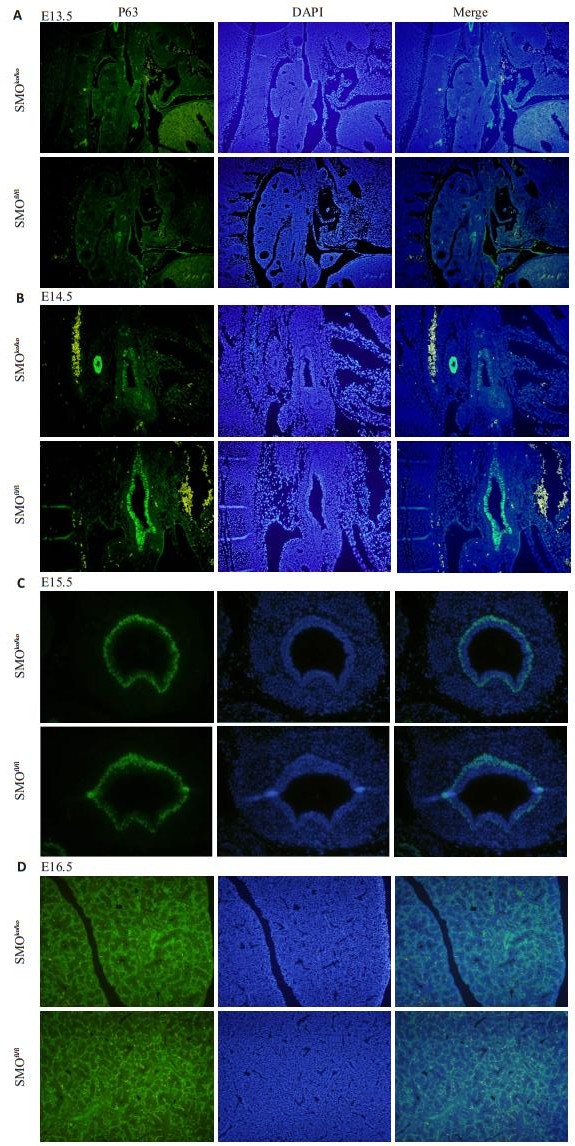
|
图 6 E13.5-E16.5 P63免疫荧光染色对比图 Figure 6 P63 immunofluorescence staining of E13.5-E16.5 mouse bronchial epithelium. A: E13.5; B: E14.5; C: E15.5; D: E16.5. (A: ×100; C: ×400; B, D: ×200) |
α-Sma是平滑肌特异性标志物,E12.5-E13.5,实验组近端及远端α-Sma的表达量较对照组上调(图 7A、B);E14.5实验组近端α-Sma的表达量上调,远端α-Sma的表达量未见明显变化(图 8A);E15.5-E16.5,实验组与对照组近端及远端α-Sma的表达未见明显差异(图 8B、C)。
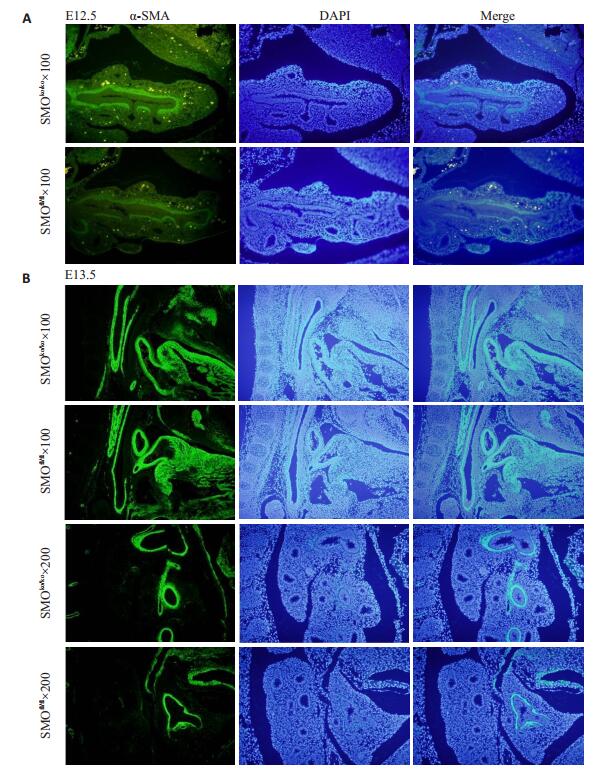
|
图 7 E12.5-E13.5 α-sma免疫荧光染色对比图 Figure 7 α-SMA immunofluorescence staining of E12.5-E13.5 mouse mesenchyme. A: E12.5; B: E13.5. (A: ×100, B: ×200) |
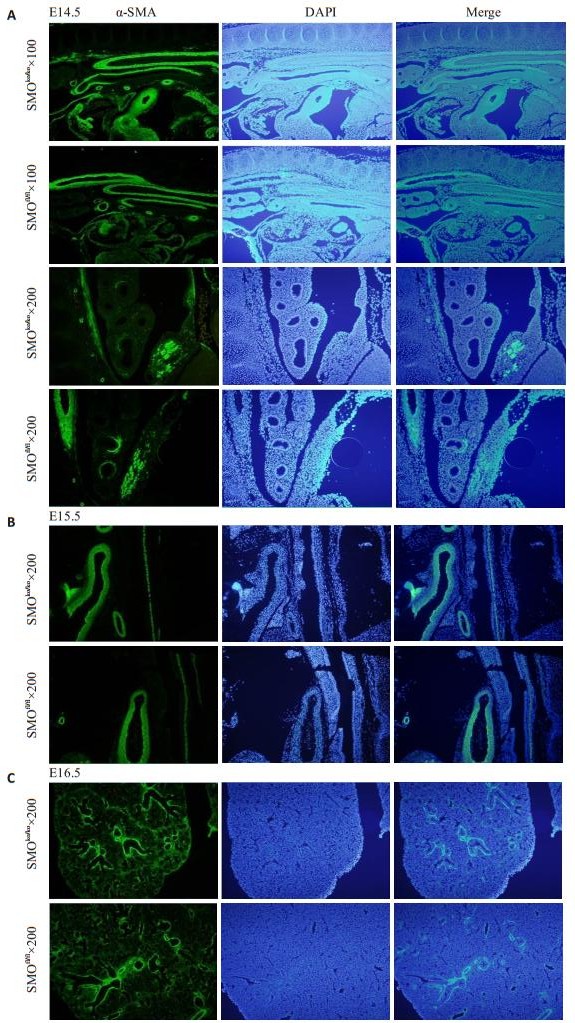
|
图 8 E14.5-E16.5 α-sma免疫荧光染色对比图 Figure 8 α-SMA immunofluorescence staining of E14.5-E16.5 mouse mesenchyme. A: E14.5; B: E15.5; C: E16.5 |
Shh通路信号分子Smo及Pdgfr-α在小鼠胚胎肺发育过程的不同时期的表达部位及表达量有着明显的差异[11, 17]。本研究发现,Smo在假腺期早期的肺上皮与间质中显著表达,随后表达量逐渐下调,主要集中在肺间质,而在上皮的表达量明显下降。说明Smo在假腺早期对上皮及细胞起着较为直接的作用,此时,支气管进一步形成,在左边形成一个次级芽,右边形成四个,同时在间充质中形成软骨和血管,随着胚胎肺的发育,其作用部位主要在间质,说明Shh在气管分支形成中是必须的,但其对上皮细胞是否有间接影响,有待后续实验结果。在假腺期早期胚胎肺中Pdgfr-α集中在远端肺上皮及间质,后期逐渐往近端发展,远端的表达下降,直至集中在主支气管周围的近端间质,说明Pdgfr-α以间质表达为主,且有着从远处转移至近处的特点。选用Pdgfr-α-cre有着较高的空间与时间的选择性,可以达到在假腺期肺间质中特异敲除Shh通路的目的,从而探讨间质及上皮的相互作用。
我们利用Cre-Loxp技术制备间质特异性敲除Smo转基因小鼠模型(该转基因小鼠由美国南加州大学/洛杉矶县儿童医院馈赠)。Smof/f表示floxed smo基因纯合子,无野生型Smo。PDGFR-α-creERT2与ROSA26mTmG报告小鼠交配,产生PDGFR-α-creERT2;Rosa26mTmG后代;鼠尾检测发现其基因组DNA均可经PCR扩增得到重组后的300 bp条带。PDGFR-α-creERT2;Rosa26mTmG母鼠与Smof/f公鼠交配,在怀孕第E8.5,腹腔内注射溶解在葵花籽油的他莫昔芬8 mg,在肺中胚层祖细胞中特异性敲除Smo。同窝出生的是有Smo基因及cre缺失基因的对照小鼠。
研究报道,Shh缺陷小鼠表现为气管食管和肺形态发生的异常,包括肺芽的发育不全,肺不对称性的缺失以及单一的气管食管管道。Ptch1缺失小鼠在E9-E10死亡[18]。Gli1-/-突变小鼠可以存活,在大体形态上是正常的[19]。Gli2缺失小鼠出生时即死亡,Gli3缺陷小鼠可以存活,但它们的肺叶变小,肺叶的形状也不正常[20-21]。TTF-1是对气道上皮分化及其重要的分子。本研究发现,在假腺期特异性失活Shh信号通路之后,小鼠胚胎体积及重量均缩小,胚胎轻度水肿,支气管直径变小,双侧肺叶横径减少,间质产生软骨基质硫酸软骨素的量下调,引起气管环形成滞后,气管狭窄[24-25]。说明E12.5-E16.5胚胎肺间质中表达的Shh信号通路,可以作用于支气管上皮的发育,影响到支气管分支的形成,提高支气管分支的数量以及呼吸管道占肺总量的比例,降低间质比例,若缺乏势必对出生后肺通气功能产生影响[22-23]。但Shh信号通路是通过何种分子作用于上皮的仍需进一步探讨。
后续实验发现,E12.5并未在肺上皮中发现P63的表达,E13.5-E15.5实验组P63表达量下降,而E16.5实验组P63表达量与对照组相比无明显差异,说明Smo可能在E13.5-E15.5期间通过促进P63的表达以促进上皮的发育,而E12.5 Smo对上皮的作用并未开启,E16.5 Smo的表达基本无法测出,因而对P63的表达无影响。在E12.5-E13.5 Smo可通过抑制α-Sma的表达抑制近端及远端的平滑肌发育,而E14.5 Pdgfr-α的表达主要集中在近端间质,因此Smo在此时可抑制近端平滑肌发育,而对远端平滑肌无明显作用,E15.5-E16.5随Pdgfr-α的表达,Smo通路对气道远端平滑肌的发育均无显著影响,说明此刻Smo通过α-Sma对间质的作用主要在E12.5-E13.5,而在E15.5关闭。
在小鼠胎肺发育过程中,Shh、FGF10、BMP4、Wnt通路蛋白的相对表达量,对于肺分支的发育起到重要的调控作用,参与上皮、间质之间的作用。Shh通路不仅仅影响该通路本身的基因分子的表达,研究报道FGF信号通路在远端二级肺芽尖被激活,与正常肺相比,Shh缺失小鼠肺中FGF10的表达下调。Shh抑制了FGF10在肺远端肺芽尖间质中的表达,并抑制FGF10在肺芽之间的表达,以利于新肺芽的定位生长。相反的是,FGF10提高了Shh在上皮中的表达,于是Shh可以反过来调控间质的形成[7, 22]。BMP4蛋白主要表达于胎肺气道上皮细胞以及气道外周的尖端部位,起到抑制上皮细胞增殖、对抗FGF10的作用,扮演者抑制过度分支或产生新分支点信号蛋白的作用[23-25]。然而,Shh通路和FGF、BMP、EGF和WNT家族之间在胚胎肺发育过程中的相互作用关系尚有待实验进一步研究。
综上所述,本研究发现Shh信号通路在小鼠肺发育过程中起着重要作用,影响上皮与间质的相关作用,促进支气管分支、气管环、肺叶的形成,促进远端上皮的发育,而抑制近端上皮的发育,促进假腺晚期近端平滑肌的发育,而抑制假腺早期平滑肌的发育。
| [1] |
Herriges M, Morrisey EE. Lung development: orchestrating the generation and regeneration of a complex organ[J].
Development, 2014, 141(3): 502-13.
DOI: 10.1242/dev.098186. |
| [2] |
Peng T, Tian Y, Boogerd CJ, et al. Coordination of heart and lung co-development by a multipotent cardiopulmonary progenitor[J].
Nature, 2013, 500(7464): 589-92.
DOI: 10.1038/nature12358. |
| [3] |
Hines EA, Jones MK, Verheyden JM, et al. Establishment of smooth muscle and cartilage juxtaposition in the developing mouse upper airways[J].
Proc Natl Acad Sci USA, 2013, 110(48): 19444-9.
DOI: 10.1073/pnas.1313223110. |
| [4] |
Moura RS, Silva-Goncalves C, Vaz-Cunha PA. Expression analysis of Shh[J].
Histochem Cell Biol, 2016, 146(4): 457-66.
DOI: 10.1007/s00418-016-1448-1. |
| [5] |
万华靖, 石芳. 肺发育与相关疾病机制研究进展[J].
中华实用儿科临床杂志, 2016, 31(16): 1201-4.
DOI: 10.3760/cma.j.issn.2095-428X.2016.16.001. |
| [6] |
邵亚楠. Sonic Hedgehog信号通路在胎肺发育和肺部疾病中的研究进展[J].
国际儿科学杂志, 2012, 39(2): 203-5, 211.
|
| [7] |
Kim N, Yamamoto H, Pauling MH, et al. Ablation of lung epithelial cells deregulates FGF-10 expression and impairs lung branching morphogenesis[J].
Anat Rec(Hoboken), 2009, 292(1): 123-30.
DOI: 10.1002/ar.v292:1. |
| [8] |
Pepicelli CV, Lewis PM, Mcmahon AP. Sonic hedgehog regulates branching morphogenesis in the mammalian lung[J].
Curr Biol, 1998, 8(19): 1083-6.
DOI: 10.1016/S0960-9822(98)70446-4. |
| [9] |
Lan Y, Jiang RL. Sonic hedgehog signaling regulates reciprocal epithelial-mesenchymal interactions controlling palatal outgrowth[J].
Development, 2009, 136(8): 1387-96.
DOI: 10.1242/dev.028167. |
| [10] |
Gouveia L, Betsholtz C, Andrae J. Expression analysis of plateletderived growth factor receptor alpha and its ligands in the developing mouse lung[J].
Physiol Rep, 2017, 5(6): e13092.
DOI: 10.14814/phy2.13092. |
| [11] |
Kimani PW, Holmes AJ, Grossmann RE, et al. PDGF-Ralpha gene expression predicts proliferation, but PDGF-A suppresses transdifferentiation of neonatal mouse lung myofibroblasts[J].
Respir Res, 2009, 10: 119.
DOI: 10.1186/1465-9921-10-119. |
| [12] |
Datta A, Kim GA, Taylor JM, et al. Mouse lung development and NOX1 induction during hyperoxia are developmentally regulated and mitochondrial ROS dependent[J].
Am J Physiol Lung Cell Mol Physiol, 2015, 309(4): L369-77.
DOI: 10.1152/ajplung.00176.2014. |
| [13] |
Tondreau MY, Boucher E, Simard M, et al. Sex-specific perinatal expression of glutathione peroxidases during mouse lung development[J].
Mol Cell Endocrinol, 2012, 355(1): 87-95.
DOI: 10.1016/j.mce.2012.01.022. |
| [14] |
Mehta A, Dobersch S, Dammann RH, et al. Validation of tuba1a as appropriate internal control for normalization of gene expression analysis during mouse lung development[J].
Int J Mol Sci, 2015, 16(3): 4492-511.
DOI: 10.3390/ijms16034492. |
| [15] |
Corbit KC, Aanstad P, Singla V, et al. Vertebrate smoothened functions at the primary cilium[J].
Nature, 2005, 437(761): 1018-21.
|
| [16] |
Metzger RJ, Klein OD, Martin GR, et al. The branching programme of mouse lung development[J].
Nature, 2008, 453(7196): 7U1-45.
|
| [17] |
Miwa H, Era T. Generation and Characterization of PDGFRa-GFPCreERT2 Knock-in Mouse Line[J].
Genesis, 2015, 53(5): 329-36.
DOI: 10.1002/dvg.v53.5. |
| [18] |
Goodrich LV, Milenkovic L, Higgins KM, et al. Altered neural cell fates and medulloblastoma in mouse patched mutants[J].
Science, 1997, 277(5329): 1109-13.
DOI: 10.1126/science.277.5329.1109. |
| [19] |
Park HL, Bai C, Platt KA, et al. Mouse Gli1 mutants are viable but have defects in SHH signaling in combination with a Gli2 mutation[J].
Development, 2000, 127(8): 1593-605.
|
| [20] |
Motoyama J, Liu J, Mo R, et al. Essential function of Gli2 and Gli3 in the formation of lung, trachea and oesophagus[J].
Nat Genet, 1998, 20(1): 54-7.
DOI: 10.1038/1711. |
| [21] |
Grindley JC, Bellusci S, Perkins D, et al. Evidence for the involvement of the Gli gene family in embryonic mouse lung development[J].
Dev Biol, 1997, 188(2): 337-48.
DOI: 10.1006/dbio.1997.8644. |
| [22] |
White AC, Lavine KJ, Ornitz DM. FGF9 and SHH regulate mesenchymal Vegfa expression and development of the pulmonary capillary network[J].
Development, 2007, 134(20): 3743-52.
DOI: 10.1242/dev.004879. |
| [23] |
Domyan ET, Ferretti E, Throckmorton K, et al. Signaling through BMP receptors promotes respiratory identity in the foregut via repression of Sox2[J].
Development, 2011, 138(5): 971-81.
DOI: 10.1242/dev.053694. |
| [24] |
Shu W, Guttentag S, Wang Z, et al. Wnt/beta-catenin signaling acts upstream of N-myc, BMP4, and FGF signaling to regulate proximal-distal patterning in the lung[J].
Dev Biol, 2005, 283(1): 226-39.
|
| [25] |
Goss AM, Tian Y, Tsukiyama T, et al. Wnt2/2b and beta-catenin signaling are necessary and sufficient to specify lung progenitors in the foregut[J].
Dev Cell, 2009, 17(2): 290-8.
DOI: 10.1016/j.devcel.2009.06.005. |
 2018, Vol. 38
2018, Vol. 38

