2. 江西省儿童医院,江西 南昌 330006
2. Jiangxi Provincial Children's Hospital, Nanchang 330006, China
沙门氏菌为一组寄生于人类和动物肠道内生化反应和抗原构造相似的革兰阴性杆菌,通过食物和水源经口感染,可引起伤寒、副伤寒、细菌性食物中毒、腹泻、菌血症和败血症[1-2]。其发病率及死亡率有逐年升高的趋势,对于免疫力尚未发育完善的儿童,严重的沙门菌感染常常危及生命。据统计,我国食源性疾病和食物中毒病例中分离的病原体沙门菌一直排名前三,其中检出率最高的为鼠伤寒沙门菌[3]。目前,除伤寒沙门菌感染外,其他沙门菌感染在临床上还缺乏有效的防治手段。因此,深入研究沙门菌的致病因子及其机制具有重要的临床意义。沙门氏菌可存在大小约8 000高度保守的毒力质粒(spv),该基因位点与细胞内细菌生长粘附和全身感染有关。而spvB作为spv基因的重要组成部分,在细菌入侵宿主细胞后表达上调,其与细菌的毒力和增殖密不可分[4-5]。
自噬是一种高度保守的溶酶体再循环过程,不仅能够降解受损伤细胞器和错误折叠蛋白等物质,还有异体吞噬的功能,即通过检测、聚集并摧毁入侵胞内的病原微生物,提供早期固有免疫的作用[6-7]。p38信号通路作为MAPK通路里的一个亚型,是炎症反应中的一个重要参与者。当机体受到感染、组织损伤等信号刺激时,p38MAPK通路会活化并发挥重要调节作用[8-9]。前期研究表明,spvB能够抑制宿主细胞的自噬,这与Chu等[10]的研究结果相符,然而携带有spvB基因的沙门菌对入侵的宿主细胞自噬的抑制作用的具体机制尚不明确,本研究以体外细胞实验为基础构建鼠伤寒沙门菌感染模型,并进一步探讨spvB基因的毒力作用机制及与p38MAPK信号通路相关性,为揭示沙门菌感染的发病机制并探寻其新的防治手段提供思路。
1 材料和方法 1.1 实验材料携带spv基因的野生型鼠伤寒沙门菌株211(STM-211)是由江西省儿童医院微生物室保存的临床分离株;敲除spvB基因的沙门菌(STM-ΔspvB)、回补spvB基因的沙门菌(STM-c-spvB)由本实验组前期实验构建完成,-80 ℃保存。人肠道上皮细胞株Henle-407是由天津商业大学生物技术与食品科学学院阮元华教授惠赠。
1.2 主要试剂和仪器主要试剂及仪器包括SS琼脂培养基(索莱宝公司);DMEM培养基(BI公司);胎牛血清(BI公司)DMSO(Sigma公司);RIPA裂解液(康为CW公司);LC3B抗体(Sigma公司);P62抗体、p38抗体、p-p38抗体购自CST公司;GAPDH内参抗体(Affinity公司);鼠二抗、兔二抗(TransGEN公司);通路抑制剂SB203580(Sigma公司);超低温冰箱(德国西门子公司);CO2培养箱(BSD-100,上海博讯);多功能酶标仪(Thermo公司);高速离心机(Eppendorf公司);电泳仪(Bio-Rad公司);倒置荧光显微镜(Zeiss公司);分光光度计(752C,上海第三分析仪器厂)。
1.3 主要方法 1.3.1 细胞和细菌的培养取Henle-407细胞使用含10%胎牛血清的DMEM培养基培养,放置于37 ℃、5% CO2细胞培养箱内。从-80 ℃冰箱中取出受试菌株接种到5 mL LB培养液中,37 ℃摇菌过夜,将同等比例稀释的菌液涂布于SS琼脂培养基上,37 ℃培养过夜,直至生长出肉眼可见的单菌落,存放于4 ℃冰箱备用。每次实验挑取单菌落接种到5 mL LB液体培养基中,37 ℃振荡培养至对数生长期后可用于实验。细菌采用稀释涂布平板法进行计数。
1.3.2 细胞分组及培养取一定量的Henle-407细胞接种于培养皿中(6孔板接种1.3×106/孔,10 cm细胞培养皿接种6.5×106/孔,24孔板接种1×105/孔)。
1.3.2.1 细胞p38MAPK水平检测细胞分为4组,即STM-211感染组,STM-ΔspvB感染组和STM-c-spvB感染组正常细胞对照组。将细胞与对应的受试菌进行共培养(详见2.3)分别于0点后的1、2、4 h收集细胞进行胞内活菌计数(详见1.3.4)或提取总蛋白,用免疫印迹法(WB)检测细胞p38的磷酸化水平表达(详见1.3.5)。
1.3.2.2 SB203580干预对自噬相关蛋白表达的影响细胞分为8组,即STM-211组、STM-ΔspvB组、STM-cspvB组、正常细胞组(Control)、SB203580干预的STM-211组(SB203580+STM-211)、SB203580干预的STM-ΔspvB组(SB203580+STM-ΔspvB)、SB203580干预的STM-c-spvB组(SB203580+STM-c-spvB)、SB203580干预的正常细胞组(SB203580+Control)。SB203580干预即把细胞预先用含10 µmol/LSB203580的培养液预处理1 h后,再将相应受试菌与Henle-407细胞共培养。共培养1、3 h后收集细胞并提取总蛋白,WB检测细胞自噬相关蛋白自噬标记蛋白微管相关蛋白1轻链3(LC3)和P62的表达水平,免疫荧光染色(IF)观察细胞自噬相关蛋白LC3的表达(详见1.3.6)。
1.3.3 建立细胞感染模型细胞贴壁后,各组细胞按感染复数(MOI)100:1分别加入处于对数期的STM-211、STM-ΔspvB细菌、STM-c-spvB或无菌细胞培养基,于37 ℃、5% CO2条件下共培养1 h。去上清液,取无菌磷酸缓冲盐溶液(PBS)洗2遍,加入含有50 μg/mL庆大霉素10%胎牛血清(FBS)的DMEM培养基以杀灭胞外菌,设该时间点为0点。然后置于37℃、5% CO2条件下继续进行共培养1 h,取PBS洗两遍,加入将含有5 μg/mL最小抑菌浓度庆大霉素的细胞培养基,以抑制从感染细胞中释放出来的细菌增值。于不同时间节点收集细胞并检测相关指标。
1.3.4 细胞内活菌稀释涂板计数在共培养进行1、2和4 h后,对各感染组细胞进行胞内活菌数目的测定。收集各感染组细胞,随后分别用0.1%的Triton X-100进行透膜处理,取无菌生理盐水稀释一定比例后,直接涂板接种于SS琼脂平板,作菌落计数,并计数出各组细胞内的细菌存活数目。
1.3.5 免疫印迹法Henle-407细胞与相应受试细菌进行共培养后,从细胞培养箱中取出细胞弃上清,取4 ℃预冷的PBS洗2遍。细胞加入裂解液,每2×106细胞中加入80 μL裂解液并用细胞刮刀收集于离心管中,冰上静置15 min,超声裂解细胞后,4 ℃14 000 g离心10 min。得到总蛋白上清,取少量样品用BCA蛋白定量试剂盒在酶标仪上对样品中蛋白浓度进行测定。取50 µg样品上样,选用10%~15% SDS-PAGE凝胶和Tris-甘氨酸电泳缓冲液电泳,并将蛋白转膜至PVDF膜上,5%脱脂奶粉或胎牛血清(BSA)室温封闭2 h;加入一抗于4 ℃摇床孵育过夜。次日TBST洗膜后加入相应HRP标记的羊抗兔IgG,室温孵育2 h,加入TBST液于摇床上洗4次,每次10 min;ECL化学发光液显影后,于凝胶成像系统拍照并分析各组细胞蛋白的表达情况。
1.3.6 细胞免疫荧光法(IF)在将细胞接种到24孔板之前,先把无菌小玻片置于培养板中制作细胞爬片,细菌干预同上(1.3.3)。然后细胞用预冷的PBS清洗,随后用4%的多聚甲醛溶液室温固定0.5 h,加入0.1%的Triton X-100进行透膜处理,各加入3% BSA室温封闭1 h,加入一抗4 ℃孵育过夜,次日PBS洗3遍后加入相应的荧光二抗IgG,室温避光孵育1 h,用PBS洗3遍后,DAPI室温避光染核5 min,PBS洗3遍,用90%的甘油封片。置于荧光显微镜下观察。
1.4 统计学处理用SPSS17.0统计分析软件进行数据处理,数据采用均数±标准差表示,组间比较采用t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 检测各组细胞p38MAPK信号通路的表达水平在不同组的沙门菌作用不同时间后,用免疫印记法检测p38MAPK信号通路的表达水平,结果显示:各个感染组的p38磷酸化水平均较对照组增高;感染后的1 h,STM-ΔspvB感染组p38的磷酸化水平显著高于STM-211和STM-c-spvB感染组(P < 0.05),这种趋势一直持续到2 h和4 h(P < 0.05);并且STM-211、STM-ΔspvB或STM-c-spvB感染组随着时间增加,p38的磷酸化水平也呈升高趋势(图 1)。
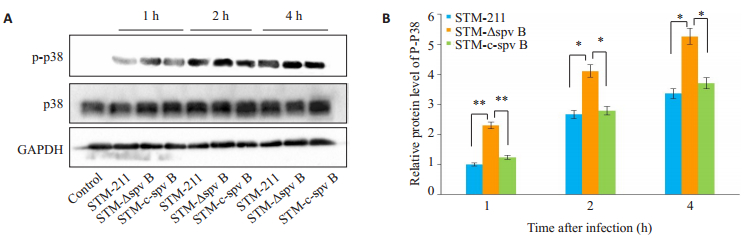
|
图 1 免疫印迹法检测各组细胞的p38磷酸化水平 Figure 1 Levels of p38 phosphorylation in each group detected by Western blotting. A: Wester blots in each group; B: Ratios of P-p38/GAPDH in each group. n=6. *P < 0.05, **P < 0.01. |
经过共培养1、2和4 h后,收集不同组细胞并时行胞内活菌数的测定。经检测,在细菌干预后的1 h,各感染组培养基中的细菌总量未明显差别,从2 h开始,STM-ΔspvB感染组的细菌存活量明显低于STM-211和STM-c-spvB感染组(P < 0.05),4 h时,细菌数目虽有增长而STM-ΔspvB组较STM-211和STM-c-spvB组的数量差距依然很明显(P < 0.05,图 2)。
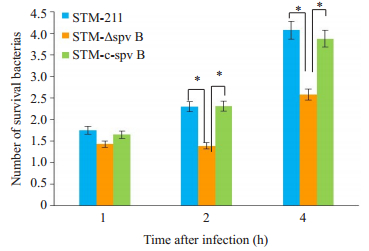
|
图 2 各感染组胞内细菌存活数量的测定 Figure 2 Intracellular live bacterium counts in each group. n=8. *P < 0.05. |
按1.3.2.2的分组,免疫印记法检测各组细胞相关蛋白LC3和P62的表达,结果显示:在感染后的1 h,STM-ΔspvB感染组LC3Ⅱ的表达水平显著高于STM-211和STM-c-spvB感染组(P < 0.05),自噬底物P62蛋白水平则较STM-211和STM-c-spvB感染组下降(P < 0.05);经SB203580处理后,对照组、STM-211和STMc-spvB感染组的LC3Ⅱ水平较前无明显差异(P > 0.05),而STM-ΔspvB感染组则显著降低(P < 0.05);P62蛋白水平STM-ΔspvB感染组较SB203580处理前显著升高(P < 0.05),其它组较处理前无明显差异(图 3A)。感染后3 h,LC3Ⅱ和P62蛋白水平表达保持感染1 h时的趋势,经SB203580干预后,STM-ΔspvB组LC3Ⅱ表达量显著升高,P62表达量显著降低,而STM-211和STM-cspvB组LC3Ⅱ和P62蛋白水平较未经SB203580干预组无明显改变(图 3B)。
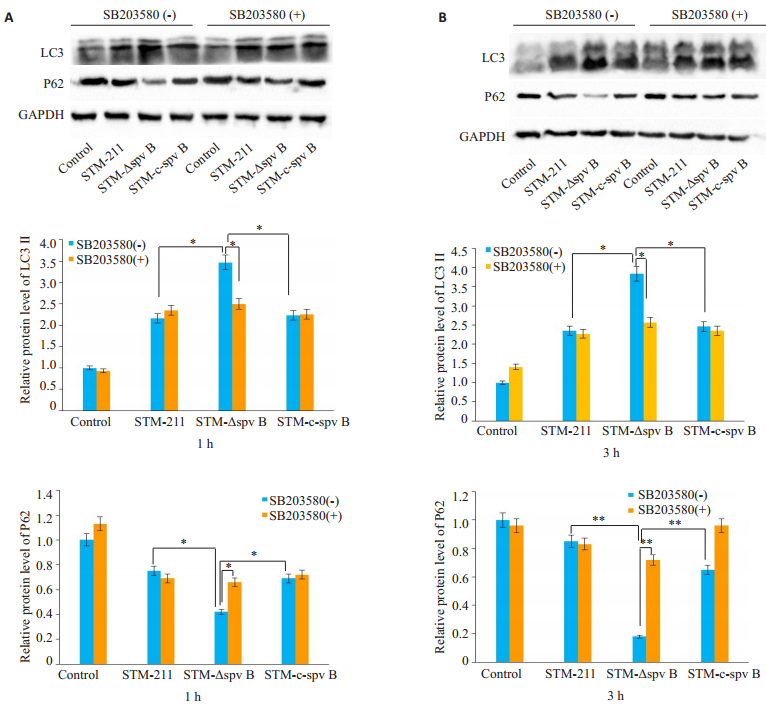
|
图 3 SB203580处理对鼠伤寒沙门氏菌感染后的Henle-407细胞自噬水平的影响 Figure 3 Effects of SB203580 treatment on autophagic levels in Henle-407 cells after Salmonella typhimurium infection. A: Relative protein level of autophagy related protein at 1 h after infection. B: Relative protein level of autophagy related protein at 3 h after infection. n=6. *P < 0.05, **P < 0.01. |
细胞自噬相关蛋白LC3参与自噬溶酶体的形成,这一过程可以通过细胞免疫荧光染色LC3阳性点状聚焦显示。结果表明:共培养结束后2 h,与对照组相比,各感染组细胞核周的LC3点状结构显著增加;STM-ΔspvB组显著多于STM-211组。经SB203580处理后,STM-ΔspvB组LC3颗粒荧光小点数量明显减少,STM-211组较处理前无明显改变(图 4)。
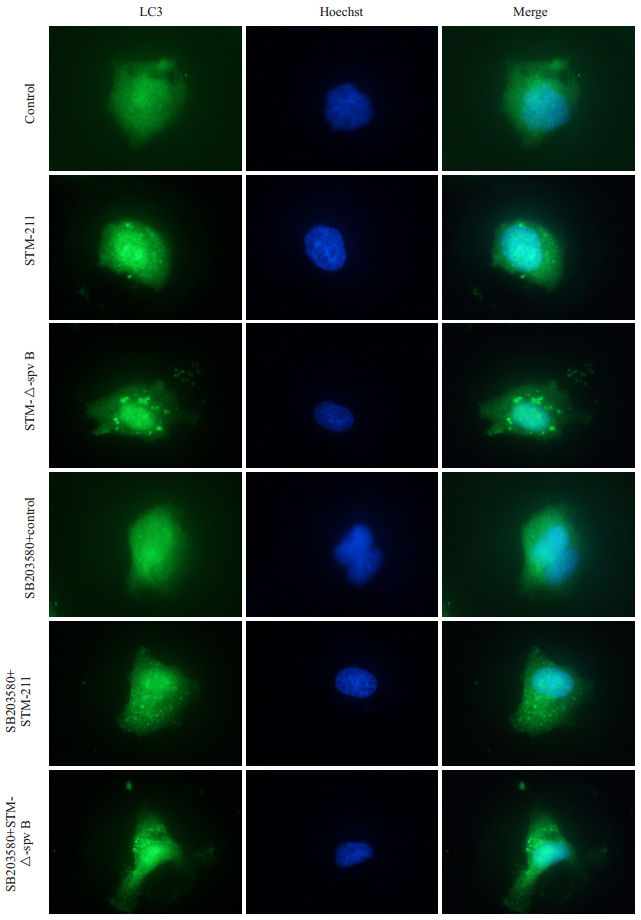
|
图 4 各组细胞免疫荧光染色 Figure 4 Immunofluorescence staining of each group of cells (Original magnification: ×100). |
自噬是真核细胞内的重要降解系统之一,可通过选择性地移除蛋白聚合体和损伤细胞器,以维持生命体内蛋白质代谢的平衡和细胞内环境的稳定。其与多种疾病的发生发展密切相关,如感染、神经退行性疾病和癌症[11-12]。在正常情况下,自噬处于一个基本水平的活跃状态,但当遭遇饥饿、低氧、错误折叠蛋白积累或细菌入侵的情况时,自噬水平将迅速上调[13-14]。作为一个细胞内膜转运过程,自噬在控制细菌感染和毒素入侵方面起到非常重要的作用。研究表明,核点蛋白52(NDP52)连接自噬体表面的微管相关蛋白1轻链3(LC3),可将泛素化的沙门氏菌递送至自噬体内加以清除[15-16]。然而许多包含沙门菌在内的细胞内病原体可通过修饰或干扰等机制阻止或中断自噬,甚至利用自噬促进自身在宿主细胞内的存活与增殖,延长其在细胞内的生命周期。
spvB基因为spv基因簇包含5个基因之一,是必不可少的毒力表型,其作用是增强对宿主细胞的毒性作用以及感染间期细胞内的细菌增殖[17-19]。研究表明,spvB可影响细胞内的细菌生长率。沙门氏菌接触到细胞内环境后spv基因表达上调,Gotoh等[20]通过模拟细胞内离子浓度诱导沙门菌通过TTSS分泌的SpvB蛋白量增加。而SpvB蛋白可诱导宿主细胞内的P小体分解[21],同时其C-端结构域具有的ADP-核糖基转移酶活性,可阻止其共价修饰G-肌动蛋白单体聚合形成微丝[22],从而诱导真核细胞骨架的损失和凋亡的发生。p38MAPK信号传导通路是MAPK家族的重要组成部分,主要由免疫因子、病原体和环境应激等因素活化。许多报道认为p38MAPK可通过mTOR依赖性途径正向调节自噬的发生[23],如葡萄糖缺乏[24]、干扰素γ [25]和白藜芦醇[26]刺激等。活化后的p38可以诱导细胞产生一系列的反应,如激活下游的转录因子等,从而影响细胞的生长和繁殖[27-28]。
在本研究中,检测各组p38磷酸化水平结果显示,突变株感染组明显较野生株感染组细胞p38磷酸化水平高,提示spvB基因对Henle-407细胞的影响与p38通路密切相关。胞内活菌计数也表明,突变株较野生株和回补株受到宿主细胞更强的抑制,而未经SB203580处理的鼠伤寒沙门氏菌的研究结果显示,突变株组的自噬水平明显高于野生株组和回补株组,可以推测突变株感染组胞内活菌量较少可能是由于受到宿主细胞更强自噬作用的抑制。另一方面,WB和IF的结果显示,经过SB203580处理的野生株STM-211和回补株STM-cspvB感染组自噬水平与未处理组自噬水平无明显差异,而SB203580+STM-ΔspvB组较STM-ΔspvB组自噬水平明显降低,表明沙门菌在入侵宿主细胞后spvB基因抑制Henle-407细胞自噬可能是通过负调控p38信号通路达成的,也提示p38分子及相关信号通路在调节细胞自噬水平和抗感染方面发挥重要作用。本研究对沙门菌毒力质粒spvB基因抑制宿主自噬的调节机制进行了初步探索,验证了p38MAPK信号通路在沙门菌感染肠粘膜上皮细胞Henle-407中的重要作用,然而该结论目前只停留在体外研究阶段,对于更加复杂的体内环境是否能得到验证还有待进一步研究。
| [1] |
陈强, 余晓君, 李俏俏, 等. 引起儿童腹泻的沙门菌属临床分离株的耐药特点及分子流行病学研究[J].
中华检验医学杂志, 2011, 34(3): 249-53.
|
| [2] |
Asgharpour F, Rajabnia R, Shahandashti EF, et al. Investigation of class Ⅰ integron in salmonella infantis and its association with drug resistance[J].
Jundishapur J Microbiol, 2014, 7(5): e10019.
|
| [3] |
Yang BW, Qiao LP, Zhang XL, et al. Serotyping, antimicrobial susceptibility, pulse field gel electrophoresis analysis of Salmonella isolates from retail foods in Henan Province, China[J].
Food Control, 2013, 32(1): 228-35.
DOI: 10.1016/j.foodcont.2012.11.022. |
| [4] |
Hochmann H, Pust S, von Figura G, et al. Salmonella enterica SpvB ADP-ribosylates actin at position arginine-177-characterization of thecatalytic domain within the SpvB Protein and a comparison to binary clostridial actin-ADP-ribosylating toxins[J].
Biochemistry, 2006, 45(4): 1271-7.
DOI: 10.1021/bi051810w. |
| [5] |
Fierer J, Eckmann L, Fang F, et al. Expression of the salmonella virulence plasmid gene spvB in cultured macrophages and nonphagocytic cells[J].
Infect Immun, 1993, 61(12): 5231-6.
|
| [6] |
Shin HJ, Kim H, Oh S, et al. AMPK-SKP2-CARM1 signalling cascade in transcriptional regulation of autophagy[J].
Nature, 2016, 534(768): 553-7.
|
| [7] |
Miller C, Celli J. Avoidance and subversion of eukaryotic homeostatic autophagy mechanisms by bacterial pathogens[J].
J Mol Biol, 2016, 428(17, SI): 3387-98.
DOI: 10.1016/j.jmb.2016.07.007. |
| [8] |
Khong WX, Foo DG, Trasti SL, et al. Sustained high levels of IL-6 contribute to the pathogenesis of Enterovirus 71 in a neonate mouse mod-el[J].
J Virol, 2011, 85(7): 3067-76.
DOI: 10.1128/JVI.01779-10. |
| [9] |
Hsu WY, Chao YW, Tsai YL, et al. Resistin induces Monocyte-Endothelial cell adhesion by increasing ICAM-1 and VCAM-1 expression in endothelial cells via p38MAPK-dependent pathway[J].
J Cell Physiol, 2011, 226(8): 2181-8.
DOI: 10.1002/jcp.22555. |
| [10] |
Chu YY, Gao S, Wang T, et al. A novel contribution of spvB to pathogenesis of Salmonella Typhimurium by inhibiting autophagy in host cells[J].
Oncotarget, 2016, 7(7): 8295-309.
|
| [11] |
Liliana Tateosian N, Miguel Pellegrini J, Oscar Amiano N, et al. IL17A augments autophagy in Mycobacterium tuberculosis-infected monocytes from patients with active tuberculosis in association with the severity of the disease[J].
Autophagy, 2017, 13(7): 1191-204.
DOI: 10.1080/15548627.2017.1320636. |
| [12] |
Lamb CA, Yoshimori T, Tooze SA. The autophagosome: origins unknown, biogenesis complex[J].
Nat Rev Mol Cell Biol, 2013, 14(12): 759-74.
DOI: 10.1038/nrm3696. |
| [13] |
Kumsal AT, Gozde K, Deniz GO, et al. MIR181A regulates starvation-and rapamycininduced autophagy through targeting of ATG5[J].
Autophagy, 2013, 9(3): 374-85.
DOI: 10.4161/auto.23117. |
| [14] |
Boya P, Reggiori F, Codogno P. Emerging regulation and functions of autophagy[J].
Nat Cell Biol, 2013, 15(7): 713-20.
DOI: 10.1038/ncb2788. |
| [15] |
Thurston TL, Ryzhakov G, Bloor S, et al. The TBK1 adaptor and autophagy receptor NDP52 restricts the proliferation of ubiquitincoated bacteria[J].
Nat Immunol, 2009, 10(11): U103-1215.
|
| [16] |
Lazarou M, Sliter DA, Kane LA, et al. The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy[J].
Nature, 2015, 524(7565): 309-14.
DOI: 10.1038/nature14893. |
| [17] |
Tezcan-Merdol D, Nyman T, Lindberg U, et al. Actin is ADPribosylated by the Salmonella enterica virulence-associated protein SpvB[J].
Mol Microbiol, 2001, 39(3): 606-19.
DOI: 10.1046/j.1365-2958.2001.02258.x. |
| [18] |
Guiney DG, Lesnick M. Targeting of the actin cytoskeleton during infection by Salmonella strains[J].
Clin Immunol, 2005, 114(3): 248.
DOI: 10.1016/j.clim.2004.07.014. |
| [19] |
Lesnick ML, Reiner NE, Fierer J, et al. The salmonella spvB virulence gene encodes an enzyme that ADP-ribosylates actin and destabilizes the cytoskeleton of eukaryotic cells[J].
Mol Microbiol, 2001, 39(6): 1464-70.
DOI: 10.1046/j.1365-2958.2001.02360.x. |
| [20] |
Gotoh H, Okada N, Kim YG, et al. Extracellular secretion of the virulence plasmid-encoded ADP-ribosyltransferase SpvB in Salmonella[J].
Microb Pathog, 2003, 34(5): 227-38.
DOI: 10.1016/S0882-4010(03)00034-2. |
| [21] |
Eulalio A, Froehlich KS, Mano M, et al. A candidate approach implicates the secreted salmonella effector protein SpvB in P-Body disassembly[J].
PLoS One, 2011, 6(3): e17296.
DOI: 10.1371/journal.pone.0017296. |
| [22] |
Derakhshandeh A, Firouzi R, Khoshbakht R. Association of three plasmid-encoded spv genes among different salmonella serotypes isolated from different origins[J].
Indian J Microbiol, 2013, 53(1): 106-10.
DOI: 10.1007/s12088-012-0316-5. |
| [23] |
Wei YJ, An ZY, Zou ZJ, et al. The stress-responsive kinases MAPKAPK2/MAPKAPK3 activate starvation-induced autophagy through Beclin 1 phosphorylation[J].
Elife, 2015, 4: e05289.
|
| [24] |
Moruno-Manchon JF, Perez-Jimenez E, Knecht E. Glucose induces autophagy under starvation conditions by a p38 MAPK-dependent pathway[J].
Biochem J, 2013, 449(2): 497-506.
DOI: 10.1042/BJ20121122. |
| [25] |
Matsuzawa T, Kim BH, Shenoy AR, et al. IFN-gamma elicits macrophage autophagy via the p38 MAPK Signaling Pathway[J].
J Immunol, 2012, 189(2): 813-8.
DOI: 10.4049/jimmunol.1102041. |
| [26] |
Chang YP, Ka SM, Hsu WH, et al. Resveratrol inhibits NLRP3 inflammasome activation by preserving mitochondrial integrity and augmenting autophagy[J].
J Cell Physiol, 2015, 230(7): 1567-79.
DOI: 10.1002/jcp.24903. |
| [27] |
Keil E, Höcker R, Schuster M, et al. Phosphorylation of Atg5 by the Gadd45β-MEKK4-p38 pathway inhibits autophagy[J].
Cell Death Differ, 2013, 20(2): 321-32.
DOI: 10.1038/cdd.2012.129. |
| [28] |
Cuadrado A, Nebreda AR. Mechanisms and functions of p38 MAPK signalling[J].
Biochem J, 2010, 429(3): 403-17.
DOI: 10.1042/BJ20100323. |
 2018, Vol. 38
2018, Vol. 38

