在组织创伤、感染、毒素反应以及自身免疫性应激损伤中常常伴随着炎症反应[1-2]。适度的炎症反应可以促使宿主移除有害刺激和机体启动防御性愈合,研究表明多种疾病诱导的组织损伤是由过激的炎症反应引起,多种感染性疾病如脓毒症、急性肺炎和感染性休克的病理进展与急性炎症有密切的联系[3-5]。当机体检测到病原体侵入后,免疫系统中各种免疫细胞渗入炎症区域。在这些免疫细胞中,巨噬细胞在炎症反应中发挥重要作用。巨噬细胞在炎症组织中积聚,去除感染因子,消除炎症和消除死亡细胞。巨噬细胞在宿主防御(包括炎症)的起始和调节中起着重要的作用,并且可以被多种炎症刺激如LPS和TNF-α激活以引发炎症过程的级联。它们还通过分泌多种炎症介质(包括细胞因子、趋化因子和蛋白酶)在炎症过程中修复受损组织。
细胞呼吸代谢过程中产生的活性氧自由基(ROS)作为一种细胞信号分子在炎症反应中扮演着重要的角色[6-7]。然而,研究发现过量生成的ROS能导致细胞凋亡的发生,多种致命性疾病如自身免疫性疾病是由ROS异常产生导致的。因此,探讨ROS在炎症反应过程中所执行的功能[8-9]是非常重要的。
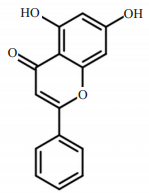
白杨素(Chrysin)又名白杨黄素(图 1),属于黄酮类化合物[10]。白杨素具有抗氧化[11]、抗肿瘤[12]、抗炎[13]等广泛药理活性,该类化合物在植物中分布广泛,毒性比较低,因此是新药开发研究中一个非常重要的资源[14]。白杨素在抗氧化应激和抗炎方面具有独特的潜能,然而关于白杨素是否在革兰氏阴性细菌表面脂多糖诱导的炎症反应以及具体的抗炎作用机制还未见报道。
|
图 1 白杨素的化学结构式 Figure 1 Chemical structure of chrysin. |
JAK-STATs信号通路是调控细胞因子和生长因子中最重要的一条通路,参与了细胞增殖、细胞分化和细胞迁移[15]等多种生理活动。研究已证实JAK-STATs信号的失调能导致多种炎症反应[16]的发生,因此针对JAK-STATs信号靶点进而研发抗炎药物是可行的。
虽然已经有诸多研究报道了白杨素具有抗炎效果,但在革兰氏阴性细菌表面脂多糖诱导的炎症反应以及具体的抗炎作用机制并未见报道。BALB/c小鼠腹腔巨噬细胞系RAW264.7细胞与原代培养的腹腔巨噬细胞相比,细胞株较易获得,细胞的同源性较好,生存时间长,分化程度高,易于观察,具有良好的巨噬细胞特性,是目前比较肯定的用于研究的体外巨噬细胞模型之一。因此在这项研究中,我们以RAW264.7细胞为研究模型,验证了白杨素的抗炎作用,并证实了白杨素可以下调JAK和STAT信号蛋白的磷酸化。本研究着重评估了JAK-STATs信号在巨噬细胞中的抗炎效果以及拓展白杨素在临床上的用药范围。
1 材料和方法 1.1 细胞培养RAW264.7小鼠腹腔巨噬细胞系购买于中科院典型培养物保藏委员会昆明细胞库,使用含10%胎牛血清DEME完全培养基(美国Hyclone)培养RAW264.7细胞,每隔24~36 h传代1次。细胞培养箱(购自美国Thermo)设置条件为:CO2浓度:5%,温度:37 ℃,取对数生长期的细胞用于实验。
1.2 细胞活力值检测将RAW264.7细胞接种于96孔板,1×104/孔,分别使用不同浓度的白杨素(购自中国Derick)(0、5、10、20、40、60、80、100、150、200 μg/mL)孵育RAW264.7细胞24 h,更换细胞培养液,使用PBS清洗1遍,使用完全培养基将CCK-8(购自日本DOJINDO)按1: 10的比例稀释后,每孔加入100 μL的CCK-8完全培养基稀释液,37 ℃孵育2 h,使用酶标仪(购自美国Thermo)检测吸光度A450 nm波长的A(λ)值。
细胞增值率= [A(λ)实验组-A(λ)调零孔] [/A(λ)空白对照组-A(λ)调零孔]
1.3 活性氧簇的检测将2×107 RAW264.7细胞接种于6孔板,分别设置空白对照组、单加药物组、LPS(购自美国Sigma)刺激组和白杨素浓度梯度组,按照1:200的比例使用无血清培养基稀释CM-H2DCFDA荧光探针(购自中国Beyotime),使CM-H2DCFDA的终浓度为50 μL/mL,每组加1 mL CM-H2DCFDA探针稀释培养基,37 ℃孵育细胞1 h后,预孵育白杨素2 h,LPS刺激15 min,弃尽培养液,使用无血清DEME培养基清洗3次,充分洗涤细胞以及除去未进入细胞的游离探针;于488 nm激发波长,525 nm发射波长处使用倒置荧光显微镜(购自日本Olympus)观察细胞内荧光水平,并拍照(400×)。
1.4 N-乙酰-L-半胱氨酸(NAC)抑制ROS产生将2×107 RAW264.7细胞接种于6孔板,分别设置空白对照组、NAC组、LPS刺激组和NAC实验组,孵育RAW264.7细胞24 h,更换细胞培养液,加入NAC后37 ℃孵育细胞2 h后,LPS分别刺激16 h和4 h后Western blotting检测炎症蛋白和JAK-STATs信号通路蛋白表达情况。
1.5 炎症因子的检测将1×107 RAW264.7细胞接种于12孔板,孵育白杨素和LPS后,取细胞培液,12 000 r/min离心15 min取上清样品,4 ℃存放备用;炎症因子均使用ELISA检测试剂盒(R & D Systems)来检测;使用酶标仪在450 nm波长处测定各孔的A值。
1.6 Western blottingRAW264.7细胞提前24 h使用6孔板进行铺板,密度为2×105/孔,分别设置空白对照组组、单加白杨素组、LPS刺激组和白杨素浓度梯度组;继续培育24 h后,每孔加入150 μL蛋白裂解液(购自中国Beyotime)及蛋白酶抑制剂PMSF裂解30 min,加入150 μL 2 × SDS loading buffer,水浴煮沸5 min,使用4%浓缩胶,12%分离胶进行SDS-PAGE蛋白电泳,转膜至NC膜上,5%脱脂牛奶封闭2 h,一抗(购自美国Cell Signaling Technology)4 ℃孵育过夜,荧光二抗(购自美国LICOR Biosciences)孵育1 h,PBS清洗3次,3 min/次,使用Odyssey imaging system(购自美国LI-COR Biosciences)进行成像观察实验结果。
1.7 激光共聚焦显微镜观察STAT-1、STAT-3核转位RAW264.7细胞经白杨素处理后,4%多聚甲醛固定15 min,3% BSA封闭1 h,孵育STAT-1和STAT-3一抗4 ℃过夜,孵育红色荧光蛋白标记二抗1 h,DAPI避光染色2 h,PBS清洗,利用激光共聚焦显微镜(购自德国Leica)观察STAT-1和STAT-3核转位情况。
1.8 数据统计使用GraphPad Prism 5软件进行数据统计,组间比较采用SNK-Q检验,P < 0.05认为差异有统计学意义。
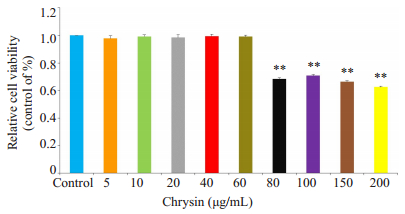
2 结果 2.1 白杨素对RAW264.7细胞的生物毒性作用为了评估白杨素对RAW264.7细胞增殖活力的影响,我们使用不同浓度的白杨素(0、5、10、20、40、60、80、100、150、200 μg/mL)对RAW264.7细胞进行处理,培育24 h后,每孔加入100 μL的CCK-8试剂孵育2 h,酶标仪测A450 nm,图 2实验结果表明白杨素在小于60 μg/mL时对RAW264.7细胞活力没有显著影响,因此我们将10、30、60 μg/mL浓度分别作为RAW264.7细胞的低、中、高剂量组。
|
图 2 白杨素对RAW264.7细胞的生物毒性作用 Figure 2 Effect of chrysin on RAW264.7 cell viability (n=5). **P < 0.01 vs Control group. |
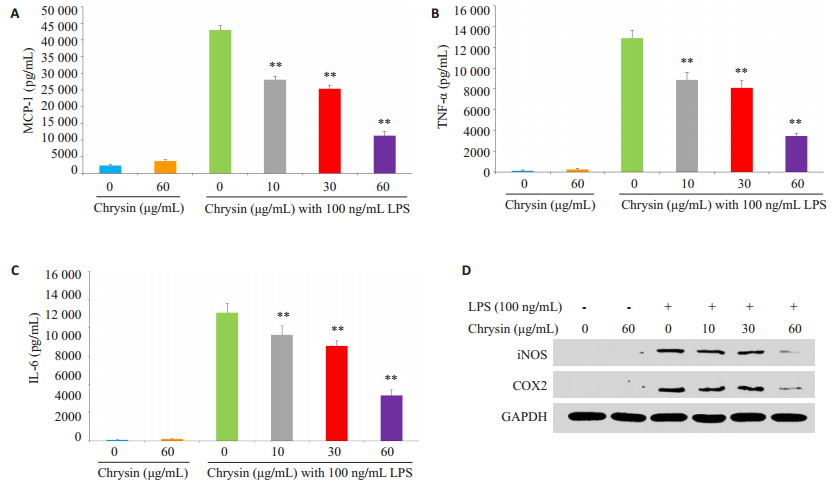
为了验证白杨素是否可以抑制LPS诱导的RAW264.7细胞因子的释放,我们选取促炎因子TNF-α、IL-6和趋化因子MCP-1作为观察指标,观察RAW264.7细胞受到LPS刺激后的炎症反应程度。使用不同浓度的白杨素(10、30、60 μg/mL)预孵育RAW264.7细胞2 h后加入100 ng/mL的LPS进行诱导,并设置空白对照组、单加白杨素组、LPS刺激组和不同浓度白杨素(10、30、60 μg/mL)+LPS组,37 ℃培养18 h后,取培养基用ELISA法分别检测各组TNF-α、IL-6和MCP-1,Western blotting检测炎症蛋白iNOS和COX-2。结果发现白杨素可以显著抑制LPS诱导RAW264.7细胞中TNF-α,IL-6,MCP-1的产生和释放以及iNOS和COX-2蛋白的表达,并呈剂量依赖性(图 3)。
|
图 3 白杨素对LPS诱导RAW264.7细胞炎症因子释放和炎症蛋白表达的影响 Figure 3 Effect of chrysin on release of inflammatory cytokines and expression of inflammatory proteins in RAW264.7 cells induced by LPS. A: MCP-1 secretion in RAW264.7 cells; B: TNF-α secretion in RAW264.7 cells; C: IL-6 secretion in RAW264.7 cells (*P < 0.05, **P < 0.01 vs LPS Group, n=3); D: iNOS and COX-2 expressions in RAW264.7 cells (*P < 0.05, **P < 0.01 vs LPS Group, n=5). |
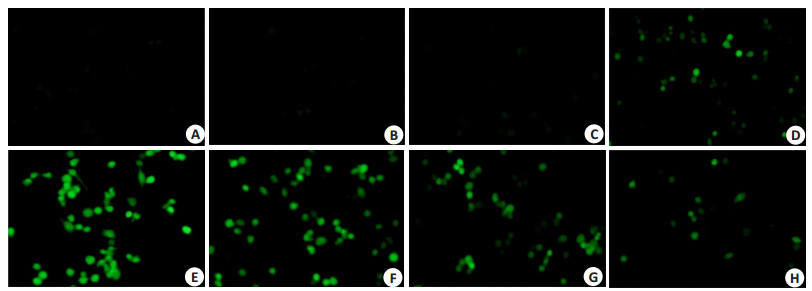
我们研究发现RAW264.7细胞经LPS刺激产生大量的内源性ROS,ROS介导巨噬细胞的吞噬功能及炎症信号的传递。使用不同浓度白杨素(10、30、60 μg/mL)预孵育RAW264.7细胞2 h,加入100 ng/mL的LPS诱导15 min后,使用活性氧探针CM-H2DCFDA检测RAW264.7细胞内ROS水平的变化情况,实验结果见图 4,结果显示,和空白对照组、白杨素组比较,LPS刺激组的RAW264.7细胞胞内绿色荧光显著增强,当孵育白杨素时,ROS水平明显被抑制,这说明白杨素可以有效地清除LPS诱导RAW264.7细胞内源性ROS的蓄积。
|
图 4 白杨素抑制LPS诱导RAW264.7细胞ROS的产生 Figure 4 Chrysin inhibits the LPS-induced ROS production in RAW264.7 cells (Original magnification: × 400, CM-H2DCFDA). A: Control; B: Chrycin (60 μg/mL); C: NAC (20 μmol/L); D: NAC (20 μmol/L)+LPS (100 ng/mL); E: LPS (100 ng/mL); F: LPS (100 ng/mL)+ Chrycin (10 μg/mL); G: LPS (100 ng/mL)+Chrycin (30 μg/mL); H: LPS (100 ng/mL)+Chrycin (60 μg/mL). |
白杨素预处理2 h后,分别用LPS刺激RAW264.7细胞15 min和4 h,检测JAK-STATs通路各信号分子的磷酸化水平,LPS刺激后,JAK-1、JAK-2、STAT-1和STAT-3处于磷酸化活化状态,当使用不同浓度白杨素(10、30、60 μg/mL)处理RAW264.7细胞后,对p-JAK-2表达没有明显影响,但是p-JAK-1、p-STAT-1和p-STAT-3的磷酸化水平被抑制,并且呈剂量依赖性。实验结果见图 5,结果表明白杨素可以有效阻断RAW264.7细胞JAK-STATs信号的活化。
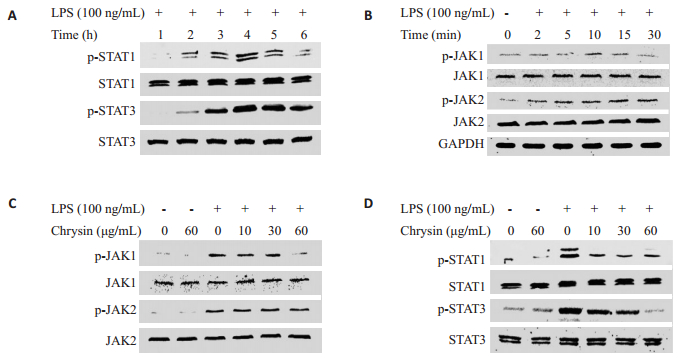
|
图 5 白杨素对LPS诱导RAW264.7细胞JAK-STATs通路蛋白活化和表达的影响 Figure 5 Effect of chrysin on JAK-STATs signaling pathway in RAW264.7 cells induced by LPS. A: Changes of p-STAT-1 and p-STAT-3 expression over time in RAW264.7 cells; B: Changes of p-JAK-1 and p-JAK-2 expression over time; C: Changes of p-JAK-1 and p-JAK-2 expression in RAW264.7 cells; D: Effect of NAC on LPS induced p-STAT-1 and p-STAT-3 expression in RAW264.7 cells. |
白杨素(10、30、60 μg/mL)处理RAW264.7细胞后2 h后用LPS刺激4 h,运用激光共聚焦显微镜观察到LPS刺激组中STAT-1和STAT-3大量进入细胞核,然而当使用60 μg/mL白杨素处理RAW264.7细胞后,STAT-1(图 6)和STAT-3(图 7)的核转位被抑制了,因而我们推断,白杨素通过抑制STAT-1和STAT-3的核转位进而抑制JAK-STATs信号通路的活化发挥抗炎作用。
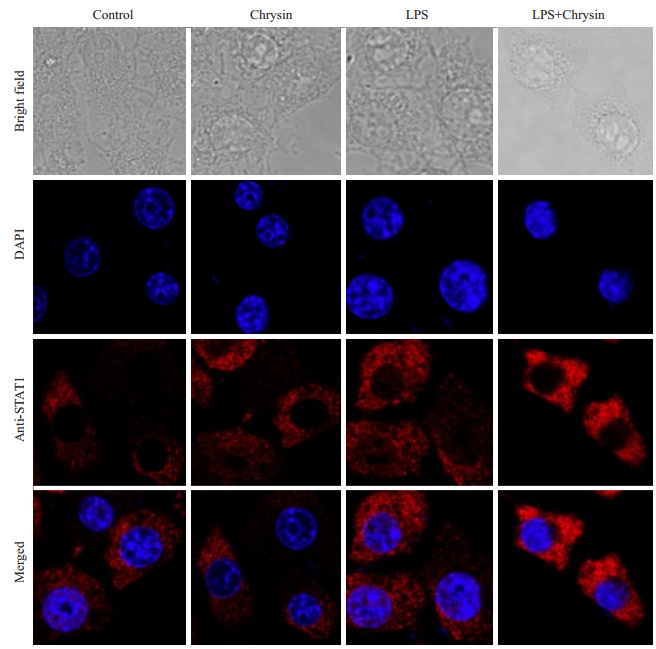
|
图 6 白杨素抑制RAW264.7细胞STAT-1转录因子入核 Figure 6 Chrysin inhibits nuclear translocation of transcription factors STAT-1 (DAPI, ×1500). |
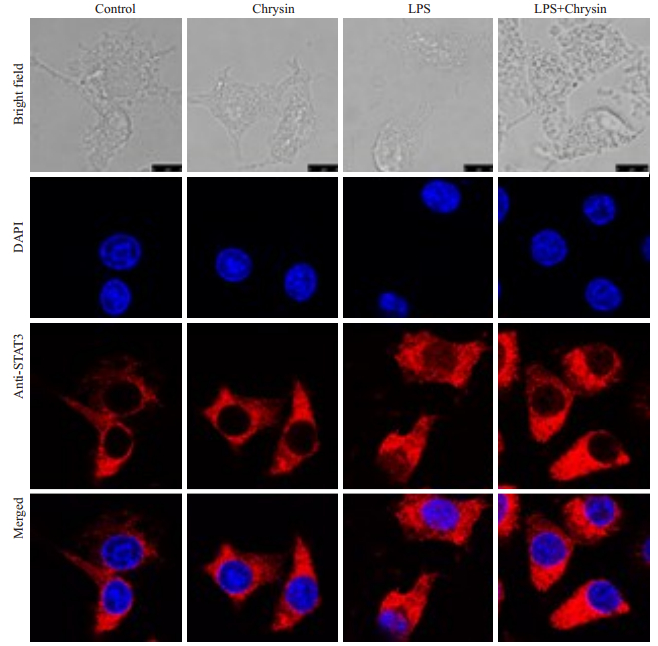
|
图 7 白杨素抑制RAW264.7细胞STAT-3转录因子入核 Figure 7 Chrysin inhibits nuclear translocation of transcription factors STAT-3 (DAPI, ×1500). |
NAC对细胞内的ROS能有效清除,可以减少LPS诱导RAW264.7细胞ROS的累积。我们证实了白杨素可以抑制LPS诱导炎症蛋白的表达以及对JAK-STATs信号转导通路的影响。使用20 μmol/L浓度的N-乙酰-L-半胱氨酸(NAC)预孵育RAW264.7细胞2 h后,加入100 ng/mL的LPS诱导18 h后,检测iNOS和COX-2蛋白的表达情况,使用LPS诱导4 h后收集细胞裂解液,运用Western blotting技术检测JAK1、JAK2、STAT1、STAT3的活化情况,实验结果图 8显示NAC能够成功抑制LPS诱导RAW264.7细胞的iNOS和COX-2蛋白的表达,同时能抑制p-JAK1、p-JAK2、p-STAT1和pSTAT3的活化。这提示我们,白杨素抑制LPS诱导RAW264.7细胞炎症蛋白的表达,是通过有效清除细胞内上游信号分子ROS进而调控JAK-STATs信号转导通路蛋白的活性而发挥作用的。
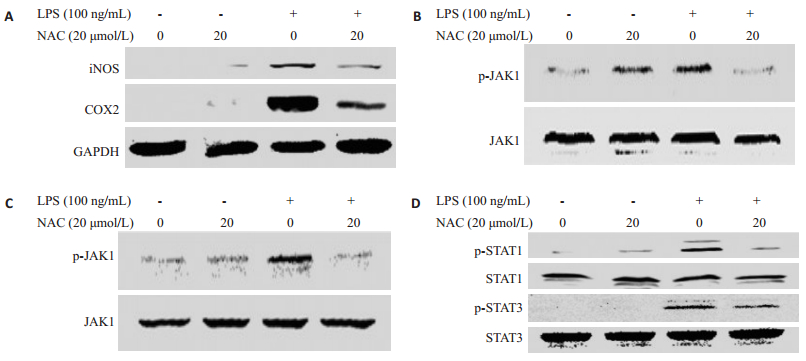
|
图 8 NAC对LPS诱导RAW264.7细胞炎症蛋白和JAK-STATs通路蛋白表达的影响 Figure 8 Effect of NAC on inflammatory protein and JAK-STATs signaling pathway in RAW264.7 cells induced by LPS. A: Effect of NAC on LPS induced iNOS and COX-2 expression in RAW264.7 cells; B: Effect of NAC on LPS induced p-JAK1 expression in RAW264.7 cells; C: Effect of NAC on LPS induced p-JAK2 expression in RAW264.7 cells; D: Effect of NAC on LPS induced p-STAT1 and p-STAT3 expression in RAW264.7 cells. |
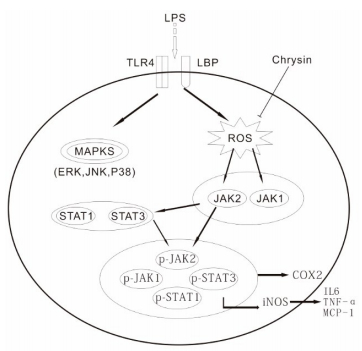
|
图 9 白杨素对LPS诱导的RAW264.7细胞发挥抗炎作用分子机制 Figure 9 Mechanism of anti-inflammatory effects of chrysin on LPS-induced inflammation in RAW264.7 cells. |
炎症反应[17-18]是机体防御系统应对外源性抗原刺激或组织损伤的一种应激性反应。巨噬细胞在宿主防御(包括炎症)的起始和调节中起着重要的作用,并且可以被多种炎症刺激如LPS和TNF-α激活以引发炎症过程的级联[19]。炎症反应在组织创伤、感染、类风湿性关节炎、中风、糖尿病和老年性痴呆等相关疾病中发挥着关键作用,且和自身免疫性应激损伤及肿瘤的发生高度相关[20-21]。炎症反应一旦出现紊乱或过激反应,会导致多种急慢性炎症反应疾病的发生,严重时可危及病人的生命,因而开发有效的预后或诊断的生物标记物和开发靶向治疗药物都是至关重要的。
白杨素药理作用广泛,具有抗氧化、抗炎、抗肿瘤、神经保护等作用。目前有关白杨素抗炎作用的研究主要集中在其衍生物的药理作用及构效关系和抗肿瘤效果。Cho等[22]证实白杨素及其衍生物能够降低RAW264.7细胞中LPS诱导的iNOS和COX-2的生成。然而,白杨素在LPS诱导的RAW264.7细胞中发挥抗炎作用的具体分子机制尚未见报道,因此,我们使用LPS诱导RAW264.7巨噬细胞炎症模型来探索白杨素对LPS诱导的炎症相关基因表达的抑制作用,并揭示其发挥抗炎作用的确切信号通路。在本研究中,CCK-8实验结果显示白杨素处理后的RAW264.7细胞,白杨素在低于60 μg/mL时对RAW264.7细胞无明显细胞毒性;白杨素对LPS诱导的RAW264.7细胞中p-JAK-1、pSTAT-1、p-STAT-3表达受到明显抑制,实验结果表明白杨素能有效抑制巨噬细胞的炎症反应。我们的研究结果表明白杨素发挥抗炎作用很可能是由于通过使JAKSTATs通路失活引起的。
研究表明促炎细胞因子如MCP-1、IL-6和TNF-α在许多疾病的发病机制中起重要作用[23]。一些研究还表明促炎细胞因子的表达与体内外的炎症和巨噬细胞活化严重程度相关[24]。因此,在未来的研究中抑制这些促炎细胞因子的表达成为缓解甚至治愈某些疾病的希望。有研究表明天然植物中抗氧化剂能显著降低LPS诱导的促炎基因表达,包括IL-6、I L-1β、MCP-1、iNOS和COX-2,抑制了MAPK信号通路的磷酸化,并降低巨噬细胞中活性氧的水平[25]。在本研究中,MCP-1,IL-6和TNF-α的释放量指示LPS刺激的RAW264.7细胞中炎症的严重程度。如图 3所示,通过ELISA测定法测定白杨素对MCP-1、TNF-α和IL-6分泌的影响。白杨素预处理能有效地以剂量依赖的方式抑制这些细胞因子的释放。实验结果表明白杨素在基因转录和翻译水平上均表现出对这些促炎细胞因子产生的抑制作用。
在巨噬细胞中,ROS还可以作为第二信使调节多条信号激酶级联并激活相关转录因子,包括MAPKs和JAK-STAT [26-27]来调节促炎细胞因子的释放和炎症介质的产生。我们实验证实了LPS诱导RAW264.7细胞产生的ROS同JAK-STATs依赖性的炎症因子和炎症介质的表达和释放之间的关系。NAC是一种还原性的活性氧清除剂[28],可以清除各种细胞刺激时引发产生的内源性活性氧。当使用NAC孵育RAW264.7细胞后,LPS刺激引起的炎症蛋白iNOS、COX-2的表达和释放被抑制,且炎症因子和趋化因子IL-6、TNF-α及MCP-1也同样被抑制,这说明ROS是炎症因子表达调控的上游信号分子。图 4表明白杨素能够有效清除LPS诱导的细胞内ROS的蓄积,因此ROS是白杨素抑制LPS诱导RAW264.7细胞炎症反应的作用靶点。这说明白杨素发挥抗炎作用是通过抑制ROS来实现的。
JAK-STATs信号通路是由酪氨酸激酶JAK和转录因子STAT级联组成,该信号在增殖、生长、凋亡、免疫等重要的生理过程[16]中发挥调控作用。我们研究发现,白杨素可以有效地抑制LPS诱导RAW264.7细胞JAK-STATs信号的活化并抑制转录因子STAT-1、STAT-3转位进入核内。并且用NAC清除细胞内ROS后,LPS激活的JAK-STATs通路受到明显抑制。因此白杨素是通过清除LPS刺激生成的细胞内ROS,进而调控其下游JAK-STATs信号通路的活化来发挥抗炎作用。
综上所述,本研究结果表明白杨素可以有效地抑制LPS诱导RAW264.7细胞中炎性因子和炎症相关蛋白的表达和生成来发挥抗炎作用,并且白杨素发挥抗炎作用是通过清除细胞内源性ROS的生成,进而调控JAKSTATs信号而发挥抗炎作用。本研究证实了开发特异性靶向抑制剂对抗炎治疗的可行性,并验证了白杨素具有发挥抗炎作用效果的潜在可能。这些实验结果加深我们对白杨素抗炎作用的认识和理解,为其作为临床治疗药物的开发提供了理论基础。
| [1] |
Nathan C. Points of control in inflammation[J].
Nature, 2002, 420(6917): 846-52.
DOI: 10.1038/nature01320. |
| [2] |
Nabavi SF, Braidy N, Orhan IE, et al. Rhodiola rosea L. and alzheimer's disease: from farm to pharmacy[J].
Phytother Res, 2016, 30(4): 532-9.
DOI: 10.1002/ptr.v30.4. |
| [3] |
Hsu CC, Lien JC, Chang CW, et al. Yuwen02f1 suppresses LPSinduced endotoxemia and adjuvant-induced arthritis primarily through blockade of ROS formation, NFkB and MAPK activation[J].
Biochem Pharmacol, 2013, 85(3): 385-95.
DOI: 10.1016/j.bcp.2012.11.002. |
| [4] |
Zingarelli B, Sheehan M, Wong HR. Nuclear factor-kappaB as a therapeutic target in critical care medicine[J].
Crit Care Med, 2003, 31(1 Suppl): S105-11.
|
| [5] |
Rim HK, Cho W, Sung SH, et al. Nodakenin suppresses lipopolysaccharide-induced inflammatory responses in macrophage cells by inhibiting tumor necrosis factor receptor-associated factor 6 and nuclear factor-κB pathways and protects mice from lethal endotoxin shock[J].
J Pharmacol Exp Ther, 2012, 342(3): 654-64.
DOI: 10.1124/jpet.112.194613. |
| [6] |
Mitochondria LG, Species RO. Which role in physiology and pathology[J].
Adv Exp Med Biol, 2012, 942(3): 93-136.
|
| [7] |
Nathan C, Cunningham- Bussel A. Beyond oxidative stress: an immunologist's guide to reactive oxygen species[J].
Nat Rev Immunol, 2013, 13(5): 349-61.
DOI: 10.1038/nri3423. |
| [8] |
Dewaele M, Maes H, Agostinis P. ROS-mediated mechanisms of autophagy stimulation and their relevance in cancer therapy[J].
Autophagy, 2010, 6(7): 838-54.
DOI: 10.4161/auto.6.7.12113. |
| [9] |
Qi S, Feng Z, Li Q, et al. Myricitrin modulates NADPH oxidasedependent ROS production to inhibit endotoxin-mediated inflammation by blocking the JAK/STAT1 and NOX2/p47phox Pathways[J].
Oxid Med Cell Longev, 2017: 9738745.
|
| [10] |
Johnson VJ, He Q, Osuchowski MF, et al. Physiological responses of a natural antioxidant flavonoid mixture, silymarin, in BALB/c mice: Ⅲ. Silymarin inhibits T-lymphocyte function at low doses but stimulates inflammatory processes at high doses[J].
Planta Med, 2003, 69(1): 44-9.
DOI: 10.1055/s-2003-37023. |
| [11] |
Chen YH, Yang ZS, Wen CC, et al. Evaluation of the structureactivity relationship of flavonoids as antioxidants and toxicants of zebrafish larvae[J].
Food Chem, 2012, 134(2): 717-24.
DOI: 10.1016/j.foodchem.2012.02.166. |
| [12] |
Calderwood DA, Ginsberg MH. Talin forges the links between integrins and actin[J].
Nat Cell Biol, 2003, 5(8): 694-7.
DOI: 10.1038/ncb0803-694. |
| [13] |
Gresa-Arribas N, Serratosa J, Saura J, et al. Inhibition of CCAAT/ enhancer binding protein δ expression by chrysin in microglial cells results in anti-inflammatory and neuroprotective effects[J].
J Neurochem, 2010, 115(2): 526-36.
DOI: 10.1111/jnc.2010.115.issue-2. |
| [14] |
杨晓露, 刘朵, 卞卡, 等. 甘草总黄酮及其成分体外抗炎活性及机制研究[J].
中国中药杂志, 2013, 38(1): 99-104.
|
| [15] |
Khanna P, Chua PJ, Bay BH, et al. The JAK/STAT signaling cascade in gastric carcinoma (Review) J][J].
Int J Oncol, 2015, 47(5): 1617-26.
DOI: 10.3892/ijo.2015.3160. |
| [16] |
Arumuggam N, Bhowmick NA, Rupasinghe HP. A review: phytochemicals targeting JAK/STAT signaling and IDO expression in cancer[J].
Phytother Res, 2015, 29(6): 805-17.
DOI: 10.1002/ptr.v29.6. |
| [17] |
Tracey KJ. The inflammatory reflex[J].
Nature, 2002, 420(6917): 853-9.
DOI: 10.1038/nature01321. |
| [18] |
Andersson J. The inflammatory reflex -Introduction[J].
J Intern Med, 2005, 257(2): 122-5.
DOI: 10.1111/jim.2005.257.issue-2. |
| [19] |
Laveti D, Kumar M, Hemalatha R, et al. Anti-inflammatory treatments for chronic diseases: a review[J].
Inflamm Allergy Drug Targets, 2013, 12(5): 349-61.
DOI: 10.2174/18715281113129990053. |
| [20] |
Daniel D, Meyer-Morse N, Bergsland EK, et al. Immune enhancement of skin carcinogenesis by CD4 + T cells[J].
J Exp Med, 2003, 197(8): 1017-28.
DOI: 10.1084/jem.20021047. |
| [21] |
Prehn RT, Prehn LM. Cancer immunotherapy by immunosuppression[J].
Theor Biol Med Model, 2010, 7(1): 45.
DOI: 10.1186/1742-4682-7-45. |
| [22] |
Cho H, Yun CW, Park WK, et al. Modulation of the activity of proinflammatory enzymes, COX-2 and iNOS, by chrysin derivatives[J].
Pharmacol Res, 2004, 49(1): 37-43.
DOI: 10.1016/S1043-6618(03)00248-2. |
| [23] |
Turner MD, Nedjai B, Hurst T, et al. Cytokines and chemokines: At the crossroads of cell signalling and inflammatory disease[J].
Biochim Biophys Acta, 2014, 1843(11): 2563-82.
DOI: 10.1016/j.bbamcr.2014.05.014. |
| [24] |
Cavaillon JM. Cytokines and macrophages[J].
Biomed Pharmacother, 1994, 48(10): 445-53.
DOI: 10.1016/0753-3322(94)90005-1. |
| [25] |
徐传翀. 小檗碱通过SIRT1途径抑制巨噬细胞炎症反应的机制研究[D]. 南京: 南京中医药大学, 2016.
http://cdmd.cnki.com.cn/Article/CDMD-10315-1016291450.htm
|
| [26] |
Zhang LL, Mu GG, Ding QS, et al. PTEN represses colon Cancer progression through inhibiting paxillin transcription via PI3K/AKT/ NF-kB pathway[J].
J Biol Chem, 2015, 290(24): 15018-29.
DOI: 10.1074/jbc.M115.641407. |
| [27] |
Pawate S, Shen Q, Fan F, et al. Redox regulation of glial inflammatory response to lipopolysaccharide and interferongamma[J].
J Neurosci Res, 2004, 77(4): 540-51.
DOI: 10.1002/(ISSN)1097-4547. |
| [28] |
吴宾, 樊苗苗, 郭涛, 等. 糖尿病小鼠主动脉平滑肌ROS/NF-κB信号通路对MuRF1介导的BK-β1降解的调控作用[J].
心脏杂志, 2017, 29(3): 253-8.
|
 2018, Vol. 38
2018, Vol. 38

