皮肤创伤修复的各个阶段均有大量生长因子参与[1]。动物实验和临床研究证明,多种生长因子可以促进创伤愈合[2-4]。肝细胞生长因子(HGF)是一种多功能生长因子,已有研究表明HGF可以促进创伤愈合[5-7]。然而,HGF在体外稳定性较差,在应用时极易被体内的酶降解,难以在局部发挥持久有效的作用[8]。另一方面,HGF在体内快速扩散会导致一系列的全身毒副作用[9]。因此,构建安全有效的HGF药物缓释体系对于其应用至关重要[10-11]。聚乳酸-羟基乙酸共聚物(PLGA)在医药领域中得到广泛应用[12-13]。PLGA纳米粒可对生长因子实现较高的包封效率,提高其稳定性和生物利用度[14];且缓释药物与PLGA代谢产物乳酸共同促进创伤修复[15]。然而,目前关于HGF的药物缓释体系还鲜有报道。
本研究采用PLGA为包裹材料,利用正交试验设计方案,优化PLGA纳米粒的制备条件,采用优化条件制备HGF纳米粒,对其进行质量评价和生物学活性的评价。
1 材料和方法 1.1 主要试剂及仪器PLGA,50: 50,相对分子质量24 000~38 000;聚乙烯醇,相对分子质量13 000~23 000(Sigma);甘露醇、蔗糖(广州市化学试剂厂);超高速离心机(贝克曼);冷冻干燥机(CHRIST);马尔文纳米粒度仪,英国;透射电镜,日本;BCA试剂盒(碧云天);HGF(R & D);HGF ELISA试剂盒(冬歌生物);酶标仪,Epoch(Bio Tek)。
1.2 PLGA纳米粒的制备纳米粒的制备参照文献[16]报道,并稍作改进。将适量的BSA溶于灭菌水中(含有10%甘露醇和5%蔗糖,5% PEG400)作为水相,一定量的PLGA溶解于二氯甲烷和丙酮中(3 : 1)作为油相;水相加到油相中,超声1 min形成初乳;把PVA溶液加到初乳中,超声1 min形成复乳,复乳分散到水中,温和磁力搅拌4 h,挥发有机溶剂,14 000 r/min离心,20 min,收集上清和沉淀。收集上清检测包封率,沉淀用灭菌水清洗2遍后,冷冻干燥24 h,储存于-20 ℃冰箱备用。制备HGF纳米粒需在水相中加入适量的HGF。
1.3 正交试验设计优化PLGA纳米粒的制备条件根据正交试验设计的流程,采用L(9 34)正交表,考察PVA浓度、PLGA用量、超声功率3个因素,其中第四列为空列,每种因素安排3水平,共进行9种方案的实验。具体设计见表 1。
| 表 1 正交试验的因素和水平 Table 1 Factors and levels of orthogonal tests |
取一定量的纳米粒分散在灭菌水中,稀释至目视浑浊浓度,置于马尔文纳米粒度分析仪中检测。
1.4.2 表面形态和内部结构的观察取一滴样品滴于碳涂层铜网上,用滤纸从液珠边缘吸去多余的液体,滴上3%磷钨酸水溶液负染2 min,滤纸吸去染液,室温干燥后在透射电镜下进行观察。
1.5 PLGA纳米粒中药物包封率、载药率和回收率的测定 1.5.1 包封率测定收集离心过程中的上清液,BSA纳米粒的浓度使用BCA试剂盒检测,HGF纳米粒的浓度使用HGF ELISA试剂盒检测。
包封率=系统中包封的蛋白药物量/系统中包封与未包封的蛋白药物总量×100%
1.5.2 载药量测定称取一定量的纳米粒,加入0.5 mL二氯甲烷溶解,加入0.5 mL灭菌水萃取纳米粒中的蛋白质,离心,取上层,共萃取3次,收集3次的萃取液。BSA-纳米粒的浓度使用BCA试剂盒检测,HGF纳米粒的浓度使用HGF ELISA试剂盒检测。
载药量=纳米粒中所含有的蛋白药物量/纳米粒的总量×100%
1.5.3 回收率的测定收集干燥后的所有纳米粒,在分析天平上称质量后除以所有投料量的总和。
1.5.4 BCA试剂盒检测步骤首先配制预设浓度的蛋白标准品溶液,按比例配置BCA工作液,充分混匀,在96孔板相应的孔中分别加入梯度体积的标准品溶液和样品(n=3),然后加入工作液,置于37 ℃孵育箱中孵育30 min后,置于酶标仪中,在波长562 nm处检测吸光度值,作出标准曲线和计算出相应的浓度。
1.5.5 HGF ELISA试剂盒检测步骤在酶标板相应的孔中加入标准品和样品,设置空白孔,封膜后置于37 ℃中孵育30 min,洗液洗板5次,每次洗后拍干,加酶标试剂,空白孔除外,封膜,置于37 ℃中孵育30 min,洗液洗板5次,拍干,加入A液和B液显色,封膜,置于37 ℃中孵育15 min,加入终止液,置于酶标仪中在波长450 nm处检测吸光度(A)值,作出标准曲线,算出样品浓度。
1.6 PLGA纳米粒体外释放度的测定称取一定量的纳米粒,置透析膜内,加入5 mL PBS(pH值=7.4),在37 ℃下,转速72 r/min条件下进行释放,于时间点6、12、24、48、72、120、168 h后取样500 μL并补回等量新鲜的PBS,储存于4 ℃冰箱备测。BSA纳米粒采用BCA试剂盒检测;HGF纳米粒采用ELISA试剂盒检测。计算出累积释放量,作出释放曲线图。
1.7 HaCaT细胞的培养人永生角质形成细胞(HaCaT)购买于上海中科院,无菌条件下复苏,接种于10 cm2培养皿,置于37 ℃,5% CO2条件下培养,至80%~95%融合后,胰酶消化,传代备用。
1.8 细胞增殖实验实验分4组,对照组、BSA纳米粒组、HGF溶液组、HGF纳米粒组。细胞悬液按3.0×103/孔的密度接种于96孔板中,用含10% FBS的高糖培养基培养,置于37 ℃,5% CO2培养箱中。过夜后,更换0.1% FBS培养基,饥饿12 h后按照实验方案在相应孔中加入相应的刺激。然后用维持培养基培养。在时间点12、24、48、72 h加入10 μL CCK8试剂,培养箱中孵育3 h后在波长450 nm处检测吸光度,检测细胞增殖情况。
1.9 统计方法数据采用均数±标准差表示,通过SPSS20.0统计软件完成统计分析,正交试验数据采用方差分析,细胞增殖实验采用单因素方差分析(One-way ANOVA)进行组间比较,若差异具有统计学意义,则采用LSD-t或SNK-q检验进行两两比较,P < 0.05时差异具有统计学意义。
2 结果 2.1 正交试验因素对平均粒径、包封率、载药率和回收率的结果根据正交试验设计的流程,采用L9(34)正交表,考察PVA浓度、PLGA用量和超声功率对平均粒径、包封率、载药率和回收率的影响,进行9种方案的试验。试验结果如表 2所示。
| 表 2 试验因素对平均粒径、包封率、载药率和回收率的结果 Table 2 Test results on average particle size, encapsulation efficiency, drug loading rate and recovery rate |
对正交试验的结果进行了方差分析,如表 3所示。PVA浓度对BSA纳米粒平均粒径具有统计学意义(P < 0.05),而PLGA用量(P=0.061)和超声功率(P=0.251)对平均粒径没有统计学意义,说明PVA浓度是影响BSA纳米粒平均粒径的关键因素。如表 4和表 5所示,PLGA用量对BSA纳米粒包封率和载药量均有统计学意义(P < 0.05),说明PLGA用量是影响包封率和载药量的关键因素。根据表 6可知,PLGA用量、PVA浓度、超声功率对回收率具有统计学意义(P < 0.05),说明三者都是影响纳米粒回收率的关键因素。
| 表 3 平均粒径的方差分析结果 Table 3 Variance analysis of the average particle size |
| 表 4 包封率的方差分析结果 Table 4 Variance analysis of encapsulation efficiency of the nanoparticles |
| 表 5 载药量的方差分析结果 Table 5 Variance analysis of drug loading rate of the nanoparticles |
| 表 6 回收率的方差分析结果 Table 6 Variance analysis ofrecovery |
根据正交试验原理,极差越大,表明该因素的水平变化对试验指标的影响越大。我们以平均粒径较小,包封率,载药量和产率较高为考察指标,根据表 7分析结果选取出纳米粒的最优制备条件为:PVA浓度为1%,PLGA用量为25 mg,超声功率为70 W。利用最优制备条件制备BSA纳米粒三批,检测得出包封率为(73.12± 6.38)%,载药量为(4.45±0.63)%,回收率为(46.92±4.0)%。
| 表 7 纳米粒的平均粒径、包封率、载药率和回收率结果的极差分析 Table 7 Range analysis of the average size, encapsulation efficiency, drug loading rate and recovery rate of the nanoparticles |
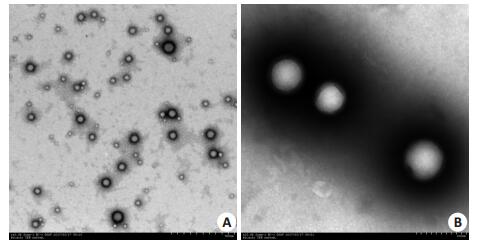
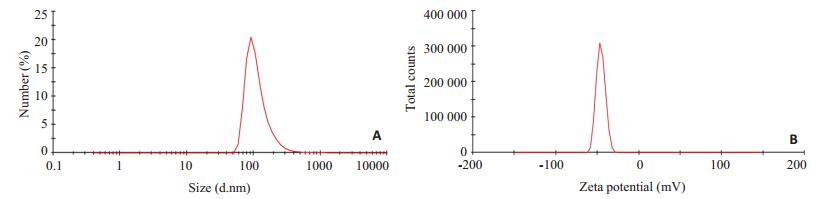
利用上述最优制备条件制备HGF纳米粒三批。透射电镜结果显示HGF纳米粒规整球形,表面光滑,呈膜壳药库型纳米粒包裹着药物(图 1);纳米粒度仪检测得出HGF纳米粒的粒径为234.4±4.8 nm,Zeta电位为-46.72±1.7 Mv,多分散指数为0.236±0.012。HGF纳米粒的粒径分布和Zeta电位见图 2。检测得出HGF纳米粒的包封率为(77.75 ± 3.04)%,载药量为(0.002293 ± 0.000427)%,回收率为(49.33±9.34)%。
|
图 1 HGF纳米粒的透射电镜图 Figure 1 Transmission electron microscope images of HGF-loaded nanoparticles (A: ×10 000, B: ×20 000) |
|
图 2 HGF纳米粒的粒径分布图(A)和Zeta电位图(B) Figure 2 Size distribution of HGF nanoparticles (A) and Zeta potential of HGF nanoparticle (B) |
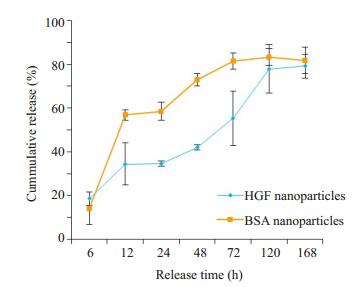
对BSA纳米粒和HGF纳米粒进行体外释放试验,结果如图 3所示,两种载药纳米粒的释放表现为:最初的突释阶段,而后的缓慢释放阶段和最后的趋于平缓阶段。在6 h时,BSA纳米粒和HGF纳米粒的累积释放百分率分别为(14.22±7.3)%、(18.56±3.02)%,体现为最初的突释;而在12~120 h为缓慢释放阶段。在24 h时,两者的累积释放百分率分别为(58.53±4.08)%、(34.65± 1.29)%;最后在168 h时,分别达到了(81.72±5.99)%和(79.12±5.36)%。
|
图 3 载药纳米粒的体外累积释放度曲线 Figure 3 Cumulative release curves of drug loaded nanoparticles in vitro |
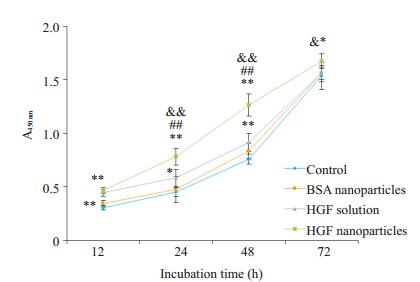
采用CCK-8法测定细胞的增殖来验证HGF纳米粒的生物相容性和生物学活性,结果见图 4,在12 h时,HGF纳米粒组和HGF溶液组促细胞增殖速度均快于对照组(P < 0.01),但两者之间差异无统计学意义(P>0.05);但到24 h和48 h时,HGF纳米粒组对细胞的促增殖作用均强于另外3组(P < 0.01)。
|
图 4 CCK-8检测HGF纳米粒对HaCaT细胞增殖的影响 Figure 4 The effect of HGF nanoparticles on the proliferation of HaCaT cells was detected by Cell Counting Kit-8 (n=6) (**P < 0.01/*P < 0.5 vs Control, ##P < 0.01 vs HGF Solution, & & P < 0.01/ & P < 0.5 vs BSA nanoparticles) |
HGF可以促进伤口的再上皮化、诱导血管的形成和减少瘢痕的形成[17-19],然而其半衰期短,稳定性差,难以被高效利用。本研究以聚乳酸-羟基乙酸共聚物PLGA为HGF的载体,其优点在于可通过商业途径购买GMP级别的PLGA,理化性能稳定,纯度高,在生物体内的降解稳定并可实现药物的控释[20]。根据文献报道显示,PLGA在体内水解形成的乳酸和乙醇酸单体可经三羧酸循环被代谢掉,生物安全性极高[15]。
目前制备PLGA纳米粒的主要方法有乳化-扩散法,盐析法,纳米沉淀法(溶剂挥发法),乳化溶剂挥发法(O/W)和复乳法溶剂挥发法(W/O/W)等[21]。本实验采用复乳法溶剂挥发法(W/O/W),相较于其它方法制备过程简单,所使用的有机溶剂毒性较小,可用于包裹水溶性蛋白质药物[22]。
为了探索构建PLGA纳米粒的优化条件,本研究采用正交试验设计,考察了表面活性剂聚乙烯醇(PVA)浓度,PLGA用量和超声功率对纳米粒的粒径分布、包封率、载药量和回收率的影响情况。方差分析结果显示:(1)PLGA用量是影响包封率、载药量和回收率的关键因素。其原因可能是PLGA的用量越大,油相的浓度越高,黏度也就越大,这可以减少小液滴中药物的扩散,因此所包裹的药物越多[23]。(2)PVA浓度是影响平均粒径的关键因素。PVA能够保持制备过程中乳液的稳定性,从而保持纳米粒的形态和粒径大小的稳定。一般来说,PVA浓度越低,油水界面的总表面积较低,纳米粒比表面积下降,粒径越大,相反,粒径越小[24]。(3)PVA浓度和超声功率两者是影响纳米粒回收率的重要因素。在纳米粒的制备过程中,表面活性剂和机械搅拌力如超声是纳米乳液形成和稳定存在所必不可少的。PVA浓度不足,可能会使纳米乳滴合并或者破相而析出,因而材料析出导致回收率降低。当超声功率太小时,波长的振幅太小,不能把纳米乳液完全分散开,导致纳米乳滴合并析出,因而回收率降低[25]。通过极差分析得到纳米粒的最优条件为PVA浓度为1%,PLGA用量为25 mg,超声功率为70 W。
进一步,本研究利用上述优化条件制备HGF纳米粒,并检测其缓释能力。体外释放度曲线显示,HGF的释放分为突释阶段,缓慢释放阶段和最后的趋于平缓阶段。在6 h时,HGF纳米粒和BSA纳米粒的累积释放百分率分别为(14.22±7.3)%、(18.56±3.02)%。根据《中国药典》 2010版2部附录的要求,开始0.5 h时累积释放百分率小于40%,突释合格。突释出现的原因可能是吸附在纳米粒表面的蛋白药物立即扩散溶解到释放介质中。而后12~120 h为药物的缓慢释放阶段,一方面是因为PLGA在释放介质中水化溶胀后形成水化膜而延缓药物的释放,另一方面随着PLGA材料的降解,药物逐渐扩散进释放介质中[26]。在120 h时,纳米粒中的药物逐渐释放完全,HGF纳米粒的累积释放百分率达到(83.38±3.91)%,这满足了创伤愈合前期伤口需要快速补充外源性生长因子的需求。
最后,本研究利用细胞增殖实验检测构建的HGF纳米粒的生物相容性和生物学活性。实验结果显示,HGF纳米粒组可以维持HaCaT细胞的正常生长,并且可以明显促进角质形成细胞增殖,说明HGF纳米粒具有较好的生物安全性和生物学活性。在最初的12 h,由于HGF纳米粒中HGF释放量尚少,因此促进细胞增殖能力较弱。而在24 h和48 h,HGF纳米粒组促进HaCaT细胞增殖的能力强于其它3组,这可能是因为包裹的HGF被缓释出来,HGF浓度逐渐增大;而HGF溶液组中的HGF在前12 h被消耗掉,因而促进细胞增殖能力降低。而在72 h时,由于细胞已经长满,所以四组差异不大。
综上所述,本研究利用PLGA纳米粒包裹HGF,制得的HGF纳米粒理化性质较好,可以实现HGF的缓释,具有良好的生物相容性和生物学活性。然而,因为时间关系,本研究目前仅在细胞水平上了完成了HGF纳米粒的生物学活性的验证,随着实验的进展,我们会进一步在小鼠皮肤创伤模型上验证HGF纳米粒的生物安全性和其对创伤修复的影响。
| [1] | Eming SA, Martin P, Tomic-Canic M. Wound repair and regeneration: mechanisms, signaling, and translation[J]. Sci Transl Med, 2014, 6(265): 265sr6. DOI: 10.1126/scitranslmed.3009337. |
| [2] | Maddaluno L, Urwyler C, Werner S. Fibroblast growth factors:key players in regeneration and tissue repair[J]. Development, 2017, 144(22): 4047-60. DOI: 10.1242/dev.152587. |
| [3] | Zhang L, Xu P, Wang X, et al. Activin B regulates adipose-derived mesenchymal stem cells to promote skin wound healing via activation of the MAPK signaling pathway[J]. Int J Biochem Cell Biol, 2017, 87: 69-76. DOI: 10.1016/j.biocel.2017.04.004. |
| [4] | Werner S, Grose R. Regulation of wound healing by growth factors and cytokines[J]. Physiol Rev, 2003, 83(3): 835-70. DOI: 10.1152/physrev.2003.83.3.835. |
| [5] | Miyagi H, Thomasy SM, Russell P, et al. The role of hepatocyte growth factor in corneal wound healing[J]. Exp Eye Res, 2018, 166: 49-55. DOI: 10.1016/j.exer.2017.10.006. |
| [6] | Bevan D, Gherardi E, Fan TP, et al. Diverse and potent activities of HGF/SF in skin wound repair[J]. J Pathol, 2004, 203(3): 831-8. DOI: 10.1002/(ISSN)1096-9896. |
| [7] | Miura Y, Van Ngo Thai Bich, Furuya M, et al. The small G protein Arf6 expressed in keratinocytes by HGF stimulation is a regulator for skin wound healing[J]. Sci Rep, 2017, 7: 46649. DOI: 10.1038/srep46649. |
| [8] | Laiva AL, O'Brien FJ, Keogh MB. Innovations in Gene and Growth Factor delivery systems for Diabetic Wound Healing[J]. J Tissue Eng Regen Med, 2017. |
| [9] | Tayalia P, Mooney DJ. Controlled growth factor delivery for tissue engineering[J]. Advanced Materials, 2009, 21(32/33, SI): 3269-85. |
| [10] | Park JW, Hwang SR, Yoon IS. Advanced growth factor delivery systems in wound management and skin regeneration[J]. Molecules, 2017, 22(8): 1259-79. DOI: 10.3390/molecules22081259. |
| [11] | Tabata Ⅱ. The importance of drug delivery systems in tissue engineering[J]. Pharm Sci Technolo Today, 2000, 3(3): 80-9. DOI: 10.1016/S1461-5347(00)00242-X. |
| [12] | 唐宇星, 赵庆, 杨中萌, 等. 聚乳酸共聚物复合脂肪干细胞对骨质疏松性骨折愈后生物力学的影响[J]. 中国组织工程研究, 2017, 21(10): 1577-82. DOI: 10.3969/j.issn.2095-4344.2017.10.017. |
| [13] | 孙雅楠, 张秀梅, 马欣, 等. 红细胞膜包裹PLGA纳米粒的制备和体外毒性及药物释放初探[J]. 中国新药杂志, 2017, 26(19): 2352-7. |
| [14] | 李素铠, 欧阳斌, 徐晓秋, 等. PLGA纳米药物递送系统的建立及其对bFGF生物学活性的维持[J]. 第三军医大学学报, 2016, 28(11): 1319-24. |
| [15] | Porporato PE, Payen VL, De Saedeleer CJ, et al. Lactate stimulates angiogenesis and accelerates the healing of superficial and ischemic wounds in mice[J]. Angiogenesis, 2012, 15(4): 581-92. DOI: 10.1007/s10456-012-9282-0. |
| [16] | Donaghue IE, Shoichet MS. Controlled release of bioactive PDGFAA from a hydrogel/nanoparticle composite[J]. Acta Biomater, 2015, 25: 35-42. DOI: 10.1016/j.actbio.2015.08.002. |
| [17] | Toyoda M, Takayama H, Horiguchi N, et al. Overexpression of hepatocyte growth factor/scatter factor promotes vascularization and granulation tissue formation in vivo[J]. FEBS Lett, 2001, 509(1): 95-100. DOI: 10.1016/S0014-5793(01)03126-X. |
| [18] | Li JF, Duan HF, Wu CT, et al. HGF accelerates wound healing by promoting the dedifferentiation of epidermal cells through beta(1)-Integrin/ILK pathway[J]. Biomed Res Int, 2013: 470418. |
| [19] | Ha XQ, Li YM, Lao MF, et al. Effect of human hepatocyte growth factor on promoting wound healing and preventing scar formation by adenovirus-mediated gene transfer[J]. Chin Med J (Engl), 2003, 116(7): 1029-33. |
| [20] | Chereddy KK, Vandermeulen G, Preat V. PLGA based drug delivery systems: Promising carriers for wound healing activity[J]. Wound Repair Regen, 2016, 24(2): 223-36. DOI: 10.1111/wrr.12404. |
| [21] | Astete CE, Sabliov CM. Synthesis and characterization of PLGA nanoparticles[J]. J Biomater Sci Polym Ed, 2006, 17(3): 247-89. DOI: 10.1163/156856206775997322. |
| [22] | Jain RA. The manufacturing techniques of various drug loaded biodegradable poly (lactide-co-glycolide) (PLGA) devices[J]. Biomaterials, 2000, 21(23): 2475-90. DOI: 10.1016/S0142-9612(00)00115-0. |
| [23] | 安森博, 汪龙, 胡懿郃. 聚乳酸-羟基乙酸共聚物载药微球性质及缓释行为的影响因素[J]. 中国医院药学杂志, 2016, 36(13): 1140-4. |
| [24] | 张晔, 包洪政, 曹洪玉. 表面活性剂聚乙烯醇(PVA)在纳米粒子制备中的作用[J]. 赤峰学院学报:自然科学版, 2009, 25(1): 15-6. |
| [25] | Landfester K, Eisenblatter J, Rothe R. Preparation of polymerizable miniemulsions by ultrasonication[J]. Jct Res, 2004, 1(1): 65-8. |
| [26] | 王颐婷, 李伟炜, 沈梅, 等. 聚乙二醇/聚己内酯/聚乙烯亚胺载胰岛素纳米粒的体外释药性能[J]. 南方医科大学学报, 2016, 36(1): 109-15. |
 2018, Vol. 38
2018, Vol. 38

