Ⅰ型人类免疫缺陷病毒(HIV-1)是导致获得性免疫缺陷综合征(AIDS)的元凶。HIV-1性传播是一个低效的传播途径,据报道,无任何保护措施的阴道性交的感染率大约为1/1000-1/10000 [1-2],然而,约80%性传播案例都是由单个HIV-1变异毒株建立的新感染[3-5],这种病毒被称为初始传播(TF)病毒。研究表明[6-8],相对于HIV-1慢性感染患者血液中的病毒多样性,急性感染者血液内检测到的HIV-1病毒具有高度同源性,这说明“黏膜瓶颈”导致传播过程中病毒遗传多样性的显著减少,并在生殖道局部先天免疫反应的选择压力下,选择出少数能增加传播适应性的优势变异株。而存在于慢性感染患者体内的病毒准种与这种优势变异株(TF病毒)相对应,称之为慢性控制病毒(CC病毒)。对急性感染者及其匹配的慢性控制者的病毒序列分析发现,具有更近祖上基因的病毒会优先传播[9],该共有序列代表着启动感染的病毒基因组的一部分。TF病毒是建立新感染的病毒株,只有阻断TF毒株的感染,才能真正防止HIV-1的传播。
德国科学家Münch教授研究发现,精液源性病毒增强因子(SEVI)能显著增强HIV-1感染[10],这大大提高了HIV-1性传播的几率。一方面,男性感染者精液中的病毒种群主要由少数几种病毒毒株组成,不过精液中病毒滴度最高的毒株往往不是TF病毒,但可以确定的是这些高滴度的普通毒株与SEVI及TF、CC病毒共存于精液中[11]。另一方面,精液作为传播介质,对HIV-1的黏膜传播起着举足轻重的作用。在以往SEVI增加HIV-1感染的研究中发现,SEVI广泛促进CXCR4、CCR5嗜性及双嗜性普通毒株感染靶细胞[12],但SEVI对TF、CC病毒感染的影响并不清楚。
ADS-J1是我们实验室发现的一个小分子阴离子化合物,具有抑制HIV-1进入靶细胞的作用[12]。本研究中,我们扩增了一对TF及其相匹配的CC克隆病毒,先用SEVI分别与TF、CC混合后感染TZM-bl细胞,后用经ADS-J1处理的SEVI或ADS-J1直接分别与TF、CC病毒共孵后感染TZM-bl细胞,通过荧光素酶实验来检测SEVI对TF、CC病毒感染能力的影响,验证进入抑制剂ADS-J1对TF、CC病毒的直接抗病毒作用,及其对SEVI增强TF、CC病毒感染的拮抗作用。通过测定SEVI与ADS-J1混合处理后的Zeta电位,初步探索ADS-J1拮抗SEVI增强TF、CC病毒感染的作用机制,为HIV-1黏膜传播的机制提供参考。
1 材料和方法 1.1 实验材料 1.1.1 细胞株293Tx、TZM-bl、CEMx174 5.25M7细胞株均来源于NIHRR;CH236 TF、CH236 CC感染性克隆病毒质粒皆由美国宾夕法尼亚大学Beatrice H. Hahn教授惠赠。
1.1.2 主要试剂多肽PAP248-286(纯度>95%)(北京中科亚光生物科技有限公司),用PBS配置成10 mg/mL的贮存液于4 ℃冰箱保存;RPMI 1640培养基,DMEM培养基,胰蛋白酶(含0.25% EDTA),胎牛血清(FBS),链霉素及青霉素(美国Gibco公司);硫磺素T(Sigma);ADS-J1(自主合成);磷酸盐缓冲液PBS(广州捷倍斯生物科技有限公司);转染试剂PEI(上海起福生物科技有限公司);荧光素酶活性检测试剂盒(美国Promega公司)。
1.1.3 实验仪器CO2恒温细胞培养箱(美国Thermo公司),生物安全柜(新加坡ESCO公司),-80 ℃超低温冰箱(美国Thermo公司),台式低温高速离心机(德国Eppendorf公司),Thermomixer恒温振荡仪(德国Eppendorf公司),Genios Pro型Tecan酶标仪(美国Tecan公司),倒置光学显微镜(日本Nikon公司),Zetasizer Nano ZS90(英国Malvern公司)。
1.2 实验方法 1.2.1 硫磺素T(ThT)实验多肽PAP248-286贮存液用PBS稀释至2.5 mg/mL,于37 ℃、1400 r/min在恒温振荡仪上振荡48 h,使其聚集成为SEVI淀粉样纤维。SEVI溶液梯度稀释(400、200、100、50 μg/mL),立即加硫磺素T在酶标仪上检测荧光强度。激发波长450 nm(带宽5 nm),发射波长535 nm(带宽10 nm)。
1.2.2 噻唑蓝(MTT)比色法生长良好的TZM-bl细胞用胰蛋白酶(含0.25% EDTA)消化后,离心收集细胞,以104/孔、100 μL/孔接种于96孔板,37 ℃过夜;次日,每孔加入50 μL新鲜的含10% FBS的DMEM培养基;另加入50 μL不同浓度的SEVI稀释液;继续培养72 h,吸去培养基,每孔加入100 μL的0.5 mg/mL MTT溶液,37 ℃孵育4 h;弃上清,每孔加入150 μL的DMSO溶解紫色结晶,震荡10 min,用酶标仪在570 nm处检测吸光度。每组浓度设置3个复孔。SEVI对CEMx174 5.25M7悬浮细胞的毒性实验也采用类似的方法,采用RPMI 1640培养基(10% FBS,200 μg/mL G418,1 μg/mL嘌呤霉素、青霉素/链霉素)培养,细胞以106 /孔、150 μL/孔接种于96孔板。培养72 h后,1500 r/min离心5 min,弃去上清,后续步骤同上。
1.2.3 PEI转染法293Tx细胞以5×105/mL的密度接种于6孔细胞培养板,每孔接种2 mL,37 ℃过夜;次日,待细胞生长至80%,于转染前2 h更换新鲜的DMEM培养基,将CH236 TF和CH236 CC两种质粒(4 μg/孔)分别与PEI转染试剂(1 μg/μL)按3:1(质量比)混合,转染293Tx细胞;转染10 h后,弃去上清,加入新鲜的含10% FBS的DMEM培养基;继续培养48 h,离心,收集上清(即病毒原液),过滤后分装,置于-80 ℃冰箱,备用。
1.2.4 荧光素酶实验TZM-bl细胞以104/孔、100 μL/孔接种于96孔板,37 ℃过夜;次日,CH236 TF和CH236 CC克隆病毒与系列稀释的SEVI溶液按1: 1体积比混合,室温下孵育10 min;混合物以100 μL/孔加入细胞中,只加培养基组作为空白对照,仅加病毒组作为阳性对照;感染3 h后,更换新鲜的含10% FBS的DMEM培养基;继续培养72 h后,按照荧光素酶活性检测试剂盒说明书检测病毒滴度:弃去上清,每孔加200 μL PBS洗板1次,再加入50 μL细胞裂解液,振荡裂解20 min,移取40 μL细胞裂解后的溶液至96孔白色平底微孔板中,每孔加入70 μL荧光素酶底物(预先用水1: 1稀释),立即用酶标仪测定发光值。每组设置3复孔。ADS-J1对SEVI增强病毒感染的影响也用荧光素酶实验进行评估。ADS-J1系列稀释液与SEVI等体积混合,于37 ℃孵育15 min,5000 r/min离心10 min,弃去上清,用空白DMEM培养基重悬沉淀,与病毒等体积混合,室温下孵育10 min,其余步骤同上。ADS-J1直接的抗病毒作用同样用荧光素酶实验评估。ADS-J1系列稀释液与病毒等体积混合,室温下孵育10 min,其余步骤同上。仅加病毒、未加ADS-J1组的抑制率当作0,并作为阳性对照组。
1.2.5 Zeta电位检测ADS-J1系列稀释液(240、120、60、30 μg/mL)与SEVI(400 μg/mL)等体积混合,37 ℃孵育30 min,室温下5000 r/min离心5 min,弃去上清;用1 mL浓度为1mmol的KCl重悬沉淀,室温孵育10 min,将样品倾倒入Zeta电位检测池,使用Zetasizer Nano ZS90电位测定仪检测,每个样品重复检测3次。
1.2.6 统计学分析直方图均采用Excel进行处理。采用SPSS 22.0软件对实验数据进行统计学分析,实验数据以均数±标准差表示。数据分析采用单因素方差分析(One-Way ANOVA),组间两两比较用LSD法,方差不齐则用Dunnett T3检验法,当P < 0.05时差异具有统计学意义。
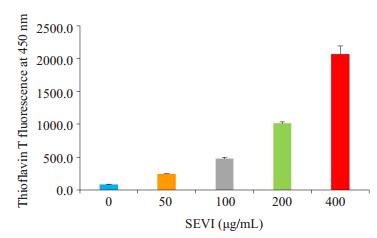
2 结果 2.1 PAP248-286在PBS中能自组装成形成SEVI淀粉样纤维淀粉样纤维能与硫磺素T特异性结合,诱导硫磺素T荧光的强吸收,而多肽单体则没有此作用。ThT实验结果(图 1)显示,PAP248-286在PBS中形成淀粉样纤维SEVI,并呈浓度依赖性。
|
图 1 ThT法检测PAP248-286在PBS中形成SEVI淀粉样纤维的情况 Figure 1 SEVI amyloid fibrils formation of PAP248-286 in PBS detected by ThT test. The fluorescence intensities of SEVI (0, 50, 100, 200, 400 μg/mL) were detected by Thioflavin T assay with excitation wavelength at 450 nm |
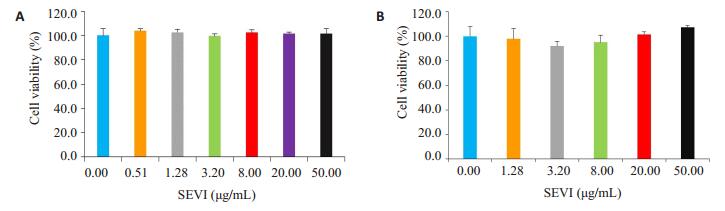
对TZM-bl细胞中的MTT实验结果进行One-way ANOVA方差分析,P=0.250,方差齐性,SEVI浓度为0 μg/ mL的对照组与其他各浓度组之间的比较采用LSD检验法分析,P>0.05(图 2A),说明SEVI在0~50 μg/mL浓度范围内对TZM-bl细胞没有毒性作用。
|
图 2 MTT法检测SEVI对TZM-bl细胞及CEMx174 5.25M7细胞的毒性作用 Figure 2 Cytotoxicities of SEVI on TZM-bl (A) and CEMx174 5.25M7 cells (B) analyzed by MTT assay |
同样,对CEMx174 5.25M7细胞中的MTT实验结果进行One-way ANOVA方差分析,P值为0.213(P> 0.05),方差齐性,SEVI浓度为0 μg/mL的对照组与其他各浓度组之间的比较采用LSD法分析,P>0.05(图 2B),说明SEVI在0~50 μg/mL浓度范围内对CEMx174 5.25M7细胞没有毒性作用。
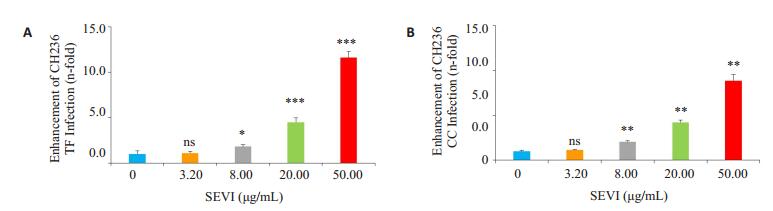
2.3 SEVI能增强CH236 TF和CC HIV-1毒株感染已有研究表明,精液蛋白PAP的不同片断形成的淀粉样纤维(如SEM1、SEM2、SEVI)能促进普通HIV-1毒株的感染[10, 13-14]。本研究中,我们采用TZM-bl报告系统考察SEVI对TF和CC HIV-1病毒感染有无促进作用。先利用One-way ANOVA进行方差分析,CH236 TF、CH236 CC组P值分别为0.091、0.006。CH236 TF组方差齐性,采用LSD法两两比较;而CH236 CC组方差不齐,采用Dunnett T3检验法。结果表明,TF和CC毒株的结果类似,除了低浓度3.2 μg/mL组与空白对照组没有显著性差异(P>0.05,图 3A,图 3B)外,浓度为8、20、50 μg/mL的组均与空白对照组有显著性差异(P < 0.05,图 3A,图 3B),说明SEVI在较高浓度时能以浓度依赖的方式促进TF和CC HIV-1感染靶细胞。
|
图 3 SEVI对CH236 TF和CH236 CC病毒感染的影响 Figure 3 Effect of SEVI on CH236 TF and CH236 CC virus infection. A: Enhancement fold of SEVI on CH236 TF analyzed by luciferase activity. B: Enhancement fold of SEVI on CH236 CC analyzed by luciferase activity. *P < 0.05, **P < 0.01, ***P < 0.001 vs blank control |
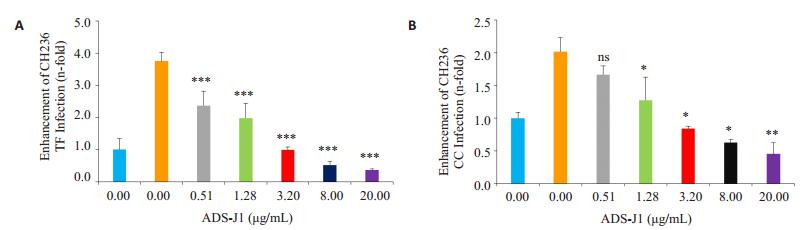
ADS-J1是具有拮抗SEVI促进普通HIV-1毒株感染的小分子阴离子化合物,前面的实验结果已经验证SEVI对TF和CC HIV-1病毒感染的促进作用,接下来,我们将SEVI的浓度设为20 μg/mL,考察ADS-J1拮抗SEVI增强CH236 TF和CC HIV-1毒株感染的情况。One-way ANOVA方差分析结果表明,CH236 TF组P值为0.112(P>0.05),方差齐性,采用LSD法两两比较,ADS-J1浓度在0.51、1.28、3.20、8.00、20.00 μg/mL时均显著拮抗SEVI增强CH236 TF病毒感染作用(P < 0.05,图 4A)。CH236 CC组P值为0.033(P < 0.05),方差不齐,采用Dunnett T3检验法,ADS-J1浓度在1.28、3.20、8.00、20.00 μg/mL时显著拮抗SEVI增强CH236 TF病毒感染作用(P < 0.05,图 4B)。此实验结果表明,ADS-J1拮抗SEVI增强TF和CC HIV-1感染靶细胞,并呈浓度依赖作用。
|
图 4 ADS-J1拮抗SEVI增强CH236 TF和CH236 CC病毒感染 Figure 4 Antagonism of ADS-J1 on SEVI-mediated enhancement of CH236 TF and CH236 CC viruses in vitro. A: Enhancement fold of SEVI treated with ADS-J1 on CH236 TF analyzed by luciferase activity. B: Enhancement fold of SEVI treated with ADS-J1 on CH236 CC analyzed by luciferase activity. *P < 0.05, **P < 0.01, ***P < 0.001 vs blank control |
gp41是HIV-1跨膜糖蛋白,介导HIV-1与靶细胞融合,从而HIV-1进入细胞内。有研究表明,ADS-J1可以通过抑制gp41六螺旋束结构的形成,进而抑制HIV-1进入靶细胞的作用[12]。我们设计了ADS-J1系列浓度(0.51、1.28、3.20、8.00、20.00、50.00 μg/mL),考察ADSJ1是否能抑制CH236 TF和CC HIV-1毒株感染TZMbl细胞。实验结果用One-way ANOVA进行方差分析,CH236 TF组、CH236 CC组的P分别为0.117、0.061(P> 0.05),方差齐性,采用LSD法两两比较,ADS-J1在浓度0.51、1.28、3.20、8.00、20.00、50.00 μg/mL时均显著抑制CH236 TF、CC HIV-1毒株感染靶细胞(P < 0.05,图 5)。以上结果表明,ADS-J1不仅能拮抗SEVI增强CH236 TF、CC HIV-1毒株感染作用,还可以直接抑制病毒感染靶细胞。
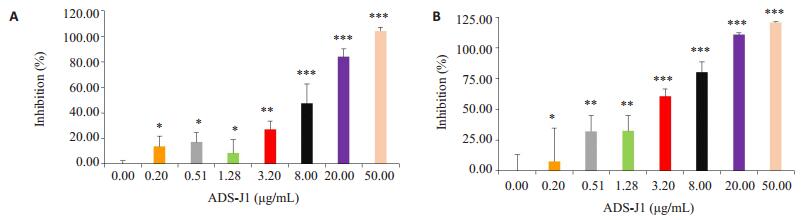
|
图 5 ADS-J1抑制CH236 TF和CC HIV-1毒株感染 Figure 5 ADS-J1 inhibited the infection of CH236 TF and CH236 CC viruses in vitro. A: Inhibition (%) of CH236 TF viruses treated with indicated concentration of ADS-J1 analyzed by luciferase activity. B: Inhibition (%) of CH236 CC viruses treated with indicated concentration of ADS-J1 analyzed by luciferase activity. *P < 0.05, **P < 0.01, ***P < 0.001 vs blank control |
既然ADS-J1本身就能抑制TF和CC HIV-1感染,那么图 4中加入ADS-J1后,SEVI促感染作用的降低是两种作用的简单叠加,还是ADS-J1对SEVI的拮抗作用呢?SEVI淀粉样纤维促进HIV感染的作用机制是,纤维富含正电荷,能与带负电荷的病毒粒子结合,拉近病毒与靶细胞之间的距离,从而促进病毒感染[14-15]。ADS-J1为小分子阴离子化合物,我们通过Zeta电位法探讨ADS-J1拮抗SEVI促感染作用的机制。淀粉样纤维富含正电荷,用不同浓度ASD-J1处理SEVI后,检测混合物的Zeta电位。结果显示,SEVI(400 μg/mL)电位为+20.9±0.36 mV,ADS-J1(30 μg/mL)电位为-4.2± 0.20 mV。SEVI所带的正电荷被ADS-J1呈浓度依赖性地中和,并在ADS-J1为60 μg/mL时逆转为带负电(图 6)。Zeta电位法的结果表明,ADS-J1能中和SEVI表面的正电荷。
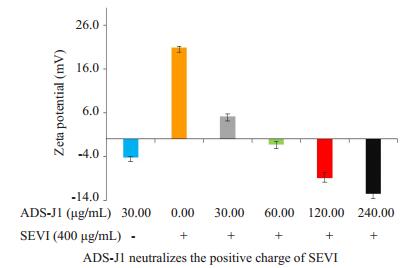
|
图 6 ADS-J1中和SEVI表面的正电荷 Figure 6 ADS-J1 neutralizes the positive charge of SEVI. Zeta potential of SEVI treated with serial concentration of ADSJ1 was detected by Zetasizer Nano ZS90 |
性传播已经成为HIV-1的最主要传播方式,生殖道黏膜、直肠或口腔黏膜组织为HIV-1的性传播提供了主要的感染位点[16],而建立黏膜新感染的毒株为TF病毒,约80%为单株TF感染。男性长期感染者血液内的病毒分泌到精液的过程中,病毒载量和多样性大大减少,但一些毒株仍然可以通过精液传播,可见黏膜瓶颈和先天性免疫并不能完全阻止病毒传播,反而选择出能打破这些屏障的TF优势变异株。研究表明,天然存在于精液中的SEVI能显著增加HIV-1感染,其在精液中含量高达42 μmol/L,约占精液固体蛋白的35% [10, 15],我们猜测这也为TF传播提供了极有利的条件。目前,尚未有以生殖道为靶点来阻止HIV-1传播的药物上市[13],其中生殖道局部杀微生物剂是一种很有研发前景的药物,它可以通过直接灭活HIV-1、阻断HIV-1黏附及抑制病毒进入靶细胞,或抑制病毒在靶细胞内复制,增强阴道和子宫的天然免疫反应等多个靶点将HIV-1 “扼杀”在摇篮。然而,许多在体外证实有效的局部杀微生物剂,临床试验结果均以失败告终[13]。如前所述,SEVI可能是导致杀微生物剂临床试验失败的罪魁祸首。因此,SEVI和TF、CC毒株可以作为HIV杀微生物剂研发的方向。
本研究中,首先我们在体外将PAP248-286多肽溶解在PBS中,在37 ℃下剧烈震荡48 h,ThT实验表明,PAP248-286单体浓度依赖性地形成了淀粉样纤维SEVI。剧烈震荡形成SEVI用于后续的病毒感染实验,但精液中SEVI的形成至今没有明确的机制,可能与多肽氨基酸残基间相互作用、介质疏水性、温度、pH、金属离子等有关[17]。
针对HIV R5病毒的实验表明,大量带正电荷的SEVI犹如一张“大网”牢牢捕获带负电的病毒,并且可以降低病毒与细胞膜间的静电排斥,增加了病毒在细胞膜上的粘附率从而促进病毒与靶细胞的融合[14]。然而,SEVI对TF和CC病毒感染能力的影响目前尚不清楚,虽然TF病毒的低糖基化[20]导致它在黏液中相对容易迁移,可能难以被SEVI淀粉样纤维捕获,但是TF病毒的包膜糖蛋白几乎是普通HIV-1的2倍[19],带正电荷的SEVI可能对病毒与细胞膜上的融合极为有利,因此,我们猜测SEVI可能也会增加TF及其相匹配的CC病毒感染。本研究中,我们利用CH236 TF和CC感染性克隆转染293T细胞获得病毒,进一步的病毒感染实验表明,SEVI确实能增强TF、CC病毒感染靶细胞,增强倍数依次为11.6±0.7和8.9±0.7倍,增强的效果较普通R5毒株的效果弱,这一结果与精液增强病毒感染的结果类似(本课题组数据,未列出),这可能与不同病毒本身的感染能力、病毒稀释的倍数等因素有关。值得一提的是,TF和CC病毒本身的滴度也远低于普通的毒株,两者之间往往相差几个数量级。
ADS-J1是我们课题组采用高通量筛选得到的小分子化合物,它除了抑制SEVI的形成、降解成熟的SEVI,还通过靶向HIV-1 gp41、gp 120阻断病毒进入靶细胞,具有“三重”作用的ADS-J1有望作为先导化合物来研发以SEVI为靶点同时直接抑制病毒感染的杀微生物剂[12, 20-22]。基于这些研究基础,我们预测ADS-J1也可以拮抗SEVI增强TF、CC毒株感染靶细胞的能力。为了证实这一猜测,我们首先将ADS-J1和SEVI在37 ℃下共孵育,然后与TF及CC病毒混匀后感染TZMbl细胞,结果证实ADS-J1可以拮抗SEVI增强TF及CC毒株的感染,且拮抗作用呈浓度依赖性。高浓度的ADS-J1甚至将病毒滴度降低至对照值以下,暗示ADSJ1不仅拮抗SEVI增强TF、CC病毒感染,可能还可以直接抑制TF、CC病毒感染靶细胞,接下来我们通过ADSJ1对TF、CC的抗病毒实验证明了这一猜测。如前所述,SEVI表面的正电荷是增强病毒感染的重要原因,ADS-J1是一种阴离子化合物,它能中和SEVI表面的正电荷。为进一步探索ADS-J1拮抗SEVI增强病毒感染的作用机制,我们用不同浓度的ADS-J1处理SEVI,检测其电位,结果证实ADS-J1能浓度依赖性地中和SEVI表面的正电荷。因此,我们认为,SEVI增强TF和CC病毒感染能力的作用机制与增强普通R5病毒感染能力的作用机制是一致的,而ADS-J1通过中和SEVI表面的正电荷而拮抗其增强作用。
本研究利用体外感染模型,初步证实了ADS-J1拮抗SEVI增强TF和CC病毒的感染能力及其作用机制,TF病毒作为有效建立新感染的毒株,我们认为这一结果比SEVI增强其他普通HIV-1毒株感染对于黏膜传播过程的了解更具参考意义。然而,鉴于体内环境的复杂性,需要进一步的体内实验或利用模拟体内环境的模型才能更好地了解TF病毒的传播机制,以寻求阻断TF病毒感染机体的有效方法。
| [1] | Gray RH, Wawer MJ, Brookmeyer R, et al. Probability of HIV-1 transmission per coital act in monogamous, heterosexual, HIV-1-discordant couples in Rakai, Uganda[J]. Lancet, 2001, 357(9263): 1149-53. DOI: 10.1016/S0140-6736(00)04331-2. |
| [2] | Padian NS, Shiboski SC, Glass SO, et al. Heterosexual transmission of human immunodeficiency virus (HIV) in northern California: results from a ten-year study[J]. Am J Epidemiol, 1997, 146(4): 350-57. DOI: 10.1093/oxfordjournals.aje.a009276. |
| [3] | Derdeyn CA, Decker JM, Bibolletruche F, et al. Envelope constrained neutralization sensitive HIV-1 after heterosexual transmission[J]. Science, 2004, 303: 2019-22. DOI: 10.1126/science.1093137. |
| [4] | Haaland RE, Hawkins PA, Salazargonzalez J, et al. Inflammatory genital infections mitigate a severe genetic bottleneck in heterosexual transmission of subtype A and C HIV-1[J]. PLoS Pathog, 2009, 5: e1000274. DOI: 10.1371/journal.ppat.1000274. |
| [5] | Frater AJ, Edwards CT, McCarthy N, et al. Passive sexual transmission of human immunodeficiency virus type 1 variants and adaptation in new hosts[J]. J Virol, 2006, 80: 7226-34. DOI: 10.1128/JVI.02014-05. |
| [6] | Keele BF, Giorgi EE, Salazar-Gonzalez JF, et al. Identification and characterization of transmitted and early founder virus envelopes in primary HIV-1 infection[J]. Proc Natl Acad Sci U S A, 2008, 105(21): 7552-7. DOI: 10.1073/pnas.0802203105. |
| [7] | Abrahams MR, Anderson JA, Giorgi EE, et al. Quantitating the multiplicity of infection with human immunodeficiency virus type 1 subtype C reveals a non-Poisson distribution of transmitted variants[J]. J Virol, 2009, 83: 3556-67. DOI: 10.1128/JVI.02132-08. |
| [8] | Iyer SS, Bibollet-Ruche F, Sherrill-Mix S, et al. Resistance to type 1 interferons is a major determinant of HIV-1 transmission fitness[J]. Proc Natl Acad Sci U S A, 2017, 114(4): E590-9. DOI: 10.1073/pnas.1620144114. |
| [9] | Carlson JM, Schaefer M, Monaco DC, et al. HIV transmission. Selection bias at the heterosexual HIV-1 transmission bottleneck[J]. Science, 2014, 345(6193): 1254031. DOI: 10.1126/science.1254031. |
| [10] | Munch J, Rucker E, Standker L, et al. Semen-derived amyloid fibrils drastically enhance HIV infection[J]. Cell, 2007, 131(6): 1059-71. DOI: 10.1016/j.cell.2007.10.014. |
| [11] | Boeras DI, Hraber PT, Hurlston M, et al. Role of donor genital tract HIV-1 diversity in the transmission bottleneck[J]. Proc Natl Acad Sci U S A, 2011, 108(46): E1156-63. DOI: 10.1073/pnas.1103764108. |
| [12] | Xun T, Li W, Chen J, et al. ADS-J1 inhibits semen-derived amyloid fibril formation and blocks fibril-mediated enhancement of HIV-1 infection[J]. Antimicrob Agents Chemother, 2015, 59(9): 5123-34. DOI: 10.1128/AAC.00385-15. |
| [13] | Arnold F, Schnell J, Zirafi O, et al. Naturally occurring fragments from two distinct regions of the prostatic acid phosphatase form amyloidogenic enhancers of HIV infection[J]. J Virol, 2012, 86(2): 1244-9. DOI: 10.1128/JVI.06121-11. |
| [14] | Roan NR, Münch J, Arhel N, et al. The cationic properties of SEVI underlie its ability to enhance human immunodeficiency virus infection[J]. J Virol, 2009, 83(1): 73-80. DOI: 10.1128/JVI.01366-08. |
| [15] | Yolamanova M, Meier C, Shaytan AK, et al. Peptide nanofibrils boost retroviral gene transfer and provide a rapid means for concentrating viruses[J]. Nat Nanotechnol, 2013, 8(2): 130-6. DOI: 10.1038/nnano.2012.248. |
| [16] | Smith-McCune K, Chen JC, Greenblatt RM, et al. Unexpected inflammatory effects of intravaginal gels (Universal Placebo Gel and Nonoxynol-9) on the upper female reproductive tract: A randomized crossover study[J]. PLoS One, 2015, 10(7): e0129769. DOI: 10.1371/journal.pone.0129769. |
| [17] | Sheftic SR, Snell JM, Jha S, et al. Inhibition of semen-derived enhancer of virus infection (SEVI) fibrillogenesis by zinc and copper[J]. Eur Biophys J, 2012, 41(9): 695-704. DOI: 10.1007/s00249-012-0846-0. |
| [18] | Frost SD, Liu Y, Pond SL, et al. Characterization of human immunodeficiency virus type 1 (HIV-1) envelope variation and neutralizing antibody responses during transmission of HIV-1 subtype B[J]. J Virol, 2005, 79(10): 6523-7. DOI: 10.1128/JVI.79.10.6523-6527.2005. |
| [19] | Parrish NF, Gao F, Li H, et al. Phenotypic properties of transmitted founder HIV-1[J]. Proc Natl Acad Sci U S A, 2013, 110(17): 6626-33. DOI: 10.1073/pnas.1304288110. |
| [20] | Wang H, Qi Z, Guo A, et al. ADS-J1 Inhibits Human Immunodeficiency Virus Type 1 Entry by Interacting with the gp41 Pocket Region and Blocking Fusion-Active gp41 Core Formation[J]. Antimicrob Agents Chemother, 2009, 53(12): 4987-98. DOI: 10.1128/AAC.00670-09. |
| [21] | Yu F, Lu L, Liu Q, et al. ADS-J1 inhibits HIV-1 infection and membrane fusion by targeting the highly conserved pocket in the gp41 NHR-trimer[J]. Biochim Biophys Acta, 2014, 1838: 1296-305. DOI: 10.1016/j.bbamem.2013.12.022. |
| [22] | González-Ortega E, Mena M-P, Permanyer M, et al. ADS-J1 Inhibits HIV-1 entry by interacting with gp120 and does not block fusion-active gp41 core formation[J]. Antimicrob Agents Chemother, 2010, 54(10): 4487-92. DOI: 10.1128/AAC.00359-10. |
 2018, Vol. 38
2018, Vol. 38

