2. 西北妇女儿童医院,陕西 西安 710000;
3. 中国科学院地球环境研究所黄土与第四纪地质国家重点实验室,陕西 西安 710075
2. Northwest Women and Children's Hospital, Xi'an 710000, China;
3. State Key Laboratory of Loess and Quaternary Geology, Institute of Earth Environment, Chinese Academy of Science, Xi'an 710075, China
可吸入颗粒物(PM)已成为日益受到重视的空气污染物,其中PM2.5对人类健康危害最为严重。而呼吸系统是PM2.5暴露和作用的主要靶器官,人群流行病学实验已证实了PM2.5暴露引起或促进了众多呼吸系统相关疾病的发生和发展[1-2]。而相关毒理学实验揭露了PM2.5引起呼吸系统损伤的作用机制主要与氧化应激、炎症反应有关[3]。
芍药苷作为中国传统中草药芍药的有效活性成分,是一种天然的抗氧化剂,具有抗炎、镇痛[4],抗过敏[5]、抗纤维化[6]、免疫调节[7]、抗高血脂[8]、抗血小板聚集等作用[9]。芍药苷也对多种心肺细胞具有重要保护作用,能减轻脂多糖、过氧化氢及缺氧等所致的细胞损害,其机制可能也与芍药苷的抗氧化及抗炎症等作用相关[10-12]。为了减少PM2.5环境污染带来的危害, 本研究采用中医药“治未病”的思想,利用芍药苷的抗氧化功能来干预呼吸系统损伤,探索芍药苷对大气PM2.5造成呼吸系统相关疾病的潜在药用价值[13],进而对其进行防治。
而芍药苷是否对经PM2.5悬浊液染毒的支气管上皮细胞有直接作用,国内外尚未见报道。因此本实验拟用人正常支气管上皮细胞(BEAS-2B细胞)在浓缩大气PM2.5悬浊液染毒的同时使用不同浓度芍药苷进行干预,测定BEAS-2B细胞的细胞存活率及毒理学指标,如胞内MDA,ROS,研究不同浓度PM2.5及不同浓度芍药苷对支气管上皮细胞的交互影响。从细胞毒理学水平评价芍药苷对PM2.5染毒致支气管上皮细胞损伤的保护作用,探索其可能的保护作用及机制。
1 材料和方法 1.1 实验材料人支气管上皮细胞(BEAS-2B细胞),四甲基偶氮唑盐(MTT,Amresco)。芍药苷(索莱宝科技,分析纯,纯度>98%)。
KB-120F智能TSP-PM10中流量采样器(金仕达电子科技)、2.0 μm PTFE微孔滤膜(海成世过滤器材)、Infinire M200型酶标仪(Tecan)、倒置相差荧光显微镜(千欣仪器)、流式细胞仪(BD FACSCalibur)。
1.2 实验方法 1.2.1 PM2.5的准备方法2014年11月21日~2015年3月15日-,在西安交通大学医学部公共卫生学院卫法楼七楼进行采样,每天采样10 h,滤膜每2 d换1次。采样后将滤膜有尘面对折放入滤膜袋,并避光储存于-20 ℃冰箱中。将采集好的PM2.5的采样滤膜剪碎成若干块小片,将其完全浸入50 mL三蒸水中,进行超声分离,制备成颗粒物悬液,将悬液分装放置于-80 ℃低温冰箱中过夜,后置于SCientz-10ND真空冻干机进行除水处理,所得干燥灰色絮状颗粒物低温冰箱保存备用。将所得PM2.5颗粒装入冻存管中,后置于液氮罐中冷冻灭菌24 h。用1640培养基溶解所得颗粒物,使得最终浓度为2 mg/mL备用,然后置于-80 ℃保存。
1.2.2 指标测定方法用酶标仪进行MTT法测量;用流式细胞仪定量检测细胞内ROS水平;用倒置相差荧光显微镜观察细胞内ROS的分布;用硫代巴比妥酸(TBA)比色法测定细胞培养上清MDA的含量。
1.3 统计学分析方法本实验采用析因设计,有芍药苷干预浓度与PM2.5干预浓度两个因素,利用析因设计资料的方差分析比较芍药苷干预浓度与PM2.5干预浓度的主效应及交互效应,利用单因素方差分析比较芍药苷干预浓度单独效应。检验水准ɑ=0.05。
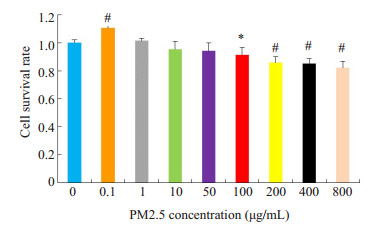
2 结果 2.1 不同浓度的PM2.5染毒对BEAS-2B细胞干预后MTT的测量结果用不同浓度的PM2.5对生长状态良好的细胞进行24 h干预,用MTT实验来评价PM2.5对BEAS-2B细胞生长繁殖的影响。PM2.5干预浓度与细胞存活率之间呈剂量-反应关系(r=-0.759,P=0.018)。PM2.5干预对BEAS-2B细胞存活率的影响呈低浓度(0.1 μ、1.0 μg/mL)促进增殖,高浓度(10、200、400、800 μg/mL)抑制增殖。PM2.5以100、200、400、800 μg/mL浓度干预BEAS-2B细胞24 h时,其细胞存活率与对照组(0 μg/mL)细胞存活率相比明显下降(P < 0.05,图 1)。
|
图 1 不同浓度的PM2.5对BEAS-2B细胞存活率的影响 Figure 1 Effects of different concentrations of PM2.5 on the viability of BEAS-2B cells. Compared with the control group, *P < 0.05; Compared with the control group, #P < 0.01 |
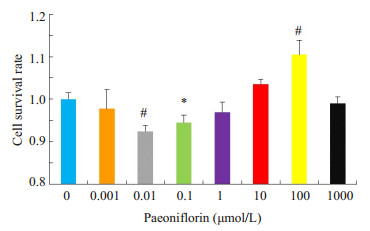
用不同浓度的芍药苷对生长状态良好的细胞进行24 h干预,用MTT实验来评价芍药苷对BEAS-2B细胞生长繁殖的影响。在芍药苷低浓度(0.001、0.01、0.1、1.0 μmol/L)时,抑制该细胞增殖,0.01和0.1 μmol/L时,芍药苷显著降低BEAS-2B细胞存活率;高浓度(10、100、1000 μmol/L)时,促进该细胞增殖,芍药苷100 μmol/L浓度时可以显著提高BEAS-2B细胞存活率(P < 0.01,图 2)。
|
图 2 不同浓度的芍药苷对BEAS-2B细胞增殖的影响 Figure 2 Effects of different concentrations of paeoniflorin on the viability of BEAS-2B cells. Compared with the control group, *P < 0.05; Compared with the control group, #P < 0.01 |
用不同浓度的PM2.5和不同浓度的芍药苷对生长状态良好的细胞进行干预,在干预24 h后用MTT实验来评价芍药苷对PM2.5所致BEAS-2B细胞的生长抑制的保护作用。以下是芍药苷干预浓度与PM2.5干预浓度的主效应、交互效应及单独效应分析结果(表 1)。
| 表 1 芍药苷干预对PM2.5染毒BEAS-2B细胞存活率测定结果的影响 Table 1 Effect of paeoniflorin on the survival rate of BEAS-2B cells with PM2.5 exposure (Mean±SD, n=3) |
采用析因设计资料的方差分析,结果发现对于不同PM2.5干预浓度水平,细胞存活率随浓度上升而下降(P < 0.0001)。在不同浓度芍药苷干预时,细胞存活率随浓度上升而上升(P < 0.0001),而芍药苷干预浓度与PM2.5干预浓度之间不存在显著的交互效应(P>0.05)。
2.3.2 不同芍药苷浓度对各PM2.5浓度组细胞存活率的影响对芍药苷干预进行单独效应分析,对于PM2.5的不同浓度组,均采用单因素方差分析比较芍药苷剂量组间细胞存活率的差异,结果表明其他PM2.5浓度组未见明显统计学差异,只有800 μg/mL PM2.5浓度组中,细胞存活率随着芍药苷浓度增加而上升(P < 0.05)。
2.3.3 不同浓度芍药苷对细胞存活率的影响利用Dunnett-t检验将芍药苷干预浓度逐一与对照组(0 μmol/L)进行多重比较,发现芍药苷1 μmol/L浓度组与对照组相比,细胞存活率明显增高(P < 0.05);而在芍药苷10和100 μmol/L剂量组与染毒对照组比较时,细胞存活率均显著性增高(P < 0.0001)。
2.4 芍药苷对PM2.5诱导的BEAS-2B细胞损伤的保护效应用不同浓度的PM2.5和不同浓度的芍药苷对生长状态良好的细胞进行干预,在干预24 h后细胞内ROS及细胞培养上清MDA含量结果如下。
2.4.1 不同浓度芍药苷对PM2.5诱导BEAS-2B细胞内ROS含量的影响采用析因设计资料的方差分析,ROS结果发现不同PM2.5干预浓度下,随浓度上升细胞内ROS含量增加(P < 0.0001);不同浓度芍药苷干预时,细胞内ROS含量随浓度上升而减少(P < 0.0001),而芍药苷干预浓度与PM2.5干预浓度之间;在细胞内ROS含量中存在显著的交互效应(P < 0.0001)。
对芍药苷干预进行单独效应分析,分别利用单因素方差分析比较每个PM2.5浓度组内芍药苷剂量与ROS含量的差异,发现在每个PM2.5浓度组,不同芍药苷剂量组间细胞内ROS含量随浓度上升而减少(P < 0.0001);利用Dunnett-t检验进行芍药苷干预浓度之间的多重比较,使芍药苷(1.0,10,100 μmol/L)浓度组细胞存活率均数逐一与对照组(0 μmol/L)进行比较;发现三个芍药苷剂量组与染毒对照组比较时,细胞内ROS含量均显著性降低(P < 0.0001,表 2)。
| 表 2 芍药苷干预对PM2.5染毒BEAS-2B细胞内ROS含量测定结果的影响 Table 2 Effect of paeoniflorin on the ROS content in BEAS-2B cells with PM2.5 exposure (Mean±SD, n=3) |
采用析因设计资料的方差分析,MDA结果发现不同PM2.5干预浓度下,随浓度上升细胞培养上清MDA含量增加(P < 0.0001);不同浓度芍药苷干预时,细胞培养上清MDA含量含量随浓度上升而减少(P < 0.0001);但在MDA的产生中不存在显著的交互效应(P>0.05)。
对芍药苷干预进行单独效应分析,分别利用单因素方差分析比较每个PM2.5浓度组内芍药苷剂量与细胞培养上清中MDA的差异,发现在(400、800 μg/mL)PM2.5浓度组,不同芍药苷剂量组间细胞培养上清中MDA含量随浓度上升而显著减少(P < 0.0001);在(0 μg/mL)PM2.5浓度组,组间MDA含量随浓度上升而减少(P < 0.05);利用Dunnett-t检验进行芍药苷干预浓度之间的多重比较,使芍药苷(1.0、10、100 μmol/L)浓度组细胞存活率均数逐一与对照组(0 μmol/L)进行比较,发现芍药苷(1.0 μmol/L)剂量组与染毒对照组比较时,细胞培养上清中MDA含量显著性降低(P < 0.0001)。芍药苷(10、100 μmol/L)剂量组与染毒对照组比较时,MDA含量均降低(P < 0.05,表 3)。
| 表 3 芍药苷干预对PM2.5染毒BEAS-2B细胞MDA含量测定结果的影响 Table 3 Effect of paeoniflorin on MDA content in BEAS-2B cells with PM2.5 exposure (Mean±SD, n=3) |
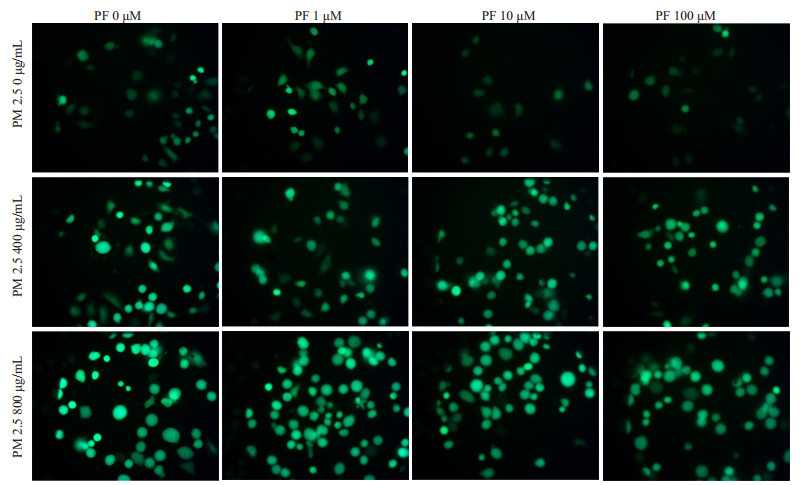
利用荧光显微镜定性观察BEAS-2B细胞内ROS水平,发现了随着PM2.5浓度的增加,细胞内荧光强度增强,随着芍药苷浓度的增加,细胞内荧光强度明显减弱(图 3)。
|
图 3 芍药苷处理对PM2.5诱导的BEAS-2B细胞损伤的ROS水平的定性观察 Figure 3 Qualitative observation of ROS level in BEAS-2B cells with PM2.5 exposure and paeoniflorin treatment |
既往研究表明大气PM2.5对BEAS-2B细胞有着明显的细胞毒性,影响着细胞的生长繁殖[14-16]。本实验得到与既往研究类似的发现,PM2.5干预浓度与细胞存活率之间存在着剂量-反应关系,PM2.5具有明显的细胞毒性反应。但除此之外,从实验结果中亦发现PM2.5低浓度时能够刺激BEAS-2B细胞增殖,这可能与毒物兴奋作用有关,通过低剂量毒物对机体内稳态的微干扰,启动一系列修复和维持机制,如通过对转录因子和激酶的激活,增加细胞保护和修复性蛋白的表达。
由于既往研究中未曾发现研究芍药苷诱导BEAS-2B细胞毒性的实验,故对其处理阈剂量不甚清楚。故本实验采用不同浓度的芍药苷对生长状态良好的BEAS-2B细胞进行干预,在干预24 h后用MTT实验来评价芍药苷对BEAS-2B细胞的毒性作用。发现用不同浓度的芍药苷干预使得BEAS-2B细胞生长曲线为S型曲线,即芍药苷在低浓度时,抑制BEAS-2B细胞的生长增殖;在高浓度时,促进BEAS-2B细胞增殖。而结合析因方差分析及多重比较发现,在有PM2.5干预细胞时,随着芍药苷浓度的增加,细胞存活率显著升高,说明芍药苷对BEAS-2B细胞具有一定保护作用。其次,实验结果显示了不同浓度的芍药苷对不同浓度PM2.5诱导的BEAS-2B细胞损伤的保护作用。尤其在800 μg/mL PM2.5浓度染毒组中,芍药苷10 μmol/L干预的染毒组和100 μmol/L干预的染毒组细胞存活率与染毒对照组相比均显著性增高,说明芍药苷能够减轻PM2.5诱导的BEAS-2B细胞毒性,对高浓度PM2.5所致BEAS-2B细胞的生长抑制有一定的保护作用。
Yan等[13]曾体外培养BEAS-2B细胞,发现PM2.5干预能够明显地增加细胞内ROS的生成。同样本实验定量及定性地检测了BEAS-2B细胞内ROS水平,发现随着PM2.5浓度的增加,BEAS-2B细胞内ROS水平显著增加。而经芍药苷干预后,随着芍药苷干预浓度的增加,细胞内ROS含量显著下降。并在不同的PM2.5染毒浓度组中,各个芍药苷干预染毒组分别与染毒对照组相比,细胞内ROS均显著性降低。
此外,本研究还发现随着PM2.5浓度的增加,MDA的含量显著增高。这与Deng等用PM2.5干预人体外培养的A549细胞发现一致,PM2.5能够明显增加细胞培养上清中MDA的释放[17],说明PM2.5诱导BEAS-2B细胞发生了氧化应激损伤。同样经芍药苷干预后,随着芍药苷干预浓度的增加细胞培养上清MDA含量显著下降。在不同浓度的PM2.5染毒浓度组中,与染毒对照组相比,细胞培养上清MDA含量也显著下降。
氧化应激是指机体在需要清除体内老化的细胞,或在遭受各种有害刺激时,体内高活性分子如ROS产生过多,氧化程度超出氧化物的清除能力,机体氧化系统和抗氧化系统失衡, 导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物,从而导致组织损伤[19-20]。既往研究表明,芍药苷具有很强的抗氧化作用,在细胞氧化应激损伤状态下,芍药苷可以通过降低细胞内ROS的生成,增加抗氧化物谷胱甘肽及超氧化物歧化酶的产生,同时激活抗氧化通路核因子E2相关因子2/血红素氧合酶1,诱导血红素氧合酶l基因的表达来保护内皮细胞的氧化损伤,抑制细胞凋亡[21-23]。中、高浓度的ROS可通过细胞氧化应激反应诱导细胞凋亡甚至导致其坏死。细胞内ROS水平的增加就表明了氧化应激反应的进行。
而在生物体内,自由基作用于脂质发生过氧化反应,氧化最终产物为MDA[24]。它可以间接测定膜系统受损程度,引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性,在体外可影响线粒体呼吸链复合物及线粒体内关键酶活性[25]。研究表明芍药苷能显著降低缺氧诱导的乳鼠心肌细胞产生的MDA[10],从而抑制氧化亢进。细胞上清中MDA水平的增加就表明了细胞膜已经受损,细胞生长受抑制。在本实验中,芍药苷对BEAS-2B细胞中的氧化应激过程有了明显的干预效果,对细胞的氧化应激损伤具有显著保护作用。
综上所述,本文的主要发现首先是芍药苷在低浓度时抑制BEAS-2B细胞的生长增殖,在高浓度时促进BEAS-2B细胞增殖。其次,芍药苷对PM2.5所致BEAS-2B细胞的生长抑制有一定的保护作用,其机制可能与芍药苷明显减轻了PM2.5诱导的BEAS-2B细胞氧化应激损伤有关。
| [1] | Cortez-Lugo M, Ramirez-Aguilar M, Perez-Padilla R, et al. Effect of personal exposure to PM2.5 on respiratory health in a Mexican panel of patients with COPD[J]. Int J Environ Res Public Health, 2015, 12(9): 10635-47. DOI: 10.3390/ijerph120910635. |
| [2] | Zhao J, Bo L, Gong C, et al. Preliminary study to explore genePM2.5 interactive effects on respiratory system in traffic policemen[J]. Int J Occup Med Environ Health, 2015, 28(6): 971-83. DOI: 10.13075/ijomeh.1896.00370. |
| [3] | Rui W, Guan L, Zhang F, et al. PM2.5-induced oxidative stress increases adhesion molecules expression in human endothelial cells through the ERK/AKT/NF-κB-dependent pathway[J]. J Appl Toxicol, 2016, 36(1): 48-59. DOI: 10.1002/jat.3143. |
| [4] | Tao Y, Wen ZH, Song YQ, et al. Paeoniflorin attenuates hepatic ischemia/reperfusion injury via anti-oxidative, anti-inflammatory and anti-apoptotic pathways[J]. Exp Ther Med, 2016, 11(1): 263-8. DOI: 10.3892/etm.2015.2902. |
| [5] | Zhang TZ, Yang ZC, Yang SH, et al. Immunoregulatory effects of paeoniflorin exerts anti-asthmatic effects via modulation of the Th1/Th2 equilibrium[J]. Inflammation, 2015, 38(6): 2017-25. DOI: 10.1007/s10753-015-0182-5. |
| [6] | Chen J, Liu M, Li L L, et al. ASSA14-03-02 protective effects of paeoniflorin against myocardial fibrosis in isoprenaline-induced chronic heart failure rats[C]. Scientific Sessions of Asia Pacific Heart Association & Chinese Cardiologists' Congress. 2015: 465-70. |
| [7] | Yu J, Zhu XY, Qi X, et al. Paeoniflorin protects human EA.hy926 endothelial cells against gamma-radiation induced oxidative injury by activating the NF-E2-related factor 2/heme oxygenase-1 pathway[J]. Toxicol Lett, 2013, 218(3): 224-34. DOI: 10.1016/j.toxlet.2013.01.028. |
| [8] | Zhang LJ, Yang B, Yu BP. Paeonillorin protects against nonalcoholic fatty liver disease induced by a high-fat diet in mice[J]. Biol Pharm Bull, 2015, 38(7): 1005-11. DOI: 10.1248/bpb.b14-00892. |
| [9] | 王慧, 热娜·卡斯木, 王晓梅, 等. 新疆赤芍抗血小板聚集作用及其不同组分分析[J]. 中国药学杂志, 2014, 49(13): 1109-12. |
| [10] | Qian GQ, Ding JJ, Zhang XZ, et al. Preconditioning with glycyrrhizic, ferulic, paeoniflorin, cinnamic prevents rat hearts from ischemia/reperfusion injury via endothelial nitric oxide pathway[J]. Pharmacogn Mag, 2015, 11(42): 292-6. DOI: 10.4103/0973-1296.153081. |
| [11] | 祁王忠, 段韶军. 芍药苷对肺腺癌细胞A549凋亡的诱导作用[J]. 中国药房, 2015, 22: 3103-5. DOI: 10.6039/j.issn.1001-0408.2015.22.24. |
| [12] | 吴晓芳, 韩晶, 易建华. 芍药苷对心肺细胞的保护作用及机制研究进展[J]. 医学综述, 2015, 21(24): 4531-3. DOI: 10.3969/j.issn.1006-2084.2015.24.040. |
| [13] | Yan Z, Wang J, Li J, et al. Oxidative stress and endocytosis are involved in upregulation of interleukin-8 expression in airway cells exposed to PM2.5[J]. Environ Toxicol, 2015. |
| [14] | Liu T, Wu B, Wang Y, et al. Particulate matter 2.5 induces autophagy via inhibition of the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin kinase signaling pathway in human bronchial epithelial cells[J]. Mol Med Rep, 2015, 12(2): 1914-22. DOI: 10.3892/mmr.2015.3577. |
| [15] | Longhin E, Holme J, Gutzkow KB, et al. Cell cycle alterations induced by urban PM 2.5 in bronchial epithelial cells:characterization of the process and possible mechanisms involved[J]. Fibre Toxicol, 2013, 10: 63. DOI: 10.1186/1743-8977-10-63. |
| [16] | Huang Q, Zhang J, Peng S, et al. Effects of water soluble PM2.5 extracts exposure on human lung epithelial cells (A549):A proteomic study[J]. J Appl Toxicol, 2014, 34(6): 675-87. DOI: 10.1002/jat.v34.6. |
| [17] | Deng X, Zhang F, Rui W, et al. PM2.5-induced oxidative stress triggers autophagy in human lung epithelial A549 cells[J]. Toxicolin Vitro, 2013, 27(6): 1762-70. DOI: 10.1016/j.tiv.2013.05.004. |
| [18] | Filomeni G, De Zio D, Cecconi F. Oxidative stress and autophagy:the clash between damage and metabolic needs[J]. Cell Death Differ, 2015, 22(3, SI): 377-88. DOI: 10.1038/cdd.2014.150. |
| [19] | Hancock RD. Oxidative Stress[J]. Encycl Appl Plant Sci, 2017: 27-35. |
| [20] | Vandemoortele A, Babat P, Yakubu M, et al. Reactivity of Free Malondialdehyde during in vitro simulated gastrointestinal digestion[J]. J Agric Food Chem, 2017, 65(10): 2198-204. DOI: 10.1021/acs.jafc.7b00053. |
| [21] | 宋少练. 芍药苷对晚期氧化蛋白产物诱导人脐静脉内皮细胞氧化应激损伤的干预作用[D]. 广州: 南方医科大学, 2015. |
| [22] | Li P, Li Z. Neuroprotective effect of paeoniflorin on H2O2-induced apoptosis in PC12 cells by modulation of reactive oxygen species and the inflammatory response[J]. ExpTher Med, 2015, 9(5): 1768. |
| [23] | Yan Z, Wang J, Li J, et al. Oxidative stress and endocytosis are involved in upregulation of interleukin-8 expression in airway cells exposed to PM2.5[J]. Environ Toxicol, 2016(12): 1869-78. |
| [24] | He L, Yang X, Xu K, et al. A mitochondria-targeted fluorescent probe for imaging endogenous malondialdehyde in HeLa cells and onion tissues[J]. Chem Commun (Camb), 2017, 53(29): 4080-3. DOI: 10.1039/C7CC00512A. |
| [25] | Dong H, Li R, Yu C, et al. Paeoniflorin inhibition of 6-hydroxydopamine-induced apoptosis in PC12 cells via suppressing reactive oxygen species-mediated PKCδ/NF-κBpathway[J]. Neuroscience, 2015, 285: 70-80. DOI: 10.1016/j.neuroscience.2014.11.008. |
 2018, Vol. 38
2018, Vol. 38

