胃癌是世界上发病率第2的恶性肿瘤,是癌症死亡的第3大常见原因,严重威胁人类健康。目前胃癌的治疗主要包括手术及化疗,其中化疗副作用带来的患者生活质量下降及依从性差仍是亟待改善的问题。近年来有很多专家学者探索胃癌化疗的优化方案,其中就包括了新型纳米材料的研发,从而实现低毒、高效的化疗方案。
纳米级别的材料设计和使用在解决肿瘤化疗问题上受到越来越多的关注,其中就包括药物递送[1]。纳米材料在药物递送中的作用主要是通过对药物的包裹,减少药物在递送过程中的损失及造成的副作用,实现靶向给药[2]。因此纳米材料是解决目前化疗难题的可行措施。
纳米药物载体通常由天然或合成高分子材料制成,丝胶蛋白(Sericin)作为从天然蚕丝中提取的一种高分子材料,具有价格低廉、生物相容性好和安全的优势,已有少数研究将丝胶蛋白作为合成纳米载体的重要组成部分[3]。但目前丝胶蛋白在医学上的应用主要在组织工程支架等领域,在化疗领域涉及较少,且多作为搭载化疗药的纳米载体的组成成分,而这些研究中对丝胶蛋白本身是否具备抗肿瘤效应没有延伸探索。此外,丝胶蛋白在动物中已被验证对皮肤肿瘤和结肠肿瘤有一定影响[4-6],但其机制尚未阐明。因此,本研究旨在探索丝胶蛋白对MKN45胃癌细胞活力的影响及相关机制。
1 材料和方法 1.1 材料NKN-45胃癌细胞购自中科院上海细胞库;DMEM高糖培养基、胎牛血清、胰蛋白酶购自HyClone;CCK8细胞增殖检测试剂盒购自上海碧云天公司;LC3双荧光自噬病毒、凋亡、周期试剂盒购自上海吉凯公司;丝胶蛋白购自上海步克医药科技公司;LC3、p62、Beclin、GAPDH单克隆抗体购自美国CST公司。
1.2 方法 1.2.1 细胞培养与转染常规复苏MKN45细胞,用含10%胎牛血清的DMEM培养基,置于37 ℃、含5% CO2培养箱中培养。当细胞处于对数生长期时接种于6孔板,接种密度控制为4×105/孔左右,24 h后按照病毒转染试剂说明书转染LC3双荧光自噬病毒,用嘌呤霉素筛选LC3双荧光自噬病毒的MKN45稳转株。实验分为3组,即空白对照组(Blank)、丝胶蛋白阳性组(Sericin)、丝胶蛋白加自噬抑制剂组(Sericin+3-MA)。
1.2.2 检测丝胶蛋白体内外抗肿瘤效应收集细胞接种于96孔板,接种密度约为1000/孔,培养体系为100 μL,继续常规培养24 h后,加入不同浓度丝胶蛋白,在48 h培养时间点,加入10 μL CCK8试剂,培养箱孵育2 h后,450 nm波长下测定吸光度(A),表示细胞的增殖能力,绘制细胞生长曲线。将种植胃癌的裸鼠分为2组,即对照组(Saline)、丝胶蛋白阳性组(Sericin);每组5只,在对照组注射生理盐水(Saline),丝胶蛋白组注射丝胶蛋白,分别在注射后第7、9、11、13、15天测量肿瘤体积和质量,绘制肿瘤生长曲线。
1.2.3 CCK-8实验检测细胞增殖活性收集细胞接种于96孔板,接种密度约为1000/孔,培养体系为100 μL,继续常规培养24 h后,Sericin组加入500、600、700 µg/mL 3种浓度丝胶蛋白,Sericin+3-MA组在Sericin组基础上加入自噬抑制剂3-MA,在48 h培养时间点,加入10 μL CCK8试剂,培养箱孵育2 h后,450 nm波长下测定吸光度,表示细胞的增殖能力,绘制细胞存活率对比图。
1.2.4 流式法检测细胞凋亡情况按照方法1.2.2对细胞进行处理。48 h后采集细胞,根据凋亡试剂盒说明书处理细胞,流式细胞仪上机检测各组凋亡细胞比例。
1.2.5 流式法检测细胞周期情况按照方法1.2.2对细胞进行处理。48 h后采集细胞,根据凋亡试剂盒说明书处理细胞,流式细胞仪上机检测各组周期细胞比例。
1.2.6 荧光显微镜检测细胞自噬情况按照方法1.2.2对筛选过的自噬病毒稳转细胞株进行处理。48 h在荧光倒置显微镜下,用560 nm、480 nm波长激发下分别观察细胞红、绿荧光表达情况。
1.2.7 透射电镜检测细胞自噬情况按照方法1.2.2对细胞进行处理。48 h后采集细胞,沿壁缓慢加入电镜固定液(1.5%~2.5%中性戊二醛)。4 ℃下固定15 min,树脂包埋、切片,最后用透射电镜(HITACHI HT7700,日本)观察细胞形态。
1.2.8 Western blotting检测细胞自噬蛋白表达情况按照方法1.2.2对细胞进行处理,48 h后收集细胞。使用细胞裂解液提取新鲜冰冻组织或者细胞的总蛋白,用BCA法测定蛋白浓度,调整每孔上样量为20 µg,经10% SDS-PAGE凝胶电泳后,凝胶蛋白转移至硝酸纤维素膜。5%脱脂牛奶封闭后,以LC3一抗(1:1 500),GAPDH一抗(1:3 000),p62(1:1 000),Beclin(1:1 000)一抗置4 ℃冰箱孵育过夜。次日,PBST洗涤3次后,以兔二抗(1:5 000)常温孵育1 h。PBST洗涤3次,ECL化学发光法显像并保存图像。
1.2.9 统计学方法采用SPSS 20.0统计软件进行数据分析。实验数据以均数±标准差表示,两组数据比较,正态分布则用t检验,非正态分布则采用Mann-Whitney U检验。以P<0.05为差异有统计学意义。
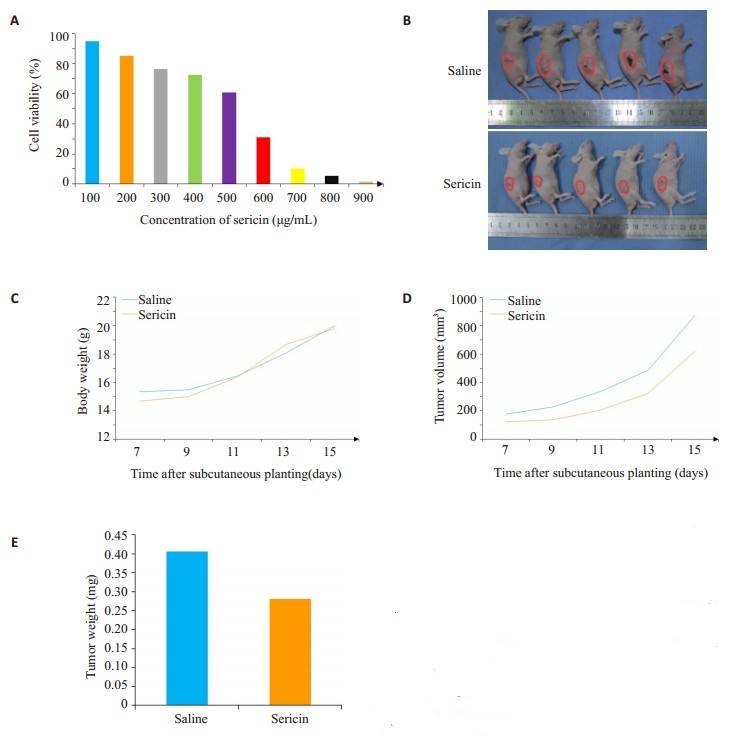
2 结果 2.1 丝胶蛋白抑制MKN45胃癌细胞的增殖选用不同浓度的丝胶蛋白与MKN45胃癌细胞共孵育48 h后,CCK8实验显示,随着丝胶蛋白浓度的提高,MKN45胃癌细胞存活率明显下降(图 1A),说明丝胶蛋白在体外可抑制胃癌细胞的的增殖能力。从数据中计算出半数抑制浓度IC50为543 µg/mL。裸鼠肿瘤体积和质量测量显示,随着时间延长,肿瘤大小逐渐增加,与对照组相比,丝胶蛋白组肿瘤体积及质量均明细减少(图 1B、D),说明丝胶蛋白在裸鼠体内有抗肿瘤效应;而两组间的裸鼠体重增长没有统计学差异,说明丝胶蛋白组的良好生物安全性(图 1C)。
|
图 1 A、丝胶蛋白共孵育后MKN45胃癌细胞的细胞存活率;B、丝胶蛋白组与对照组裸鼠体内肿瘤大小;C、丝胶蛋白组与对照组裸鼠体重;D、丝胶蛋白组与对照组裸鼠肿瘤体积;E、丝胶蛋白组与对照组裸鼠肿瘤质量 Figure 1 Effect of sericin on viability of gastric cancer MKN45 cells (A) and growth of MKN45 cell xenograft in nude mice. A: Viability of MKN45 gastric cancer cells; B: Tumor size in nude mice in sericin group and saline group; C: Body weight of nude mice in sericin group and saline group; D: Tumor volume in nude mice in sericin group and saline group; E: Tumor weight in nude mice in sericin group and saline group. |
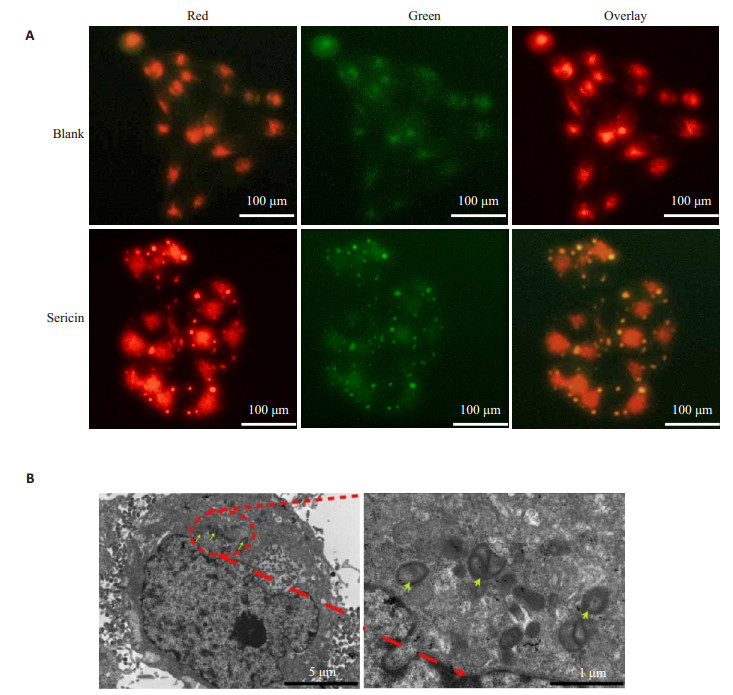
荧光倒置显微镜和透射电镜观察(图 2)显示,与空白对照组相比,丝胶蛋白组可引起胃癌细胞自噬体明显增加。
|
图 2 A、丝胶蛋白共孵育后MKN45胃癌细胞LC3荧光图;B、丝胶蛋白共孵育后MKN45胃癌细胞透射电镜图 Figure 2 LC-3 fluorescence microscopy (A) and transmission electron microscopy (B) of MKN45 cells after incubation with sericin. |
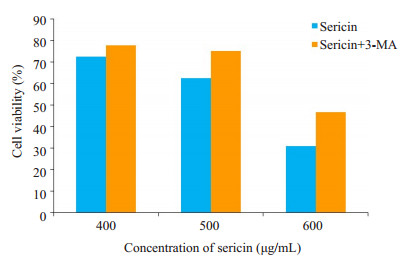
选用500、600、700 µg/mL 3种浓度的丝胶蛋白与MKN45胃癌细胞共孵育48 h,选用500、600、700 µg/mL 3种浓度的丝胶蛋白分别加入3-MA与MKN45胃癌细胞共孵育48 h,CCK8实验(图 3)显示,Sericin+3-MA组胃癌细胞存活率较Sericin组均明显增加(t值分别为2.788,6.595,8.227),说明3-MA可逆转丝胶蛋白抑制MKN45胃癌细胞增殖的效应。
|
图 3 Sericin组和Sericin+3-MA组MKN45胃癌细胞的细胞存活率 Figure 3 Cell viability of MKN45 cells in sericin group and sericin+3-MA group. |
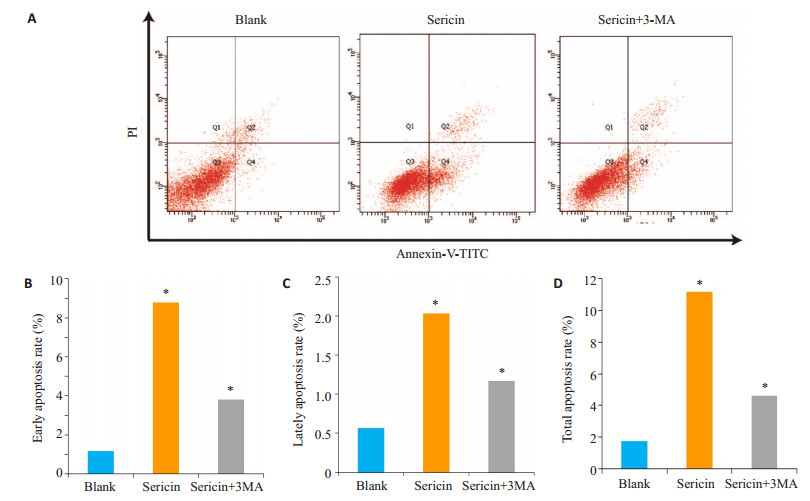
选用IC50浓度的丝胶蛋白与MKN45胃癌细胞共孵育48 h后行流式学分析。该实验提示:丝胶蛋白可抑制胃癌细胞的抗凋亡能力,其早期凋亡(P=0.0068)、晚期凋亡(P=0.0066)与总凋亡P=0.0005)细胞数量较对照组,均有显著增加(图 4)。而Sericin+3-MA组较Sericin组早期凋亡(P=0.0173)、晚期凋亡(P=0.0339)与总凋亡P=0.0039)均有显著降低。
|
图 4 丝胶蛋白共孵育后MKN45胃癌细胞的凋亡百分比的变化 Figure 4 Changes in apoptosis rate of MKN45 cells after incubation with sericin. A: Flow cytometry of the cells in 3 groups; B: Early apoptosis rate; C: Late apoptosis rate; D: Total apoptosis rate. *P < 0.05 vs blank. |
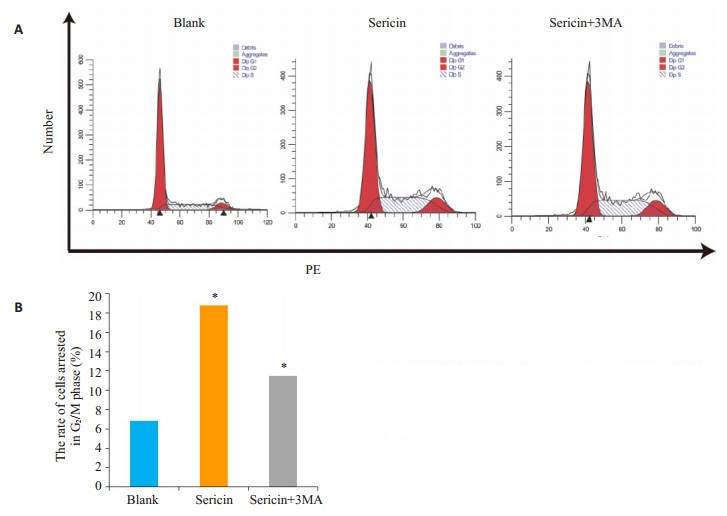
选用IC50浓度的丝胶蛋白与MKN45胃癌细胞共孵育48 h后行流式学分析。该实验显示:与空白对照组相比,丝胶蛋白组G2/M期细胞数量有显著增加(P=0.001,图 5)。而Sericin+3-MA组较Sericin组G2/M期细胞数量有显著降低(P=0.0059,图 5)。
|
图 5 丝胶蛋白共孵育后MKN45胃癌细胞的周期变化 Figure 5 Changes in cell cycle of MKN45 cells after incubation with sericin. A: Flow cytometry in 3 groups; B: Rate of cells arrested at G2/M phase. *P < 0.05 vs blank. |
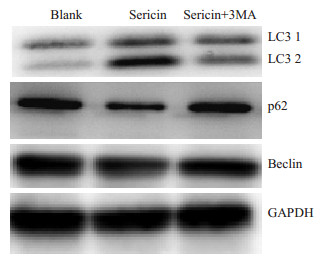
与空白对照组相比,丝胶蛋白组可见LC3-2表达上调,p62表达逐渐下调,Beclin表达增加(图 6),而Sericin+3-MA组蛋白表达介于两组之间。提示丝胶蛋白诱导胃癌细胞发生自噬。
|
图 6 丝胶蛋白共孵育后MKN45胃癌细胞的自噬相关蛋白(LC3、p62、Beclin)的变化 Figure 6 Changes of autophagy-related proteins (LC3, p62, and Beclin) in MKN45 cells after incubation with sericin. |
丝胶蛋白在体外实验中除了表现出抗氧化活性[7]、抑制脂质过氧化和酪氨酸酶活性[8],而且在动物中已被验证对皮肤肿瘤和结肠肿瘤有一定影响[4-6],关于丝胶蛋白在这个过程中的作用机制仍阐述不够清晰。因此,本研究探索了丝胶蛋白对MKN45胃癌细胞活力的影响及相关机制。
常见的化学预防作用可归因于几种机制,如抑制癌细胞增殖、诱导细胞凋亡和调控癌细胞周期。在本研究中,随着丝胶蛋白浓度增加,MKN45胃癌细胞的存活率明显下降,表明丝胶蛋白在一定程度上可以抑制胃癌细胞增殖;在裸鼠实验中也证实了丝胶蛋白在体内具有抑制肿瘤生长的效应。而在丝胶蛋白作为纳米载体成分的研究中,由于浓度较低,载体并没有表现出抗肿瘤效应[9],这与本研究中丝胶蛋白低浓度时没有抑制细胞增殖活性的结果一致,因此丝胶蛋白抑制肿瘤细胞增殖的产生有浓度依赖效应。
凋亡是胃癌化疗的重要作用过程[10-11],从后续实验结果中可以看到,丝胶蛋白处理组胃癌细胞无论早期凋亡还是晚期凋亡比例均有显著增加,早期细胞凋亡的特征是细胞膜的变化,通常位于细胞膜内的磷脂酰丝氨酸移动到外表面,线粒体膜电位下降;晚期凋亡涉及核染色质的碎裂。凋亡的阶段取决于不同的凋亡刺激以及抗凋亡和促凋亡蛋白的功能[12-14]。因此,丝胶蛋白可能对一些与胃癌细胞凋亡相关的未鉴定的蛋白质有影响。不仅如此,丝胶蛋白也表现阻滞细胞周期的特性。细胞周期是涉及细胞增殖的复杂过程。细胞周期正常模式的缺陷可能导致过度增殖,最终导致癌细胞的形成[15]。在胃癌有关研究中,将细胞周期阻滞于G2/M期是重要的化学预防靶点[16-17]。本研究中丝胶蛋白处理组胃癌细胞阻滞于G2/M期比例明显多于空白对照组,即丝胶蛋白可以通过阻滞胃癌细胞周期抑制细胞增殖。而临床上阿糖胞苷、氟尿嘧啶等抗肿瘤药物杀灭癌细胞的机制也与阻滞细胞增殖周期有关[18-19],因此丝胶蛋白具备与传统临床药物类似的生物学抗癌细胞增殖周期特点。
细胞自噬是真核生物中高度保守的依赖于溶酶体的分解代谢途径,与多种生理和病理过程密切相关,在肿瘤的发生发展中起重要作用[20],如在饥饿诱导的肿瘤细胞自噬研究中,自噬可以将肿瘤细胞阻滞于G2/M期[21]。因此许多研究将自噬作为肿瘤治疗的关键环节[22]。肿瘤周围微环境中的自噬有促进肿瘤生长的作用[23],而肿瘤细胞自身的自噬对肿瘤发展的作用仍存在争议。纳米材料如钽纳米颗粒[24]、槲皮素纳米颗粒[25]以及二氧化硅纳米粒子[26]已被证实有诱导细胞自噬的作用,我们推测丝胶蛋白可能通过诱导胃癌细胞自噬,实现对胃癌细胞增殖的抑制作用。本研究采用GFP-LC3荧光体系示踪,在倒置荧光显微镜下可观察到绿色斑点即为自噬体;为进一步验证,在透射电镜下可以观察到丝胶蛋白处理组细胞中可见双层膜包裹小部分细胞质的结构,此为自噬小体,这初步表明丝胶蛋白有诱导胃癌细胞自噬的作用。3-甲基腺嘌呤(3-MA)是实验研究中常用的自噬抑制剂[27-28],本研究设置Sericin+3-MA组进一步验证丝胶蛋白是否对自噬有调控作用,与丝胶蛋白组相比,Sericin+3-MA组细胞存活率明显上升,且凋亡比例和周期阻滞比例也明显下降,证明3-MA对丝胶蛋白抑制胃癌细胞增殖呈相反作用,即丝胶蛋白抑制胃癌细胞增殖的作用机制与自噬有关。接下来用Western blotting检测自噬相关蛋白LC3-2、p62蛋白及自噬基因表达蛋白Beclin蛋白,结果可见丝胶蛋白组LC3-2表达上调,p62表达逐渐下调,Beclin表达增加,符合自噬增多的表现;且Sericin+3-MA组自噬蛋白表达有所下降。因此,丝胶蛋白可能通过诱导MKN45胃癌细胞自噬抑制细胞增殖。目前本研究局限性在于未能进一步阐明丝胶蛋白对胃癌细胞自噬的调节机制,PI3K/AKT/mTOR信号通路为抑制肿瘤自噬的常见信号通路[29-30],我们推测丝胶蛋白可能通过阻断此通路从而增加肿瘤细胞自噬,因此本课题组将在丝胶蛋白诱导肿瘤细胞自噬作用机制方面开展进一步工作。
| [1] | Pelaz B, Alexiou C, Alvarez-Puebla RA, et al. Diverse applications of nanomedicine[J]. ACS Nano, 2017, 11(3): 2313-81. DOI: 10.1021/acsnano.6b06040. |
| [2] | Gabizon A, Bradbury M, Prabhakar U, et al. Cancer nanomedicines: closing the translational gap[J]. Lancet, 2014, 384(9961): 2175-6. DOI: 10.1016/S0140-6736(14)61457-4. |
| [3] | Hu DD, Xu ZP, Hu ZY, et al. pH-Triggered Charge-Reversal silk Sericin-Based nanoparticles for enhanced cellular uptake and doxorubicin delivery[J]. ACS Sustain Chem Eng, 2017, 5(2): 1638-47. DOI: 10.1021/acssuschemeng.6b02392. |
| [4] | Zhaorigetu S, Yanaka N, Sasaki M, et al. Silk protein, sericin, suppresses DMBA-TPA-induced mouse skin tumorigenesis by reducing oxidative stress, inflammatory responses and endogenous tumor promoter TNF-alpha[J]. Oncol Rep, 2003, 10(3): 537-43. |
| [5] | Sasaki M, Kato N, Watanabe H, et al. Silk protein, sericin, suppresses colon carcinogenesis induced by 1, 2-dimethylhydrazine in mice[J]. Oncol Rep, 2000, 7(5): 1049-52. |
| [6] | Zhaorigetu S, Sasaki M, Kato N. Consumption of sericin suppresses colon oxidative stress and aberrant crypt foci in 1, 2-dimethylhydrazine-treated rats by colon undigested sericin[J]. J Nutr Sci Vitaminol (Tokyo), 2007, 53(3): 297-300. DOI: 10.3177/jnsv.53.297. |
| [7] | Dash R, Acharya C, Bindu PC, et al. Antioxidant potential of silk protein sericin against Hydrogen peroxide-induced oxidative stress in skin fibroblasts[J]. BMB Rep, 2008, 41(3): 236-41. DOI: 10.5483/BMBRep.2008.41.3.236. |
| [8] | Chlapanidas T, Farago S, Lucconi GA, et al. Sericins exhibit ROSscavenging, anti-tyrosinase, anti-elastase, and in vitro immunomodulatory activities[J]. Int J Biol Macromol, 2013, 58: 47-56. DOI: 10.1016/j.ijbiomac.2013.03.054. |
| [9] | Huang L, Tao KX, Liu J, et al. Design and fabrication of multifunctional sericin nanoparticles for tumor targeting and pHResponsive subcellular delivery of cancer chemotherapy drugs[J]. ACS Appl Mater Interfaces, 2016, 8(10): 6577-85. DOI: 10.1021/acsami.5b11617. |
| [10] | Li C, Wang YH, Wang CH, et al. Anticancer activities of harmine by inducing a pro-death autophagy and apoptosis in human gastric cancer cells[J]. Phytomedicine, 2017, 28: 10-8. DOI: 10.1016/j.phymed.2017.02.008. |
| [11] | Badr EN, Abdel FS, Pan D, et al. Chemopreventive activity of MGN-3/biobran against chemical induction of glandular stomach carcinogenesis in rats and its apoptotic effect in gastric cancer cells[J]. Integr Cancer Ther, 2016, 15(4): P26-34. DOI: 10.1177/1534735416642287. |
| [12] | Indran IR, Tufo G, Pervaiz S, et al. Recent advances in apoptosis, mitochondria and drug resistance in cancer cells[J]. BiochimBiophysActa, 2011, 1807(6): 735-45. |
| [13] | Kelly RJ, Lopez-Chavez A, Citrin D, et al. Impacting tumor cellfate by targeting the inhibitor of apoptosis protein survivin[J]. Mol Cancer, 2011, 10: 35. DOI: 10.1186/1476-4598-10-35. |
| [14] | Ascenzi P, Polticelli F, Marino M, et al. Cardiolipin drives cytochrome c proapoptotic and antiapoptotic actions[J]. IUBMB Life, 2011, 63(3, SI): 160-5. DOI: 10.1002/iub.v63.3. |
| [15] | 南祯, 梁勇, 付蓉, 等. MicroRNA-233在淋巴细胞白血病原代细胞中表达及作用机制的研究[J]. 中国实验血液学杂志, 2013, 21(3): 556-61. |
| [16] | Ling H, Lu LF, He J, et al. Diallyl disulfide selectively causes checkpoint kinase-1 mediated G2/M arrest in human MGC803 gastric cancer cell line[J]. Oncol Rep, 2014, 32(5): 2274-82. DOI: 10.3892/or.2014.3417. |
| [17] | Gao SY, Li J, Qu XY, et al. Downregulation of Cdk1 and cyclinB1 expression contributes to oridonin-induced cell cycle arrest at G2/M phase and growth inhibition in SGC-7901 gastric cancer cells[J]. Asian Pac J Cancer Prev, 2014, 15(15): 6437-41. DOI: 10.7314/APJCP.2014.15.15.6437. |
| [18] | Huehls AM, Huntoon CJ, Joshi PM, et al. Genomically incorporated 5-Fluorouracil that escapes UNG-Initiated base excision repair blocks DNA replication and activates homologous recombination[J]. Mol Pharmacol, 2016, 89(1): 53-62. |
| [19] | Karnitz LM, Flatten KS, Wagner JM, et al. Gemcitabine-induced activation of checkpoint signaling pathways that affect tumor cell survival[J]. Mol Pharmacol, 2005, 68(6): 1636-44. |
| [20] | 李晓婷, 张晓鹏. 细胞自噬在肿瘤发生、转移与治疗中的作用[J]. 当代医学, 2011, 17(9): 13-4. |
| [21] | 葛军娜, 黄丹, 肖田, 等. 饥饿诱导肿瘤细胞自噬对细胞周期的影响[J]. 癌症, 2008, 27(8): 788-94. |
| [22] | O'Donovan TR, Rajendran S, O'Reilly S, et al. Lithium modulates autophagy in esophageal and colorectal cancer cells and enhances the efficacy of therapeutic agents in vitro and in vivo[J]. PLoS One, 2015, 10(8): e134676. |
| [23] | Katheder NS, Khezri R, O'farrell F, et al. Microenvironmental autophagy promotes tumour growth[J]. Nature, 2017, 541(7637): 417-20. DOI: 10.1038/nature20815. |
| [24] | Kang CR, Wei LM, Song B, et al. Involvement of autophagy in Tantalum nanoparticle-induced osteoblast proliferation[J]. Int J Nanomedicine, 2017, 12: 4323-33. DOI: 10.2147/IJN. |
| [25] | Lou M, Zhang LN, Jia PG, et al. Quercetin nanoparticles induced autophagy and apoptosis through AKT/ERK/Caspase-3 signaling pathway in human neuroglioma cells: In vitro and in vivo[J]. Biomed Pharmacother, 2016, 84: 1-9. DOI: 10.1016/j.biopha.2016.08.055. |
| [26] | Yu Y, Duan J, Yu Y, et al. Silica nanoparticles induce autophagy and autophagic cell death in HepG2 cells triggered by reactive Oxygen species[J]. J Hazard Mater, 2014, 270: 176-86. DOI: 10.1016/j.jhazmat.2014.01.028. |
| [27] | Wu YY, Wang X, Guo HJ, et al. Synthesis and screening of 3-MA derivatives for autophagy inhibitors[J]. Autophagy, 2013, 9(4): 595-603. DOI: 10.4161/auto.23641. |
| [28] | Coker-Gurkan A, Arisan ED, Obakan P, et al. Inhibition of autophagy by 3-MA potentiates purvalanol-induced apoptosis in Bax deficient HCT 116 colon cancer cells[J]. Exp Cell Res, 2014, 328(1): 87-98. DOI: 10.1016/j.yexcr.2014.07.022. |
| [29] | Wu Y, Li Y, Zhang H, et al. Autophagy and mTORC1 regulate the stochastic phase of somatic cell reprogramming[J]. Nat Cell Biol, 2015, 17(6): 715-25. DOI: 10.1038/ncb3172. |
| [30] | Paquette M, El-Houjeiri L, Pause A. mTOR Pathways in Cancer and Autophagy[J]. Cancers (Basel), 2018, 10(1): E18. DOI: 10.3390/cancers10010018. |
 2018, Vol. 38
2018, Vol. 38

