2. 福建医科大学附属第一医院 干部病房//福建省高血压研究所,福建 福州 350004
2. VIP Department, First Affiliated Hospital of Fujian Medical University/Fujian Hypertension Research Institute, Fuzhou 350004, China
根据2007年我国心肌病诊断与治疗建议[1],扩张型心肌病(DCM)是一类既有遗传又有非遗传因素造成的复合型心肌病,以左室扩大或左右双心室扩大,伴有心肌收缩和(或)舒张功能减退,伴或不伴充血性心衰为特征。传统观点认为,这部分病人按照标准抗心衰治疗,病情常反复发作,随着慢性心衰的进展,渐发展到终末期难治性心衰阶段,最终需要心脏移植。
近年来,国内外越来越多的研究发现,经过有效的治疗,部分原发性和继发性DCM患者心脏结构和功能可以发生逆转[2-4],有学者将其称为左心室逆重构(LVRR)[5],但各中心报道的LVRR发生率差别较大,究其原因,在原发性DCM中混杂入继发性DCM、继发性DCM病因不明或病因干预不彻底、LVRR评价标准差别都是导致LVRR的发生率差别较大的主要原因。因此,本研究设计严格的纳入、排除标准和LVRR评价标准,以将原发性和继发性DCM区别分析,并探讨其出现心脏结构和功能逆转的预测因素,为今后难治性心衰及DCM的治疗提供新思路。
1 资料和方法 1.1 研究对象收集福建医科大学附属第一医院,时间:2012年1月~2016年6月,462例诊断为DCM的患者。
1.2 原发性DCM纳入标准(1)符合2007年我国心肌病诊断与治疗建议DCM诊断标准:(a)心脏扩大:LVEDD > 5.0 cm(女性)和 > 5.5 cm(男性);(b)LVEF < 45%。(2)患者随访期间复查相关血液学指标及超声心动图。排除标准:(1)继发性DCM如缺血性心肌病、高血压性心脏病、感染/免疫性DCM、中毒性DCM、围产期心肌病等。(2)慢性肾脏病,肾小球滤过率≤60%。(3)患者失访及全因死亡。
1.3 继发性DCM纳入标准(1)符合2007年我国心肌病诊断与治疗建议DCM诊断标准:(a)心脏扩大:LVEDD > 5.0 cm(女性)和 > 5.5 cm(男性);(b)LVEF < 45%。(2)患者随访期间复查相关血液学指标及超声心动图。(3)病因明确:(a)缺血性心肌病:均行静息/复合门控心肌灌注显像,符合缺血性心肌病表现,若行经皮冠状动脉介入治疗(PCI),术后所有病变血管心肌梗死溶栓治疗血流3级,若合并快速型心律失常,排除心房颤动或心房扑动,均行动态心电图,早搏负荷≤10%。(b)心动过速型心肌病:有多次的常规心电图或动态心电图证实心律失常反复发作,均行射频消融治疗,并排除冠心病、高血压、糖尿病。(c)肥胖性心肌病:体质量指数≥32且病史≥10年。(d)酒精性心肌病:大量饮酒史(乙醇量≥125 mL/d,病史≥10年)。(4)若合并高血压、糖尿病,病史应≤5年。排除标准:(1)慢性肾脏病,肾小球滤过率≤60%。(2)患者失访及全因死亡。(3)可伴发DCM的自身免疫性疾病、代谢内分泌疾病和遗传性疾病。
1.4 研究方法收集患者首次入院(基线)和随访期间资料,主要包括:(1)一般情况:年龄、性别、吸烟史、饮酒史、身高、体质量、心肌病家族史;(2)临床特点:症状、体征、血压、心率、纽约心脏协会心功能分级(NYHA分级);(3)辅助检查:血常规、临床生化、超声心动图中左心室舒张末期直径(LVEDD)及左室射血分数(LVEF)、N末端-B型脑钠肽原(NT-proBNP)、肌钙蛋白Ⅰ(TNI);(4)随访期间平均运动耐量(MET)及用药情况;(5)病因干预为PCI、射频消融、生活行为习惯干预;(6)根据是否发生LVRR分为LVRR组和未LVRR组。
1.5 评价LVRR标准LVEF提高≥100%,或LVEF≥45%,且LVEDD降低≥10 mm,或LVEDD≤55 mm(男性)和≤50 mm(女性)。
1.6 统计学方法数据采用SPSS 19.0软件进行分析处理。计量资料以均数±标准差表示,组间差异性比较采用独立样本t 检验,组内差异性比较采用配对t检验;计数资料以例数或百分率表示,组间比较采用χ2检验。心脏结构和功能发生逆转的预测因素分析采用多变量Logistic回归分析。P < 0.05为差异有统计学意义。
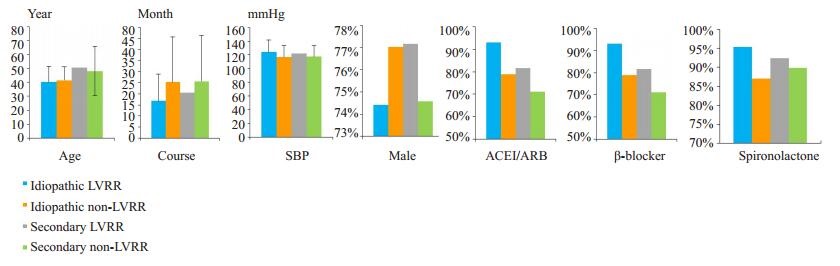
2 结果 2.1 基线资料研究纳入252例原发性DCM和210例继发性DCM患者,在原发性DCM中,男性193例(76.6%),年龄(44.11±15.60)岁,心衰病史(23.80±19.53)月,NYHA心功能Ⅰ、Ⅱ、Ⅲ、Ⅳ级患者分别占7.54%、25.79%、40.48%、26.19%。基线收缩压(118.24±16.92)mmHg。出院时服用血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂、螺内酯的患者分别有81.35%、77.78%、88.49%。在继发性DCM中,男性159例(75.71%),年龄(49.27±18.76)岁,心衰病史(23.49±19.34)月,NYHA心功能Ⅰ、Ⅱ、Ⅲ、Ⅳ级患者分别占9.52%、21.90%、37.62%、30.95%。基线收缩压(119±20.75)mmHg,出院时服用ACEI或ARB、β受体阻滞剂、螺内酯的患者分别有75.71%、74.76%、90.95%(表 1、表 2和图 1)。
| 表 1 原发性扩张型心肌病患者临床资料比较结果 Table 1 Comparison of clinical data in idiopathic DCM |
| 表 2 继发性扩张型心肌病患者临床资料比较结果 Table 2 Comparison of clinical data in Secondary DCM |
|
图 1 原发性和继发性DCM患者的基线资料情况 Figure 1 Baseline data in patients with idiopathic and secondary DCM. |
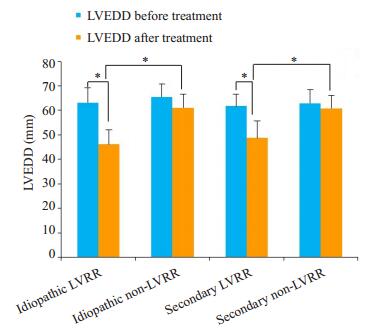
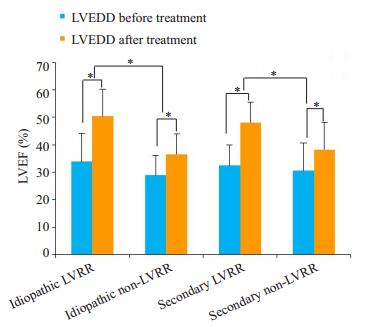
随访时间为(24.13±15.60)月,有17.06%的原发性DCM患者心脏结构和功能发生逆转,LVEF由(33.80± 10.37)%增加至(50.41 ± 9.88)%(P < 0.01),LVEDD由(63.22 ± 6.01)mm降低至(46.18 ± 5.90)mm(P < 0.01)。有43.81%的原发性DCM患者心脏结构和功能发生逆转,LVEF由(32.38 ± 7.47)%增加至(48.13 ± 7.36)%(P < 0.01),LVEDD由(61.77±4.85)mm降低至(48.73± 6.89)mm(P < 0.01)(表 1、表 2和图 2、图 3)。
|
图 2 原发性和继发性DCM患者治疗前后LVEDD的比较结果 Figure 2 Comparison of LVEDD before and after treatment in patients with idiopathic and secondary DCM. *P < 0.01, LVEDD: Left ventricular end diastolic dimension; LVRR: Left ventricular reverse remodeling. |
|
图 3 原发性和继发性DCM患者治疗前后LVEF的比较结果 Figure 3 Comparison of LVEF before and after treatment in patients with idiopathic and secondary DCM. *P < 0.01, LVEF: left ventricular ejection fraction. |
多变量Logistic回归分析显示,对于原发性DCM患者,基线心衰病史短(OR=0.913,P < 0.01)、基线收缩压高(OR=1.062,P < 0.01)、无电解质紊乱比例高(OR= 0.347,P < 0.01)、RDW低(OR=0.205,P < 0.01)、LVEDD小(OR=0.799,P < 0.01)及LVEF(OR=1.142,P < 0.01)高是其发生LVRR的独立预测因素。对于继发性DCM患者,基线心衰病史短(OR=0.954,P < 0.01)、RDW低(OR=1.011,P < 0.01)、住院期间是否行病因干预(OR=1.073,P < 0.01)是其发生LVRR的独立预测因素(表 3、4)。
| 表 3 原发性DCM患者发生LVRR基线临床恢复指标的Logistic回归分析 Table 3 Logistic regression analysis of baseline clinical recovery indicators of LVRR patients occurred in patients with idiopathic DCM |
| 表 4 继发性DCM患者发生LVRR基线临床恢复指标的Logistic回归分析 Table 4 Logistic regression analysis of baseline clinical recovery indicators of LVRR patients occurred in patients with Secondary DCM |
传统认为DCM单纯药物治疗疗效一般,无法阻止病情的发展,心脏再同步化治疗、干细胞移植术、心脏移植等新手段治疗则可以延长部分患者的预期寿命[6-8]。回顾近年国内外DCM及心力衰竭指南[9-10],强调去除病因和加强随访管理(如药物、生活行为习惯干预、心脏康复)对于患者预后的重要性,并且关注药物治疗可以减缓或逆转心室重构。目前证据确凿的药物有ACEI、ARB、β受体阻滞剂、螺内酯,因此在重视和肯定药物治疗和新手段治疗DCM的同时,我们也需积极探寻病因干预及心脏康复训练对DCM患者心脏结构和功能的影响。既往已有国内外多中心报道,经标准抗心衰药物治疗,约26%~48%的DCM患者LVEF可改善,部分患者LVEF和LVEDD均恢复正常[2, 11]。但是,有些研究只关注了原发性DCM患者,或某一项病因的继发性DCM,对于原发性DCM与继发性DCM治疗的侧重点对比尚未有相关研究报道。
首先,本研究发现,随访中17.06%的原发性DCM患者经过标准抗心衰药物治疗发生LVRR,继发性DCM在标准抗心衰药物治疗的基础上进行病因干预,纳入人群中LVRR占43.33%,不仅心脏结构和功能发生逆转,运动耐量也显著改善。原发性DCM患者的LVRR发生率低于既往研究,继发性DCM患者发生率与既往研究大致相当,可能原因有:①本研究属于回顾性分析,前期收集临床资料时,就已严格按原发性和继发性分类,原发性DCM样本中合并高血压、糖尿病、快速型心律失常等导致心脏扩大的常见病因的患者数量较少,继发性DCM均详细分析临床资料探究其病因,对于病因不明的,从临床观察中发现其病因可能是多个因素共同作用的结果,评估是否对每个因素进行干预,并未简单认为是原发性DCM;②本研究排除了慢性肾脏病和全因死亡的患者,这部分患者常合并多种基础疾病,对结果会产生较大的偏移;③本研究定义了更为严格和符合临床实际的LVRR标准。既往已有文献报道,对于缺血性心肌病、心动过速型心肌病、肥胖性心肌病、酒精性心肌病等继发性DCM,针对性进行PCI、射频消融术、生活行为习惯干预后,部分患者的心脏结构和功能可以发生逆转[12-15]。本研究再次证实,住院期间行病因干预是继发性DCM患者发生LVRR的预测因素,但我们更需思考在行病因治疗后,心脏结构和功能未发生逆转的深层次原因。心力衰竭、心脏扩大是由多因素共同作用的结果,不是单纯进行某项干预就能彻底解除的,慢性心衰的患者,在某个病因的长期影响下,心脏结构出现了病理性变化,但此时心功能仍可以代偿,故临床症状不明显,始动病因很难被临床所发现。同时存在的或随之出现的其他心血管病危险因素,加重了心脏结构病理性变化,导致心脏功能的恶化,心衰进展,故而出现临床症状,临床上表现为难治性心力衰竭和DCM。这种多因素所致的心力衰竭和继发性DCM,始动病因占据主导作用,是引起心脏结构出现病理性变化的最初原因,但始动病因往往被加之而来的多种病因覆盖,因而被忽视,我们强调的是,继发性DCM的管理要重视发现和干预始动病因,兼顾多重病因。
其次,本研究肯定了既往大多数研究成果关于心衰病史、入院收缩压、QRS波宽度、基线LVEDD和LVEF水平、血清钠离子浓度、QT离散度等与LVEF和(或)LVEDD逆转有关[16-19],同时还发现RDW是原发性和继发性DCM患者发生LVRR的预测因素。RDW是检测外周血红细胞异质性的一项参数,临床除用于贫血的鉴别诊断外,还与肿瘤、炎症性肠病、肝脏疾病、营养代谢不良有关[20-23]。近十年来发现,RDW与心血管疾病相关,如急慢性心衰、冠状动脉疾病、心房纤颤、肺动脉高压,是部分心血管疾病发生及预后预测因素之一[24-28]。但是,目前对于RDW在DCM中的研究报道甚少。本研究中DCM中RDW升高的可能的机制有:①LVRR组合并严重心衰(NYHA≥Ⅲ级)的患者比例较未LVRR组多,急慢性心衰可通过多种机制激活肾素-血管紧张素-醛固酮系统及交感-肾上腺系统,导致血清中缩血管激素升高、肾脏缺血,间接促进肾脏分泌促红细胞生成素和骨髓造血,导致RDW升高。②未LVRR组的患者由于心脏长期扩大,冠脉供血不足,易导致冠状微循环缺血、冠脉血流储备降低的发生,故在低冠状动脉血流储备的患者中RDW常升高[29]。
再次,本研究发现,无论是原发性DCM还是继发性DCM,随访期间LVRR组的平均运动耐量均高于未LVRR组。国内外越来越多的指南关注到心脏康复对于心血管疾病预后的重要性[30]。运动耐量是反应心脏康复功能状态的评价指标,是目前已知的心血管疾病预后的最强预测因素,运动耐量每提高1MET,全因死亡风险可以降低12%[31]。其机制主要与改善患者肌肉峰值摄氧量、内皮功能、血清硝酸盐浓度有关[32-33]。在冠心病中,改善心肌、骨骼肌能量代谢的药物如曲美他嗪与其他抗心绞痛药物联合使用,可以增强患者的运动耐量1.1~1.5 MET,并改善患者的预后[34-35]。但是国内外缺乏对于DCM患者运动耐量与预后的评价,本研究关注到LVRR的DCM患者运动耐量的显著变化,但遗憾的是,目前临床资料对于基线运动耐量关注度少,无法说明提高DCM患者的运动耐量,可以促进DCM患者心脏结构和功能的恢复。
综上,本研究提供了充足的证据支持部分原发性DCM患者经标准抗心衰药物治疗后,心脏结构和功能可以发生逆转,对于继发性DCM患者,通过病因干预,心脏结构和功能可以发生逆转,并首次发现RDW是原发性和继发性DCM患者发生LVRR的预测因素。本研究的局限性在于样本来自单中心、样本量不够庞大、随访数据不够详尽、随访时间不够长,对于发生LVRR的患者长期预后是否明显优于未发生者、发生LVRR患者复发DCM的概率等更符合临床实际的问题是本团队未来的研究方向。
| [1] | 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 中国心肌病诊断与治疗建议工作组[J]. 中华心血管病杂志, 2007, 35(1): 5-16. |
| [2] | 邹长虹, 巫雪飞, 周琼, 等. 扩张型心肌病患者左心室射血分数及舒张末期内径恢复正常的相关因素分析[J]. 中华心血管病杂志, 2014, 42(10): 851-5. DOI: 10.3760/cma.j.issn.0253-3758.2014.10.012. |
| [3] | Perlman S, Paz O, Hagay Z, et al. Reversible heart failure with left ventricular dysfunction in a postpartum Woman with familial hypertrophic cardiomyopathy[J]. Israel Med Assoc J, 2013, 15(5): 256-7. |
| [4] | Choi JO, Kim EY, Lee GY, et al. Predictors of left ventricular reverse remodeling and subsequent outcome in nonischemic dilated cardiomyopathy[J]. Circ J, 2013, 77(2): 462-9. DOI: 10.1253/circj.CJ-12-0507. |
| [5] | 张健, 邹长虹. 扩张型心肌病患者左心室逆重构[J]. 中华心血管病杂志, 2016, 44(4): 287-91. |
| [6] | Huffman C, Wagman G, Fudim M, et al. Reversible cardiomyopathies-a review[J]. Transplant Proc, 2010, 42(9): 3673-8. DOI: 10.1016/j.transproceed.2010.08.034. |
| [7] | 汪烨, 任学军, 韩智红. 扩张型心肌病患者心脏再同步化治疗术后早期及远期随访[J]. 中国心脏起搏与心电生理杂志, 2013, 27(3): 222-4. DOI: 10.7695/zgxzqb201303010. |
| [8] | 徐茂椿, 邱建平, 张瑜, 等. 扩张型心肌病患者心脏再同步化治疗的疗效观察[J]. 临床心血管病杂志, 2010, 26(2): 100-3. |
| [9] | 中华医学会心血管病学分会中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2014[J]. 中国实用乡村医生杂志, 2014, 42(24): 3-10. DOI: 10.3969/j.issn.1672-7185.2014.24.04. |
| [10] | Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. Kardiol Pol, 2016, 74(10): 1037-147. DOI: 10.5603/KP.2016.0141. |
| [11] | Gupta A, Goyal P, Bahl A. Frequency of recovery and relapse in patients with nonischemic dilated cardiomyopathy on GuidelineDirected medical therapy[J]. Am J Cardiol, 2014, 114(6): 883-9. DOI: 10.1016/j.amjcard.2014.06.021. |
| [12] | Patrianakos AP, Nyktari E, Parthenakis FI, et al. Reversible left ventricular apical ballooning after heavy alcohol consumption in a patient with hypertrophic cardiomyopathy[J]. Int J Cardiol, 2013, 164(3): E29-31. DOI: 10.1016/j.ijcard.2012.09.163. |
| [13] | Saito T, Asai K, Sato S, et al. Myocardial alterations and clinical implications associated with recovery of cardiac function in dilated cardiomyopathy with obesity[J]. Int J Cardiol, 2013, 168(1): 144-50. DOI: 10.1016/j.ijcard.2012.09.046. |
| [14] | Jennifer LH, Kenneth BM. Myocardial reverse remodeling[J]. Cardiovasc Ther, 2012, 30(3): 172-81. DOI: 10.1111/cdr.2012.30.issue-3. |
| [15] | Moore JP, Patel PA, Shannon KM, et al. Predictors of myocardial recovery in pediatric tachycardia-induced cardiomyopathy[J]. Heart Rhythm, 2014, 11(7): 1163-9. DOI: 10.1016/j.hrthm.2014.04.023. |
| [16] | Mcnamara DM, Starling RC, Cooper LT, et al. Clinical and demographic predictors of outcomes in recent onset dilated cardiomyopathy[J]. J Am Coll Cardiol, 2011, 58(11): 1112-8. DOI: 10.1016/j.jacc.2011.05.033. |
| [17] | 杨洁, 侯翠红, 刘周英, 等. 心电图异常对预测扩张型心肌病致慢性心力衰竭患者的预后意义[J]. 中国循环杂志, 2016, 31(3): 218-22. |
| [18] | 巫雪飞, 邹长虹, 黄燕, 等. 住院扩张型心肌病患者低钠血症的发生率及其对预后的判断价值[J]. 中国循环杂志, 2015, 30(6): 529-33. |
| [19] | 陈卫文, 林靖宇, 刘军, 等. 单中心左室射血分数小于等于0.35患者宽QRS波时限比例调查及相关因素分析[J]. 中国心脏起搏与心电生理杂志, 2015, 29(6): 529-32. |
| [20] | Spell DW, Jones DV, Harper WF, et al. The value of a complete blood count in predicting cancer of the colon[J]. Cancer Detect Prev, 2004, 28(1): 37-42. DOI: 10.1016/j.cdp.2003.10.002. |
| [21] | Aml MN. Red cell distribution width in type 2 diabetic patients[J]. Diabetes Metab Syndr Obes, 2015, 8: 525-33. |
| [22] | Wang H, Xu H, Niu J. Red blood cell distribution width and globulin, noninvasive indicators of fibrosis and inflammation in chronic hepatitis patients[J]. Eur J Gastroenterol Hepatol, 2016, 28(9): 997-1002. DOI: 10.1097/MEG.0000000000000662. |
| [23] | Salvagno GL, Sanchis-Gomar F, Picanza A, et al. Red blood cell distribution width: A simple parameter with multiple clinical applications[J]. Crit Rev Clin Lab Sci, 2015, 52(2): 86-105. DOI: 10.3109/10408363.2014.992064. |
| [24] | Liu S, Wang P, Shen PP, et al. Predictive values of red blood cell distribution width in assessing severity of chronic heart failure[J]. Med Sci Monit, 2016, 22: 2119-25. DOI: 10.12659/MSM.898103. |
| [25] | Praveen N, Suneetha K, Naidu OK, et al. Correlation of red cell distribution width with the severity of coronary artery disease-A single center study[J]. Indian Heart J, 2018, 126(6): 1053-7. |
| [26] | Wakili R, Voigt N, Kääb S, et al. Recent advances in the molecular pathophysiology of atrial fibrillation[J]. J Clin Invest, 2011, 121(8): 2955-68. DOI: 10.1172/JCI46315. |
| [27] | Adamsson Eryd S, Borné Y, Melander O, et al. Red blood cell distribution width is associated with incidence of atrial fibrillation[J]. J Intern Med, 2014, 275(1): 84-92. DOI: 10.1111/joim.2013.275.issue-1. |
| [28] | Hampole CV, Mehrotra AK, Thenappan T, et al. Usefulness of red cell distribution width as a prognostic marker in pulmonary hypertension[J]. Am J Cardiol, 2009, 104(6): 868-72. DOI: 10.1016/j.amjcard.2009.05.016. |
| [29] | Caliskan M, Ozulku M, Gullu H, et al. Interrelation of RDW and coronary flow reserve in patient with idiopathic dilated cardiomyopathy[J]. Cardiovasc Ther, 2012, 30(1, SI): 87. |
| [30] | 中国康复医学会心脏康复专业委员会. 稳定性冠心病心脏康复药物处方管理专家共识[J]. 中华心血管病杂志, 2016(1): 7-11. |
| [31] | Myers J, Prakash M, Froelicher V, et al. Exercise capacity and mortality among men referred for exercise testing[J]. N Engl J Med, 2002, 346(11): 793-801. DOI: 10.1056/NEJMoa011858. |
| [32] | Villelabeitia Jaureguizar K, Vicente-Campos DA, Hernandez De La Pena C, et al. Effect of High-Intensity interval versus continuous exercise training on functional capacity and quality of Life in patients with coronary artery disease a randomized clinical trial[J]. J Cardiopulm Rehabil Prev, 2016, 36(2): 96-105. DOI: 10.1097/HCR.0000000000000156. |
| [33] | Zamani P, Rawat D, Shiva-Kumar P, et al. Effect of inorganic nitrate on exercise capacity in heart failure with preserved ejection fraction[J]. Circulation, 2015, 131(4): 371. DOI: 10.1161/CIRCULATIONAHA.114.012957. |
| [34] | Güler N, Eryonucu B, Güneş A, et al. Effects of trimetazidine on submaximal exercise test in patients with acute myocardial infarction[J]. Cardiovasc Drugs Ther, 2003, 17(4): 371-4. DOI: 10.1023/A:1027376529708. |
| [35] | Fabijanović D, Lovrić BM, Šimonček T. Effects of trimetazidine therapy in patients with stable ischaemic heart disease[J]. Cardiologia Croatica, 2014, 9(5/6): 250. |
 2018, Vol. 38
2018, Vol. 38

