阿尔茨海默病(AD)分为家族性AD和散发性AD,家族性AD的发病与APP、PS1、PS2基因突变直接导致Aβ产生过多有关;散发性AD是遗传缺陷如基因突变、环境因素如细胞氧化应激损害等因素共同作用的结果,Aβ沉积可能只是这些因素作用后的结果,而非病变的启动环节。因此,传统的Aβ诱导的AD细胞模型可能仅适合于对家族性AD的研究,散发性AD细胞模型的制备更需要考虑由后天因素如基因突变、环境改变等所致的Aβ增多。自Scherzer首次提出AD发病与SORL1缺乏有关[1]以来,SORL1减少与AD发生发展的关系一直被关注。以往的研究认为:SORL1表达降低,APP向Aβ生成增多,导致Aβ的异常沉积,从而增加AD发病的风险[2];但近年的研究发现SORL1还可能通过影响tau相关蛋白[3]、炎症相关物质[4]及神经营养因子[5]等多种物质的代谢或转运参与AD的发生和发展。SORL1减少对神经细胞的作用是否可以与Aβ对神经细胞的毒性作用类似,尚未见研究报道。
本研究拟通过慢病毒载体干扰目的基因SORL1在小鼠神经瘤细胞株细胞(N2a细胞)内的表达,观察敲低SORL1对细胞活力、细胞凋亡率、炎症相关因子TNF-α和IL-1β的表达等方面的影响,并与传统的Aβ25-35诱导AD细胞模型进行比较,试图构建一种新的模拟散发性AD病理改变的细胞模型,为研究和发现SORL1在AD发病中的更多作用机制提供理论依据。
1 材料和方法 1.1 细胞培养与转染N2a购于Sigma,细胞培养和Aβ诱导的AD细胞模型制备过程按以往的实验操作步骤执行[6]。RNA干扰慢病毒载体(SORL1-shRNA,其序列为TGTCACAA AGCATCCTATTAACTCGAGTTAATAGGATGCTTT GTGACA)及空病毒载体由湖南赛业生物公司协助设计和构建,取相等体积的细胞种板并根据产品说明书进行SORL1-shRNA的转染。
1.2 实验分组对照组:未经干预的野生型N2a细胞;AD组:用Aβ 25-35诱导的N2a细胞;空白组:用慢病毒空载体转染的N2a细胞;SORL1敲低组:SORL1-shRNA慢病毒载体转染的N2a细胞。
1.3 qRT-PCR测定用于对照组、空白组和SORL1敲低组的细胞SORL1mRNA表达的检测:将这3组细胞放入恒温箱中孵育48 h,用Trizol法提取细胞mRNA,按逆转录试剂盒说明进行逆转录获取cDNA,用qRT-PCR方法测定SORL1 mRNA含量。PCR的循环条件是:98 ℃,2 min(1 cycle);98 ℃ 10 s;60 ℃ 10 s;68 ℃ 30 s(40 cycles)。记录下Ct值,利用2-ΔΔCt的方法分析。独立实验重复3次。
1.4 Western blot检测用于对照组、空白组和SORL1敲低组的细胞SORL1蛋白表达的检测:分别用含有蛋白酶抑制剂PMSF的RIPA缓冲液在冰上提取这3组细胞的总蛋白,经BCA法测定总蛋白浓度,等量的蛋白通过SDSPAGE分离,并转移到PVDF膜上;用含TBST的5%新鲜牛奶室温封闭1 h,加入一抗(1:500小鼠抗SORL1),4 ℃孵育过夜。TBST洗涤后,加入二抗在室温孵育1 h;使用ECL试剂盒检测蛋白,用图像分析软件分析目标带的光密度值;用内参GAPDH校准。独立实验重复3次。
1.5 细胞活力的检测MTT法分别测定4组N2a细胞的活力:分别将4组细胞加入相应的物质孵育24 h,每孔加入20 μL MTT(5 mg/mL),置于37 ℃避光继续培养4 h,吸弃孔内液体后,每孔加入150 μL二甲基亚砜(DMSO),将细胞培养板放在摇床上低速振荡10 min至结晶物溶解,使用酶标仪读取490 nm波长处各孔吸光度(A)。独立实验重复3次。
1.6 细胞凋亡率的检测流式细胞仪分别检测4组细胞的细胞凋亡率:分别将四组细胞放入恒温箱中孵育48 h,用不含EDTA的胰酶消化收集细胞,用PBS洗涤细胞2次并收集细胞,加入500 μL的Binding Buffer悬浮细胞,加入5 μL Annexin V-APC混匀后,再加入5 μL PI混匀,室温避光反应5~ 15 min,用流式细胞仪检测。独立实验重复3次。
1.7 TNFα、IL-1β含量的检测ELISA分别检测4组细胞培养上清液中TNFα、IL-1β含量:分别将4组细胞放入恒温箱中孵育,48 h后取上清液,用ELISA试剂盒(联科生物公司)测定TNF-α、IL-1β含量,具体操作方法参照试剂盒说明书进行,450 nm处测定吸光度。独立实验重复3次。
1.8 统计学方法采用SPSS 19.0统计软件,计量资料以均数±标准差表示,组间比较采用单因素方差分析,组间多重比较采用LSD检验,以P < 0.05为差异有统计学意义。
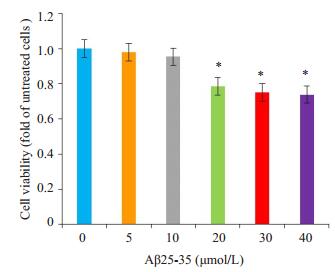
2 结果 2.1 Aβ25-35诱导的细胞模型用不同浓度的Aβ25-35诱导N2a细胞24 h后(图 1),与对照组(0 μmol)相比,20 μmol时N2a细胞活力明显下降,差异有统计学意义(P < 0.05)。故本实验选取Aβ 25~35浓度为20 μmol诱导的N2a细胞24 h作为该实验的传统的AD细胞模型。
|
图 1 不同浓度Aβ25-35对N2a细胞活力的影响 Figure 1 Effect of different concentrations of Aβ25-35 on N2a cell viability. *P < 0.05 vs 0 μmol/L group. |
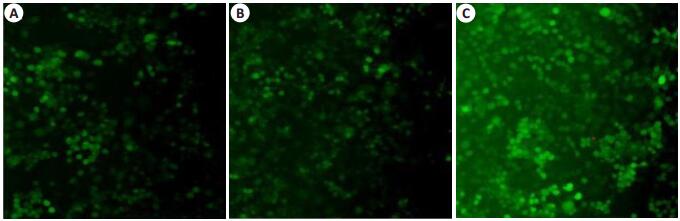
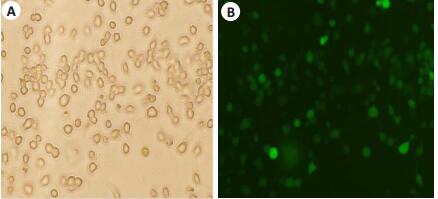
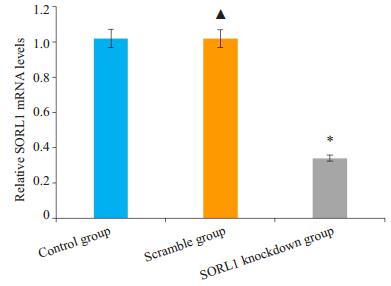
将不同MOI值的SORL1-shRNA慢病毒载体转染正常N2a细胞,转染48 h后,在荧光显微镜下观察慢病毒转染效率,图 2中的A、B、C的MOI分别为20、40、60。最适MOI值选择标准是转染效率较高、细胞生长未受明显抑制,本实验MOI选择是60,加用适宜浓度的G418筛选至转染效率大于80%(图 3)。分别采用qRT-PCR及Western blot方法检测细胞SORL1 mRNA含量及蛋白表达(图 4、5)。空白组与对照组比较,SORL1 mRNA及蛋白无明显差异(P>0.05);与空白组比较,SORL1敲低组细胞SORL1 mRNA降低(P < 0.01),SORL1蛋白表达减少(P < 0.01)。
|
图 2 显微镜下绿色荧光蛋白的表达 Figure 2 Expression of green fluorescent protein in cells transfected with the lentivirus vector at the MOI of 20 (A), 40 (B), and 60 (C) under fluorescence microscope (Original magnification: ×10). |
|
图 3 转染细胞经G418筛选后在白光和荧光下的比较 Figure 3 Transfected cells after G418 selection under white light (A) and fluorescence (B) microscope (×20). |
|
图 4 各组细胞SORL1mRNA相对表达量 Figure 4 Relative expression of SORL1 mRNA in each group. *P < 0.01 vs the Scramble group; ▲P>0.05 vs the control group. |
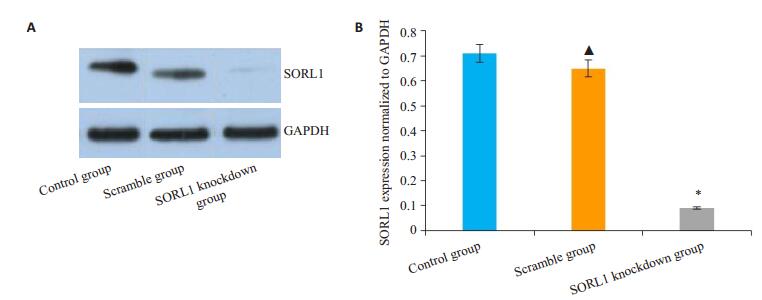
|
图 5 各组细胞SORL1蛋白的相对表达量 Figure 5 Western blots (A) and quantitative analysis (B) of SORL1 protein in different groups. *P < 0.01 vs the Scramble group; ▲P>0.05 vs the control group. |
MTT法检测各组细胞的细胞活力(图 6)。AD组与对照组比较,SORL1敲低组与空白组比较,AD组和SORL1敲低组的细胞存活率均下降,差异有统计学意义(P < 0.05);空白组与对照组比较、SORL1敲低组与AD组比较,细胞活力差异均无统计学意义(P>0.05)。
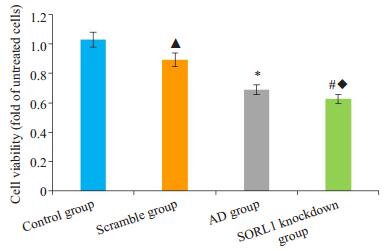
|
图 6 各组细胞存活率的比较 Figure 6 Comparison of cell viability among the groups. *P < 0.05 vs the control group; #P < 0.05 vs the Scramble group; ▲P> 0.05 vs the control group; ◆P>0.05 vs the AD group. |
流式细胞仪检测各组细胞的细胞凋亡(图 7)。AD组与对照组比较、SORL1敲低组与空白组的细胞凋亡率结果显示:与对照组相比,AD组处于LR(早期凋亡)+UR(晚期凋亡)的细胞增多,差异有统计学意义(P < 0.05);与空白组相比,SORL1敲低组处于LR(早期凋亡)+UR(晚期凋亡)的细胞增多,差异有统计学意义(P < 0.05)。AD组与SORL1敲低组比较,细胞调亡率差异无统计学意义(P>0.05)。
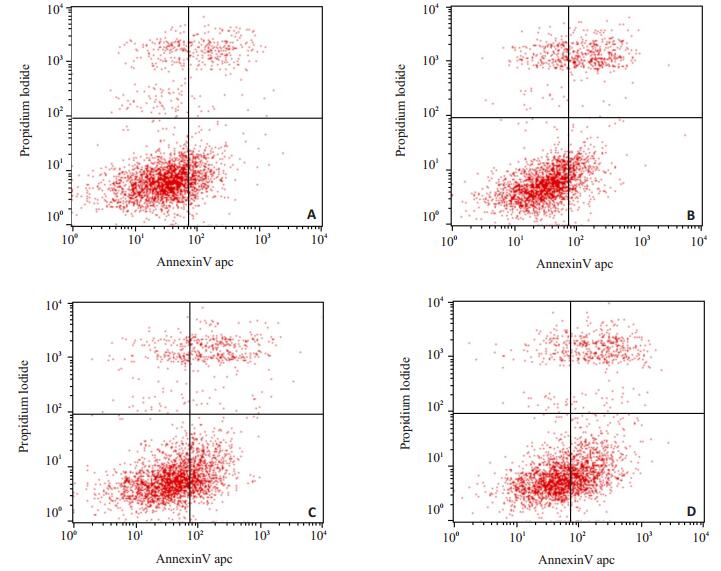
|
图 7 各组细胞凋亡率的比较 Figure 7 Comparison of Apoptosis rate among the groups. A: Control group; B: Scramble group; C: AD group; D: SORL1 knockdown group. |
ELISA检测对照组、空白组、AD组和SORL1敲低组细胞的培养上清液TNF-α、IL-1β含量(ng/L)分别为:50.17±0.40、14.86±0.37;50.37±0.38、15.03±0.28;75.66± 0.21、22.01±0.30;74.99±0.40、21.33±0.21。AD组与对照组比较、SORL1敲低组与空白组比较,TNF-α、IL-1β含量均增多,差异有统计学意义(P < 0.05);空白组与对照组比较、SORL1敲低组与AD组比较,TNF-α、IL-1β含量差异均无统计学意义(P>0.05)。
3 讨论AD病理改变的核心是Aβ对神经细胞的毒性作用,包括神经细胞的氧化应激、轴突损伤、突触丢失和炎症级联反应等,最终导致神经元死亡和细胞功能丧失。脑内的慢性炎症反应是各种致病因素激活星型胶质细胞发生炎症性级联反应所致,表现为TNF-α、IL-1β等炎性因子的增加[7-8]。如Dal Pra等[9]研究表明AD患者脑脊液中TNF-α增多,它们可阻碍神经元之间的突触传递信号、通过神经毒性机制及神经元凋亡机制加速中枢神经系统炎症毒性及神经元的凋亡;IL-1是在免疫炎症中起调控作用的促炎因子,由Aβ反复刺激小胶质细胞产生,进而促进活化的星形胶质细胞过度表达S100βmRNA,引起神经元细胞内钙超载,诱导神经元的凋亡[10]。因此,传统的AD细胞模型的制备是在神经细胞培养过程中加入有细胞毒性作用的Aβ,通过检测干预细胞的细胞活力、细胞凋亡和相关炎性指标判断AD模型的成功与否[11-14]。与对照组比较,本实验所采用Aβ诱导的AD细胞模型在细胞活力、细胞凋亡和相关炎性因子表达等方面都有差异(P>0.05),说明该模型符合以往的传统AD细胞模型。
近年的全基因组关联分析发现至少包括SORL1在内的20多种基因被列为散发性AD的风险基因[15-18]。SORL1基因位于11q23.2-q24.2,其编码的蛋白在中枢神经系统中普遍表达,主要分布于大脑皮层、海马和小脑[19-20]。由于SORL1化学结构的复杂性决定了其功能的复杂性[21]。SORL1作为细胞内分选受体可在高尔基体(TGN)、细胞表面、神经元和多种细胞器之间穿梭,参与多种物质在细胞内的转运和代谢[22-24]。年轻时(未出现AD症状前)的SORL1基因突变导致脑组织结构的改变和以后几十年AD的易感性[25-26],说明了SORL1减少可能是散发性AD发病的始动环节之一,即:减少细胞内SORL1的表达可能使细胞出现AD样的病理改变,敲低细胞内SORL1的表达就可能建立一种更贴近于散发性AD始发病理改变的细胞模型。本研究显示:SORL1敲低组的SORL1 mRNA和蛋白表达量明显低于空白组,而空白组与对照组比较SORL1 mRNA和蛋白表达无明显变化,说明通过SORL1-shRNA的制备并转染给N2a成功构建了SORL1敲低细胞模型;SORL1敲低组与空白组比较,细胞存活率下降、细胞凋亡率增加、炎症因子TNF-α和IL-1β表达增加,说明敲低细胞内SORL1的表达可导致细胞损伤和凋亡;SORL1敲低组与AD组比较,细胞存活率、细胞凋亡率和炎症因子TNF-α及IL-1β含量无差异,说明敲低细胞内SORL1可出现类似的Aβ25-35诱导的细胞损伤和凋亡等病理改变。从SORL1的生理功能和作用用机制来看,SORL1敲低所致的病理改变更符合散发性AD的发生过程,因此认为:敲低细胞内SORL1的表达有望成为一种新型的散发性AD细胞模型。
虽然细胞模型研究存在许多局限性,如无法检测主要存在于细胞外的Aβ或无法显现AD所有的病理改变,但证实了敲低细胞内SORL1表达可导致细胞出现AD样病理改变,为进一步研究SORL1的作用机制和通过SORL1基因剔除建立散发性AD动物模型提供理论基础。
| [1] | Scherzer CR, Offe K, Gearing M, et al. Loss of apolipoprotein E recepter LR11 in Alzheimer disease[J]. Arch Neurol, 2004, 61(8): 1200-5. |
| [2] | Rogaeva E, Meng Y, Lee JH, et al. The neuronal sortilin-related receptor SORL1 is genetically associated with Alzheimer disease[J]. Nat Genet, 2007, 39(2): 168-77. DOI: 10.1038/ng1943. |
| [3] | Yu L, Chibnik LB, Srivastava GP, et al. Association of brain DNA methylation in SORL1, ABCA7, HLA-DRBS, SLC24A4, and BIN1 with pathological diagnosis of Alzheimer disease[J]. JAMA Neurol, 2015, 72(1): 15-24. DOI: 10.1001/jamaneurol.2014.3049. |
| [4] | Larsen JV, Petersen CM. SorLA in interleukin-6 signaling and turnover[J]. Mol Cell Biol, 2017, 37(11): e00641-16. |
| [5] | Geng Z, Xu FY, Huang SH, et al. Sorting protein-related receptor SorLA controls regulated secretion of glial cell line-derived neurotrophic factor[J]. J Biol Chem, 2011, 286(48): 41871-82. DOI: 10.1074/jbc.M111.246413. |
| [6] | 谢婧雯, 赵艳, 奉夏露, 等. 丁苯酞对A25-35诱导的阿尔茨海默病细胞模型的保护作用[J]. 南方医科大学学报, 2017, 37(9): 1228-33. |
| [7] | Birch AM. The contribution of astrocytes to Alzheimer's disease[J]. Biochem Soc Trans, 2014, 42(5): 1316-20. DOI: 10.1042/BST20140171. |
| [8] | Gong CY, Zhou AL, Mao JH, et al. The role of Toll-like receptor 4 on inflammation and Aβ formation in cortex astrocytes[J]. Sheng Li Xue Bao, 2014, 66(6): 631-8. |
| [9] | Dal Pra I, Chiarini A, Pacchiana RA, et al. Emerging concepts of how beta-amyloid proteins and pro-inflammatory cytokines might collaborate to produce an 'Alzheimer brain' (Review)[J]. Mol Med Rep, 2008, 1(2): 173-8. |
| [10] | Matousek SB, Ghosh S, Shaftelss, et al. Chronic IL-1betamediated-neuroinflammation mitigates amyloid pathologyina mouse model of Alzheimer's disease without inducing overt neurodegeneration[J]. J Neuroimmune Pharmacol, 2012, 7(1): 156-64. DOI: 10.1007/s11481-011-9331-2. |
| [11] | Gu HZ, Li L, Cui C, et al. Overexpression of let-7a increases neurotoxicity in a PC12 cell model of Alzheimer's disease via regulating autophagy[J]. ExpTher Med, 2017, 14(4): 3688-98. |
| [12] | Campolo M, Casili G, Lanza M, et al. Multiple mechanisms of dimethyl fumarate in amyloid β-induced neurotoxicity in human neuronal cells[J]. J Cell Mol Med, 2017, [Epub ahead of print]. http://europepmc.org/abstract/MED/28990726 |
| [13] | Farajdokht F, Amani M, Bavil FM, et al. Troxerutin protects hippocampal neurons against amyloid beta-induced oxidative stress and apoptosis[J]. EXCLI J, 2017, 16: 1081-9. |
| [14] | Fang XX, Sun GL, Zhou Y, et al. TGF-β1 protection againstAβ1-42-induced hippocampal neuronal inflammation and apoptosis by TβR-Ⅰ[J]. Neuroreport, 2018, 29(2): 141-6. DOI: 10.1097/WNR.0000000000000940. |
| [15] | Rosenthal SL, Kamboh MI. Late-Onset alzheimer's disease genes and the potentially implicated pathways[J]. Curr Genet Med Rep, 2014, 22(2): 85-101. |
| [16] | Karch CM, Goate AM. Alzheimer's disease risk genes and mechanisms of disease pathogenesis[J]. Biol Psychiatry, 2015, 77(1): 43-51. DOI: 10.1016/j.biopsych.2014.05.006. |
| [17] | Xiao QY, Liu ZJ, Tao S, et al. Risk prediction for sporadic Alzheimer's disease using genetic risk score in the Han Chinese population[J]. Oncotarget, 2015, 6(35): 36955-64. |
| [18] | Li JQ, Wang HF, Zhu XC, et al. GWAS-Linked loci and neuroimaging measures in alzheimer's disease[J]. Mol Neurobiol, 2017, 54(1): 146-53. DOI: 10.1007/s12035-015-9669-1. |
| [19] | Xia Y, Chen BY, Sun XL, et al. Presence of proNGF-Sortilin signaling complex in nigral dopamine neurons and its variation in relation to aging, lactacystin and 6-OHDA insults[J]. Int J Mol Sci, 2013, 14(7): 14085-104. |
| [20] | Breiderhoff T, Christiansen GB, Pallesen LT, et al. Sortilin-Related receptor SORCS3 is a postsynaptic modulator of synaptic depression and fear extinction[J]. PLoS One, 2013, 8(9): e75006. DOI: 10.1371/journal.pone.0075006. |
| [21] | Yin RH, Yu JT, Tan L. The role of SORL1 in alzheimer's disease[J]. Mol Neurobiol, 2015, 51(3): 909-18. DOI: 10.1007/s12035-014-8742-5. |
| [22] | Gu oY, SirkisDW, SchekmanR. Protein sorting at the trans-Golgi network[J]. Annu Rev Cell Dev Biol, 2014, 30: 169-206. DOI: 10.1146/annurev-cellbio-100913-013012. |
| [23] | CaglayanS, Takagi-NiidomeS, LiaoF, et al. Lysosomal sorting of amyloid-β by the SORLA receptor is impaired by a familial Alzheimer's disease mutation[J]. Sci Transl Med, 2014, 6(223): 223ra20. DOI: 10.1126/scitranslmed.3007747. |
| [24] | Dumanis SB, Burgert T, Caglayan SA, et al. Distinct functions for anterograde and retrograde sorting of SORLA in amyloidogenic processes in the brain[J]. J Neurosci, 2015, 35(37): 12703-13. DOI: 10.1523/JNEUROSCI.0427-15.2015. |
| [25] | Felsky D, Szeszko P, Yu L, et al. The SORL1 gene and convergent neural risk for Alzheimer's disease across the human lifespan[J]. Mol Psychiatry, 2014, 19(10): 1125-32. DOI: 10.1038/mp.2013.142. |
| [26] | Shen JL, Zhang P, Liu HG, et al. Modulation effect of the SORL1 gene on functional connectivity density in healthy young adults[J]. Brain Struct Funct, 2016, 221(8): 4103-10. DOI: 10.1007/s00429-015-1149-x. |
 2018, Vol. 38
2018, Vol. 38

