在自然环境中,有效探测新奇出现的信息,例如突然出现的声音、闪光和气味等可能包含危险信号的感觉信息对动物的生存非常关键。听觉神经系统中,神经元对新奇刺激的有效探测通常用刺激-特异性适应(SSA)方法来研究[1-2]。SSA的声音刺激通常包含两种声音序列condition1和condition2,这两种声音序列由同一强度的两个纯音f1和f2按不同的重复概率随机排列组成(f1和f2一般选取神经元听觉感受野阈上20 dB的边界频率对应的纯音)。Condition1包含90% f1和10% f2,在这个序列中高频出现的f1被称为标准刺激频率(s);而低频出现的f2被称为偏差刺激频率(d);相反,condition2包含90% f2和10% f1,其中f2被称为标准刺激频率,f1被称为偏差刺激频率。神经元对新奇刺激的探测能力表现为对偏差刺激频率(condition1中f2和condition2中f1)的响应相对增强,而对标准刺激频率发生适应性降低[3-4]。
SSA广泛存在于上行听觉神经通路的重要核团下丘[5-6],内侧膝状体[7-8],听皮层。然而,上行听觉神经通路更低位的核团耳蜗核却没有发现SSA现象[9-10]。这些证据暗示下丘可能是SSA的起源核团,因此对下丘的SSA现象的全面研究在理解这一典型现象的产生机制和存在意义就显得非常关键。过往的研究表明,听觉神经元的SSA特性受声音刺激序列中两个纯音f1和f2的频率差、动物状态(麻醉或清醒)[11-12]和给声频率[13]等因素影响,特别是不少研究结果显示麻醉状态下的SSA更显著而提示这种现象可能在很大程度上是麻醉造成的假象。但两个刺激纯音的发放类型和发放强度等响应模式本身的区别是否是SSA的影响因素目前并不清楚。而听觉神经元对声音的响应有多种主要类型起始响应型, 持续响应型, 初级响应型,不同类型又导致神经元对声音响应强度的差异,因此,在本研究中,我们以清醒小鼠为研究对象,系统研究下丘神经元对纯音f1和f2的多种响应模式条件下SSA的特性。
1 材料和方法 1.1 动物实验在6~8周的清醒状态C57BL/6小鼠上进行。所有的动物实验手术程序都遵循南方医科大学动物使用委员会标准。
1.2 手术准备在动物手术前,首先腹腔注射戊巴比妥钠进行麻醉,待实验动物完全麻醉后,将其置于立体定位仪上,暴露出颅骨,并在前额骨下放置一个参考电极。之后使用牙科水泥将一个长约1.5 cm的平头金属钉粘合在颅骨前部正中位置,然后将小鼠固定到屏蔽室的实验平台上,在立体显微镜下用颅骨钻除去下丘上方的颅骨,暴露出下丘。然后,将暴露在外的组织覆盖上凡士林塑料膜。手术完成后小鼠被放回笼子进行至少2 d的恢复。记录开始前小鼠头部被固定在一钢性的金属架,身体放置于可旋转的转盘中进行训练,直到小鼠完全适应在转盘中自由跑动或静止。训练好的小鼠随后被转移实验台进行听觉电声理记录。
1.3 声音刺激刺激声音通过TDT3系统产生。首先用RPvdsEx软件设计声音程序,然后将程序载入到TDT3的多功能处理器中(Multifunction Processor, RX6)产生声音波形,声音的强度由一个可编程衰减器(PA5)控制。合成的信号被一个静电扬声器驱动(ED1)和一个自由场的超声波喇叭(ES1,频率范围2~110 kHz)放大和传送。在实验开始前,扬声器使用1/8和1/4英寸的麦克风(Kjaer和Kjaer 4138、4135、Naerum、Denmark)进行校正。声音刺激和电声理信号记录都在TDT系统的软件Brainware中进行。
1.4 刺激参数本研究所用刺激声音与前期在人类MMN及猫听皮层的SSA [14-15]研究中所用刺激序列相似,由两个不同频率(f1和f2)的纯音按不同重复概率随机组成(图 1),f1和f2选取标准为神经元听觉感受野阈值上20 dB的边界附近所对应的纯音,两个纯音f1和f2的频率距离0.3~ 0.5 octaves。图 1D为SSA声音刺激序列的示意图,包含两组序列condition1和condition2。condition1序列由90%的f1和10%的f2随机组成,在这里f1作为标准刺激声音而f2作为偏差刺激声音;condition2序列由90%的f2和10%的f1随机组成,在这里f2作为标准刺激声音而f1作为偏差刺激声音。每组声音序列总共由200个纯音组成,给声间隔设置为2 Hz。
|
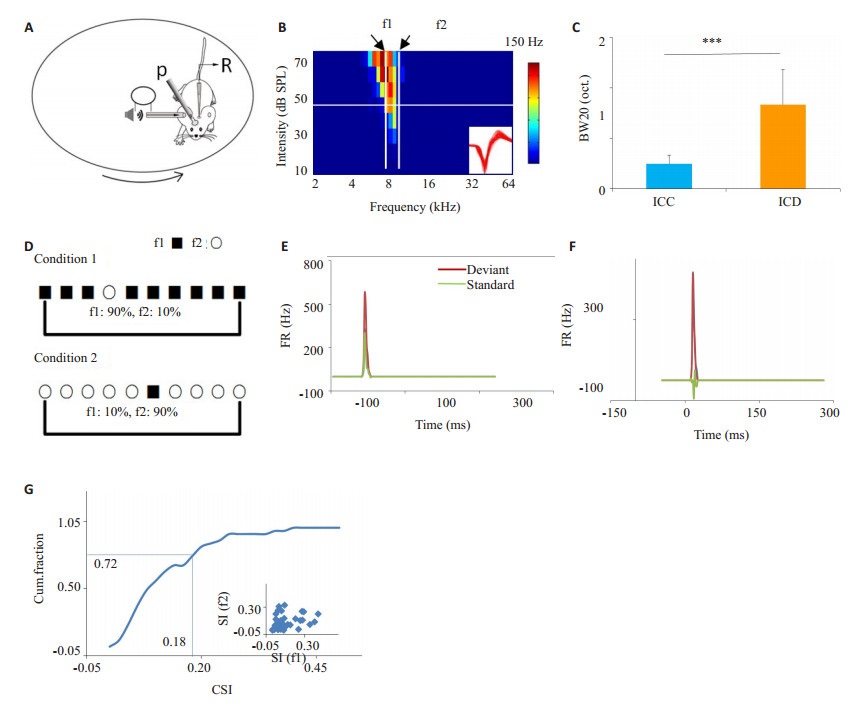
图 1 清醒小鼠IC神经元的SSA特性 Figure 1 SSA in the inferior colliculus (IC) neurons of awake mice. A: Experimental setup (R, recording electrode; P, head-fixation post); B: TRFs of spike responses of an IC neuron. The pure tones f1 and f2 were chosen to form the SSA stimulus sequence. Inset shows the superimposed 100 individual spikes; C: Comparison of BW20 between ICC (n=46) and ICD (n=32) neurons (***P < 0.001); D: Schematic diagram of SSA stimulus sequence; E and F: Representative PSTH of the response to the deviant (red) or standard (dark) tone of IC neurons with different levels of SSA; G: Cumulative fraction of CSI in 39 IC neurons. Inset, scatter plot of SI for f1 versus f2. |
电声理实验在听觉屏蔽室中进行。首先有规律记录下丘不同位置和不同深度的听觉感受野,参照下丘的频率分布梯度结构来确定ICC的位置。随后利用玻璃微电极贴附式记录下丘神经元。通过扫频来确定所记录神经元的感受野,从而选定组成SSA声音刺激序列的纯音f1和f2,在部分实验中选取了多组纯音来研究神经元的SSA性质。最后给予SSA声音序列刺激,同时记录每个纯音对应的听觉响应,电声理信号记录长度为500 ms,带宽滤波频率为10~3000 Hz,动作电位由Brainware软件根据设置的阈值条件来自动识别。
1.6 数据分析数据分析通过自写的Matlab程序进行。首先分别提取f1和f2作为标准刺激和偏差刺激所对应的听觉响应直方图(PSTH),然后计算两个纯音总体或局部在标准刺激条件下的响应s(f1)与s(f2)和在偏差刺激条件下的响应d(f1)与d(f2)。随后计算各项重要指标:(1)两个纯音的听觉响应强度差异指数(FDI):FDI=|(s(f1)-s (f2))/(s(f1)+s(f2))|;(2)频率特异的SSA指数(SI),SI (fi)=|[d(fi)-s(fi)] [/ d(fi)+s(fi)] |,其中i=1或2;(3)共同SSA指数(CSI),SSI=|[d(f1)+ d(f2)-s(f1)-s(f1)] [/ d(f1)+ d (f2)+s(f1)+s(f1)] |,指数范围在0和+1之间。计算方法与现有文献使用的方法相同。
1.7 统计学分析统计分析采用SPSS 19.0,实验数据以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用T检验,P < 0.05表示差异具有统计学意义。
2 结果 2.1 清醒小鼠下丘神经元的SSA特性实验选取清醒小鼠来研究下丘中央核(ICC)的SSA特性。清醒小鼠电声理记录实验场景的模拟图(图 1A),其中小鼠的头部被固定于一钢性结构的金属架上,身体放置于一个可灵活转动的转盘上,小鼠可自由地在转盘上平滑地跑动或静止。图 1B为一个典型ICC神经元的TRF,其中f1和f2是用来组成SSA的声音刺激序列的两个频率,f1和f2一般选取TRF中阈上20 dB强度对应的两侧边界频率的纯音。该例子中,阈上20 dB的频率宽度(BW20)为0.4 octave。在我们所记录的39个ICC神经元中,BW20的值为0.5±0.17,其显著比下丘的背侧核神经元的BW20(1.7±0.68)大(图 1C),这进一步确认我们所记录的神经元位于ICC。为了定量研究小鼠下丘的SSA特性,我们分别记录小鼠ICC神经元对两组纯音序列(condition 1: 90% f1和10% f2随机排列;condition 2: 90% f2和10% f1随机排列。声音序列如图 1D)的响应,其响应主要表现为两种情况,一种为图 1E所示,神经元在偏差刺激频率条件下听觉响应出现比较明显的变化(大部分表现为降低,小部分表现为增高)。另外一种为图 1F所示,神经元在偏差刺激频率条件下听觉响应基本维持不变。我们最后绘制所有39个神经元的SSA指数CSI的累聚曲线(图 1G),结果表明,约28%(11/39)的ICC神经元的CSI大于0.18,表现出明显的SSA特点。这与现有的文献相似[16],我们的结果进一步揭示了SSA特性是IC神经元的固有特性。
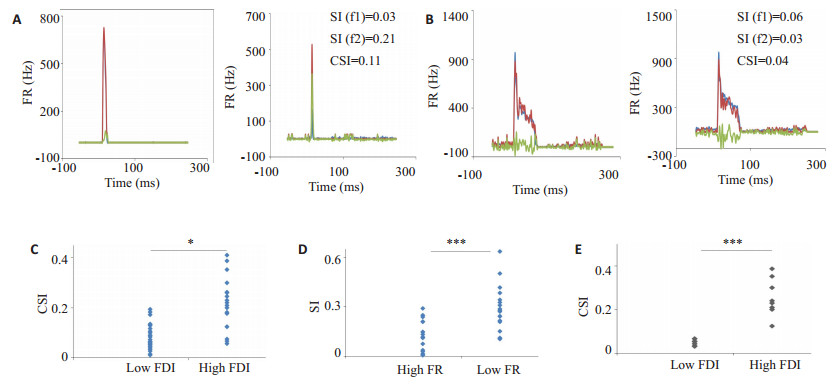
2.2 刺激纯音的听觉响应模式对SSA的影响我们研究了两个纯音的响应强度Rf1和Rf2对下丘神经元SSA的影响。从图 2A中可以看出Rf1的响应强度比Rf2大得多,其左图中的f1在condition1和condtion2条件下的听觉响应相当,而右图中的f2在偏差刺激频率condition2条件下的响应显著比标准刺激频率condtion1条件下的响应大得多,因此其SSA较大。相反地,图 2B显示了不同类型的例子,图中显示两个纯音的响应强度Rf1与Rf2相当,而相应地f1和f2分别作为condition1和condtion2时听觉响应差异也不大,因此其SSA较小。在所记录的18个FDI>0.2的神经元中,其CSI值为0.22±0.10;而26个FDI < 0.2的神经元中,其CSI值为0.08±0.05,统计显示FDI较大神经元的CSI显著高于FDI较小神经元的CSI。进一步的分析显示,在FDI较大的神经元中对听觉响应较小的纯音更易发生适应,图 2D显示听觉响应较小的纯音的频率指数(SI)显著比听觉响应较大的纯音的SI高。为了进一步证明FDI的值是SSA的影响因素,我们直接比较同一神经元在不同大小的FDI纯音组合得到的CSI,我们发现FDI较大的纯音组合对应的CSI显著比FDI较小的纯音组合对应的CSI高(图 2E)。综上所述,不管从群体神经元的结果比较还是从个体神经元结果的直接比较,两个纯音的听觉响应强度FDI都是清醒小鼠ICC神经元的SSA影响因素。
|
图 2 听觉响应强度差异对SSA的影响 Figure 2 Effect of firing-rate difference index (FDI) on SSA. A, B: Representative PSTH of the response to the deviant (red) or standard (dark) tone of IC neurons with different FDI; C: Comparison of CSI between low FDI group and high FDI group (*P < 0.05); D: Comparison of SI between high firing rate and low firing rate in the high SSA group (**P < 0.001); E: Comparison of CSI between low FDI group and high FDI group from the same neurons (***P < 0.001). |
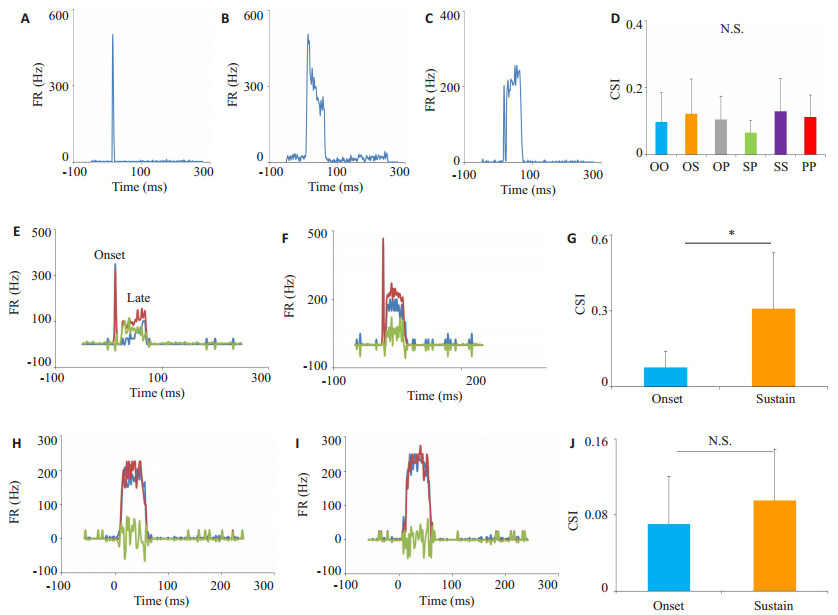
图 3A-C为小鼠ICC神经元的3种听觉响应类型的PSTH图。为了研究不同反应类型的纯音组合刺激序列是否是SSA的影响因素,我们系统地比较了3种不同PSTH组合之间的SSA的差异,结果显示,不同PSTH纯音组合的SSA在总体上没有显示出统计性差异(图 3D)。进一步地,我们又比较了SSA在PSTH的不同时间段上的差异。由于起始响应类型的响应在时间上非常短暂而很难在其PSTH做出有效的分部,因此这种分析主要在持续型和初级响应型上进行。图 3E-G显示了初级响应类型在不同时间段的SSA,我们发现相对于起始部分,持续部分的SSA显著地增高(图 3G)。而作为对照,我们分析了持续型响应在不同时间段的SSA,发现起始部分的SSA与持续部分的SSA却没有显示出统计性的差异。我们的结果显示初级响应类型的反应对于SSA在不同时程上表现了截然不同的性质。
|
图 3 听觉响应模式对SSA的影响 Figure 3 Effect of PSTH type on SSA. A-C: Representative PSTH of three important types, namely the onset, sustained and primarylike, respectively. D: Comparison of CSI of onset, sustained and primary-like group each other (no significant difference by OneWay ANOVA); E-F: Representative PSTH of primary-like type neurons in response to the deviant (red) or standard (dark) tone; G: Comparison of CSI between onset segment and sustained segment of primary-like neurons (*P < 0.05). H-L: Representative PSTH of sustained type in response to the deviant (red) or standard (dark) tone of IC neurons. J: Comparison of CSI between onset segment and sustained segment of sustained type (no significant difference). |
在这项研究中,我们使用与现有文献报道相似的方法[17],系统地研究了清醒小鼠下丘神经元的SSA性质。我们的结果显示清醒小鼠下丘约28%神经元(SCI> 0.18)表现出显著的SSA,这与现有文献报道的结果相似[18],我们的结果进一步证明了SSA在下丘神经元中广泛存在,因此可以说这种刺激特异性适应是下丘神经元在新奇听觉信息处理过程中的固有特性。
现有的研究显示,影响SSA的因素包括声音刺激序列的主要参数如两个纯音的频率差异和给声频率,神经元本身的听觉感受野特性,动物的状态(清醒或麻醉)[19]等。不同位置的听觉神经元的SSA也表现出一定的差异性。在听觉皮层,SSA呈现了一定规律的拓扑结构,听觉后区(PAF)和听觉超声区(SRAF)较强,而初级听觉皮层(A1)和听觉前区(AAF)较弱[20];SSA在皮层下结构中的IC和MGB中的分布也不均匀,表现为非丘系结构中神经元的SSA强,而丘系结构中的SSA较低或不存在。在本研究中,我们发现了ICC神经元的SSA受刺激纯音之间的听觉响应强度(RF1和RF2)差异的影响,即发放差异指数(FDI)大的条件下的SSA显著比FDI小的条件下的SSA强,这个特点不仅在神经元群体水平上表现出来,在同一神经元的不同SSA刺激序列更直接表现出来。更有意思的是ICC神经元对连续声音刺激的适应主要表现在听觉响应强度较弱的纯音中。从单神经元水平看,其对新奇声音的响应相对标准条件下的响应显著增大;而从群体水平看,对新奇声音响应增大的一个神经元群体可能在新奇声音信息的有效识别中起到主要作用。我们的发现揭示了在ICC中这一神经元群体是对新奇声音信息响应相对较弱的群体。
在大多数研究中,表示SSA强弱的指数CSI是由神经元分别对两个纯音在标准刺激频率和偏差刺激频率条件下响应的总体发放数来计算的[21-22]。但神经元对听觉刺激响应在时程上具有多种不同的反应类型,其中占比例较大的有初级反应型,给声开始型,持续型等,即使同一神经元对不同声音的响应模式也可能不一样,不同反应类型在发放总数有比较大的差别,在不同时间段上也有不同的差别,这些因素可能也会影响SSA。目前只有少量的研究关注到听觉响应不同时程上SSA的特点。在本研究中,我们发现两个不同反应类型的纯音刺激序列所对应的SSA并没有统计性差异;与持续响应类型不同,初级响应类型的SSA在起始阶段和持续阶段这两个不同阶段有显著的差异,大部分初级响应类型在持续阶段表现出很强的SSA。从反应时程上看,初级响应类型在起始阶段后面紧跟着一个很强的抑制期,这个抑制期的存在可能是导致持续阶段产生较强SSA的主要原因,这与现有文献报道的抑制性输入调控了SSA的结论相似[23-25]。
总之,本研究通过在体电生理的方法发现刺激声音的听觉响应模式也是SSA的重要影响因素,即不同类型的响应模式可能产生不同程度的SSA,从而为我们理解SSA这一典型现象的作用和产生机制提供进一步的理论基础。
| [1] | Richardson BD, Hancock KE, Caspary DM. Stimulus-specific adaptation in auditory thalamus of young and aged awake rats[J]. J Neurophysiol, 2013, 110(8): 1892-902. DOI: 10.1152/jn.00403.2013. |
| [2] | Baeuerle P, Von Der Behrens W, Koessl MA. Stimulus-Specific adaptation in the gerbil primary auditory thalamus is the result of a fast Frequency-Specific habituation and is regulated by the corticofugal system[J]. J Neurosci, 2011, 31(26): 9708-22. DOI: 10.1523/JNEUROSCI.5814-10.2011. |
| [3] | Malmierca MS, Cristaudo S, Perez-Gonzalez D, et al. Stimulus-Specific adaptation in the inferior colliculus of the anesthetized rat[J]. J Neurosci, 2009, 29(17): 5483-93. DOI: 10.1523/JNEUROSCI.4153-08.2009. |
| [4] | Ayala YA, Udeh A, Dutta K, et al. Differences in the strength of cortical and brainstem inputs to SSA and non-SSA neurons in the inferior colliculus[J]. Sci Rep, 2015, 5: 10383. DOI: 10.1038/srep10383. |
| [5] | Ayala YA, Perez-Gonzalez D, Malmierca MS. Stimulus-specific adaptation in the inferior colliculus: The role of excitatory, inhibitory and modulatory inputs[J]. Biol Psychol, 2016, 116: 10-22. DOI: 10.1016/j.biopsycho.2015.06.016. |
| [6] | Cacciaglia R, Escera C, Slabu L, et al. Involvement of the human midbrain and thalamus in auditory deviance detection[J]. Neuropsychologia, 2015, 68: 51-8. DOI: 10.1016/j.neuropsychologia.2015.01.001. |
| [7] | Reches A, Netser S, Gutfreund Y. Interactions between StimulusSpecific Adaptation and Visual Auditory Integration in the Forebrain of the Barn Owl[J]. J Neurosci, 2010, 30(20): 6991-8. DOI: 10.1523/JNEUROSCI.5723-09.2010. |
| [8] | Briley PM, Krumbholz K. The specificity of stimulus-specific adaptation in human auditory cortex increases with repeated exposure to the adapting stimulus[J]. J Neurophysiol, 2013, 110(12): 2679-88. DOI: 10.1152/jn.01015.2012. |
| [9] | Von Der Behrens W, Baeuerle P, Koessl MA. Correlating StimulusSpecific adaptation of cortical neurons and local field potentials in the awake rat[J]. J Neurosci, 2009, 29(44): 13837-49. DOI: 10.1523/JNEUROSCI.3475-09.2009. |
| [10] | Antunes FM, Malmierca MS. An overview of Stimulus-Specific adaptation in the auditory thalamus[J]. Brain Topoqr, 2014, 27(4): 480-99. DOI: 10.1007/s10548-013-0342-6. |
| [11] | Herrmann B, Henry MJ, Fromboluti EK, et al. Statistical context shapes stimulus-specific adaptation in human auditory cortex[J]. J Neurophysiol, 2015, 113(7): 2582-91. DOI: 10.1152/jn.00634.2014. |
| [12] | Nir Y, Vyazovskiy VV, Cirelli C, et al. Auditory responses and Stimulus-Specific adaptation in rat auditory cortex are preserved across NREM and REM sleep[J]. Cereb Cortex, 2015, 25(5): 1362-78. DOI: 10.1093/cercor/bht328. |
| [13] | Antunes FM, Nelken I, Covey E, et al. Stimulus-Specific adaptation in the auditory thalamus of the anesthetized rat[J]. PLoS One, 2010, 5(11): e14071. DOI: 10.1371/journal.pone.0014071. |
| [14] | Perez-Gonzalez D, Malmierca MS. Variability of the time course of stimulus-specific adaptation in the inferior colliculus[J]. Front Neural Circuits, 2012, 6: 107. |
| [15] | 王鸿南, 吴玮, 韩浩伦, 等. 刺激声频率差异变化对正常人失匹配负波的影响[J]. 中华耳科学杂志, 2015, 03(13): 525-8. |
| [16] | Duque D, Malmierca MS. Stimulus-specific adaptation in the inferior colliculus of the mouse: anesthesia and spontaneous activity effects[J]. Brain Struct Funct, 2015, 220(6): 3385-98. DOI: 10.1007/s00429-014-0862-1. |
| [17] | Malmierca MS, Anderson LA, Antunes FM. The cortical modulation of stimulus-specific adaptation in the auditory midbrain and thalamus: a potential neuronal correlate for predictive coding[J]. Front Syst Neurosci, 2015, 9: 19. |
| [18] | Ayala YA, Malmierca MS. Stimulus-specific adaptation and deviance detection in the inferior colliculus[J]. Front Neural Circuits, 2013, 6: 89. |
| [19] | Vinken K, Vogels R, Op de Beeck H. Recent visual experience shapes visual processing in rats through Stimulus-Specific adaptation and response enhancement[J]. Curr Biol, 2017, 27(6): 914-9. DOI: 10.1016/j.cub.2017.02.024. |
| [20] | Klein C. von der Behrens W, Gaese BH. Stimulus-specific adaptation in field potentials and neuronal responses to frequencymodulated tones in the primary auditory cortex[J]. Brain Topogr, 2014, 27(4): 599-610. DOI: 10.1007/s10548-014-0376-4. |
| [21] | Nieto-Diego J, Malmierca MS. Topographic distribution of Stimulus-Specific adaptation across auditory cortical fields in the anesthetized rat[J]. PLoS Biol, 2016, 14(3): e1002397. DOI: 10.1371/journal.pbio.1002397. |
| [22] | Duque D, Malmierca MS, Caspary DM. Modulation of stimulusspecific adaptation by GABA(A) receptor activation or blockade in the medial geniculate body of the anaesthetized rat[J]. J Physiol, 2014, 592(4): 729-43. DOI: 10.1113/jphysiol.2013.261941. |
| [23] | Ayala YA, Malmierca MS. The effect of inhibition on stimulusspecific adaptation in the inferior colliculus[J]. Brain Struct Funct, 2017, [Epub ahead of print]. |
| [24] | Antunes FM, Malmierca MS. An overview of Stimulus-Specific adaptation in the auditory thalamus[J]. Brain Topogr, 2014, 27(4, SI): 480-99. DOI: 10.1007/s10548-013-0342-6. |
| [25] | Valdes-Baizabal C, Parras GG, Ayala YA, et al. Endocannabinoid modulation of Stimulus-Specific adaptation in inferior colliculus neurons of the rat[J]. Sci Rep, 2017, 7(1): 6997. DOI: 10.1038/s41598-017-07460-w. |
 2018, Vol. 38
2018, Vol. 38

