2. 重庆医科大学附属儿童医院 重庆市干细胞治疗工程技术研究中心,重庆 400014;
3. 重庆医科大学附属儿童医院 呼吸中心,重庆 400014
2. Chongqing Engineering Research Center of Stem Cell Therapy, Chongqing 400014, China;
3. Respiratory Center, Children's Hospital of Chongqing Medical University, Chongqing 400014, China
支气管哮喘(简称哮喘)是儿童时期最为常见的一种慢性气道炎症性疾病,其发病率和死亡率逐年上升[1-2],给患者家庭带来沉重的精神和经济负担。哮喘重要的临床病理特征之一是气道黏液高分泌。过度分泌的黏液会阻塞气道,使肺功能下降,肺部感染增加,进而导致哮喘患者病情恶化,增加哮喘患者的病死率[3-5]。
新近研究发现,表观遗传学在哮喘的发生发展中发挥重要作用[6]。染色质重构复合物核心催化亚基Brg1是表观遗传学SWI/SNF家族的重要ATP酶亚基,其主要作用是利用ATP水解产生能量实现染色体重组[7]。有研究表明Brg1对上皮细胞增殖和分化起重要作用[8-10]。我们前期研究发现,哮喘患儿和哮喘小鼠模型均高表达Brg1 mRNA,且验证了Brg1通过抑制E-cadherin表达从而破坏气道上皮的完整性[11]。同时研究中发现敲低Brg1基因小鼠上建立哮喘模型后该模型鼠气道高反应,气道炎症均显著降低,说明Brg1在哮喘病理生理过程中起着重要的作用。气道黏液高分泌已经成为影响哮喘病情严重程度和预后的独立危险因素[12],但Brg1对于黏液高分泌的影响及其作用机制未见报道。因此本研究在前期基础上进一步探讨Brg1在哮喘气道黏液高分泌中的作用及可能机制,为治疗哮喘气道黏液高分泌提供新的方向。
1 材料和方法 1.1 实验动物SPF级雌性C57bl/6小鼠,6~8周龄,由重庆医科大学动物实验中心提供。Brg1-/-小鼠为在C57bl/6小鼠背景上特异性条件敲低Ⅱ型肺泡上皮细胞AEC2s上Brg1基因的纯合子小鼠。小鼠敲除和基因型鉴定方法[13]:将转基因小鼠Brg1fl/fl和SP-C-rtTA/(tetO)7-Cre进行交配,于生后大约7 d剪尾巴提取DNA,PCR检测小鼠基因型。将得到的纯合子小鼠给予2%多西环素水7 d,诱导(tetO)7-Cre重组酶活性从而靶向剪切AEC2s上Brg1基因。用RT-PCR和Western blot检测Brg1表达水平。
1.2 试剂卵清蛋白(OVA)和氢氧化铝凝胶(Sigma-Aldrich);IL-13 ELISA检测试剂盒(欣博盛生物科技);MUC5AC ELISA检测试剂盒(伊莱瑞特生物科技);糖原PAS染色试剂盒(雷根生物技术);兔超敏二步法免疫组化检测试剂盒(中杉金桥生物技术);STAT6兔抗鼠抗体(武汉三鹰生物技术);磷酸化STAT6兔抗鼠抗体(Abcam);BCA法蛋白定量试剂盒(百泰克生物技术);PCR引物由深圳华大基因合成;DNA Marker、SYBR Premix Ex TaqTM(TaKaRa公司);高纯总RNA快速提取试剂盒(重庆卡尔波生物技术)。
1.3 OVA激发构建正常野生型C57bl/c小鼠及Brg1-/-小鼠哮喘动物模型6~8周龄SPF级雌性小鼠随机分为4组:正常对照组、哮喘组、Brg1-/-(Brg1敲低对照组)和Brg1-/-+哮喘(Brg1敲低后构建哮喘模型组)。哮喘组和Brg1-/-+哮喘组均于实验第0、14天向小鼠腹腔内注射含20 μg鸡卵清蛋白和100 μg氢氧化铝的致敏液200 μL。实验第21天起,以1.5% OVA溶液5 mL雾化吸入进行激发,30 min/次,连续7 d。Control组和Brg1-/-组小鼠以等量生理盐水替代OVA致敏液及激发液,其余处理方法同哮喘组。
1.4 肺泡支气管灌洗液(BALF)及酶联免疫吸附实验(ELISA法)检测各组小鼠BALF中的IL-13和MUC5AC含量在最后1次雾化完24 h内将小鼠用10%水合氯醛麻醉,眼球取血后固定于泡沫板上,从气管上端插入留置针并固定。暴露胸腔和气管,用止血钳夹闭左侧肺门,预冷的无菌PBS灌洗3次,每次0.5 mL,将回吸的约1.5 mL的灌洗液于4 ℃,2500 r/min离心5 min,收集上清液,分装后冻于-80 ℃冰箱保存。参照ELISA试剂盒说明书检测其中的IL-13,MUC5AC的含量。
1.5 糖原PAS染色取左肺,马上置于4%中性甲醛溶液固定48 h、经脱水、石蜡包埋后,进行石蜡切片(片厚约4 μm),按照糖原PAS染色试剂盒说明进行PAS染色,PAS反应阳性物质(糖原或多糖)为红色或紫红色,细胞核为蓝色,细胞质为深浅不一的红色。选取直径大小一致的细支气管区取像并进行图像分析支气管黏液分泌情况。
1.6 肺组织中MUC5AC免疫组化染色石蜡包埋块,制作4 μm组织切片,脱蜡入水,一抗为兔抗小鼠MUC5AC的多克隆抗体,4 ℃孵育过夜,采用组化试剂盒孵育山羊抗兔二抗,DAB染色,苏木精复染,中性树脂封片,每组小鼠肺组织随机选取5个直径在500~1000 µm的细支气管区,应用Image Pro-Plus software 6.0软件计算阳性结果信号累积光密度(IA)。以MUC5AC染色阳性的IA值表示MUC5AC蛋白表达水平。
1.7 Western blot检测各组小鼠肺组织中STAT6和磷酸化STAT6蛋白的表达用RIPA裂解液分别裂解适量各组小鼠肺组织,离心提取总蛋白,按BCA蛋白定量试剂盒说明书测定蛋白浓度。取20 µg总蛋白经10% SDS-PAGE后转移至PVDF膜(美国Millipore公司),封闭后分别加入相应一抗(兔抗小鼠STAT6单克隆体1:500、兔抗小鼠pSTAT6多克隆抗体1: 500;内参:兔抗小鼠β-actin单克隆抗体1: 1000),4 ℃孵育过夜,漂洗后分别加入相应二抗(辣根过化物酶标记的山羊抗兔1: 5000稀释),室温孵育1 h,TBST洗膜后滴加ECL显色剂用荧光化学发光凝胶成像系统进行化学发光、照相,用Quatity One V4.62软件对条带进行定量分析。
1.8 q-PCR检测各组小鼠肺组织MUC5AC mRNA的表达采用高纯总RNA快速提取试剂盒提取各组小鼠肺组织总RNA,提取步骤参照试剂盒说明书进行。分别测定各组总RNA浓度,反转录合成模板cDNA。MUC5AC上游引物CAGCAGATCATCCGTCAGC AA,下游引物ATCGCAGCGCAGAGTCACA。内参为GAPDH上游引物CAGCGACACCCACTCCTCCA CCTT,下游引物CATGAGGTCCACCACCCTGTT GCT。PCR反应条件为:体系共10 μL;扩增条件:95 ℃预变性3 min;95 ℃变性5 s,60 ℃退火25 s,72 ℃延伸45 s,拍照1次39个循环;65~95 ℃,每升高0.5 ℃照相1次。
1.9 统计学分析本实验研究数据采用GraphPad Prism 5.0软件和SPSS 13.0统计软件进行统计分析。方差齐时,各组比较采用One-way ANOVA或Tukey检验;方差不齐时,各组比较用Kruskal-Wallis检验。组间比较用Twoway ANOVA。重复测量资料采用重复测量方差分析。以P < 0.05为差异有统计学意义。
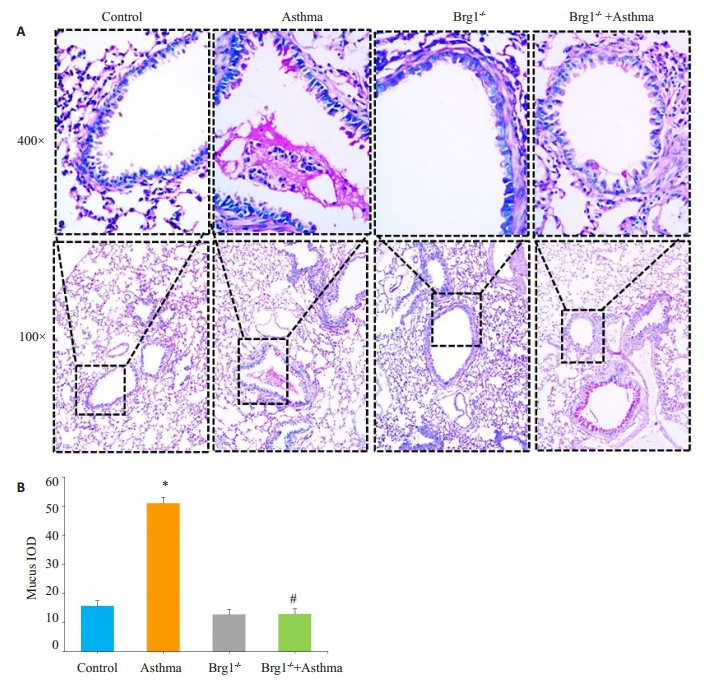
2 结果 2.1 各组小鼠肺组织糖原PAS染色结果糖原PAS染色反应阳性物质为红色或紫红色,哮喘组与Control组相比气道上皮杯状细胞明显增生,黏液过度分泌(P < 0.01)。Brg1-/-+哮喘组与哮喘组相比,杯状细胞数量、黏液分泌量均显著减少(P < 0.01),差异具有统计学意义(图 1)。
|
图 1 各组小鼠肺组织PAS染色 Figure 1 PAS staining of the lung tissues in each group. A: PAS staining; B: stastics of mucus secretion. *P < 0.05 vs Control; #P < 0.01 vs Asthma. |
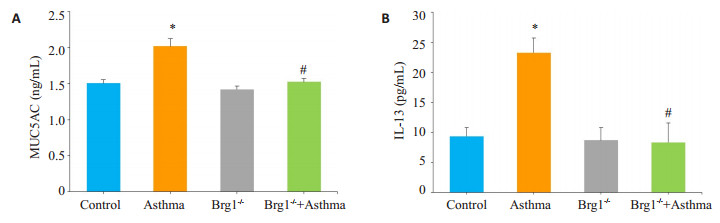
通过ELISA检测各组小鼠BAIF可知(图 2),哮喘组(2.022±0.2974)与对照组(1.508±0.1445)相比,BALF上清中黏蛋白MUC5AC表达水平显著升高(P < 0.01)。Brg1-/-+哮喘组(1.527±0.1184)则较哮喘组BALF上清中MUC5AC表达水平明显降低(P < 0.01)。细胞因子IL-13在哮喘组(23.26 ± 5.512)BALF中较对照组(9.322±2.937)明显升高(P < 0.01),且在Brg1-/-+哮喘组(8.316±7.715)与哮喘组相比明显降低,差异具有统计学意义(P < 0.01)。
|
图 2 各组小鼠BALF上清液中MUC5AC、IL-13含量 Figure 2 Expression of MUC5AC and IL-13 in the BALF of each group. *P < 0.01 vs Control; #P < 0.01 vs Asthma |
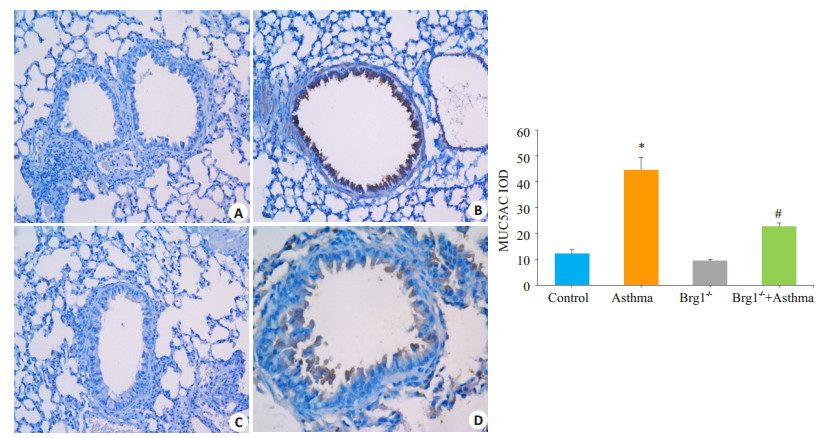
MUC5AC免疫组化染色阳性信号为气道上皮细胞细胞质及细胞膜显示黄色或黄棕色颗粒(图 3)。与Control组(12.29±3.336)比较,免疫组化染色显示哮喘组(44.62±11.76)气道上皮细胞中MUC5AC高表达(P < 0.01),而Brg1-/-+哮喘组(22.71±3.510)气道上皮细胞中MUC5AC较哮喘组表达显著减少,差异具有统计学意义(P < 0.01)。
|
图 3 各组小鼠气道上皮黏蛋白MUC5AC表达情况 Figure 3 Immunohistochemistry for detecting mucin MUC5AC expression and quantitative analysis in each group (Magnification: original magnification: ×200). A: Control; B: Asthma; C: Brg1-/-; D: Brg1-/-+Asthma. *P < 0.01 vs Control; #P < 0.01 vs Asthma. |
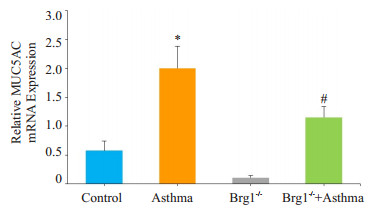
通过q-PCR检测黏蛋白MUC5AC mRNA的表达发现(图 4):哮喘组小鼠肺组织中黏蛋白MUC5AC mRNA与Control组比较,表达明显增高,差异具有统计学意义(P < 0.01)。与哮喘组比较,Brg1-/-+哮喘组MUC5AC mRNA表达显著降低,差异有统计学意义(P < 0.01)。
|
图 4 各组小鼠肺组织MUC5AC mRNA表达情况 Figure 4 Expression of MUC5AC mRNA in lung tissue of each group. *P < 0.01 vs Control, #P < 0.01 vs Asthma group |
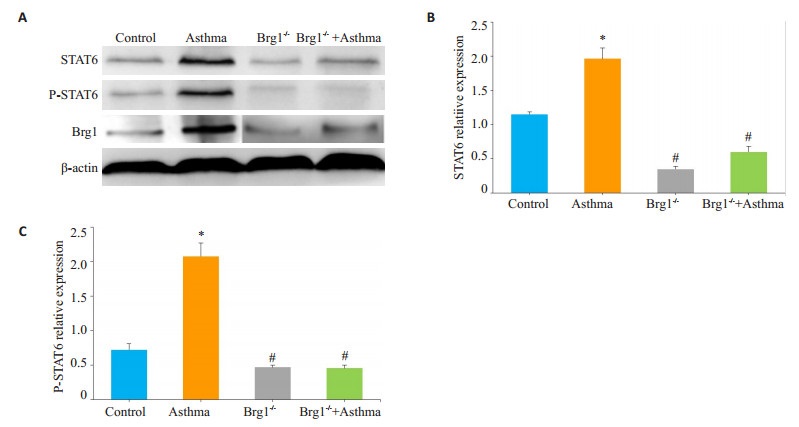
Western blot统计结果显示:与Control组相比,哮喘组小鼠肺组织STAT6和P-STAT6蛋白水平表达显著升高(P < 0.01),而Brg1-/-+哮喘组较哮喘组STAT6和PSTAT6表达明显下调(图 5,P < 0.01)。
|
图 5 各组小鼠肺组织中STAT6和p-STAT6表达情况 Figure 5 Western blotting for detecting STAT6 and PSTAT6 expression (A) and quantitative analysis (B, C) in lung tissue of each group. *P < 0.01 vs Control; #P < 0.01 vs Asthma. |
哮喘的发病机制与遗传与环境因素密切相关,研究报道表观遗传调控在遗传和环境因素之间起着非常重要的媒介作用[14-15]。表观遗传学主要研究DNA序列没有发生变化而基因的表达却发生了可遗传的改变,这些改变包括:DNA甲基化、组蛋白乙酰化和染色质重构等[6, 14-15]。Brg1定位于19p13染色体,是人类进化上高度保守的SWI/SNF染色质重构复合物中的成员之一[16]。研究显示Brg1是一种磷酸化核蛋白,主要通过ATP依赖的方式破坏组氨酸-DNA的接触,改变染色体结构从而调节基因的表达[17]。本实验研究发现当Brg1敲低后再用OVA刺激构建哮喘模型,Brg1敲低小鼠气道上皮杯状细胞数量和黏液分泌量均显著下降,差异具有统计学意义。气道黏液的主要成分是气道上皮杯状细胞分泌的黏蛋白(MUC)。研究报道哮喘患者气道上皮杯状细胞数量是正常人的3倍[4, 18];哮喘气道黏液高分泌的主要特征性表现是杯状细胞化生和MUC5AC表达上调[19]。本实验检测了BALF上清中黏蛋白MUC5AC表达水平和肺组织黏蛋白MUC5AC的表达发现敲低了Brg1后两者表达均显著降低。以上数据均表明Brg1在哮喘气道黏液高分泌中发挥重要的作用。哮喘黏液高分泌原因复杂多样,涉及诸多信号通路,其中IL-13/STAT6通路在黏液高分泌中的作用是研究最深入的。IL-13是一种主要由Th2细胞分泌的多效性细胞因子,研究表明IL-13能引起气道上皮杯状细胞化生及黏液高分泌[20],IL-13抑制剂或者直接敲除IL-13后则气道杯状细胞和MUC5AC表达显著减少[21]。本实验检测到Brg1敲低小鼠在建立哮喘模型后BALF中细胞因子IL-13较正常建模组是显著下降的。信号转导与转录激活因子6(STAT6)广泛参与各种细胞的生命活动调节,是细胞内信息传递的重要环节[22]。STAT6与哮喘的发病机制密切相关,有研究报道证实哮喘患者支气管上皮细胞内大量表达STAT6 [23],STAT6可促进TH2免疫应答和B细胞的分化等作用[24-25]。IL-13是STAT6传导通路的上游刺激因子[26]。相关研究表明IL-13和其受体IL-4Rα(或IL-13Rα1)结合后使受体上的酪氨酸残基磷酸化,该残基和STAT6结合,使STAT6被磷酸化激活,转位到细胞核内同MUC5AC启动子区域特定基因结合位点结合从而激活MUC5AC的转录[27-28]。本实验检测到Brg1敲低小鼠肺组织STAT6和P-STAT6的表达显著降低;同时MUC5AC的转录水平MUC5AC mRNA的表达明显降低。
综上所述,Brg1敲低后用OVA致敏构建哮喘模型,其气道杯状细胞数量和黏液分泌减少,肺组织MUC5AC mRNA和黏蛋白MUC5AC表达下降。在Brg1敲除小鼠哮喘组IL-13、STAT6及P-STAT6的表达也明显降低。提示Brg1可能是通过影响STAT6信号通路从而影响哮喘黏液高分泌。为今后气道黏液高分泌类型哮喘的研究和治疗提供了新的靶点和方向,但其具体机制还有待进一步的研究。
| [1] | Tanabe T, Shimokawaji T, Kanoh S, et al. Secretory phospholipases A2 are secreted from ciliated cells and increase mucin and eicosanoid secretion from goblet cells[J]. Chest, 2015, 147(6): 1599-609. DOI: 10.1378/chest.14-0258. |
| [2] | Croisant S. Epidemiology of asthma: prevalence and burden of disease[J]. Adv Exp Med Biol, 2014, 795: 17-29. DOI: 10.1007/978-1-4614-8603-9. |
| [3] | Song JW, Seo CS, Cho ES, et al. meso-Dihydroguaiaretic acid attenuates airway inflammation and mucus hypersecretion in an ovalbumin-induced murine model of asthma[J]. Int Immunopharmacol, 2016, 31: 239-47. DOI: 10.1016/j.intimp.2015.12.033. |
| [4] | Ordoñez CL, Khashayar R, Wong HH, et al. Mild and moderate asthma is associated with airway goblet cell hyperplasia and abnormalities in mucin gene expression[J]. Am J Respir Crit Care Med, 2001, 163(2): 517-23. DOI: 10.1164/ajrccm.163.2.2004039. |
| [5] | Williams OW, Sharafkhaneh A, Kim V, et al. Airway mucus: From production to secretion[J]. Am J Respir Cell Mol Biol, 2006, 34(5): 527-36. DOI: 10.1165/rcmb.2005-0436SF. |
| [6] | Ho SM. Environmental epigenetics of asthma: an update[J]. J Allergy Clin Immunol, 2010, 126(3): 453-65. DOI: 10.1016/j.jaci.2010.07.030. |
| [7] | Wong AK, Shanahan F, Chen Y, et al. BRG1, a component of the SWI-SNF complex, is mutated in multiple human tumor cell lines[J]. Cancer Res, 2000, 60(21): 6171-7. |
| [8] | Qi W, Wang R, Chen H, et al. BRG1 promotes the repair of DNA double-strand breaks by facilitating the replacement of RPA with RAD51[J]. J Cell Sci, 2015, 128(2): 317-30. DOI: 10.1242/jcs.159103. |
| [9] | Weiss RM, Guo S, Shan A, et al. Brg1 determines urothelial cell fate during ureter development[J]. J Am Soc Nephrol, 2013, 24(4): 618-26. DOI: 10.1681/ASN.2012090902. |
| [10] | Holik AZ, Krzystyniak J, Young M, et al. Brg1 is required for stem cell maintenance in the murine intestinal epithelium in a tissuespecific manner[J]. Stem Cells, 2013, 31(11): 2457-66. DOI: 10.1002/stem.v31.11. |
| [11] | Wang T, Zou W, Niu C, et al. Brg1 inhibits E-cadherin expression in lung epithelial cells and disrupts epithelial integrity[J]. J Mol Med (Berl), 2017, 95(10): 1117-26. DOI: 10.1007/s00109-017-1576-7. |
| [12] | Davis CW, Dickey BF. Regulated airway goblet cell mucin secretion[J]. Annu Rev Physiol, 2008, 70: 487-512. DOI: 10.1146/annurev.physiol.70.113006.100638. |
| [13] | 司道祝, 彭单伊, 张荣, 等. Ⅱ型肺泡上皮细胞Brg1基因条件敲低小鼠的基因型鉴定[J]. 中国细胞生物学学报, 2017, 39(3): 280-7. DOI: 10.11844/cjcb.2017.03.0283. |
| [14] | Castro-Rodríguez JA, Krause BJ, Uauy R, et al. Epigenetics in allergic diseases and asthma[J]. Rev Chil Pediatr, 2016, 87(2): 88-95. DOI: 10.1016/j.rchipe.2016.02.006. |
| [15] | DeVries A, Vercelli D. Epigenetic mechanisms in asthma[J]. Ann Am Thorac Soc, 2016, 13(Suppl 1): S48-50. |
| [16] | Wurster AL, Pazin MJ. BRG1-mediated chromatin remodeling regulates differentiation and gene expression of T helper cells[J]. Mol Cell Biol, 2008, 28(24): 7274-85. DOI: 10.1128/MCB.00835-08. |
| [17] | Hargreaves DC, Crabtree GR. ATP-dependent chromatin remodeling: genetics, genomics and mechanisms[J]. Cell Res, 2011, 21(3): 396-420. DOI: 10.1038/cr.2011.32. |
| [18] | Yamauchi K. Airway remodeling in asthma and its influence on clinical pathophysiology[J]. Tohoku J Exp Med, 2006, 209(2): 75-87. DOI: 10.1620/tjem.209.75. |
| [19] | Ni ZH, Tang JH, Chen G, et al. Resveratrol inhibits mucus overproduction and MUC5AC expression in a murine model of asthma[J]. Mol Med Rep, 2016, 13(1): 287-94. DOI: 10.3892/mmr.2015.4520. |
| [20] | Kuperman DA, Huang X, Koth LL, et al. Direct effects of interleukin-13 on epithelial cells cause airway hyperreactivity and mucus overproduction in asthma[J]. Nat Med, 2002, 8(8): 885-9. DOI: 10.1038/nm734. |
| [21] | Whittaker L, Niu N, Temann UA, et al. Interleukin-13 mediates a fundamental pathway for airway epithelial mucus induced by CD4 T cells and interleukin-9[J]. Am J Respir Cell Mol Biol, 2002, 27(5): 593-602. DOI: 10.1165/rcmb.4838. |
| [22] | Banerjee S, Biehl A, Gadina M, et al. JAK-STAT signaling as a target for inflammatory and autoimmune diseases: current and future prospects[J]. Drugs, 2017, 77(5): 521-46. DOI: 10.1007/s40265-017-0701-9. |
| [23] | Mullings RE, Wilson SJ, Puddicombe SM, et al. Signal transducer and activator of transcription 6 (STAT-6) expression and function in asthmatic bronchial epithelium[J]. J Allergy Clin Immunol, 2001, 108(5): 832-8. DOI: 10.1067/mai.2001.119554. |
| [24] | Oh CK, Geba GP, Molfino N. Investigational therapeutics targeting the IL-4/IL-13/STAT-6 pathway for the treatment of asthma[J]. Eur Respir Rev, 2010, 19(115): 46-54. DOI: 10.1183/09059180.00007609. |
| [25] | Pfitzner E, Kliem S, Baus D, et al. The role of STATs in inflammation and inflammatory diseases[J]. Curr Pharm Des, 2004, 10(23): 2839-50. DOI: 10.2174/1381612043383638. |
| [26] | Kelly-Welch AE, Hanson EM, Boothby MR, et al. Interleukin-4 and interleukin-13 signaling connections maps[J]. Science, 2003, 300(5625): 1527-8. DOI: 10.1126/science.1085458. |
| [27] | Gour N, Wills-Karp M. IL-4 and IL-13 signaling in allergic airway disease[J]. Cytokine, 2015, 75(1): 68-78. DOI: 10.1016/j.cyto.2015.05.014. |
| [28] | Lupardus PJ, Birnbaum ME, Garcia KC. Molecular basis for shared cytokine recognition revealed in the structure of an unusually high affinity complex between IL-13 and IL-13Ralpha2[J]. Structure, 2010, 18(3): 332-42. DOI: 10.1016/j.str.2010.01.003. |
 2018, Vol. 38
2018, Vol. 38

