2. 珠海南医大生物医药公共服务平台有限公司,广东 珠海 519090
2. Zhuhai SMU Biomedicine Public Service Platform, Zhuhai 519090, China
Notch信号通路广泛存在于高等生物中,是细胞命运决定和个体发育的关键信号通路之一。人和哺乳动物有4种Notch受体(Notch1-4)和5种配体(Jagged1、Jagged2和DLL1、DLL3、DLL4)[1]。自2004年首次报道约50%的T细胞急性淋巴细胞白血病患者中发现Notch1基因突变[2]以来,越来越多研究表明Notch信号通路的异常与多种肿瘤的发生发展密切相关[3-6]。Notch信号通路已经成为了新的肿瘤诊断和治疗靶点[7-9]。
胃癌是引起世界范围内癌症相关死亡的第三大原因[10],已有研究表明:Notch配体的异常表达与胃癌的发生发展密切相关。例如,Jagged1在弥散型胃癌和低分化型胃癌中显著过度表达,在T期、N期和TNM期的胃癌病人中检测到DLL4高表达[11];DLL4的过表达增强胃癌干细胞的自我更新能力,并且通过激活Notch1信号通路造成胃癌患者的不良预后[12],同时,研究发现在瘤内注射Jagged1和DLL4的siRNA可以抑制肿瘤生长[13]。已有研究发现DLL3在小细胞肺癌[14],急性髓性白血病[15]和大细胞神经内分泌瘤[16]中过表达,人DLL3在肺腺癌患者中的高表达与其总体生存率下降有关[17]。但是,DLL3在胃癌中的作用及机制尚不明确。最近,我们通过分析TCGA(The Cancer Genome Altas)数据库中393例人胃癌(GC)病人的DLL3基因突变、拷贝数变异中发现,人DLL3基因在5%的上述样本发生了的基因突变和拷贝数变异,UCSC(University of California, Santa Cruz)数据库的478例胃癌患者的RNAseq数据表明大部分患者的癌组织中DLL3表达量降低,少部分胃癌患者的癌组织中DLL3表达量增加,而Kaplan Meier生存分析表明DLL3高表达患者的生存时间降低,提示人DLL3可能与GC的发生发展密切相关,因此,有必要阐明DLL3介导的Notch信号在胃癌发生发展中的作用及分子机制。
目前未见到有关于人DLL3基因表达的报道,本研究在前期已表达人Notch配体DLL1[18]、DLL4[19]和Jagged 1 [20]的基础上,旨在构建人全长DLL3真核表达质粒,并在HEK293T细胞中获得人全长DLL3蛋白的表达,进一步转染AGS等3株胃癌细胞,探究过表达DLL3对胃癌细胞增殖的影响,采用特异性siRNA下调胃癌细胞中DLL3的表达,进一步验证DLL3对胃癌细胞增殖的影响。
1 材料和方法 1.1 材料 1.1.1 质粒,菌株,细胞系人DLL3(NM_016941)cDNA克隆(DLL3/pOTB7)质粒(优宝生物);载体pCMVTag4和HEK293T、GES-1、AGS、MGC803和MKN45细胞由本实验室保存;感受态大肠杆菌DH5α和JM109(Tiangen)。
1.1.2 试剂TaKaRa TaqTM、DL 5000 DNAmarker、pMDTM 18-T Vector Cloning Kit、限制性核酸内切酶Sal Ⅰ、BamH Ⅰ、T4 DNA连接酶、RNAiso Plus、割胶回收试剂盒、质粒提取试剂盒、PrimeScriptTM RT reagent Kit with gDNA Eraser逆转录试剂盒(TaKaRa);RT-qPCR试剂盒ChamQ SYBR qPCR Master Mix(Vazyme);LipofectamineTM 2000(Invitrogen);人DLL3-siRNA(sc-62206),Control siRNA(sc-37007)(Santa Cruz);小鼠抗人DLL3抗体(R&D Systems);兔抗人GAPDH抗体、小鼠抗人β-actin抗体(Bioworld);RIPA细胞裂解液、PMSF、170 000 protein marker、PVDF膜、EZ-ECL发光试剂、HRP标记的羊抗小鼠IgG、HRP标记的羊抗兔IgG等(弗德生物);Brad ford蛋白检测试剂盒(碧云天);引物合成、基因测序由广州艾基生物技术有限公司完成。
1.1.3 仪器PCR仪(Veriti 96 well Thermal Cycler),实时荧光定量PCR仪(ABI 7500)(Applied Biosystem)。
1.1.4 培养基小牛血清(四季青);DMEM培养基(Gibco)。
1.1.5 引物设计根据Genbank中人DLL3 (NM_ 016941.3)的基因序列,设计扩增人全长DLL3基因的PCR上下游引物,上游引物:5'-GCCACCATGGTCT CCCCACGGATGT-3';下游引物:5'-TTTCACGGAC AGAATCGAGGAAGGGTA-3';设计特异性实时荧光定量PCR(qRT-PCR)引物,以β-actin为内参检测DLL3在mRNA水平的表达,DLL3上游引物:5'-GACCCTC AGCGCTACCTTTT-3';DLL3下游引物:5'-TACATCT TCAGGGCGATTCC-3';β-actin上游引物:5'-TGGCA CCCAGCACAATGAA-3';β-actin下游引物:5'-CTAA GTCATAGTCCGCCTAGAAGCA-3'。
上述引物均由广州艾基生物技术有限公司完成。
1.2 方法 1.2.1 人全长DLL3基因的扩增以人全长DLL3/ pOTB7质粒为模板,通过PCR扩增人全长DLL3基因,PCR反应条件为95 ℃ 5 min;98 ℃ 10 s,56 ℃ 50 s、72 ℃ 2 min,34个循环;72 ℃ 15 min。PCR产物经1%琼脂糖凝胶电泳鉴定。
1.2.2 人全长DLL3/pCMV-Tag4重组质粒的构建和鉴定切胶回收PCR产物,将纯化的PCR产物与pMD18-T(9:1)在T4 DNA连接酶作用下,16 ℃连接30 min,转化感受态大肠杆菌JM109,在含有X-Gal、IPTG、Amp的LB-琼脂平板培养基上过夜培养,次日挑取白色的单菌落进行培养并提取质粒,将阳性质粒用BamH Ⅰ和Sal Ⅰ双酶切回收人全长DLL3基因,并克隆至真核表达载体pCMV-Tag4。重组质粒经BamH Ⅰ和Sal Ⅰ双酶切和DNA测序进行鉴定。
1.2.3 人全长DLL3/pCMV-Tag4重组质粒瞬时转染HEK293T细胞用DMEM完全培养基(10% FBS)常规培养HEK293T细胞,每2~3 d传代1次。以2.5×106/mL细胞接种到6孔板,待细胞生长到90%,按LipofectamineTM 2000转染试剂盒说明书进行转染,同时转染空载体pCMV-Tag4作为阴性对照组,无转染质粒的HEK293T细胞作为空白对照组,转染24 h后消化各组细胞,提取细胞总RNA和蛋白质进行mRNA和蛋白水平鉴定。
1.2.4 qRT-PCR检测人DLL3基因在mRNA水平的表达重组人全长DLL3/pCMV-Tag4质粒转染HEK293T细胞24 h后,消化各组细胞并用PBS清洗3遍离心去除上清,提取细胞总RNA,测RNA浓度和纯度后按逆转录试剂盒说明完成逆转录。按照qRT-PCR试剂盒说明,以β-actin作内参进行DLL3 mRNA检测,总反应体系为20 μL并设置3个复孔,以超纯水为模板做阴性对照,反应程序为95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.2.5 Western blot鉴定人全长DLL3在蛋白水平的表达重组人全长DLL3/pCMV-Tag4质粒转染HEK293T细胞24 h后,消化各组细胞并用PBS清洗3遍离心去除上清收集细胞,用RIPA蛋白裂解液冰上裂解细胞,每5 min涡旋振荡1次,20 min后离心取上清,用Bradford法测定蛋白浓度后加入蛋白上样缓冲液5×loading buffer,沸水浴10 min,进行10% SDS-PAGE电泳(18 mA,90 min),蛋白上样量约为10 μg,电泳结束后200 mA恒流90 min转至PVDF膜,用含5%的脱脂奶粉的TBST(10 mmol/L Tris-HCl,pH7.5,150 mmol/L NaCl,0.08% Tween-20)室温封闭1.5 h,分别加入小鼠抗人DLL3抗体和兔抗人β-actin抗体室温孵育30 min后4 ℃过夜,用TBST洗去未结合的抗体,再分别加入HRP标记的羊抗小鼠和羊抗兔IgG二抗,室温孵育1 h;TBST洗去未结合二抗后用EZ-ECL发光试剂检测结果。
1.2.6 DLL3在胃癌细胞系中的表达分析待胃癌细胞AGS、MGC803和MKN45及正常胃上皮细胞GES-1长到80%~90%时提取各细胞的总RNA,反转录为cDNA后进行qRT-PCR的检测,细胞总RNA制备和qRT-PCR步骤同1.2.4;同时用RIPA细胞裂解液(1:100加入PMSF)裂解细胞提取总蛋白,用小鼠抗人DLL3抗体检测DLL3蛋白的表达,细胞总蛋白制备和Western blot步骤同1.2.5。
1.2.7 过表达人DLL3对胃癌细胞增殖的影响重组质粒DLL3/pCMV-Tag4和载体质粒pCMV-Tag4分别按照LipofectamineTM 2000转染试剂盒说明转染胃癌细胞AGS、MGC803和MKN45后,消化各组细胞并用PBS清洗3遍去除上清收集细胞,细胞总蛋白制备和Western blot步骤同1.2.5。Western blot检测DLL3可在AGS等3株胃癌细胞中过表达后,向96孔板中汇合度长至60%的AGS、MGC803和MKN45细胞转染重组质粒DLL3/pCMV-Tag4 48 h,去上清,每孔加入200 μL MTT工作液,于细胞培养箱中孵育2 h,去上清,加入200 μL DMSO充分溶解沉淀后使用酶标仪(490 nm)检测其吸光度(A)。
1.2.8 下调人DLL3在胃癌细胞中的表达及其对细胞增殖的影响人DLL3-siRNA和Control siRNA分别按照LipofectamineTM 2000转染试剂盒说明转染胃癌细胞MGC803和MKN45细胞,24 h后消化各组细胞并用PBS清洗3遍去除上清收集细胞,细胞总蛋白制备和Western blot步骤同1.2.5。Western blot检测DLL3在MKN45和MGC803胃癌细胞中表达下调后,向96孔板中汇合度长至60%的MGC803和MKN45细胞转染DLL3-siRNA和Control siRNA 48 h,去上清,每孔加入200 μL MTT工作液,于细胞培养箱中孵育2 h,去上清,加入200 μL DMSO充分溶解沉淀后使用酶标仪(490 nm)检测其吸光度(A)。
1.2.9 统计学分析每项实验独立重复3次,应用统计学分析软件SPSS 20.0进行统计学处理,实验数据用均数±标准差表示,对于qRT-PCR结果,多组间差异比较采用单因素方差分析,两两比较采用LSD法,α=0.05;对于MTT结果,采用两独立样本t检验,P < 0.05认为差异有统计学意义。
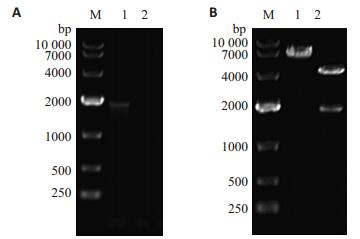
2 结果 2.1 全长人DLL3/pCMV-Tag4重组质粒的构建及鉴定以人全长DLL3/pOTB7 cDNA为模板,PCR产物经1%琼脂糖凝胶电泳电泳结果显示在1800 bp左右可见特异性目的条带(图 1A),与预期结果一致。用BamH Ⅰ和Sal Ⅰ双酶切获得人全长DLL3基因并克隆至pCMV-Tag4,重组质粒经BamH Ⅰ和Sal Ⅰ进行双酶切鉴定,获得4300 bp和1800 bp的两条片段(图 1B),大小与预期相符,将酶切正确的阳性进一步进行DNA测序,测序结果经NCBI BLAST比对,显示读码框正确,将该阳性克隆命名为DLL3/pCMV-Tag4。
|
图 1 全长人DLL3/pCMV-Tag4重组质粒的构建及鉴定 Figure 1 Construction and identification of the recombinant plasmid DLL3/pCMV-Tag4. A: PCR amplification of full-length human DLL3 gene. M: DL 10 000 DNA marker; 1: Human DLL3 gene; 2: Negative control. B: Restriction enzyme digestion of recombinant eukaryotic plasmid DLL3/pCMV-Tag4. M: DL 10 000 DNA marker; 1: DLL3/ pCMV-Tag4 plasmid; 2: DLL3/pCMV-Tag4 plasmid digested by BamH I and Sal I. |
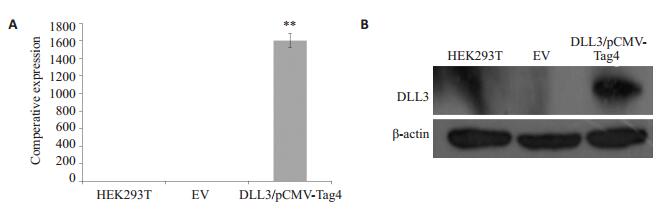
将人全长DLL3/pCMV-Tag4重组质粒和空载体pCMV-Tag4分别转染HEK293T细胞,无转染质粒HEK293T细胞作为空白对照。24 h后提取细胞总RNA,反转录成cDNA后进行qRT-PCR检测。结果显示,相对于对照组,人全长DLL3/pCMV-Tag4重组质粒转染HEK293T细胞24 h后,人DLL3的mRNA的表达水平明显升高(图 2A)。人全长DLL3/pCMV-Tag4重组质粒转染HEK293T细胞24 h后,提取细胞总蛋白,利用小鼠抗人DLL3抗体检测目的蛋白的表达,结果显示在约78 000处有一条特异性目的条带的表达,而对照组则未检测到目的条带(图 2B),说明DLL3/pCMV-Tag4重组质粒在HEK293T细胞中表达。
|
图 2 人DLL3在HEK293T细胞中表达 Figure 2 Expression of DLL3 in HEK293T cells. A: Analysis of expression of human DLL3 mRNA by qRT-PCR (**P < 0.01 vs HEK293T cells); B: Analysis of expression of full-length human DLL3 protein by Western blotting. |
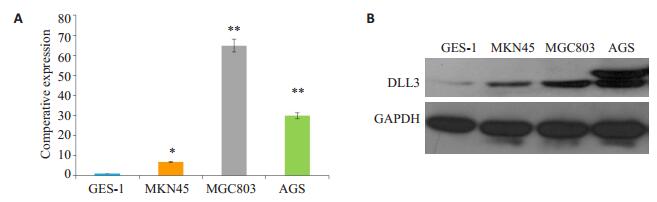
待胃癌细胞AGS、MGC803和MKN45及正常胃上皮细胞GES-1细胞长到80%~90%提取各细胞的总RNA,反转录为cDNA后进行qRT-PCR的检测,同时用RIPA蛋白强裂解细胞提取总蛋白,用小鼠抗人DLL3抗体检测人全长DLL3蛋白的表达。结果显示:相对于GES-1,人DLL3 mRNA在AGS等3株胃癌细胞中表达水平显著升高(图 3A);进一步的Western blot表明:人DLL3在3株胃癌细胞中的表达量均高于GES-1(图 3B),与qRT-PCR结果相符。
|
图 3 人DLL3基因在正常胃上皮细胞GES-1和胃癌的表达分析 Figure 3 Expression of human DLL3 gene in normal gastric epithelial cells GES-1 and 3 gastric cancer cell lines. A: Analysis of relative expression of human DLL3 mRNA by qRT-PCR (*P < 0.05, **P < 0.01 vs GES-1 cells); B: Analysis of expression of human full-length DLL3 protein by Western blotting. |
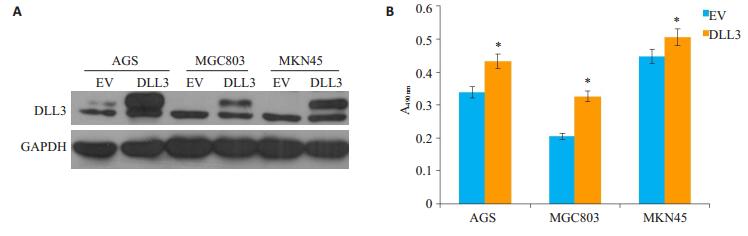
在3株胃癌细胞进行DLL3的过表达,通过Western blot检测DLL3蛋白的表达,结果显示:转染DLL3/pCMV-Tag4后,在大约68 000和78 000处有两条特异性目的条带,而转染空载体对照组只有1条68 000的目标条带,说明DLL3在胃癌细胞过表达成功(图 4A),之后我们进行了MTT实验以检测DLL3蛋白的过表达对细胞增殖的影响,结果显示,DLL3的过表达促进了胃癌细胞的增殖(图 4B)。
|
图 4 过表达人全长DLL3蛋白对胃癌细胞增殖的影响 Figure 4 Effect of over-expression of DLL3 on gastric cancer cell proliferation. A: Analysis of over-expression of human full-length DLL3 protein in gastric cancer cells by Western blotting; B: Proliferation of gastric cancer cells after over-expression of human full-length DLL3 protein (*P < 0.05 vs EV group). EV: Gastric cancer cells transfected by pCMV-Tag4 vector; DLL3: Gastric cancer cells transfected by DLL3/pCMV-Tag |
在胃癌细胞MGC803和MKN45中转染特异性人DLL3-siRNA下调DLL3的表达,通过Western blot检测DLL3蛋白的表达,结果显示:转染24 h后,同control siRNA组相比,DLL3-siRNA转染组中DLL3表达明显减少,表明采用特异性人DLL3-siRNA在上述胃癌细胞中成功下调DLL3表达(图 5A),进一步的MTT结果显示:下调DLL3抑制了上述胃癌细胞的增殖(图 5B)。
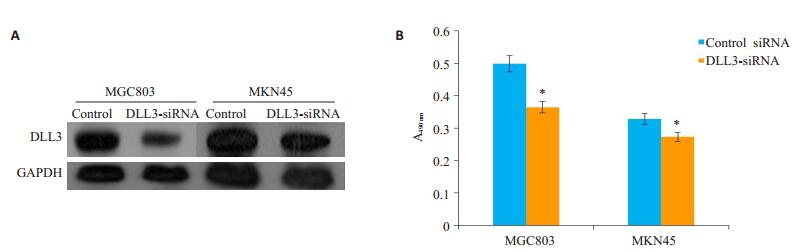
|
图 5 下调人DLL3基因的表达对胃癌细胞MGC803和MKN45增殖的影响 Figure 5 Effect of down-regulation of DLL3 on proliferation of MGC803 and MKN45 cells. A: Analysis of the expression of full-length DLL3 protein in MGC803 and MKN45 cells after transfection with specific human DLL3-siRNA by Western blotting; B: Proliferation of gastric cancer cells after DLL3-siRNA transfection (*P < 0.05 vs control siRNA group). |
人DLL3配体是由619个氨基酸组成的单次跨膜蛋白,其完整结构包含1个DSL结构域、1个胞内结构域和6个表皮生长因子样结构域。已有研究表明:DLL3可能抑制Notch受体介导的信号通路,这同DLL1和DLL4显著不同。例如DLL3不与相邻细胞表达的Notch受体结合或者激活Notch受体[21],反之当DLL3与其他Notch信号通路成员在细胞表面共表达时会抑制其他配体激活Notch信号通路[22]。在原发性肝细胞癌中,检测到DLL3基因发生甲基化沉默,当在这些癌细胞系中加入去甲基化药物或者导入外源性DLL3基因,则诱导癌细胞的凋亡[23],在晚期神经内分泌瘤大鼠模型中,一种DLL3靶向抗体药物(SC16LD6.5)能够清除大鼠体内的肿瘤起始细胞[16],最新研究发现,DLL3在超过80%的小细胞肺癌患者中均有高表达,Ⅰ期临床研究表明:使用Rova-T(抗DLL3蛋白抗体偶联细胞毒素Tesirine)治疗小细胞肺癌表现出良好的抗肿瘤活性[24]。因此,作为一个有潜在临床诊断和治疗价值的靶点,对DLL3在胃癌中的作用及其分子机制的深入研究具有重要价值。
在本研究中,我们首先通过酶切和测序分析表明成功构建了人全长DLL3/pCMV-Tag4重组质粒,当转染HEK293T细胞后发现:相对于转染空载体组,人全长DLL3/pCMV-Tag4重组质粒转染HEK293T细胞后,DLL3的mRNA水平显著提高(P < 0.05),进一步的Western blot结果显示在大约78 000处有DLL3-Flag融合蛋白特异性条带,表明人DLL3在293T细胞后获得表达。HEK293T细胞是人源化的细胞系,可对表达的目的蛋白进行翻译后修饰,有利于获得具有天然构象的重组蛋白,而pCMV-Tag4中有Flag表达标签,便于后续亲和纯化。
前期我们通过分析TCGA数据库和UCSC数据库提示人DLL3可能与胃癌的发生发展密切相关。为此,我们通过qRT-PCR和Western blot检测了DLL3在正常人胃上皮细胞GES-1和人胃癌细胞中的表达差异。结果显示,相对于GES-1,DLL3在AGS等3株胃癌细胞中表达升高(P < 0.05),其中DLL3在AGS中表达量最高,在MKN45中表达最低。为了进一步探究DLL3在胃癌中的作用,我们在AGS等3株胃癌细胞中进行DLL3的过表达,Western blot结果显示:人全长DLL3/pCMVTag4重组质粒转染上述3株胃癌细胞后,在约68 000和78 000处有两条特异性目的条带,而转染pCMV-Tag4空载体对照组只在68 000有一条目标条带,表明在AGS等3株胃癌细胞不仅检测到有表达内源性的人DLL3,而且,转染DLL3/pCMV-Tag4后获得外源性DLL3的表达。MTT实验结果表明:当人DLL3在AGS等3株胃癌细胞中过表达后均可以促进胃癌细胞的增殖(P < 0.05)。为了进一步验证这个结果,我们选择MKN45和MGC803细胞系,采用特异性人DLL3-siRNA下调上述胃癌细胞中DLL3的表达,Western blot结果表明特异性人DLL3-siRNA转染胃癌细胞后下调胃癌细胞中DLL3蛋白的表达,同时MTT结果显示:下调DLL3蛋白的表达均可抑制胃癌细胞的增殖(P < 0.05)。
综上,本研究成功在HEK293T细胞中获得人DLL3的表达,过表达DLL3则促进胃癌细胞的增殖,表明人DLL3介导的Notch信号通路可能在人胃癌发生发展中扮演重要作用。
| [1] | Chillakuri CR, Sheppard D, Lea SM, et al. Notch receptor-ligand binding and activation: insights from molecular studies[J]. Semin Cell Dev Biol, 2012, 23(4): 421-8. DOI: 10.1016/j.semcdb.2012.01.009. |
| [2] | Backer RA, Helbig C, Gentek R, et al. A central role for Notch in effector CD8(+) T cell differentiation[J]. Nat Immunol, 2014, 15(12): 1143-51. DOI: 10.1038/ni.3027. |
| [3] | Andersson ER, Lendahl U. Therapeutic modulation of Notch signalling--are we there yet?[J]. Nat Rev Drug Discov, 2014, 13(5): 357-78. DOI: 10.1038/nrd4252. |
| [4] | Brzozowa-Zasada M, Piecuch A, Dittfeld A, et al. Notch signalling pathway as an oncogenic factor involved in cancer development[J]. Contemp Oncol (Pozn), 2016, 20(4): 267-72. |
| [5] | Lim JS, Ibaseta A, Fischer MM, et al. Intratumoural heterogeneity generated by Notch signalling promotes small-cell lung cancer[J]. Nature, 2017, 545(7654): 360-4. DOI: 10.1038/nature22323. |
| [6] | Shen Q, Cohen B, Zheng WY, et al. Notch shapes the innate immunophenotype in breast cancer[J]. Cancer Discov, 2017, 7(11): 1320-35. DOI: 10.1158/2159-8290.CD-17-0037. |
| [7] | Yuan X, Wu H, Xu H, et al. Notch signaling: an emerging therapeutic target for cancer treatment[J]. Cancer Lett, 2015, 369(1): 20-7. DOI: 10.1016/j.canlet.2015.07.048. |
| [8] | Alketbi A, Attoub S. Notch signaling in cancer: rationale and strategies for targeting[J]. Curr Cancer Drug Targets, 2015, 15(5): 364-74. DOI: 10.2174/156800961505150710113353. |
| [9] | Stoeck A, Lejnine S, Truong A, et al. Discovery of biomarkers predictive of GSI response in triple-negative breast cancer and adenoid cystic carcinoma[J]. Cancer Discov, 2014, 4(10): 1154-67. DOI: 10.1158/2159-8290.CD-13-0830. |
| [10] | Smith JP, Nadella S, Osborne N. Gastrin and gastric cancer[J]. Cell Mol Gastroenterol Hepatol, 2017, 4(1): 75-83. DOI: 10.1016/j.jcmgh.2017.03.004. |
| [11] | Du X, Cheng Z, Wang YH, et al. Role of notch signaling pathway in gastric cancer: a meta-analysis of the literature[J]. World J Gastroenterol, 2014, 20(27): 9191-9. |
| [12] | Miao ZF, Xu H, Xu HM, et al. DLL4 overexpression increases gastric cancer stem/progenitor cell self-renewal ability and correlates with poor clinical outcome via Notch-1 signaling pathway activation[J]. Cancer Med, 2017, 6(1): 245-57. DOI: 10.1002/cam4.2017.6.issue-1. |
| [13] | Sun HW, Wu C, Tan HY, et al. Combination DLL4 with jagged1-siRNA can enhance inhibition of the proliferation and invasiveness activity of human gastric carcinoma by Notch1/VEGF pathway[J]. Hepatogastroenterology, 2012, 59(115): 924-9. |
| [14] | Rossi A. Rovalpituzumab tesirine and DLL3: a new challenge for small-cell lung cancer[J]. Lancet Oncol, 2017, 18(1): 3-5. DOI: 10.1016/S1470-2045(16)30575-7. |
| [15] | Yan S, Ma D, Ji M, et al. Expression profile of Notch-related genes in multidrug resistant K562/A02 cells compared with parental K562 cells[J]. Int J Lab Hematol, 2010, 32(2): 150-8. DOI: 10.1111/clh.2010.32.issue-2. |
| [16] | Saunders LR, Bankovich AJ, Anderson WC, et al. A DLL3-targeted antibody-drug conjugate eradicates high-grade pulmonary neuroendocrine tumor-initiating cells in vivo[J]. Sci Transl Med, 2015, 7(32): 302ra136. |
| [17] | Liu Z, Wu T, Li Q, et al. Notch signaling components[J]. Medicine, 2016, 95(20): e3715. DOI: 10.1097/MD.0000000000003715. |
| [18] | 粟芃芃, 叶健斌, 邱晓媚, 等. 人DLL1真核表达质粒的构建及过表达DLL1抑制人口腔鳞癌细胞SCC15的增殖[J]. 暨南大学学报:自然科学与医学版, 2017, 38(3): 185-91. |
| [19] | 叶健斌, 梁来妹, 陈中标, 等. 人Notch配体DLL4基因的克隆及真核表达[J]. 生物技术, 2015, 25(3): 223-6. |
| [20] | 叶健斌, 陈中标, 梁来妹, 等. 人Notch信号通路中Jagged1基因的克隆与真核表达[J]. 生物技术, 2015, 25(5): 437-41. |
| [21] | Chapman G, Sparrow DB, Kremmer E, et al. Notch inhibition by the ligand DELTA-LIKE 3 defines the mechanism of abnormal vertebral segmentation in spondylocostal dysostosis[J]. Hum Mol Genet, 2011, 20(5): 905-16. DOI: 10.1093/hmg/ddq529. |
| [22] | Ladi E, Nichols JT, Ge W, et al. The divergent DSL ligand Dll3 does not activate Notch signaling but cell autonomously attenuates signaling induced by other DSL ligands[J]. J Cell Biol, 2005, 170(6): 983-92. DOI: 10.1083/jcb.200503113. |
| [23] | Maemura K, Yoshikawa H, Yokoyama KA, et al. Delta-like 3 is silenced by methylation and induces apoptosis in human hepatocellular carcinoma[J]. Int J Oncol, 2013, 42(3): 817-22. DOI: 10.3892/ijo.2013.1778. |
| [24] | Rudin CM, Pietanza MC, Bauer TM, et al. Rovalpituzumab tesirine, a DLL3-targeted antibody-drug conjugate, in recurrent small-cell lung cancer: a first-in-human, first-in-class, open-label, phase 1 study[J]. Lancet Oncol, 2017, 18(1): 42-51. DOI: 10.1016/S1470-2045(16)30565-4. |
 2018, Vol. 38
2018, Vol. 38

