2. 广州医科大学附属口腔医院//广州口腔病研究所//口腔医学重点实验室,广东 广州 510140;
3. 南方医科大学深圳口腔医院,广东 深圳 518000
2. Key Laboratory of Oral Medicine, Guangzhou Institute of Oral Disease, Stomatology Hospital of Guangzhou Medical University, Guangzhou 510140, China;
3. Shenzhen Stomatological Hospital Affiliated to Southern Medical University, Shenzhen 518000, China
如何更快地修复骨缺损,一直是医学研究的热点[1]。一方面,随着1990年后期RNA干预(RNAi)作用的发现,人们发现siRNA能够特异性诱导序列基因沉默,因此siRNA用于局部治疗得到广泛研究[2],由于siRNA的易降解性,局部缓释体系的研究是siRNA局部治疗的重要研究部分[3-4]。另一方面,成骨材料层出不穷,胶原/生物活性玻璃复合材料具有生物活性玻璃优良的成骨活性和胶原优良的生物学性能而备受瞩目[5-6],同时胶原和生物活性玻璃分别作为siRNA局部缓释体系已有报道[7-8],但成骨能力仍然有限。Noggin蛋白是转化生长因子超家族成员之一,是骨形成蛋白BMP-2、-4、-5、-6和-7的拮抗蛋白,它能够结合以上蛋白从而阻止它们与受体结合[9-10],高表达noggin能够抑制前成骨细胞MC3T3成骨分化,减少小鼠颅盖骨缺损修复[11]。siRNA noggin和胶原/生物活性玻璃复合材料联合应用于成骨方面,胶原/生物活性玻璃复合材料不仅作为siRNA缓释体系,但这一缓释体系本身是否具有局部促进成骨能力仍未见报道。本研究拟结合siRNAnoggin和胶原/生物活性玻璃在成骨方面的作用,设计出负载siRNA胶原/生物活性玻璃复合材料,从而实现胶原/生物活性玻璃复合材料局部缓释siRNA的同时,达到胶原/生物活性玻璃材料与siRNA协同增效促进成骨。
1 材料和方法 1.1 主要材料α-MEM培养基,胎牛血清,胰蛋白酶(Gibco,美国); 乙基-3(-3-二甲氨基丙基),N-羟基琥珀酰亚胺,壳聚糖(Sigma,美国); siRNA(noggin),StealthTMRNAi Negative Control Duplexes(Invitrogen,美国); RT-PCR逆转录试剂盒,PCR引物,PCR试剂盒(Takara,日本); Triton-100(博士德生物,中国); 碱性磷酸酶试剂盒(南京建成,中国); CCK8试剂盒,BCA蛋白定量试剂盒,茜素红染色液(贝博,中国); 胶原(考力森,中国); 生物活性玻璃(自制)。
1.2 方法 1.2.1 负载siRNA胶原/生物活性玻璃复合材料的合成将壳聚糖粉体溶解于0.2 mol/L的乙酸溶液中得4%的壳聚糖溶液,然后将一定量的生物活性玻璃粉体分散于其中得生物活性玻璃-壳聚糖溶液,使生物活性玻璃:壳聚糖质量比为8:1。将胶原溶解于2%乙酸溶液中,得到70 mg/mL胶原溶液。将生物活性玻璃粉体/壳聚糖溶液缓慢加入到胶原溶液中,胶原/生物活性玻璃为3:2,并加入适量乙磺酸以保持溶液pH在4.8左右,搅拌均匀24 h后,得匀浆状溶液。1-乙基-3-(3-二甲氨基丙基)(EDC)和N-羟基琥珀酰亚胺(NHS)以4:1比例形成2.5 mg/mL溶液,将状溶液加入此溶液,置于4 ℃环境中24 h。1 mol/L NaOH溶液调节pH至7.2,用dd H2O调节匀浆浓度,至匀浆中胶原终浓度为30 mg/mL。然后将匀浆分装于塑料模具(48孔板)中,高度3 mm。siRNA混合有分支的PEI(12 000, Sigma),在pH7.4的无核酸PBS中,N/P比值为15,形成聚合物。30 min后,每孔中加入4.5 μL siRNA聚合物溶液。立即冷冻至-20 ℃,通过冷冻干燥24 h,得到负载siRNA胶原/生物活性玻璃支架。
1.2.2 支架浸提液CCK8细胞毒性检测制备高度1 mm、直径10 mm支架,负载noggin胶原/生物活性玻璃支架中加入3 μL 20 nmol/L noggin,取胶原/生物活性玻璃支架组、负载noggin胶原/生物活性玻璃支架组、负载阴性对照siRNA胶原/生物活性玻璃支架组分别3个样本,并分别置于10 mL离心管中,加入10% FBS和1%(青霉素和链霉素)的ɑ-MEM完全培养基5 mL,于37 ℃、95%湿度、含5% CO2的细胞培养箱中浸提,3 d后收集各组浸提液,4 ℃保存。将对数生长期细胞消化重悬制成细胞悬液,以1×104/cm2的密度接种于96孔板中,培养过夜。取出96孔板,吸除旧培养液。各组每孔中分别加入0.1 mL不同样本浸提液,空白组加入0.1 mL含血清培养液,每组重复6孔,置于培养箱培养。1、3、5 d后,取出培养板,将CCK8用不含FBS的培养液以1:10比例稀释混合。每孔加入100 μL混合液,轻轻震荡混匀试剂,将96孔板置于培养箱内孵育1~2 h后取出,于酶标仪上记录450 nm的吸光值。每组6孔的测定结果取平均值。
1.2.3 ALP活性检测制备高度1 mm、直径10 mm支架,负载noggin胶原/生物活性玻璃支架中加入12 μL 20 nmol/L noggin,每组支架材料平均分成四等分用于实验。将细胞(1.0×105/支架)接种于支架上,置于37 ℃、5% CO2的细胞培养箱中,4 h后加入2 mL成骨培养基,再直接接种1.0×105细胞于6孔板上,3 d换液1次,每个样本均设3个复孔。实验分组:胶原/生活性玻璃支架组、负载noggin胶原/生物活性玻璃支架组、负载阴性对照siRNA胶原/生物活性玻璃支架组。以细胞接种胶原/活性玻璃支架组为参照。培养14 d后,低温PBS冲洗细胞,加入0.5% triton X-100增加细胞通透性,冰上静置30 min。根据BCA蛋白定量试剂说明书检测蛋白浓度,CCK8试剂盒说明书,
1.2.4 q-PCR检测成骨相关基因表达细胞接种培养方法和实验分组同上。采用q-PCR检测内源性ALP、Runx 2、BSP基因的表达。按照TRIzol试剂盒说明书提取总RNA,利用Takara Prime Script® RT reagent试剂盒逆转录合成cDNA,采用Takara SYSB®Prime Ex TaqTMⅡ试剂盒进行RT-PCR反应,检测noggin基因的表达水平。引物序列见表 1。
| 表 1 q-PCR检测相关引物序列表 Table 1 Gene and primers of quantitative real-time PCR |
细胞接种培养方法同上。实验分组:空白组、胶原/生物活性玻璃支架组、负载noggin胶原/生物活性玻璃支架组、负载阴性对照siRNA胶原/生物活性玻璃支架组。以细胞直接接种6孔板上为参照。培养14 d后,4%多聚甲醛固定10 min,10 mg/mL茜素红染色30 min,PBS洗3遍,倒置相差显微镜观察,IPP 6.0软件(Image-Pro Plus 6.0)进行矿化面积计算。
1.3 统计学方法采用SPSS 22.0软件进行统计学处理,两组间样本均数比较采用非配对t检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 支架浸提液CCK8细胞毒性检测支架浸提液CCK8细胞毒性检测结果如图 1所示,培养第1天时,各组细胞增殖水平无明显差异,培养3、5 d后,其余3组细胞增殖数目明显高于空白组,差异具有统计学意义(P < 0.05)。负载阴性对照siRNA胶原/生物活性玻璃支架组和负载noggin胶原/生物活性玻璃支架组细胞增殖水平无明显差异。
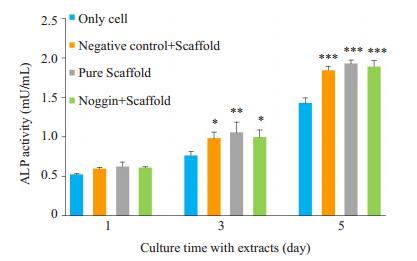
|
图 1 支架浸提液对细胞增殖的影响 Figure 1 Proliferation of MC3T3 cells cultured with extracts of different composites for 1, 3 and 5 days. The data are presented as Mean ± SD (n=3). *P < 0.05, **P < 0.01, ***P < 0.001 vs blank control cells. |
ALP活性检测结果显示培养7 d后,各组ALP活性均无显著差异。培养14 d后,负载noggin胶原/生物活性玻璃支架组ALP活性高于负载阴性对照siRNA胶原/生物活性玻璃支架组和胶原/生物活性玻璃支架组,差异具有统计学意义(P < 0.05)。
2.3 q-PCR检测成骨相关基因表达通过q-PCR在RNA水平对成骨相关基因进行定量分析,结果见图 3。培养14 d后,负载noggin胶原/生物活性玻璃支架组ALP表达水平高于负载阴性对照siRNA胶原/生物活性玻璃支架组和胶原/生物活性玻璃支架组,差异具有统计学意义。负载noggin胶原/生物活性玻璃支架组Runx-2、BSP表达水平明显高于负载阴性对照siRNA胶原/生物活性玻璃支架组和胶原/生物活性玻璃支架组,差异具有统计学意义。
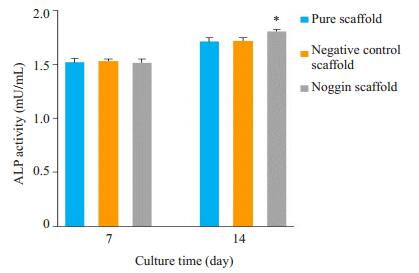
|
图 2 MC3T3在不同支架上生长7、14 d后ALP活性检测 Figure 2 ALP activity of MC3T3 cells cultured with different composites for 7 and 14 days. The data are presented as Mean±SD (n=3). *P < 0.05 vs empty scaffold group. |
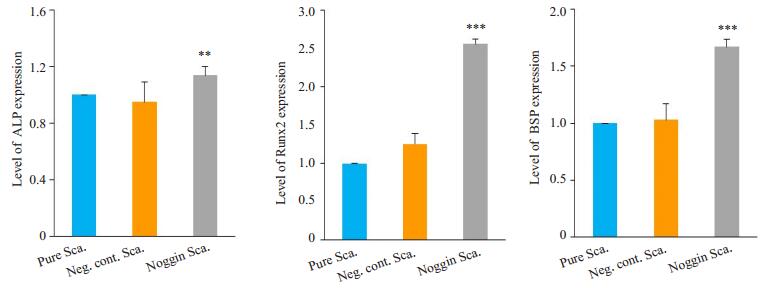
|
图 3 MC3T3在不同支架上粘附生长成骨相关基因表达检测 Figure 3 Expressions of bone-related genes in MC3T3 cells cultured with different composites for 14 days. The data are presented as Mean±SD (n=3). **P < 0.01; ***P < 0.001 vs empty scaffold group. |
成骨诱导14 d后对各组进行茜素红矿化染色,倒置显微镜下观察,可见黑色部分是散落的支架材料,纯细胞组可见极少的散在红点(图 4A)。负载阴性对照siRNA胶原/生物活性玻璃支架组和胶原/生物活性玻璃支架组可见支架散落区域红色结节密集(图 4B、C)。负载noggin胶原/生物活性玻璃支架组有大量矿化染色阳性的结节,色橘红,支架散落区域红色结节大量分布,红色结节连接成片(图 4D)。IPP 6.0计算矿化结节面积,结果显示负载noggin胶原/生物活性玻璃支架组矿化结节形成量高于其余3组,差异具有统计学意义(P < 0.05)。负载阴性对照siRNA胶原/生物活性玻璃支架组和胶原/生物活性玻璃支架组矿化结节形成量高于空白组,差异具有统计学意义(图 4E)。
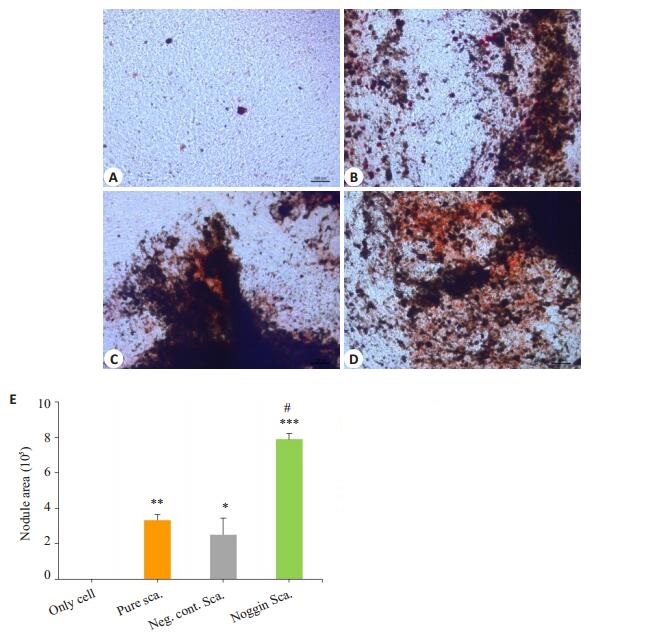
|
图 4 RAS染色检测矿化结节 Figure 4 Detection of mineralized nodules by RAS staining in MC3T3 cells cultured with different composites (Original magnification: × 100). A: Blank control cells; B: Empty scaffold; C: Negative control siRNA + scaffold; D: Noggin siRNA + scaffold; E: Nodule area was calculated by IPP 6.0. The data are presented as Mean±SD (n=3). *P < 0.05, **P < 0.01; ***P < 0.001 vs blank control cells, #P < 0.01 vs empty scaffold group. |
随着1990年后期RNAi作用的发现,一个新的治疗领域被开启,即通过siRNA诱导特异性序列基因沉默。相对于其它RNAi方法,siRNA的巨大优势在于它能够直接与RNA诱导的沉默复合体(RISC machinery)直接作用,通过简单的剂量控制加以调控,而且无需进入核内起作用[12-13]。然而,siRNA治疗广泛用于应用于临床,造福人类,仍然有很长的道路要走。而在这一探索中面临的最大的挑战就是克服强大的解剖和生理的屏障将siRNA释放到目标组织的细胞内[14]。siRNA的局部治疗相对全身应用具有明显优势,siRNA直接递送到靶组织,确保局部达到有效浓度,减少脱靶效应。目前,局部注射和局部应用siRNA已经出现在大量的临床实验中,通过局部持续释放体系实现空间和时间上的双重调控[15-16]。本实验通过胶原/生物活性玻璃材料缓释siRNA具有良好的局部成骨效果,有望成为一种新的骨组织工程材料。
本实验发现胶原/生物活性玻璃复合材料浸提液有利于成骨细胞的增殖。胶原一种可酶促降解的纤维性细胞外基质成分,能与细胞相互作用,影响细胞的形态、骨架组装及增殖[17]。生物活性玻璃析出的钙、磷元素是骨骼组织的重要组成元素,它们在成骨细胞矿化增殖中起促进加速作用[18]。作为siRNA载体的一种,PEI被广泛用于非病毒基因转染,它能够通过静电作用浓缩siRNA,PEI复合体具有质子海绵的特性,保护siRNA免受核酸酶的降解,在大量体内实验中,PEI已成功转染DNA和siRNA到大脑,肺,腹部,和肿瘤[19-20]。本实验中以PEI作为转染试剂,包裹Noggin基因成功转染细胞,同时由于本实验中PEI使用剂量低,无明显细胞毒性作用,与以往研究结果一致[21]。同时本实验结果显示,抑制Noggin基因对成骨细胞增殖无明显促进作用。以往有实验认为,BMP-2对成骨细胞增殖起促进作用,抑制noggin基因可增强BMP-2对成骨细胞增殖的促进作用[22],这与本实验结果不符,可能由于本实验noggin有效浓度较低,促进作用不明显。关于调节骨组织生长和矿化机制的研究,一直是相关领域研究的热点。目前,一般认为成骨过程分为两个阶段,即增殖和矿化,从成骨细胞增殖的早期阶段到最后的矿化是特定序列基因调节的结果。有研究表明,具有去分化作用的FGF-2在骨形成的第一阶段,即骨细胞增殖过程起作用,BMP-2促进成骨细胞分化和矿化,对细胞增殖能力的影响较小[23],本实验结果与这一实验结果相符。Betz等[24]也同样发现延迟注射BMP-2可以获得更多的骨缺损修复,从而产生具有更高矿化和机械强度的修复组织。
为了观察各组材料对MC3T3成骨作用的影响,本实验首先检测了MC3T3黏附各组材料生长后,ALP活性差异。ALP是成骨细胞分泌的一种重要的细胞外基质蛋白,参与骨质成熟钙化过程调节,其活性高低一直被用于反映细胞促矿化能力和向成骨方向转化趋势的指标[25]。培养7 d后,各组ALP活性均无显著差异。培养14 d后,负载noggin胶原/生物活性玻璃支架组ALP活性高于负载阴性对照siRNA胶原/生物活性玻璃支架组和胶原/生物活性玻璃支架组,差异具有统计学意义。以往实验证实聚乙烯乙二醇poly(PEG)水凝胶局部缓释noggin,可提高干细胞ALP活性[26]。本实验ALP活性测定结果显示负载noggin胶原/生物活性玻璃支架组能够提高成骨细胞ALP活性,与以往研究结果一致。
ALP是重要的早期成骨分化的标记物。除了ALP,本实验还检验了Runx-2和BSP基因,Runx-2是一种具有较早期的并具有重要特征的成骨分化标记物,BSP基因是一种较晚期的成骨分化标记物[27]。本实验通过对ALP、Runx-2、BSP等成骨相关基因,进一步验证各组材料对MC3T3细胞成骨作用的影响。细胞黏附材料生长14 d后,负载noggin胶原/生物活性玻璃支架组ALP活性高于负载阴性对照siRNA胶原/生物活性玻璃支架组和胶原/生物活性玻璃支架组,差异具有统计学意义,这与ALP活性检测结果一致。而Runx-2和BSP基因,负载siRNA胶原/生物活性玻璃支架组表达量明显其余两组,尤其是Runx-2基因。在成骨相关基因检测中,noggin基因的下调,导致ALP、Runx-2、BSP等成骨相关基因表达量上升,尤其是Runx-2基因明显上升差异显著,这与Nguyen等[28]实验结果相符,但是遗憾的是作者未在结论中对这一实验结果加以分析。在Fan [29]等实验结果中,作者通过下调noggin基因,同样得到ALP、Runx-2、BSP等成骨相关基因表达量上升,但是Runx-2基因相对于其他成骨基因变化无明显差异。由于BMP-Smad信号通路在成骨过程中具有重要作用,作者进一步研究发现了noggin抑制则BMP-Smad信号通路增强,进而增强Smad 1/5/8磷酸化,Runx-2和OCN等基因表达量增高。由于Runx-2基因受BMP信号通路直接调控,因此noggin基因的下调,直接导致Runx-2基因表达量明显上升。这也就解释了本实验的研究结果。
骨结节形成是成骨研究的关键,本实验通过茜素红染色观察成骨结节形成。成骨诱导14 d后对各组进行茜素红矿化染色,负载noggin胶原/生物活性玻璃支架组有大量矿化染色阳性的结节,色橘红,支架散落区域红色结节大量分布,红色结节连接成片。结果显示负载noggin胶原/生物活性玻璃支架组矿化结节形成量高于其余三组,差异具有统计学意义,与以往实验结果一致[30]。负载阴性对照siRNA胶原/生物活性玻璃支架组和胶原/生物活性玻璃支架组矿化结节形成量高于空白组,差异具有统计学意义。以上结果表明胶原/生物活性玻璃复合材料具有一定成骨效果,负载noggin胶原/生物活性玻璃成骨效果更优于胶原/生物活性玻璃复合材料。
综上所述,本研究证实负载siRNA胶原/生物活性玻璃复合材料浸提液有利于细胞增殖,材料具有良好的生物相容性。本研究进一步验证负载siRNA胶原/生物活性玻璃材料具有良好的成骨效果,有可能成为一种新的骨组织工程材料,以提高骨缺损区域局部成骨能力。
| [1] | Tang D, Tare RS, Yang LY, et al. Biofabrication of bone tissue: approaches, challenges and translation for bone regeneration[J]. Biomaterials, 2016, 83: 363-82. DOI: 10.1016/j.biomaterials.2016.01.024. |
| [2] | Shin J, Cho JH, Jin Y, et al. Mussel Adhesion-Inspired reverse transfection platform enhances osteogenic differentiation and bone formation of human adipose-derived stem cells[J]. Small, 2016, 12(45): 6266-78. DOI: 10.1002/smll.201601868. |
| [3] | Nelson CE, Kim AJ, Adolph EJ, et al. Tunable delivery of siRNA from a biodegradable scaffold to Promote angiogenesis in vivo[J]. Adv Mater, 2014, 26(4): 607-14. DOI: 10.1002/adma.201303520. |
| [4] | Germershaus O, Nultsch K. Localizednon-viral delivery of nucleic acids: Opportunities, challenges and current strategies[J]. Asian J Pharm Sci, 2014, 10(3): 159-75. |
| [5] | Pon-On W, Charoenphandhu N, Teerapornpuntakit J, et al. Mechanical properties, biological activity and protein controlled release by poly(vinyl alcohol)-bioglass/chitosan-collagen composite scaffolds: A bone tissue engineering applications[J]. Mater Sci Eng C Mater Biol Appl, 2014, 38(38): 63-72. |
| [6] | 贺鹏, 段莉. 联合应用胶原膜与生物活性玻璃引导牙槽骨再生的X射线能谱分析[J]. 广东牙病防治, 2005, 13(3): 210-1. |
| [7] | Vinas-Castells R, Holladay C, Di Luca AA, et al. Snail1 Downregulation using small interfering RNA complexes delivered through collagen scaffolds[J]. Bioconjug Chem, 2009, 20(12): 2262-9. DOI: 10.1021/bc900241w. |
| [8] | Zimmerman LB, De Jesús-Escobar JM, Harland RM. The spemann organizer signal noggin bindsand inactivates bone morphogenetic protein 4[J]. Cell, 1996, 86: 599-606. DOI: 10.1016/S0092-8674(00)80133-6. |
| [9] | Aspenberg P, Jeppsson C, Economides A. The bone morphogenetic proteins antagonist noggininhibits membranous ossification[J]. J Bone Miner Res, 2001, 16: 497-500. DOI: 10.1359/jbmr.2001.16.3.497. |
| [10] | Devlin RD, Du Z, Pereira RC, et al. Skeletaloverexpression of noggin results in osteopenia and reduced bone formation[J]. Endocrinology, 2003, 144: 1972-8. DOI: 10.1210/en.2002-220918. |
| [11] | Kim TH, Singh RK, Kang MS, et al. Inhibition of osteoclastogenesis through siRNA delivery with tunable mesoporous bioactive nanocarriers[J]. Acta Biomater, 2016, 29(29): 352-64. |
| [12] | Sliva K, Schnierle BS. Selective gene silencing by viral delivery of short hairpin RNA[J]. Virol J, 2010, 7(1): 248-58. DOI: 10.1186/1743-422X-7-248. |
| [13] | Bartlett DW, Davis ME. Insights into the kinetics of siRNA-mediated genesilencing from live-cell and live-animal bioluminescent imaging[J]. Nucleic Acids Res, 2006, 34(1): 322-33. DOI: 10.1093/nar/gkj439. |
| [14] | Dykxhoorn DM, Palliser D, Lieberman J. The silent treatment: siRNAs as small molecule drugs[J]. Gene Ther, 2006, 13(6): 541-52. DOI: 10.1038/sj.gt.3302703. |
| [15] | Ma ZW, Yang CX, Song W, et al. Chitosan hydrogel as siRNA vector forprolongedgene silencing[J]. J Nanobiotecg, 2014, 12(1): 1-9. DOI: 10.1186/1477-3155-12-1. |
| [16] | Kim YM, Park MR, Song SC. Injectable polyplex hydrogel for Localized and long-term deliveryof siRNA[J]. ACS Nano, 2012, 6(7): 5757-66. DOI: 10.1021/nn300842a. |
| [17] | Place ES, Evans ND, Stevens MM. Complexity in biomaterials for tissue engineering[J]. Nat Mater, 2009, 8(6): 457-70. DOI: 10.1038/nmat2441. |
| [18] | Ferraz EP, Oliveira FS, De Oliveira PT, et al. Bioactive glass-based surfaces induce differential gene expression profiling of osteoblasts[J]. J Biomed Mater Res A, 2017, 105(2): 419-23. DOI: 10.1002/jbm.a.v105.2. |
| [19] | Benjaminsen RV, Mattebjerg MA, Henriksen JR, et al. The possible "protonsponge"effect of polyethylenimine (PEI) does not include change in lysosomal pH[J]. Mol Ther, 2013, 21(1): 149-57. DOI: 10.1038/mt.2012.185. |
| [20] | Grabowska AM, Kircheis R, Kumari R, et al. Systemic in vivo delivery of siRNA to tumours using combination of polyethyleneimineandtransferrin-polyethyleneimine conjugates[J]. Biomater Sci, 2015, 3(11): 1439-48. DOI: 10.1039/C5BM00101C. |
| [21] | Laroui H, Geem D, Xiao B, et al. Targeting intestinal inflammation with CD98 siRNA/PEI-loaded nanoparticles[J]. Mol Ther, 2014, 22(1): 69-80. DOI: 10.1038/mt.2013.214. |
| [22] | Cao H, Ke Y, Zhang Y, et al. Icariin stimulates MC3T3-E1 cell proliferation and differentiation through up-regulation of bone morphogenetic protein-2[J]. Int J Mol Med, 2012, 29(3): 435-9. |
| [23] | Hughes-Fulford M, Li CF. The role of FGF-2 and BMP-2 in regulation of gene induction, cell proliferation and mineralization[J]. J Orthop Surg Res, 2011, 6(1): 240-7. |
| [24] | Betz OB, Betz VM, Nazarian A, et al. Delayed administration of adenoviral BMP-2 vector improves the formation of bone in osseous defects[J]. Gene Ther, 2007, 14(13): 1039-44. DOI: 10.1038/sj.gt.3302956. |
| [25] | Whyte MP. Hypophosphatasia and the role of alkaline phosphatase in skeletal mineralization[J]. Endocr Rev, 1994, 15(4): 439-61. |
| [26] | Zheng L, Tu Q, Meng S, et al. Runx2/DICER/miRNA pathway in regulating osteogenesis[J]. J Cell Physiol, 2017, 232(1): 182-91. DOI: 10.1002/jcp.25406. |
| [27] | Scanlon V, Walia B, Yu J, et al. Loss of Cb1-PI3K interaction modulates the periosteal response to fracture by enhancing osteogenis commitment and differentiation[J]. Bone, 2017, 95: 124-35. DOI: 10.1016/j.bone.2016.11.020. |
| [28] | Nguyen MK, Jeon O, Krebs MD, et al. Sustained localized presentation of RNA interfering molecules from in situ forming hydrogels to guide stem cell osteogenic differentiation[J]. Biomaterials, 2014, 35(24): 6278-86. DOI: 10.1016/j.biomaterials.2014.04.048. |
| [29] | Fan JB, Im CS, Guo M, et al. Enhanced osteogenesis of adiposederived stem cells by regulating bone morphogenetic protein signaling antagonists and agonists[J]. Stem Cells Transl Med, 2016, 5(4): 539-51. DOI: 10.5966/sctm.2015-0249. |
| [30] | Cui ZK, Fan JB, Kim S, et al. Delivery of siRNA via cationic sterosomes to enhance osteogenic differentiation of mesenchymal stem cells[J]. J Control Release, 2015, 217: 42-52. DOI: 10.1016/j.jconrel.2015.08.031. |
 2018, Vol. 38
2018, Vol. 38

