2. 南方医科大学南方医院 病理科,广东 广州 510515
2. Institute of Molecular Immunology, School of Laboratory Medicine and Biotechnology, Southern Medical University, Guangzhou 510515, China
宫颈癌是妇科三大恶性肿瘤之一,高危型人乳头状瘤病毒(hr-HPV)的感染是绝大部分宫颈癌发生的主要病因[1]。肿瘤微环境(TME)对于恶性肿瘤的发生发展起着巨大的作用,TME中大量炎症细胞浸润所致肿瘤相关性炎症已经成为癌症的第7大标志,肿瘤相关巨噬细胞(TAMs)与癌症发生、进展和预后不良有关。TAMs可以从多个方面影响肿瘤组织的增殖、侵袭和转移的能力,可作为恶性肿瘤预后评估的一个客观指标[2-4]。而TAMs具有多个分子标记物,包括CD68、CD163、CD204等[5],有研究表明CD163作为TAMs的特异性标志物,同时能反应单核巨噬细胞功能的临床指标[6]。研究发现CD163+巨噬细胞的分布与宫颈癌细胞的浸润方式有显著关联[7],但尚未有人对CD163+巨噬细胞与hr-HPV感染之间进行相关性研究。本研究通过整理正常宫颈组织、宫颈上皮内瘤变(CIN)和宫颈鳞状细胞癌(SCC)患者的临床资料,应用免疫组织化学技术检测相应组织中CD163+巨噬细胞的表达水平,探讨TAMs与hr-HPV感染之间的相关性及其临床意义。
1 资料和方法 1.1 临床资料收集南方医科大学南方医院妇产科2011年1月~ 2013年12月期间112例患者宫颈标本。其中子宫肌瘤子宫全切手术16例,宫颈活检组织4例,宫颈环切手术25例,宫颈冷刀锥切手术26例,宫颈癌根治性子宫切除手术41例,得到16例正常宫颈组织,29例CIN Ⅰ期组织,26例CIN Ⅱ~Ⅲ期组织,41例SCC(Ⅰ~Ⅱa期)组织。排除孕妇与急性盆腔感染患者,宫颈腺癌患者,宫颈癌根治性手术前后接受过放射治疗与化疗等非手术治疗患者。患者临床病理资料(包括HPV感染状况、年龄、FIGO分期、组织学分型、淋巴结转移情况)来源于南方医科大学南方医院妇产科。患者HPV感染检测方式部分为第二代杂交捕获法(HC2),部分为HPV分型检测结果,病理资料均由病理科主任医师审核。所有患者知情同意,经医院伦理委员会批准。
1.2 主要试剂CD163小鼠抗人单克隆抗体购自美国Abcam。免疫组织化学检测试剂盒与DAB显色试剂盒购自中杉金桥公司。
1.3 方法 1.3.1 免疫组织化学检测CD163+巨噬细胞在组织中的表达情况将组织标本置于福尔马林中固定,石蜡包埋,5 μm厚连续切片。组织切片脱蜡水化,于室温中与3% H2O2-甲醇共同孵育30 min去除内源性过氧化物酶活性。与柠檬酸盐缓冲液(pH6.0)共同置于微波炉中微波15 min进行抗原修复。10%山羊血清于37 ℃中封闭1 h。CD163小鼠抗人单克隆抗体经一抗稀释液稀释(1:200)于4 ℃冰箱孵育过夜。切片与二抗于37 ℃共同孵育30 min。DAB显色1 min,苏木素复染。梯度酒精脱水,二甲苯透明,风干后中性树脂封片固定。
1.3.2 CD163+巨噬细胞的计数与表达量评分两名经验丰富的病理医生进行双盲阅片。CD163表达于巨噬细胞的细胞膜上,呈棕黄色颗粒状,每个样本以低倍镜(×100)进行筛选,选择细胞呈棕黄色的细胞最密集的区域进行进一步分析,在高倍镜(×400)下随机计算五个视野的巨噬细胞的平均数量,根据棕黄色的细胞所占比例,对CD163+巨噬细胞的表达量进行0~3的评分:0分 < 5%;1分5%~20%;2分20%~50%;3分 > 50%,0~1分为低水平表达,2~3分为高水平表达。
1.4 统计学分析采用SPSS19.0软件进行统计学分析。使用卡方检验分析频率表,使用Spearman秩和检验来评估各分类变量之间的相关性。分布表表示为均值±均标准差。所有检验为双向检验,P < 0.05认为差异有统计学意义。
2 结果 2.1 CD163+巨噬细胞增多与宫颈组织恶性转化相关CD163主要表达于巨噬细胞的细胞膜上,呈棕黄色颗粒状。CD163+巨噬细胞的表达随着宫颈组织恶性进展(从正常组织到SCC)呈现上升的趋势(图 1A),正常宫颈组织、CIN Ⅰ、CIN Ⅱ~Ⅲ以及SCC中CD163+巨噬细胞的计数的均值分别为5.4、39.1、69.4以及132.1。同时SCC中CD163的表达量明显高于不同时期CIN(P < 0.05),而不同时期的CIN中的CD163的表达水平也高于正常宫颈组织(P < 0.05),此外,CIN Ⅰ与CIN Ⅱ~Ⅲ之间CD163表达水平的差异也具有统计学意义(P < 0.05),CD163+巨噬细胞的密度与宫颈癌的发生发展呈正相关(Spearman's rho=0.700,P=0.000,图 1B)。
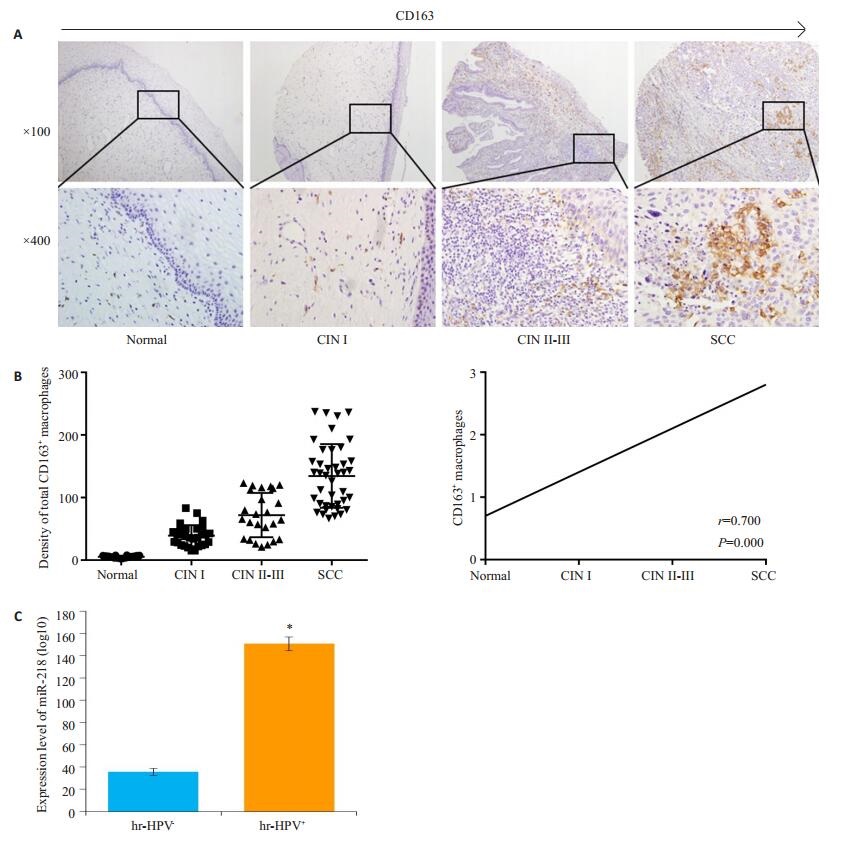
|
图 1 CD163+巨噬细胞在宫颈组织切片中的表达情况及分析结果 Figure 1 CD163+ macrophages were upregulated with the progression of squamous cervical cancer. A: CD163+ macrophages in normal cervical tissue, cervical intraepithelial neoplasia (CIN) Ⅰ, CIN Ⅱ-Ⅲ, and SCC; B: Upregulation of CD163+ macrophages was positively correlated with the degree of malignancy of SCC (r=0.700, P=0.000 by Spearman correlation coefficient test); C: CD163+ macrophages was significantly upregulated in SCC with high-risk human papillomavirus (hr-HPV) infection. Error bars represent the mean±SD of 3 independent experiments. *P < 0.05 vs hr-HPV-. |
在112例患者中,hr-HPV的感染率分别为正常患者12.5%(16例中有2例感染),CIN Ⅰ患者68.9%(29例中有20例感染),CIN Ⅱ~Ⅲ患者92.3%(26例中有24例感染),SCC患者100%(41例中有41例感染)。
hr-HPV阳性患者组织切片中CD163+巨噬细胞计数密度显著高于hr-HPV阴性患者(P < 0.05,图 1C)。从表 1中可以看出,CD163+巨噬细胞的表达量评分与hr-HPV感染和宫颈组织恶变程度具有显著的相关性。其中hr-HPV阳性患者的CD163+巨噬细胞高表达量评分所占比例均比hr-HPV阴性患者高,hr-HPV阳性患者中CD163+巨噬细胞高表达量评分所占比例为92.0%(88例中的81例),而hr-HPV阴性患者仅为25.0%(24例中的6例)。在所有hr-HPV阳性患者中,CIN Ⅰ(58.6%)、CIN Ⅱ~Ⅲ(84.6%)和SCC(97.5%)中CD163+巨噬细胞高表达量评分所占比例较正常宫颈组织(12.5%)中高,同时也比hr-HPV阴性患者的CIN Ⅰ(13.7%)、CIN Ⅱ~Ⅲ(0%)和SCC(0%)高。
| 表 1 CD163+巨噬细胞表达量评分与hr-HPV感染相关性 Table 1 Correlation of CD163 + macrophages expression withhrHPV infection |
将112例患者的组织切片结果与临床资料进行一一对应,如表 2所示,CD163+巨噬细胞在瘤周集聚程度与淋巴结转移与否有着显著性差异(P=0.005),同时在FIGO分期中的Ⅰ期与Ⅱ期之间有着显著性差异(P= 0.004)。然而CD163+巨噬细胞在瘤周集聚程度与患者年龄或病理组织学分型无明显相关性(P=0.179,P= 0.571)。
| 表 2 CD163+巨噬细胞细胞数量与临床资料相关性 Table 2 Correlation of increased CD163 + macrophages with clinicopathologic features of the patients |
hr-HPV感染被认为是宫颈癌发病的重要因素。一般从hr-HPV最初感染到癌前病变, 最终演变为宫颈浸润癌至少需要10~15年。这些提示hr-HPV感染只是一个始动因素。肿瘤生长不仅取决于恶性肿瘤细胞的遗传改变, 也取决于基质、血管、浸润炎症细胞等TME的改变。TAMs作为TME的重要组成部分参与了肿瘤的发生发展[8-10]。研究发现,病毒感染与多种肿瘤的发生发展密切相关,可以促进炎性细胞(如TAMs)及炎性介质(如细胞因子、趋化因子等)募集到TME中,参与肿瘤恶变过程。大量研究表明TME中TAMs的聚集与病毒的感染密切相关[11-12],而病毒感染导致的慢性炎症也会引起CD163+巨噬细胞的功能活化[13],我们研究发现CD163+巨噬细胞在hr-HPV阳性患者中具有更高的表达量,提示TAMs可能参与hr-HPV感染导致宫颈恶性病变的进展过程。
我们进一步研究发现CD163+巨噬细胞与宫颈恶性转化之间有着显著的关联性(Spearman's rho=0.700,P= 0.000),其表达量随着宫颈恶性病变进展而增高。该结果提示巨噬细胞浸润增多及其伴随的炎症微环境加重可能参与宫颈恶性病变的发展。TAMs对肿瘤的影响是多方面的,不仅能通过血管内皮生长因子C促进脉管生成[14-15],同时能够增强肿瘤细胞增殖、迁移和侵袭的能力[16-18],而且能与TME中肿瘤相关成纤维细胞(CAFs)以及细胞因子相互作用,抑制免疫系统对肿瘤的监视与清除能力[19-21]。这些结果均提示CD163+巨噬细胞在肿瘤的发生发展中起着关键作用。可以猜测TAMs在宫颈癌TME中可通过一些分子机制直接或间接地参与了宫颈癌的发生发展,需进一步的基础研究来明确TAMs在宫颈癌组织中的作用。
在对CD163+巨噬细胞与宫颈癌患者临床病理参数相关性的研究中,我们发现CD163+巨噬细胞与宫颈癌淋巴结转移以及FIGO分期有显著的相关性。卵巢癌患者晚期腹膜中的巨噬细胞浸润较卵巢癌早期病变患者明显增多[22]。在其他恶性肿瘤的研究中,亦有类似的发现。研究表明,肿瘤局部浸润的TAMs可产生多种促进肿瘤生长的细胞因子,并释放基质降解酶促进肿瘤的侵袭转移。宫颈癌局部活化的巨噬细胞表达大量VEGF-C,与肿瘤周围癌性淋巴管形成有关,提示TAMs可分泌多种因子促进宫颈癌淋巴管生成从而促进淋巴结转移[23]。这与我们的研究结果相吻合。
宫颈癌分期进展和淋巴结转移是宫颈癌患者治疗失败、复发与死亡的主要原因[24-25]。大量文献显示,TAMs在肿瘤组织中浸润与肿瘤患者的不良预后相关[9, 26-27]。但TAMs是否可作为宫颈癌预后的预测因素在既往的研究中是有争议的,有研究者报道CD163+巨噬细胞与宫颈癌治疗后的生存期有着显著相关[28]。TAMs的增高可以导致淋巴管密度增高,从而促进淋巴结转移降低患者的生存时间[29]。但也有文献报道CD68+巨噬细胞与肿瘤复发之间没有显著关联[30]。本次研究因样本量有限及随访数据的不足,无法将CD163+巨噬细胞与宫颈癌治疗的预后和生存时间之间进行进一步分析,需要进一步扩大样品数目及随访数据方可验证CD163+巨噬细胞是否能够作为评估宫颈癌治疗预后的因素。
本次研究通过免疫组织化学法和临床数据评估CD163+巨噬细胞与hr-HPV感染宫颈癌之间的相关性,发现宫颈组织恶性变的程度与CD163+巨噬细胞的表达成正相关,hr-HPV感染与巨噬细胞中CD163表达量具有显著相关性,提示CD163+巨噬细胞可以作为hr-HPV感染所致宫颈癌的前瞻性预测因素,但两者在宫颈癌发生发展之间的具体相互作用机制仍需进一步研究以明确。
| [1] | Crow JM. HPV: The global burden[J]. Nature, 2012, 488(7413): 52-3. |
| [2] | Lu HH, Clauser KR, Tam WL, et al. A breast cancer stem cell niche supported by juxtacrine signalling from monocytes and macrophages[J]. Nat Cell Biol, 2014, 16(11): 1105. DOI: 10.1038/ncb3041. |
| [3] | Schneider C, Teufel A, Yevsa T, et al. Adaptive immunity suppresses formation and progression of diethylnitrosamine-induced liver Cancer[J]. Gut, 2012, 61(12): 1733-43. DOI: 10.1136/gutjnl-2011-301116. |
| [4] | Gordon SR, Maute RL, Dulken BW, et al. PD-1 expression by tumour-associated macrophages inhibits phagocytosis and tumour immunity[J]. Nature, 2017, 545(7655): 495-9. DOI: 10.1038/nature22396. |
| [5] | Qian BZ, Pollard JW. Macrophage diversity enhances tumor progression and metastasis[J]. Cell, 2010, 141(1): 39-51. DOI: 10.1016/j.cell.2010.03.014. |
| [6] | Switala JR, Hendricks M, Davidson A. Serum ferritin is a costeffective laboratory marker for hemophagocytic lymphohistiocytosis in the developing world[J]. J Pediatr Hematol Oncol, 2012, 34(3): e89-92. DOI: 10.1097/MPH.0b013e31824227b9. |
| [7] | Li Y, Huang G, Zhang S. Associations between intratumoral and peritumoral M2 macrophage counts and cervical squamous cell carcinoma invasion patterns[J]. Int J Gynaecol Obstet, 2017, 139(3): 346-51. DOI: 10.1002/ijgo.2017.139.issue-3. |
| [8] | Mantovani A, Romero P, Palucka AK, et al. Tumour immunity: effector response to tumour and role of the microenvironment[J]. Lancet, 2008, 371(9614): 771-83. DOI: 10.1016/S0140-6736(08)60241-X. |
| [9] | Ruffell B, Coussens LM. Macrophages and therapeutic resistance in cancer[J]. Cancer Cell, 2015, 27(4): 462-72. DOI: 10.1016/j.ccell.2015.02.015. |
| [10] | Falleni M, Savi F, Tosi D, et al. M1 and M2 macrophages' clinicopathological significance in cutaneous melanoma[J]. Melanoma Res, 2017, 27(3): 200-10. DOI: 10.1097/CMR.0000000000000352. |
| [11] | Tan KL, Scott DW, Hong FX, et al. Tumor-associated macrophages predict inferior outcomes in classic Hodgkin lymphoma: a correlative study from the E2496 Intergroup trial[J]. Blood, 2012, 120(16): 3280-7. DOI: 10.1182/blood-2012-04-421057. |
| [12] | Wang S, Chen Z, Hu C, et al. Hepatitis B virus surface antigen selectively inhibits TLR2 ligand-induced IL-12 production in monocytes/macrophages by interfering with JNK activation[J]. J Immunol, 2013, 190(10): 5142-51. DOI: 10.4049/jimmunol.1201625. |
| [13] | 陈燕丽, 陈福雄, 邓长柏, 等. EB病毒感染患儿CD163表达及其临床意义[J]. 中国当代儿科杂志, 2015, 17(5): 492-5. DOI: 10.7499/j.issn.1008-8830.2015.05.016. |
| [14] | Yeo EJ, Cassetta L, Qian BZ, et al. Myeloid WNT7b mediates the angiogenic Switch and metastasis in breast Cancer[J]. Cancer Res, 2014, 74(11): 2962-73. DOI: 10.1158/0008-5472.CAN-13-2421. |
| [15] | Ji H, Cao RH, Yang YL, et al. TNFR1 mediates TNF-alpha-induced tumour lymphangiogenesis and metastasis by modulating VEGF-CVEGFR3 signalling[J]. Nat Commun, 2014, 5(3): 4944. |
| [16] | Nabeshima A, Matsumoto Y, Fukushi J, et al. Tumour-associated macrophages correlate with poor prognosis in myxoid liposarcoma and promote cell motility and invasion via the HB-EGF-EGFRPI3K/Akt pathways[J]. Br J Cancer, 2015, 112(3): 547-55. DOI: 10.1038/bjc.2014.637. |
| [17] | Laoui D, Movahedi K, Van Overmeire E, et al. Tumor-associated macrophages in breast cancer: distinct subsets, distinct functions[J]. Int J Dev Biol, 2011, 55(7/9, SI): 861-7. |
| [18] | Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19(11): 1423-37. DOI: 10.1038/nm.3394. |
| [19] | Kren L, Slaby O, Muckova K, et al. Expression of immunemodulatory molecules HLA-G and HLA-E by tumor cells in glioblastomas: an unexpected prognostic significance[J]. Neuropathology, 2011, 31(2): 129-34. DOI: 10.1111/neu.2011.31.issue-2. |
| [20] | Belai EB, de Oliveira CE, Gasparoto TH, et al. PD-1 blockage delays murine squamous cell carcinoma development[J]. Carcinogenesis, 2014, 35(2): 424-31. DOI: 10.1093/carcin/bgt305. |
| [21] | Kennedy BC, Showers CR, Anderson DE, et al. Tumor-associated macrophages in glioma:friend or foe[J]. J Oncol, 2013, 25(8): 486912. |
| [22] | Wang XP, Deavers M, Patenia R, et al. Monocyte/macrophage and T-cell infiltrates in peritoneum of patients with ovarian Cancer or benign pelvic disease[J]. J Transl Med, 2006, 4(5): 30. |
| [23] | Schoppmann SF, Birner P, Stockl J, et al. Tumor-associated macrophages Express lymphatic endothelial growth factors and are related to peritumoral lymphangiogenesis[J]. Am J Pathol, 2002, 161(3): 947-56. DOI: 10.1016/S0002-9440(10)64255-1. |
| [24] | Lee MY, Chou CY, Tang MJ, et al. Epithelial-mesenchymal transition in cervical cancer: correlation with tumor progression, epidermal growth factor receptor overexpression, and snail upregulation[J]. Clin Cancer Res, 2008, 14(15): 4743-50. DOI: 10.1158/1078-0432.CCR-08-0234. |
| [25] | Colombo N, Carinelli S, Colombo A, et al. Cervical cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012, 23(7): 27-32. |
| [26] | Medrek C, Ponten F, Jirstrom KA. The presence of tumor associated macrophages in tumor stroma as a prognostic marker for breast cancer patients[J]. BMC Cancer, 2012, 12(3): 306. |
| [27] | Steidl C, Lee T, Shah SP, et al. Tumor-Associated macrophages and survival in classic hodgkin's lymphoma[J]. N Engl J Med, 2010, 362(10): 875-85. DOI: 10.1056/NEJMoa0905680. |
| [28] | Carus A, Ladekarl M, Hager H, et al. Tumour-associated CD66b+ neutrophil count is an independent prognostic factor for recurrence in localised cervical cancer[J]. Br J Cancer, 2013, 108(10): 2116-22. DOI: 10.1038/bjc.2013.167. |
| [29] | 李妍, 郝权. 高迁移率族蛋白1和肿瘤相关巨噬细胞与宫颈癌淋巴管密度的相关性研究[J]. 中国肿瘤临床, 2014, 41(4): 222-6. |
| [30] | Nedergaard BS, Nielsen K, Nyengaard JR, et al. Stereologic estimation of the total numbers, the composition and the anatomic distribution of lymphocytes in cone biopsies from patients with stage I squamous cell carcinoma of the cervix uteri[J]. APMIS, 2007, 115(12): 1321-30. DOI: 10.1111/apm.2007.115.issue-12. |
 2018, Vol. 38
2018, Vol. 38

