压疮是身体局部组织长期受压,尤其是经骨突的压力和/或伴随的剪切力造成的局部血液循环障碍,产生的皮肤和/或深部组织缺血损伤[1],其形成是内外多种因素联合作用的结果[2]。研究显示,缺血预处理、后处理是调动机体内源性保护机制的有效措施,能够提高组织、器官对缺血再灌注损伤的耐受能力,远隔组织的后处理也能减轻原发缺血组织的损伤[3, 31]。Zhao等[4]在犬的心肌缺血再灌注(IR)损伤模型上证实了缺血后处理可以减轻心肌的梗死面积,保护内皮功能,减少中性粒细胞聚集。缺血后处理(I-postC)由于实施于再灌注开始后,己经成功地用于骨骼肌、脑、肠、脊髓、肾脏、肝脏、心脏、肺脏等再灌注损伤的实验性研究或临床研究。大量临床研究结果表明,I-postC能够诱导机体内源性保护机制,降低内皮的功能紊乱,减少细胞凋亡率,减少缺血坏死区域,从而减轻组织IR损伤[5],其机制研究已渐成为热点之一[6-7],虽然缺血后处理对以心脏、肾脏为主的其他器官组织的保护作用的研究逐渐增多,但关于IPostC与压疮缺血再灌注性损伤的关系尚不清楚,IPostC对压疮缺血再灌注损伤保护作用的有效时间窗问题也尚未见报道。本研究在建立了大鼠压疮缺血再灌注损伤模型的基础上,观察了缺血后处理对不同时间窗造成的压疮的影响,拟发现缺血后处理对压疮保护作用的时间窗,现报道如下。
1 材料和方法 1.1 材料 1.1.1 实验动物健康雄性Sprague-Dawlye(SD)大鼠68只,8~12周龄,SPF级,体质量220~250 g,中山大学动物实验中心提供,分笼饲养于安静室温环境,自由进食,饮水,在新环境中熟悉1周后进行实验。在本压疮模型研究中,性激素对所观测结果无明显干预作用,雌雄大鼠间无对照意义,故统一选用雄性大鼠。各组体质量比较,差异无统计学意义(P > 0.05)。
1.1.2 主要仪器超净工作台(中山大学北校区动物实验室)、电子称、空气压缩机(美国)、相机、离心机(德国)、HARRIS INC超低温冰箱(-70 ℃)(美国)、BX50-OLYMPUS光学显微镜(日本)、外科手术器械一套(上海金粒医疗器械)。
1.1.3 主要试剂10%水合氯醛、4%多聚甲醛固定液、4%戊二醛固定液、磷钨酸苏木素染色试剂盒,荧光免疫组化监测试剂盒(SP-9002)(北京中杉金桥生物技术有限公司);中性粒细胞浸润度试剂盒(碧云天生物技术研究所)。
1.2 方法 1.2.1 动物模型制作选取健康成年雄性SD大鼠制作缺血再灌注性损伤压疮模型。腹腔注射10%水合氯醛(400 mg/kg剂量)麻醉大鼠。选取大腿股薄肌部位面积约2 cm×2 cm,剪去腿部毛发。将大鼠俯卧于加压装置胶布固定四肢,连接空气压缩机与压力汽缸,将压力接触面垂直作用于大鼠大腿股薄肌处,412.5 mmHg压力下持续受压2 h[8],麻醉造模成功,施压及后处理完成后,在麻醉状态下切取大鼠股薄肌受压中心部位皮肤肌肉组织大小约0.5 cm×0.5 cm×0.5 cm制片观察;随机取腹主动脉血液2 mL,分别装入Ep管中,以3600 r/min的速度在4 ℃下离心10 min,取血浆,-70 ℃冰箱保存待用,最后使用空气栓塞法处死大鼠[9]。
1.2.2 缺血后处理4组实验大鼠在给予2、4、6、8 h受压缺血时间达到后,解除压力,即刻给予解压10 min/压迫10 min间断缺血,共3个循环,1个处理时间共计1 h[10]。
1.2.3 动物分组68只SD大鼠按随机数字表法分为9组,空白组(S组)4只,不干预;实验组每组8只,Ⅰa组:受压缺血2 h;Ⅰb组:受压缺血2 h+即刻给予缺血后处理(组);Ⅱa组:受压缺血4 h;Ⅱb组:受压缺血4 h+即刻给予缺血后处理(组);Ⅲa组:受压缺血6 h;Ⅲb组:受压缺血6 h+即刻给予缺血后处理(组)(麻醉后俯卧固定于大鼠固定板上持续施压6 h解压后即刻行后处理);Ⅳ a组:受压缺血8 h;Ⅳb组:受压缺血8 h+即刻给予缺血后处理(组)[11]。
1.2.4 观察指标的测定 1.2.4.1 皮肤及皮下组织损伤程度的测量取材组织采用PTAH(磷钨酸苏木素)染色。具体染色步骤:取材组织块,固定后,常规石蜡包埋,4 μm切片;参考王艳等[12]的方法,将大鼠皮肤损伤分为轻度、中度及重度3个等级。轻度损伤:鳞状上皮细胞变薄,表皮与真皮连接疏松,真皮轻度胶原变性,毛细血管扩张,少量淋巴细胞浸润;中度损伤:鳞状上皮部分核固缩,表皮与真皮部分分离,真皮胶原纤维变性,炎细胞浸润明显,脂肪细胞游离,毛细血管扩张充血,横纹肌水肿、间隙增宽;重度损伤:鳞状上皮脱屑,表皮与真皮分离,真皮胶原纤维溶解,细胞核碎裂,脂肪细胞溶解,毛细血管淤血,横纹肌退行性变,横纹模糊不清。
1.2.4.2 中性粒细胞浸润的测定采用HE法,对皮肤中性粒细胞的浸润程度分为Ⅰ~Ⅳ共4个等级[13],该染色步骤如下:(1)取材组织块,固定后,常规石蜡包埋,4 μm切片。(2)切片常规用二甲苯脱蜡,(3)苏木素染色5 min,自来水冲洗。(4)盐酸乙醇分化30(s提插数下)。(5)自来水浸泡15 min或温水(约50 ℃)5 min。(6)置伊红液2 min。(7)常规脱水,透明,封片。
1.2.4.3 血清中超氧化物歧化酶(SOD)活力测定SOD能清除超氧阴离子自由基,保护细胞免受损伤,对机体的氧化与抗氧化平衡起着至关重要的作用[14],采用黄嚓吟氧化酶法测定SOD活力。利用722型分光光度计在550 nm波下测定吸光度,通过公式计算SOD活力,酶活性规定为每毫升反应液中SOD抑制率达到50%时所对应的SOD量[15]。
1.2.4.4 血清中丙二醛(MDA)含量测定MDA是脂质过氧化反应的产物,它在血清及组织中的含量间接反映了自由基对组织的破坏程度,其含量的多少可以及反映组织的脂质过氧化反应的速度和强度[16]。利用722型可见光分光光度计在532 nm波长下测定吸光度(A),并利用公式计算其含量[17]。
1.2.4.5 血清中NO含量测定(硝酸还原酶法)NO是体内作一种反应性极强的自由基,具有广泛的生理作用,如松弛血管平滑肌,抑制血小板聚集,动脉粥样硬化等作用,压疮等组织损伤可影响血液循环中NO的生成[18]。采用硝酸还原酶化学比色法测定NO含量,NO遇氧及水生成硝酸盐及亚硝酸盐,后二者遇硝酸盐显色剂可生成淡红色偶氮化合物,利用722型可见光分光光度计在A550 nm波下测定吸光度,检测出血清中NO的含量[19]。
1.3 统计学方法压疮发生率比较、皮肤压伤程度比较采用有序多分类资料的秩和检验。组间比较采用单因素方差分析,实验组与对照组之间的两两比较使用Dunnett-t检验,数据用均数±标准差表示,以P < 0.05为差异有统计学意义。所有数据采用SPSS16.0统计软件包处理完成。
2 结果 2.1 不同干预方式与损伤程度的关系b组(施压+处理组)大鼠当中17只表现为轻度皮肤损伤,中度10只,重度为4只;而a组(施压组)分别为14、14、4只,3组的损伤程度的秩均值分别为3、38、34,其例数构成差异具有统计学意义(P=0.001,表 1)
| 表 1 不同处理组大鼠皮肤损伤程度的比较 Table 1 Comparison of the skin lesion severity among different groups (n) |
受压6 h组有2只大鼠表现为重度损伤,8 h有6只重度损伤(37.5%);而受压2 h及4 h均无造成重度损伤。在损伤程度方面,以4 h及6 h主要造成轻度及中度的皮肤损伤[均为n=15(分别为9+6及7+8)]。经检验,不同受压时间造成的损伤程度的秩均值分别为25、29、36、40,其例数构成差异有统计学意义(P=0.043,表 2)。
| 表 2 不同受压时间窗大鼠皮肤损伤程度的比较 Table 2 Comparison of skin lesion severity among different compression time windows |
a与b组以Ⅰ及Ⅱ级的浸润程度为主(图 1及2),其次为Ⅲ及Ⅳ级;组间比较显示b组Ⅰ级程度(最轻)只数多于a组(n=17 vs n=15),Ⅱ级少于a组(n=8 vs n=10),且在Ⅳ级比较同样是b组只数少于a组(n=1 vs n=2)。经检验,3组的中性粒细胞浸润程度的秩均值分别为3、37、36,差异有统计学意义(P=0.002,表 3)。
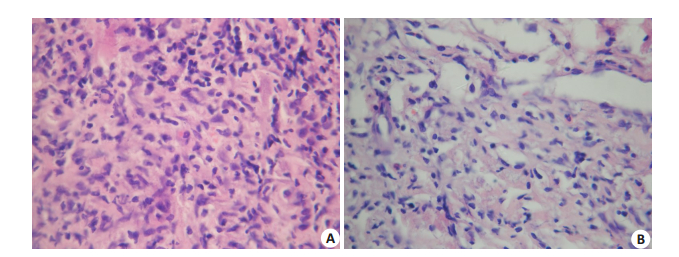
|
图 1 中性粒细胞浸润分级 Figure 1 Grade of neutrophil infiltration. A: Grade Ⅰ neutrophil infiltration (HE staining,original magnification: × 20); B: Grade Ⅱ neutrophil infiltration (DAB staining and hematoxylin counterstaining, ×20). |
| 表 3 不同处理组大鼠受压部位皮肤及皮下组织中性粒细胞浸润程度的比较 Table 3 Comparison of neutrophil infiltration in compressed skin and subcutaneous tissue among different groups |
64只造模鼠以Ⅰ及Ⅱ级的浸润程度为主(n=32及n=18),其次为Ⅲ及Ⅳ级(n=11及n=3);2 h造成的浸润程度最轻,其次为4 h及6 h;8 h所造成的浸润程度最重,其中Ⅲ级达6只(37.5%)。经检验,不同受压时间所导致的中性粒细胞浸润程度的秩均值分别为24、29、35、42,差异有统计学意义(P=0.027,表 4)。
| 表 4 不同受压时间窗大鼠受压部位皮肤及皮下组织中性粒细胞浸润程度的比较 Table 4 Comparison of neutrophil infiltration in compressed skin and subcutaneous tissue among groups with different compression time |
随着干预时间的延长,a及b组均表现SOD含量下降,且其梯度差异具有统计学意义(P值分别为0.02、0.007),均表现为2、4及6 h均显著高于8 h;2 h及4 h均高于6 h,而2 h及4 h之间差异无统计学意义。组间比较方面,b组2、4及6 h的SOD含量显著高于a组(P < 0.05),但8 h的差异无统计学意义(表 5)。
| 表 5 不同处理组大鼠不同受压时间窗血清SOD(U/mL)活力比较 Table 5 Comparison of serum SOD activity in rats with different compression time (U/mL, Mean±SD) |
随着干预时间的延长,a及b组均表现MDA含量上升,且其梯度差异具有统计学意义(P < 0.001),均表现为2、4及6 h均显著低于8 h;2 h显著低于4 h及6 h,而4 h及6 h之间差异无统计学意义。组间比较方面,b组2、4及6 h的MDA含量显著低于a组(P < 0.05),但8 h的差异无统计学意义(表 6)
| 表 6 不同处理组大鼠不同受压时间窗血清MDA含量比较 Table 6 Comparision of serum MDA levels in rats with different compression time (nnol/mL, Mean±SD) |
随着干预时间的延长,a及b组均表现NO含量上升,且其梯度差异具有统计学意义(P < 0.001),均表现为2、4及6 h均显著低于8 h;2 h及4 h显著低于6 h,而2 h及4 h之间无统计学差异。组间比较方面,b组2、4及6 h的NO含量显著低于a组(P < 0.05),但8 h的差异无统计学意义(表 7)。
| 表 7 不同处理组大鼠不同受压时间窗血清NO含量比较 Table 7 Comparison of serum NO levels in rats with different compression time(μmol/L, Mean±SD) |
缺血再灌注损伤(IRI)是组织器官缺血一段时间后,血液重新灌注冲击血管,导致组织器官损伤进一步加重的现象[20]。据最近的研究表明,缺血再灌注损伤已成为压疮的主要决定性因素[20]。压疮缺血再灌注过程中由于出现血流方式的改变,涡流现象,导致了血管内皮功能紊乱、血管收缩、血液粘度增高、红细胞聚集增强、血流减慢、白色微栓形成及无复流现象等微循环障碍[21]。Donato-Trancoso Alin等研究发现,缺血再灌注产生的自由基与细胞损伤与压疮的发生有关[22]。也有研究发现,缺血后处理保护作用与缺血预处理的效应相当,因不必预知缺血事件的发生,可控性要优于缺血预处理,所以具有更广泛的应用范围和实用价值[23]。通过抑制缺血再灌注后自由基的爆发产生来防止自由基对组织的直接损害[22],以及减少其参与中性粒细胞,缺血后处理对各种缺血再灌注损伤组织均能够起到一定的保护作用,缺血后处理己经成功地用于脑、肠、脊髓、肾脏、肝脏、心脏、肺脏等再灌注损伤的实验性研究或临床研究[20],国外的研究发现用大鼠大脑中动脉闭塞模型,在再灌注前行缺血后处理,脑梗死的面积明显缩小[24],肝脏缺血后处理抗损伤作用的研究也得到了证实,表明缺血后处理对肝脏的缺血再灌注损伤有一定的保护作用,应用缺血后处理对缺血再灌注大鼠肠粘膜损伤的保护作用的研究[25]也得到同样的结果。研究已证实缺血后处理可改善心、脑、肾、骨骼肌等损伤后的功能恢复,减少氧自由基及脂质反应,减少过度炎症反应以及因细胞凋亡及血管内皮细胞的调节失衡从而造成组织细胞的损害,但其治疗方案及效果尚待进一步探索。
本课题组前期研究发现,缺血后处理可明显减轻大鼠骨骼肌缺血再灌注性压疮的2 h的损伤,I-PostC组与IR组同样受压时间,IR组和I-PostC组大鼠出现Ⅰ期压疮的发生率为100%;I-PostC组血清NO、MDA含量均高于S组,明显低于IR组,SOD活性低于S组,明显高于IR组,表明缺血造成的骨骼肌损害在2 h后即开始逐渐恢复,I-PostC组较S组恢复快,说明缺血后处理对局灶性缺血具有长期的保护作用,缺血功能的恢复不一定只取决于受压时间的缩短。本次研究在前期研究的基础上,增加了对缺血后处理在不同的时间窗内对压疮损伤的观察,发现在相同的方法和受压时间内,受压2、4、6 h IR组与I-PostC组比较受压大鼠皮肤及皮下组织、中性粒细胞浸润程度、血清SOD活性、MDA及NO含量均有显著性差异。因此可见,一定的时间内缺血后处理在缺血再灌注性压疮中具有保护性作用。
临床上长期卧床或端坐位的患者,极易发生压疮,患者翻身的间隔时间没有明确的规定,一般以2 h翻身1次,使用气垫床的ICU压疮高危人群4 h翻身1次,老年患者逐步延长压迫间隔时间(每阶段延长30 min)的体位更换方法,其压疮发生率低于常规2 h翻身组。这些方法对部分患者能起到一定的预防压疮的作用,但尚缺少长期卧床患者的系统的研究,研究对象的基线如何保持一致性以及缺血处理有效时间窗并未明确。本研究在以上研究的基础上,选择缺血处理的时间为2、4、6、8 h,时间选择上与前期研究结果一致[26]。本研究发现,大鼠即便是在同一时间、同一缺血再灌注循环次数下也会出现不同的损伤结果,说明每只大鼠的皮肤耐受性是存在差异的。相同的方法和相同受压的时间内,受压2、4、6 h IR组与I-PostC组比较受压大鼠皮肤及皮下组织、中性粒细胞浸润程度、SOD活性、MDA及NO含量均有显著性差异。但受压8 h IR组与I-PostC组差异并无显著性差异,由此说明,在一定的时间窗内缺血后处理在缺血再灌注性压疮中具有保护性作用,但其保护作用并非在任何受压时间内,连续受压超过8 h受压组织已形成短时间内不可逆转的损伤,如再进行缺血后处理已不再具有临床意义[27, 30]。临床上患者亦是如此,皮下脂肪薄、营养不良的长期卧床患者亦应该勤观察、多翻身,而且应根据患者自身的身体条件制定相应的翻身时间和次数[28-29]。在本实验最终选定的受压2、4、6、8 h四个缺血时间点中,通过对各项实验结果的分析,提示缺血后处理能对经历2、4、6 h缺血合并再灌注的大鼠产生保护作用;随着缺血时间的延长,缺血后处理对大鼠缺血再灌注损伤的保护作用逐渐减弱,最后消失。
以本实验的结果为依据,可以得出以下结论:(1)缺血后处理可以减轻大鼠缺血再灌注性压疮,表现为皮肤颜色改变、炎性细胞的聚集减轻、氧自由基的改变下降,功能缺损的改善,但这种保护作用会受到骨骼肌缺血时间的限制,随着缺血时间的延长后处理的保护作用会逐步减弱;(2)缺血后处理对大鼠骨骼肌缺血再灌注损伤保护作用有效时间窗为缺血6 h以内,以4 h内最佳。
本研究从基础研究出发,参照文献动物压疮模型的制作方法使用压力装置在大鼠身上建立压疮模型,研究压疮发生的原因,组织的病理改变,以及压疮发生过程中生化指标的变化,从细胞超微结构、分子水平等方面探讨皮肤损伤机制,在此基础上,研究了缺血再灌注后处理对不同时间窗造成的压疮的保护效果,探讨缺血再灌注后处理的最佳保护时间。以上结果为压疮的处理提供了重要参考,在临床护理实践过程中具有一定的临床价值。
| [1] | Oliveira CC, Sabino PP, Ad AS, et al. Pressure ulcer: incidence and demographic, clinical and nutrition factors associated in intensive care unit patients[J]. Nutricion Hospitalaria, 2015, 32(5): 2242. |
| [2] | Posthauer ME, Banks M, Dorner B, et al. The role of nutrition for pressure ulcer management: National pressure ulcer advisory panel, European pressure ulcer advisory panel, and Pan pacific pressure injury alliance White Paper[J]. Adv Skin Wound Care, 2015, 28(4): 175-88. DOI: 10.1097/01.ASW.0000461911.31139.62. |
| [3] | Ferdinandy P, Hausenloy DJ, Heusch G, et al. Interaction of risk factors, comorbidities, and comedications with ischemia/ reperfusion injury and cardioprotection by preconditioning, postconditioning, and remote conditioning[J]. Pharmacol Rev, 2014, 66(4): 1142-74. DOI: 10.1124/pr.113.008300. |
| [4] | Liao XX, Wang LC, Yang CT, et al. Cyclooxygenase mediates cardioprotection of angiotensin-(1-7) against ischemia/reperfusioninduced injury through the inhibition of oxidative stress[J]. Mol Med Rep, 2011, 4(6): 1145-50. |
| [5] | Buchholz B, Donato M, D'annunzio V, et al. Ischemic postconditioning: mechanisms, comorbidities, and clinical application[J]. Mol Cell Biochem, 2014, 392(1/2): 1-12. |
| [6] | Csonka C, Szucs G, Varga-Orvos Z, et al. Ischemic postconditioning alters the gene expression pattern of the ischemic heart[J]. Exp Biol Med, 2014, 239(2): 141-50. DOI: 10.1177/1535370213511017. |
| [7] | Lishmanov YB, Gorbunov AS, Maslov LN. Involvement of protein kinase c-delta in the realization of cardioprotective effect of schemic postconditioning[J]. Bull Exp Biol Med, 2016, 161(3): 344-6. DOI: 10.1007/s10517-016-3410-6. |
| [8] | Cui FF, Pan YY, Xie HH, et al. Pressure combined with ischemia/ reperfusion injury induces deep tissue injury via endoplasmic reticulum stress in a rat pressure ulcer model[J]. Int J Mol Sci, 2016, 17(3): 453. |
| [9] | 黄芳, 杨晶金, 王雪玲, 等. VEGF和bFGF在大鼠压疮模型中的表达及其意义[J]. 中国病理生理杂志, 2012, 28(8): 1504-6. |
| [10] | 张自珍, 罗欣, 于小华. 黄芪注射液抑制压疮缺血再灌注损伤大鼠的炎症反应并增强其抗氧化损伤能力[J]. 细胞与分子免疫学杂志, 2015, 31(4): 507-10. |
| [11] | 王晓慧, 毛挺挺, 潘莹莹, 等. 肿瘤坏死因子α与基质金属蛋白酶2及胶原在大鼠压疮皮肤组织中的表达及意义[J]. 中华烧伤杂志, 2016, 32(3): 160-7. |
| [12] | 王艳, 刁波, 郑国荣, 等. ω-3多不饱和脂肪酸对老年大鼠组织损伤的影响[J]. 医药导报, 2013, 32(2): 139-42. |
| [13] | 邓奕辉, 覃弘宇, 文果, 等. 化瘀解毒法对MCAO大鼠凝血酶及其受体、脑组织MCP-1、NF-κB的表达及中性粒细胞浸润的影响[J]. 世界中医药, 2016, 11(4): 575-9. |
| [14] | Kasuya A, Sakabe JI, Tokura Y. Potential application of in vivo imaging of impaired lymphatic duct to evaluate the severity of pressure ulcer in mouse model[J]. Sci Rep, 2014, 4(8): 4173. |
| [15] | 肖洪玲, 龙子江, 施慧, 等. 压疮灵对大鼠压疮模型局部SOD、MDA、VEGF和EGF表达的影响[J]. 中药药理与临床, 2016(1): 137-40. |
| [16] | Avci E, Akarslan ZZ, Erten H, et al. Oxidative stress and cellular immunity in patients with recurrent aphthous ulcers[J]. Braz J Med Biol Res, 2014, 47(5): 355-60. DOI: 10.1590/1414-431X20143714. |
| [17] | 兰园淞, 高文, 廖海涛, 等. 超氧化物歧化酶、丙二醛和内皮素在大鼠压疮模型损伤中的表达及作用[J]. 护理学报, 2017, 24(9): 1-6. |
| [18] | Azadi S, Ashrafi H, Azadi A. A hopeful prospect of riociguat as a soluble guanylate cyclase stimulator for management of pressure ulcers[J]. Curr Drug Discov Technol, 2017, 60(12): 78. |
| [19] | 路雅雯, 嵇波, 戴健, 等. 不同频率电针及刺激次数对心肌缺血大鼠内关穴与非经非穴点皮肤血流灌注量的影响[J]. 北京中医药大学学报, 2016, 39(12): 1041-7. |
| [20] | Wang YY, Pu LH, Li Z, et al. Hypoxia-Inducible factor-1 alpha gene expression and apoptosis in Ischemia-Reperfusion injury a rat model of Early-Stage pressure ulcer[J]. Nurs Res, 2016, 65(1): 35-46. DOI: 10.1097/NNR.0000000000000132. |
| [21] | Gust MJ, Hong SJ, Fang RC, et al. Adipose tissue drives response to Ischemia-Reperfusion injury in a murine pressure Sore model[J]. Plast Reconstr Surg, 2017, 139(5): 1128E-38E. DOI: 10.1097/PRS.0000000000003271. |
| [22] | Donato-Trancoso A, Monte-Alto-Costa A, Romana-Souza B. olive oil-induced reduction of oxidative damage and inflammation promotes wound healing of pressure ulcers in mice[J]. J Dermatol Sci, 2016, 83(1): 60-9. DOI: 10.1016/j.jdermsci.2016.03.012. |
| [23] | Talab SS, Emami H, Elmi A, et al. Chronic Lithium treatment protects the rat kidney against ischemia/reperfusion injury: The role of nitric oxide and cyclooxygenase pathways[J]. Eur J Pharmacol, 2010, 647(1/3): 171-7. |
| [24] | Andreas M, Schmid AI, Keilani MA, et al. Effect of ischemic preconditioning in skeletal muscle measured by functional magnetic resonance imaging and spectroscopy: a randomized crossover trial[J]. J Cardiovasc Magn Reson, 2011, 13(1): 1-10. DOI: 10.1186/1532-429X-13-1. |
| [25] | Santos CH, Aydos RD, Nogueira NE, et al. Importance of duration and number of ischemic postconditioning cycles in preventing reperfusion mesenteric injuries. Experimental study in rats[J]. Acta Cirurgica Brasileira, 2015, 30(10): 709-14. DOI: 10.1590/S0102-865020150100000009. |
| [26] | Zhao H, Sapolsky RM, Steinberg GK. Interrupting reperfusion as a stroke therapy: ischemic postconditioning reduces infarct size after focal ischemia in rats[J]. J Cereb Blood Flow Metab, 2006, 26(9): 1114-21. DOI: 10.1038/sj.jcbfm.9600348. |
| [27] | Wassermann E, van Griensven M, Gstaltner KA, et al. A chronic pressure ulcer model in the nude mouse[J]. Wound Repair Regen, 2009, 17(4): 480-4. DOI: 10.1111/wrr.2009.17.issue-4. |
| [28] | Lin F, Pandya A, Cichowski A, et al. Deep tissue injury rat model for pressure ulcer research on spinal cord injury[J]. J Tissue Viability, 2010, 19(2, SI): 67-76. DOI: 10.1016/j.jtv.2009.11.009. |
| [29] | 王艳艳, 孙海琴, 张纯瑜, 等. 压疮早期动物模型的制备及评价[J]. 护理学杂志, 2010, 25(14): 1-5. DOI: 10.3870/hlxzz.2010.14.001. |
| [30] | Siu PM, Tam EW, Teng BT, et al. Muscle apoptosis is induced in pressure-induced deep tissue injury[J]. J Appl Physiol, 2009, 107(4): 1266-75. DOI: 10.1152/japplphysiol.90897.2008. |
| [31] | Rentoukas I, Giannopoulos G, Kaoukis AA, et al. Cardioprotective role of remote ischemic periconditioning in primary percutaneous coronary intervention enhancement by opioid action[J]. JACC Cardiovasc Interv, 2010, 3(1): 49-55. DOI: 10.1016/j.jcin.2009.10.015. |
 2017, Vol. 37
2017, Vol. 37

