胶质瘤是临床上常见的原发性脑肿瘤,与邻近正常脑组织无明显分界,具有高度侵袭性,常易复发且死亡率高,即使联合使用外科手术、化疗和放疗等治疗,其中位生存期平均仅1年多[1-2],5年生存率在3%以下[3-4],因此探讨胶质瘤新的治疗靶点对延长患者生存期具有重要意义。转录因子PAX6是进化上高度保守的PAX基因家族成员之一,在眼、胰腺、中枢神经系统和内分泌等组织器官的发育、分化中具有重要作用[5],如PAX6参与了小鼠视网膜发育[6]、角膜上皮细胞的分化[7]以及角膜缘干细胞的定向分化[8]等。该基因亦广泛地参与细胞增殖、迁移和黏附等生命活动以及胚胎发育、肿瘤发生等多种生物学过程[9],在帕金森氏症PAX6对多巴胺能神经元起保护作用[10]。PAX6在肿瘤的生长、侵袭和血管生成中可能发挥致癌或抑癌作用取决于不同的组织类型[11]。研究表明,PAX6的表达水平在不同肿瘤组织中存在差异,胶质瘤组织中PAX6的表达水平明显低于胶质瘤旁组织[12],但PAX6在胶质瘤组织中的作用尚不明确。本研究拟构建PAX6基因的小发夹状RNA (shRNA)的慢病毒表达重组载体shRNA-PAX6,转染胶质瘤U251细胞,观察PAX6对胶质瘤U251细胞增殖的影响,探讨PAX6在胶质瘤中的作用,为寻求胶质瘤治疗新靶点提供参考。
1 材料和方法 1.1 材料DMEM培养基(Hyclone公司),胎牛血清(Invitrogen公司),Trizol (Invitrogen公司),PCR TaqMix (广州东盛生物公司),琼脂糖(Spanish公司),凝胶回收试剂盒(OMEGA公司),pLKD-CMV-G & PR-U6-shRNA慢病毒载体(纽恩上海生物科技有限公司),核酸分子量标准(Fermentans公司),AgeI(NEB公司),EcoRI (Fermentans公司),BamHI、EcoR I、T4连接酶和逆转录试剂盒(Fermentas公司),ViraPowerTM Lentiviral Packaging Mix(Invitrogen公司),PAX6一抗和二抗购自Santa Cruz,293T细胞和U251细胞(上海细胞所),大肠杆菌DH5α菌株为本室保存。
1.2 方法 1.2.1 shRNA-PAX6载体构建根据人PAX6基因(NM_000280)序列,参考文献[13]报道的PAX6靶点序列ATGGGCGGAGTTATGATACCTAC,设计两条PAX6靶点干扰序列,如下所示:PAX6-shRNA-1:CCGGATGGGCGGAGTTATGATACCTACCTCGAGAGGTATCAT AACTCCGCCCATTTTTTG,PAX6-shRNA-2:AATTCA AAAAATGGGCGGAGTTATGATACCTACCTCGAGT AGGTATCATAACTCCGCCCA。引物退火形成带粘性末端的双链,与经此BamHI、EcoR I双酶切后线性化的慢病毒载体进行连接、转化。通用阴性对照序列(AATTCTCCGAACGTGTCACGT)作为靶序列的阴性对照(NC)亦与慢病毒载体连接。
1.2.2 阳性克隆的菌落PCR及测序鉴定挑取平板上长出的单个菌落重悬于10 µL LB液体培养基中,从中取6 µL做PCR扩增的模板,扩增引物如下,上游引物:5'-CCTATTTCCCATGATTCCTTCATA-3',下游引物:5'-GTAATACGGTTATCCACGCG-3',预计PCR扩增产物空载对照条带294 bp,阳性条带316 bp。然后取PCR产物于1%的琼脂糖凝胶电泳,凝胶成像系统拍照。另取200 µL重组阳性克隆菌液送华大基因公司进行序列测定,测序结果采用CLUSTAL X 1.8软件进行比对分析。
1.2.3 慢病毒的包装选取菌落PCR鉴定正确的阳性克隆大量扩增后,提取质粒,与慢病毒包装质粒混合物(ViraPowerTM Lentiviral Packaging Mix)共转染293T细胞,分别在转染换液24 h及48 h后收集培养的上清液,将两次收集到的病毒原液混合均匀后,4 ℃,3000 r/min离心30 min,去除细胞和碎片,上清用0.45 µm的滤器过滤。最后进行慢病毒液的浓缩和分装,将慢病毒原液12 000 g,4 ℃超速离心20 min,弃上清,将沉淀溶解在2% FBS的DMEM中。
1.2.4 慢病毒滴度测定将病毒液倍比稀释(10、1、0.1 µL)后感染处于对数生长期的293T细胞,72 h后,在荧光显微镜下观察各孔中发荧光的细胞数量,病毒滴度为各孔中表达荧光的细胞数平均数除以每孔中含有的慢病毒液体积。
1.2.5 PAX6表达的检测 1.2.5.1 Real-time PCR检测PAX6 mRNA的表达将已经包装的PAX6基因慢病毒载体(shRNA-PAX6)及慢病毒空载体(shRNA-NC)分别感染培养的胶质瘤U251细胞,72 h后收集各组细胞。Real-time PCR引物,PAX6正义链为AGACACAGCCCTCACAAAC,反义链为ATCATAACTCCGCCCATTC,扩增产物为157 bp;内参β-actin正义链为AGGGGCCGGACTCGTCA TACT,反义链为GGCGGCACCACCATGTACCCT,扩增产物为202 bp。反应体系为20 µL,按照94 ℃预变性3 min,94 ℃变性30 s,58 ℃复性30 s,72 ℃延伸30 s,40个循环,72 ℃延伸10 min。
1.2.5.2 Western blot检测PAX6蛋白的表达在病毒感染后72 h用0.25%胰酶消化收集各组细胞,1500 r/min离心后弃上清;再分别用1 mL PBS重悬细胞,1500 r/min离心弃上清,细胞沉淀用于提取蛋白。取一定量总蛋白样品进行SDS-PAGE电泳,转移到PVDF膜上,用TBST室温封闭1 h,分别用稀释的抗PAX6或内参β-actin一抗4 ℃孵育过夜。TBST漂洗3次,加入辣根过氧化物酶标记羊抗兔IgG二抗,室温孵育1 h。TBST漂洗3次,用ECL Western blot试剂盒检测。
1.2.6 MTT检测细胞活力各组细胞在慢病毒感染后0、24、48、72 h,96孔板每孔分别加入5 mg/mL的MTT 20 μL(终浓度为0.5 mg/mL),孵育4 h,弃上清,每孔加入200 μL DMSO,震荡20 min,置酶标仪570 nm处测定吸光度(A)。以正常组细胞活力为100%,实验组细胞活力按以下公式计算:细胞活力(%) =实验组吸光度/对照组吸光度×100%。
1.2.7 统计学方法用SPSS16.0软件分析实验数据,结果以均数±标准差表示,组间重复性双因素方差分析比较采用ANOVA检验。Real-time PCR数值分析采用2-ΔΔCt分析法计算基因表达的相对比值,以P<0.05为差异有统计学意义。
2 结果 2.1 pLKD-CMV-G & NR-U6-shRNA慢病毒载体的双酶切的琼脂糖凝胶电泳pLKD-CMV-G & NR-U6-shRNA慢病毒载体经AgeI和EcoRI酶切后的琼脂糖电泳凝胶电泳图,由图可见一个8208 bp的大片段,切胶纯化后得到线性化的pLKD-CMV-G & NR-U6-shRNA载体片段(图 1)。

|
图 1 AgeI和EcoRI双酶切pLKD-CMV-G & NRU6-shRNA载体 Figure 1 Digestion of pLKD-CMV-G & NR-U6-shRNA vector with Age I and EcoR I. M: DL10000 DNA marker; 1: A large fragment after enzyme digestion. |
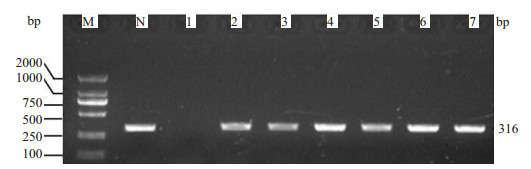
感受态大肠杆菌转化后过夜培养,可见散在的单个菌落。挑取单个菌落做为菌落PCR的模板DNA,PCR扩增产物经1%琼脂糖凝胶电泳,结果显示在1~7号转化子中,其中2~7号转化子为阳性克隆,扩增条带与预计产物大小316 bp一致(图 2)。
|
图 2 shRNA-PAX6的菌落PCR鉴定 Figure 2 Identification of shRNA-PAX6 by colony PCR. M: DS2000 DNA marker; 1: Negative transformant; 2-7: Positive transformants. |
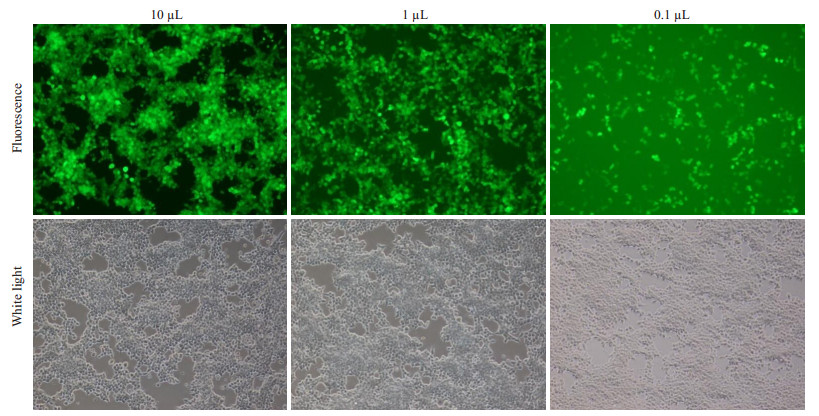
慢病毒对293T细胞系具有感染能力,并且与不同的稀释倍数相关,慢病毒对细胞的感染力直接反映在带绿色荧光的细胞数量上。荧光显微镜下可见,慢病毒液稀释的倍数越高,感染的细胞数越少(图 3)。对GFP计数后可知,本实验中该慢病毒重组载体的生产体系所获得的病毒平均滴度为6.73×108 TU/mL。
|
图 3 shRNA-PAX6慢病毒重组载体的滴度测定 Figure 3 Measurement of viral titer (Original magnification: ×100). |
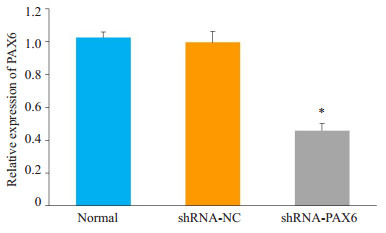
Real-time PCR结果显示:胶质瘤U251细胞感染shRNA-PAX6慢病毒重组载体48 h后,PAX6表达水平明显低于未感染组及感染shRNA-NC组(P<0.05,图 4)。
|
图 4 PAX6在U251细胞的表达 Figure 4 Expression of PAX6 mRNA in U251 cells after infection with shRNA-PAX6. Normal: Normal group; shRNA-NC: Cells infected with shRNA-NC empty vector; shRNA-PAX6: Cells infected with shRNA-PAX6 vector, *P < 0.05 vs normal group and shRNA-NC group. |
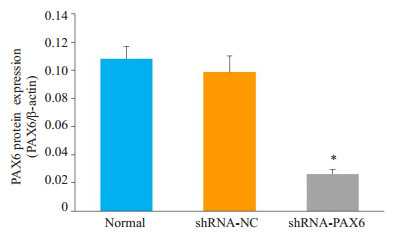
shRNA-PAX6慢病毒重组载体感染U251细胞后,通过Western blot检测PAX6蛋白的表达,结果可见PAX6蛋白表达明显低于未感染组及感染shRNA-NC组(P<0.05,图 5)。
|
图 5 U251细胞中PAX6蛋白的表达 Figure 5 Expression of PAX6 protein in U251 cells infected with shRNA-PAX6. Normal: Normal group; shRNA-NC: Cells infected with shRNA-NC empty vector; shRNA-PAX6: Cells infected with shRNA-PAX6 recombinant vector, *P < 0.05 vs normal group and shRNA-NC group. |
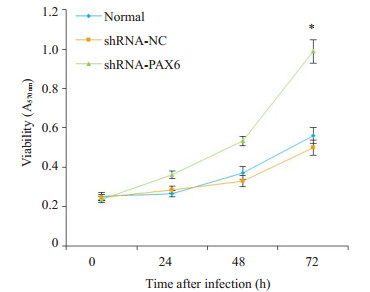
以shRNA-PAX6慢病毒重组载体感染U251细胞,在不同的时间点检测细胞增殖情况,MTT结果可见,与未感染组细胞及shRNA-NC组细胞比较,在72 h,U251细胞的增殖能力明显增强(P<0.05,图 6)。
|
图 6 PAX6对U251细胞增殖的影响 Figure 6 Effects of PAX6 silencing on the proliferation of U251 cells. *P < 0.05 vs normal group and shRNA-NC group. |
转录因子PAX6是PAX基因家族重要成员之一,该基因可通过激活或抑制下游靶基因的启动子、增强子等的转录活性从而调节靶基因的转录[14],在不同类型癌症的生长、侵袭和血管生成中可能发挥致癌或抑癌作用。研究报道[15],PAX6高表达于胰腺癌组织,其表达水平与该肿瘤的恶性程度呈正相关,抑制PAX6的表达可能通过活化酪氨酸激酶受体作用促进胰腺癌细胞凋亡、细胞生长能力降低;乳腺癌组织中PAX6表达水平的高低与其预后相关[16]。抑制PAX6的表达,可通过增加Bcl-2、CDK1和PCNA的表达,降低BAX和p21的表达,减少细胞凋亡从而促进人视网膜母细胞瘤细胞增殖[17],但另有研究报道,靶向沉默PAX6表达也可能通过调控PI3K/AKT信号通路而抑制视网膜母细胞瘤细胞增殖和侵袭[18];PAX6高表达于非小细胞肺癌A549、H1299细胞,抑制PAX6的表达,通过抑制MAPK信号通路从而抑制癌细胞增殖及细胞周期进程[19],过表达PAX6则可通过ERK和MAPK信号通路促进A549细胞的增殖和侵袭[20];在前列腺癌组织和细胞中PAX6的表达水平低于正常上皮细胞,过表达PAX6抑制前列腺癌细胞的增殖和克隆形成[21]。PAX6与膀胱癌亦具有相关性,它可能作为肿瘤抑制因子在癌症的发生发展中起着分子标志作用。胶质瘤组织中PAX6的表达水平明显低于邻近正常脑组织[11],过表达PAX6能抑制胶质瘤细胞的生长和侵袭,PAX6可能是通过抑制G1期向S期转化从而抑制细胞生长,或通过抑制VEGFA的表达而抑制肿瘤的生长、血管生成和转移[22];过表达PAX6还可能通过PI3K/Akt信号通路调控胶质瘤干细胞的生长与侵袭[23],提示PAX6在胶质瘤组织中的低表达可能是胶质瘤异常增殖、生长的原因之一。
本研究采用RNA干扰技术,参考文献[13]的报道选取2个干扰靶点作为PAX6 siRNA序列,以pLKDCMV-G & NR-U6-shRNA慢病毒载体为基因转移工具,构建了PAX6基因的shRNA-PAX6慢病毒重组载体。鉴于包装细胞系的建立是获得完整病毒颗粒并得以感染靶细胞的关键步骤,研究中选取菌落PCR及测序鉴定正确的重组慢病毒载体在293T细胞中完成对慢病毒的包装,通过荧光显微镜观察GFP的表达情况并测得慢病毒的平均滴度为6.73×108 TU/mL,表明shRNAPAX6慢病毒载体成功转染293T细胞,可以用于感染目的细胞。本研究中将shRNA-PAX6慢病毒载体感染胶质瘤U251细胞,Real-time PCR结果显示,shRNAPAX6感染组细胞PAX6 mRNA的表达均明显低于未感染组细胞及shRNA-NC感染组细胞;Western blot结果显示,shRNA-PAX6感染组细胞PAX6蛋白的表达亦明显低于未感染组细胞及shRNA-NC感染组细胞;结果表明,感染shRNA-PAX6慢病毒载体可以使U251细胞中的目的基因PAX6 mRNA及蛋白表达水平均降低,能在分子水平有效地沉默靶基因。MTT结果显示,shRNA-PAX6感染组细胞的增殖能力亦高于未感染组细胞及shRNA-NC感染组细胞,结果表明沉默PAX6的表达可增强胶质瘤U251细胞的增殖能力。
近年来的研究表明,PAX6作为microRNA-335的靶基因抑制胶质瘤U251细胞、U87细胞的增殖[24]以及抑制乳腺癌MCF-7细胞的增殖[25];但PAX6作为microRNA-7的靶基因则促进结肠直肠癌Caco-2细胞、SW480细胞的增殖[26],PAX6作为microRNA-433的靶基因则促进视网膜母细胞瘤细胞的增殖和转移[27],PAX6亦作为microRNA-375的靶基因则增强乳腺癌MCF-7细胞的活力[28]。由于PAX6调控的基因众多,而且PAX6本身又是多种microRNA的靶基因,对其调控机制尚未完全阐明,究竟PAX6基因是如何影响胶质瘤细胞的增殖、生长的,还需要作深入研究。本研究构建的shRNA-PAX6慢病毒重组载体能在分子水平有效的沉默靶基因,为进一步研究PAX6基因的功能奠定了实验基础,PAX6有望成为临床治疗胶质瘤患者的潜在靶点。
| [1] | Badhiwala JH, Nassiri F, Almenawer SA. GBM surgery in the elderly-time to be more aggressive?[J]. Clin Neurol Neurosurg, 2016, 141(2): 131-2. |
| [2] | Riedmann EM. Agenus cancer vaccine extends survival of GBM patients[J]. Hum Vaccin Immunother, 2014, 10(2): 252-3. DOI: 10.4161/hv.28444. |
| [3] | Qu ST, Yao YL, Shang C, et al. MicroRNA-330 is an oncogenic factor in glioblastoma cells by regulating SH3GL2 gene[J]. PLoS One, 2012, 7(9): e46010. DOI: 10.1371/journal.pone.0046010. |
| [4] | Dolecek TA, Propp JM, Stroup NE, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J]. Neuro Oncol, 2012, 14(Suppl 5): v1-49. DOI: 10.1093/neuonc/nos218. |
| [5] | Paixão-Côrtes VR, Salzano FM, Bortolini MC. Origins and evolvability of the PAX family[J]. Semin Cell Dev Biol, 2015, 44(8): 64-74. |
| [6] | Kim CH, An MJ, Kim DH, et al. Histone deacetylase 1 (HDAC1) regulates retinal development through a PAX6-dependent pathway[J]. Biochem Biophys Res Commun, 2017, 482(4): 735-41. DOI: 10.1016/j.bbrc.2016.11.103. |
| [7] | Kitazawa K, Hikichi T, Nakamura TA, et al. PAX6 regulates human corneal epithelium cell identity[J]. Exp Eye Res, 2017, 154(1): 30-8. |
| [8] | Ouyang H, Xue YC, Lin Y, et al. WNT7A and PAX6 define corneal epithelium homeostasis and pathogenesis[J]. Nature, 2014, 511(7509): 358-61. DOI: 10.1038/nature13465. |
| [9] | Blake JA, Ziman MR. Pax genes: regulators of lineage specification and progenitor cell maintenance[J]. Development, 2014, 141(4): 737-51. DOI: 10.1242/dev.091785. |
| [10] | Thomas MG, Welch C, Stone L, et al. PAX6 expression may be protective against dopaminergic cell loss in Parkinson's disease[J]. CNS Neurol Disord Drug Targets, 2016, 15(1): 73-9. DOI: 10.2174/1871527314666150821101757. |
| [11] | Zhou YH, Tan F, Hess KR, et al. The expression of PAX6, PTEN, vascular endothelial growth factor, and epidermal growth factor receptor in gliomas: relationship to tumor grade and survival[J]. Clin Cancer Res, 2003, 9(9): 3369-75. |
| [12] | Lin J, Teo S, Lam DH, et al. MicroRNA-10b pleiotropically regulates invasion, angiogenicity and apoptosis of tumor cells resembling mesenchymal subtype of glioblastoma multiforme[J]. Cell Death Dis, 2012, 3(10): e398. DOI: 10.1038/cddis.2012.134. |
| [13] | Zong XY, Yang HJ, Yu Y, et al. Possible role of Pax-6 in promoting breast cancer cell proliferation and tumorigenesis[J]. BMB Rep, 2011, 44(9): 595-600. DOI: 10.5483/BMBRep.2011.44.9.595. |
| [14] | Gregory-Evans CY, Wang X, Wasan KM, et al. Postnatal manipulation of Pax6 dosage reverses congenital tissue malformation defects[J]. J Clin Invest, 2014, 124(1): 111-6. DOI: 10.1172/JCI70462. |
| [15] | Lai JP, Mertens RB, Mirocha J, et al. Comparison of PAX6 and PAX8 as immunohistochemical markers for pancreatic neuroendocrine tumors[J]. Endocr Pathol, 2015, 26(1): 54-62. DOI: 10.1007/s12022-014-9346-3. |
| [16] | Xia XH, Yin WJ, Zhang XP, et al. PAX6 overexpression is associated with the poor prognosis of invasive ductal breast cancer[J]. Oncol Lett, 2015, 10(3): 1501-6. |
| [17] | Meng B, Wang YS, Li B. Suppression of PAX6 promotes cell proliferation and inhibits apoptosis in human retinoblastoma cells[J]. Int J Mol Med, 2014, 34(2): 399-408. DOI: 10.3892/ijmm.2014.1812. |
| [18] | 祁海燕, 冷非, 苏学刚. 靶向沉默Pax6基因表达抑制视网膜母细胞瘤增殖侵袭的机制研究[J]. 临床和实验医学杂志, 2017, 16(16): 1604-7. DOI: 10.3969/j.issn.1671-4695.2017.16.012. |
| [19] | Zhao XT, Yue WT, Zhang LN, et al. Downregulation of PAX6 by shRNA inhibits proliferation and cell cycle progression of human non-small cell lung cancer cell lines[J]. PLoS One, 2014, 9(1): e85738. DOI: 10.1371/journal.pone.0085738. |
| [20] | Luo JS, Li H, Zhang CF. MicroRNA-7 inhibits the malignant phenotypes of non-small cell lung cancer in vitro by targeting Pax6[J]. Mol Med Rep, 2015, 12(4): 5443-8. DOI: 10.3892/mmr.2015.4032. |
| [21] | Shyr CR, Tsai MY, Yeh S, et al. Tumor suppressor PAX6 functions as androgen receptor co-repressor to inhibit prostate cancer growth[J]. Prostate, 2010, 70(2): 190-9. |
| [22] | Qiu JF, Zhang ZQ, Wang Y, et al. Lentivirus-mediated RNAi knockdown of VEGFA in RKO colorectal cancer cells decreases tumor formation and growth in vitro and in vivo[J]. Int J Clin Exp Pathol, 2012, 5(4): 290-8. |
| [23] | Huang BS, Luo QZ, Han Y, et al. MiR-223/PAX6 axis regulates glioblastoma stem cell proliferation and the chemo resistance to TMZ via regulating PI3K/Akt pathway[J]. J Cell Biochem, 2017, 118(10): 3452-61. DOI: 10.1002/jcb.v118.10. |
| [24] | Cheng Q, Cao H, Chen ZG, et al. PAX6, a novel target of miR-335, inhibits cell proliferation and invasion in glioma cells[J]. Mol Med Rep, 2014, 10(1): 399-404. DOI: 10.3892/mmr.2014.2150. |
| [25] | Meng YB, Zou QQ, Liu TQ, et al. microRNA-335 inhibits proliferation, cell-cycle progression, colony formation, and invasion via targeting PAX6 in breast cancer cells[J]. Mol Med Rep, 2015, 11(1): 379-85. DOI: 10.3892/mmr.2014.2684. |
| [26] | Li YW, Li YH, Liu YH, et al. PAX6, a novel target of microRNA-7, promotes cellular proliferation and invasion in human colorectal cancer cells[J]. Dig Dis Sci, 2014, 59(3): 598-606. DOI: 10.1007/s10620-013-2929-x. |
| [27] | Li XH, Yang L, Shuai TH, et al. MiR-433 inhibits retinoblastoma malignancy by suppressing Notch1 and PAX6 expression[J]. Biomed Pharmacother, 2016, 82(8): 247-55. |
| [28] | Zou QY, Yi WJ, Huang JH, et al. MicroRNA-375 targets PAX6 and inhibits the viability, migration and invasion of human breast cancer MCF-7 cells[J]. Exp Ther Med, 2017, 14(2): 1198-204. |
 2017, Vol. 37
2017, Vol. 37

