2. 南方医科大学 中医药学院,广东 广州 510515
2. College of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510515, China
类风湿关节炎(RA)是一种慢性、炎性、系统性的自身免疫疾病[1],其主要发病特点为持续进展性的外周对称性小关节滑膜炎症形成,并导致关节骨和软骨破坏,进而出现受累关节的畸形和功能障碍[2]。目前RA的确切发病机制尚不清楚,绝大多数观点认为其发病主要是由细胞因子、生长与分化因子等免疫蛋白和分子通过胞内外信号转导在树突状细胞、T/B淋巴细胞、成纤维滑膜细胞(FLS)、成骨/破骨细胞等免疫细胞间形成复杂的调节网络而参与RA的发生与发展[3-4]。
白细胞介素-22 (IL-22)作为IL-10细胞因子家族成员,主要有活化辅助性T淋巴细胞、自然杀伤细胞等产生,并通过对靶细胞的作用发挥致病机制[5]。既往在胶原诱导关节炎小鼠模型研究显示:与野生小鼠相比,IL-22缺陷小鼠对胶原诱导关节炎易感性显著下降[6]。在RA患者中研究发现IL-22受体1在RA滑膜组织衬里层和衬里下层的vimentin (+) FLS中高表达[7],提示IL-22可能参与了RA滑膜病变的发展过程。同时,我们的既往研究亦发现自然杀伤细胞NKp44细胞亚群能够表达IL-22和肿瘤坏死因子α (TNFα),且其细胞上清液能在一定程度上促进FLS增殖[8-9],但IL-22参与RA-FLS增殖活化的机制尚未完全清楚。为此,本研究通过IL-22干预RA离体FLS并检测细胞的增殖程度及相关信号通路蛋白表达,以期明确IL-22促进FLS增殖的机制。
1 资料和方法 1.1 研究对象2012年2月~2013年12月期间,南方医科大学附属南方医院中医风湿科和关节骨病外科行腔镜术或关节置换术的RA膝关节滑膜组织3例,患者均满足美国风湿病学会1987年修订的RA分类标准[10]或美国风湿病学会/欧洲抗风湿病联盟2010年RA新分类标准[11]。该研究遵循赫尔辛基宣言原则,所有涉及人体样本的获得均得到患者本人的知情同意以及南方医科大学南方医院医疗机构伦理审查委员会批准(NO.NFEC20120201)。
1.2 主要仪器和试剂全自动酶标仪(BIOTEK),Mini-PROTEAN Tetra Cell蛋白电泳仪、Tram-Blot SD半干电转仪、Gel Doe 2000凝胶成像系统(Bio-Rad),BCA蛋白试剂盒(Sangon Biotech),RIPA Lysis Buffer Ⅰ,ECL Plus kit (AmershamPharmacia),immunoCruzTM mouse LSAB染色试剂盒(Santa Cruz),重组人IL-22 (RD),小鼠IgG1抗人vimentin、小鼠IgG1抗人CD68、小鼠IgG1同型对照抗体、α-氰基-(3, 4-羟基)N-苄苯乙烯胺(AG490) (Santa Cruz),抗信号传导及转录激活因子3 (STAT3)小鼠单抗、抗磷酸化STAT3 (p-STAT3)小鼠单抗、抗细胞外信号调节蛋白激酶1/2(ERK1/2)兔单抗、抗磷酸化ERK1/2(p-ERK1/2)兔单抗、抗P38兔单抗、抗磷酸化P38 (p-P38)兔单抗、抗GAPDH兔单抗(Cell Signaling),Peroxidase AffiniPure羊抗鼠IgG、Peroxidase AffiniPure羊抗兔IgG (JacksonImmuno),胎牛血清(FBS)、DMEM培养基、0.25%胰酶(GIBCO),甲基噻唑基四唑(MTT)、二甲基亚砜(DMSO)、Triton X-100 (Sigma)。
1.3 FLS分离培养和鉴定[12-13]组织块法分离培养RA-FLS:无菌条件下获取滑膜组织块,PBS洗涤后加入含20% FBS+100 U/mL青霉素+100 mg/mL链霉素的DMEM 1 mL,将组织块用手术剪剪成1 mm×1 mm×1 mm大小,铺至细胞培养瓶底部,倒置于37 ℃、5% CO2细胞培养箱中培养2 h后,加入上述培养基3 mL覆盖组织块,并正置细胞培养瓶继续培养,2~3 d更换1次培养基,当大量FLS爬出后,去除贴附的组织块继续培养,镜下FLS爬满培养瓶面积80%时进行细胞传代培养。
应用免疫组化法对第4~5代FLS进行鉴定:将FLS用含10% FBS的DMEM培养基(或含干预药物的培养基)重悬、计数、调整细胞浓度至2×105/mL,接种0.5 mL/孔于48孔板,细胞培养箱培养24、48、72 h后4%多聚甲醛1 mL室温固定20 min,按照免疫组化试剂盒步骤进行一抗、二抗孵育及终止,室温细胞核复染并封片后,荧光倒置显微镜下观察并拍照记录。
1.4 细胞体外干预分组IL-22干预FLS增殖分组:1 ng/mL IL-22组、10 ng/mL IL-22组、50 ng/mL IL-22组、100 ng/mL IL-22组、正常细胞培养液对照组,分别培养24、48、72 h后,MTT法检测细胞增殖程度。
IL-22干预FLS信号通路分组:50 ng/mL IL-22分别干预FLS 0、0.25、0.5、1、1.5、2、4 h以及8 h后,Western blot检测STAT3、ERK1/2、P38总蛋白/磷酸化蛋白以及内参蛋白的表达。
AG490抑制IL-22促进FLS增殖分组:50 ng/mL IL-22组、50 ng/mL IL-22+100 μmol/L AG490组、100 μmol/L AG490组、正常细胞培养液对照组,分别培养24、48、72 h后,MTT法检测细胞增殖程度。
1.5 FLS增殖MTT检测[9]取第4~5代FLS制备成重悬细胞液,调整细胞浓度为3×104 cell/mL,分别接种100 mL/孔细胞于96孔板(均设置3个复孔),置于37 ℃、5% CO2培养箱中培养4 h,分别在细胞贴壁后的第0、24、48小时加入含不同干预方案的培养基,并继续于细胞培养箱中培养细胞至贴壁后的第72小时,弃培养基,每孔加入含10% FBS的DMEM培养基90 μL和PBS配制的5 mg/mL的MTT液10 μL,细胞培养箱继续培养4 h后每孔加入DMSO 120 μL,低速振荡溶解结晶后酶标仪测定吸光度A490 nm。
1.6 信号通路蛋白Western blot检测[7]取第4~5代FLS制备成重悬细胞液,调整细胞浓度为1×105mL,分别接种1 mL/孔细胞于6孔板,并加入含10% FBS的DMEM培养基2 mL后置于37 ℃、5% CO2培养箱中培养24 h,加入含不同干预方案的培养基继续培养至干预结束,于冰面上用含蛋白酶抑制剂的细胞裂解液(RIPA Lysis Buffer Ⅰ)收集细胞并超声打断、离心、提取蛋白层液体,BCA蛋白试剂盒计算样品蛋白浓度(步骤见试剂盒说明书),100 ℃沸水预处理蛋白变性并离心、冷却后,分别将30 μg总量的蛋白样本加入SDSPAGE胶上样孔,电压100 V下浓缩胶电泳20 min,电压200 V下分离胶电泳40 min,PVDF半干转膜,封闭液封闭1 h,4 ℃摇床孵育一抗过夜,室温摇床孵育二抗1 h,化学发光法(ECL Plus kit)显影曝光后,凝胶成像系统摄图并Gel-Pro analyzer 4.0比较分析条带光密度。
1.7 统计学方法采用SPSS20.0软件统计分析,描述计量资料用均数±标准差,Shapiro-Wilk进行正态性检验,Levene进行方差齐性检验,检验水准为0.1,多组正态资料比较采用One-Way ANOVA,组间多重比较采用Bonferroni法(方差齐)或Tambane's T2法(方差不齐);多组非正态分布计量资料用Kruskal-Wallis秩和检验,统一双侧假设检验,P<0.05为差异有统计学意义。
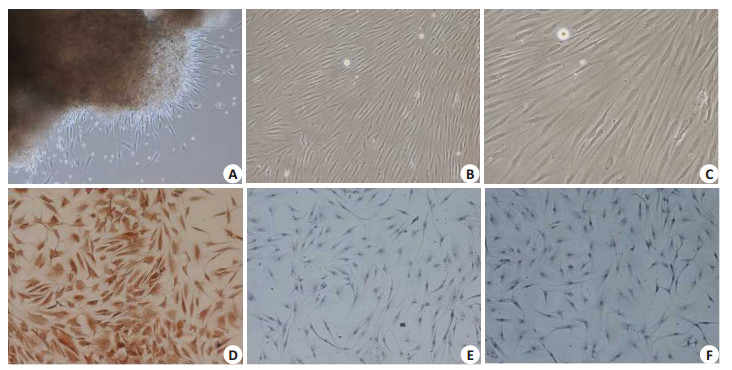
2 结果 2.1 FLS胞体外培养和鉴定RA膝关节来源的FLS体外培养呈现长梭形、“涡旋状”、贴壁优势生长(图 1A~C)。应用第4~5代FLS进行免疫组化鉴定显示:细胞因表达Vimentin使其胞质呈棕黄色染色,CD68染色呈阴性(图 1D~F)。
|
图 1 FLS体外培养和鉴定 Figure 1 In vitro culture and identification of fibroblast-like synoviocytes (FLS) from patients with rheumatic arthritis (RA). A: Primary FLS (Original magnification: ×100); B: Fourth passage of FLS (×100); C: Fourth passage of FLS (×200); D, E: Identification of FLS by immunohistochemistry for vimentin and CD68, respectively; F: Identification of FLS by immunohistochemistry with PBS. |
应用不同浓度IL-22干预FLS 24、48、72 h后,MTT法检测细胞增殖结果(表 1):在不同干预时间组,FLS增殖的整体水平差异均具有统计学意义(F=12.81,17.36,14.16;P<0.001)。进一步组间多重比较分析显示,在干预24 h和48 h组,除1 ng/mL IL-22干预与对照组相比细胞增殖无显著差异外(P=0.21,0.05),其它浓度干预组FLS的增殖均较对照组呈梯度增高变化,差异具有统计学意义(P<0.05);在干预72 h组,不同浓度IL-22干预FLS增殖均呈浓度梯度变化趋势(P<0.05)。
| 表 1 IL-22促进RA-FLS的增殖 Table 1 Effect of different concentrations of IL-22 on FLS proliferation (Mean±SD) |
应用50 ng/mL IL-22干预FLS不同时间后,Western blot检测STAT3总蛋白及其磷酸化蛋白表达的结果显示:随着干预时间的延长,STAT3磷酸化蛋白表达呈增加的变化趋势,而STAT3总蛋白及内参甘油醛-3-磷酸脱氢酶(GAPDH)蛋白未见明显变化(图 2)。进一步蛋白半定量分析结果显示(表 2):随着干预时间的延长,STAT3总蛋白表达相对灰度值(STAT3/GAPDH)的整体水平差异无统计学意义(F=4.87;P=0.68),但是其磷酸化蛋白表达相对灰度值(p-STAT3/STAT3)的整体水平差异具有统计学意义(F=4918.43;P<0.001);进一步组间多重比较结果显示:IL-22干预不同时间点STAT3磷酸化蛋白相对表达量较基线0 h均显著升高,且差异具有统计学意义(P<0.001)。

|
图 2 IL-22对FLS STAT3总蛋白及其磷酸化蛋白表达的影响 Figure 2 Effect of IL-22 on expressions of total and phosphorylated STAT3 proteins in FLS. |
| 表 2 IL-22对FLS STAT3、ERK1/2和P38总蛋白及其磷酸化蛋白表达的影响 Table 2 Effect of IL-22 on expressions of STAT3, ERK1/2, P38 and their phosphorylated proteins in FLS (Mean±SD) |
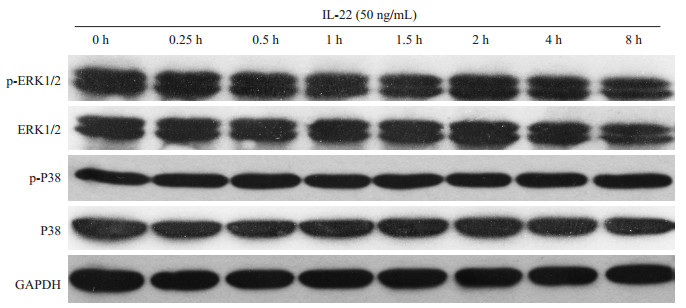
应用50 ng/mL IL-22干预FLS不同时间后,Western blot检测ERK1/2和P38总蛋白及其磷酸化蛋白表达的结果显示:在不同的干预时间,ERK1/2和P38的总蛋白、磷酸化蛋白以及内参GAPDH蛋白均未见明显变化差异(图 3)。进一步蛋白半定量分析结果显示(表 2):随着干预时间的延长,ERK1/2总蛋白表达相对灰度值(ERK1/2/GAPDH)、ERK1/2磷酸化蛋白表达相对灰度值(p-ERK1/2/ERK1/2)、P38总蛋白表达相对灰度值(P38/GAPDH)以及P38磷酸化蛋白表达相对灰度值(p-P38/P38)的整体水平差异均无统计学意义。
|
图 3 IL-22对FLS ERK1/2和P38总蛋白及其磷酸化蛋白表达的影响 Figure 3 Effect of IL-22 on expressions of ERK1/2, P38 and their phosphorylated proteins in FLS. |
联合应用50 ng/mL IL-22和100 μmol/L AG490干预FLS 24、48、72 h后,MTT增殖结果显示(表 3):在不同干预时间组,FLS增殖的整体水平差异均具有统计学意义(F=47.20,58.04,32.90;P<0.001);50 ng/mL IL-22分别干预FLS不同时间后,细胞增殖程度与空白对照组相比均显著升高,差异均具有统计学意义(P=0.001,0.008,0.005);联合50 ng/mL IL-22和100 μmol/L AG490干预FLS不同时间后,细胞增殖程度较单用IL-22干预均显著降低(P<0.01);此外,单用100 μmol/L AG490干预FLS培养24、48、72 h后,细胞增殖程度与空白对照组相比亦均显著降低,差异具有统计学意义(P<0.01)。
| 表 3 AG490抑制IL-22促进的FLS增殖 Table 3 AG490 inhibited the proliferation of FLS induced by IL-22 (Mean±SD) |
关节滑膜组织是RA主要的炎症部位,FLS的过度增殖使其通过类肿瘤细胞样方式侵蚀组织,是RA滑膜炎及最终导致骨破坏的重要机制[14-15]。通过自分泌或其它免疫细胞分泌多种细胞因子和生长趋化因子(如TNFα、IL-1、IL-17、IL-22、TGF-β等)的方式,FLS实现自身的过度增殖、活化,并迁移至关节效应部位发挥重要生物学作用[16-19]。本研究FLS体外培养显示:细胞呈现长梭形、“涡旋状”、贴壁优势生长,第4~5代FLS表达Vimentin蛋白。基于上述FLS在RA发病中的重要机制,本研究进一步以FLS为干预靶细胞进行了上游RA免疫调控机制的探讨。
IL-22主要由CD4+T细胞、自然杀伤T细胞、先天淋巴细胞以及TH22细胞分泌产生[19-20],并作用于角质形成细胞、上皮细胞,肝细胞以及成纤维细胞等多种细胞类型,通过促进自然免疫,减少组织损伤,加速再生等发挥相关生物学功能[5]。既往研究发现,IL-22缺陷小鼠对胶原诱导关节炎的发生率及关节血管翳明显下降,且低表达TNFα、IL-6、IL-1β和基质金属蛋白酶[6]。同时有研究报道同种异体间充质干细胞移植能够通过减少IL-22的表达抑制基质金属蛋白酶3的表达,进而改善大鼠关节炎症[21]。此外在人体研究的系统分析发现与骨关节患者相比,IL-22的表达在银屑病关节炎和RA患者的滑液中均显著升高[22]。鉴于IL-22受体在RA滑膜组织衬里层和衬里下层的vimentin (+) FLS中高表达[7],那么,IL-22是否直接参与了RA-FLS的病理过程?本研究应用不同浓度IL-22干预RA离体FLS,结果发现IL-22能够促进FLS的增殖,且其促增殖效应呈现一定的IL-22浓度梯度趋势。上述研究结果从另外一个角度验证了本课题组既往的研究发现,即RA患者离体自然杀伤细胞亚群NKp44细胞能够表达IL-22和TNFα,且其细胞上清液能在一定程度促进FLS增殖[8]。
RA-FLS参与免疫活化及功能依赖特定相关信号通路的激活,包括:丝裂原活化蛋白激酶途径,如JNK/ ERK/P38在RA滑膜中磷酸化水平更高,能够参与细胞的增殖、炎症因子及基质金属蛋白酶的合成分泌[23];JAK激酶/STAT途径,其中作为多种细胞因子的共同途径,STAT3是细胞存活、增殖和分化的重要信号通路[24],STAT3负突变体研究亦证明其是FLS存活的重要胞内信号[25];脾酪氨酸激酶途径,其不仅调节多种T/B免疫细胞受体信号,同时在FLS活化及IL-6分泌过程中具有重要作用[26];核因子κB途径,在炎症因子IL-1或TNFα刺激下,FLS通过活化上述信号通路促进IL-6、IL-8、基质金属蛋白酶以及细胞间粘附分子-1的转录表达[27]。可见,不同信号通路的激活不仅依赖特定的刺激信号,同时其所发挥的生物学效应亦存在较大的差异。那么在本研究中,IL-22所促进的FLS增殖的相关信号通路机制是什么?
既往研究发现RA患者NK-22细胞上清液能够分泌IL-22并上调FLS STAT3 mRNA和p-STAT3的表达[28]。IL-22能够通过STAT3磷酸化保护硝普钠诱导的FLS凋亡[29]。由于STAT3 mRNA的高表达更可能提示STAT3总蛋白的表达差异,那么IL-22究竟是通过影响STAT3总蛋白表达还是其磷酸化蛋白的表达而发挥生物学功能?此外,缺乏外源性RANKL时,IL-22预处理的RA-FLS能够促进单核细胞分化为破骨细胞,但该过程能够被p38 MAPK/NF-κB或JAK2/STAT3信号通路阻断剂所抑制[30]。那么,IL-22促进FLS的增殖过程是否同时也存在其他信号通路途径的参与?为此,本研究应用Western blot方法分析50 ng/mL IL-22干预FLS后STAT3、ERK1/2、P38总蛋白及其磷酸化蛋白的表达,结果显示:IL-22在不同的时间点均能够促进FLS中STAT3蛋白的磷酸化水平,且呈现一定的时间延长效应趋势,但IL-22干预后的STAT3总蛋白、ERK1/2总蛋白和磷酸化蛋白、P38总蛋白和磷酸化蛋白水平均未见明显表达差异。在此基础上,进一步应用100 μmol/L AG490阻断STAT3蛋白磷酸化后,50 ng/mL IL-22所促进的FLS增殖水平较对照组出现了显著降低,差异具有统计学意义,提示IL-22促进FLS的增殖依赖STAT3蛋白的磷酸化。
综上所述,本研究发现IL-22能够以浓度依赖方式促进RA-FLS的增殖,且该增殖过程是由STAT3蛋白磷酸化所介导的信号通路激活而实现,同时我们亦发现IL-22对FLS的ERK1/2和P38蛋白及其磷酸化蛋白的表达无明显作用。今后继续深入探讨RA中高表达的IL-22与FLS及其他免疫细胞之间的相互作用机制,对进一步揭示RA的发病机制以及相关靶向药物的研发具有重要的理论意义和临床价值。
| [1] | Smolen JS, Aletaha D, Mcinnes IB. Rheumatoid arthritis[J]. Lancet, 2016, 388(10055): 2023-38. DOI: 10.1016/S0140-6736(16)30173-8. |
| [2] | Valesini G, Barone F, Bompane D, et al. Advances in immunology and rheumatoid arthritis pathogenesis[J]. Reumatismo, 2004, 56(1 Suppl 1): 9-20. |
| [3] | Mcinnes IB, Schett G. The pathogenesis of rheumatoid arthritis[J]. N Engl J Med, 2011, 365(23): 2205-19. DOI: 10.1056/NEJMra1004965. |
| [4] | Bellucci E, Terenzi R, La Paglia G, et al. One year in review 2016: pathogenesis of rheumatoid arthritis[J]. Clin Exp Rheumatol, 2016, 34(5): 793-801. |
| [5] | Shabgah AG, Navashenaq JG, Shabgah OG, et al. Interleukin-22 in human inflammatory diseases and viral infections[J]. Autoimmun Rev, 2017, 16(12): 1209-18. DOI: 10.1016/j.autrev.2017.10.004. |
| [6] | Geboes L, Dumoutier L, Kelchtermans H, et al. Proinflammatory role of the Th17 cytokine interleukin-22 in collagen-induced arthritis in C57BL/6 mice[J]. Arthritis Rheum, 2009, 60(2): 390-5. DOI: 10.1002/art.v60:2. |
| [7] | Ikeuchi H, Kuroiwa T, Hiramatsu N, et al. Expression of interleukin-22 in rheumatoid arthritis: potential role as a proinflammatory cytokine[J]. Arthritis Rheum, 2005, 52(4): 1037-46. DOI: 10.1002/(ISSN)1529-0131. |
| [8] | Ren J, Feng Z, Lv Z, et al. Natural killer-22 cells in the synovial fluid of patients with rheumatoid arthritis are an innate source of interleukin 22 and tumor necrosis factor-α[J]. J Rheumatol, 2011, 38(10): 2112-8. DOI: 10.3899/jrheum.101377. |
| [9] | Zhu J, Jia E, Zhou Y, et al. Interleukin-22 secreted by NKp44 + natural killer cells promotes proliferation of Fibroblast-Like synoviocytes in rheumatoid arthritis[J]. Medicine (Baltimore), 2015, 94(52): e2137. DOI: 10.1097/MD.0000000000002137. |
| [10] | Arnett FC, Edworthy SM, Bloch DA, et al. The American rheumatism association 1987 revised criteria for the classification of rheumatoid arthritis[J]. Arthritis Rheum, 1988, 31(3): 315-24. DOI: 10.1002/(ISSN)1529-0131. |
| [11] | Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/ European League Against Rheumatism collaborative initiative[J]. Ann Rheum Dis, 2010, 69(9): 1580-8. DOI: 10.1136/ard.2010.138461. |
| [12] | Ota F, Maeshima A, Yamashita S, et al. Activin a induces cell proliferation of fibroblast-like synoviocytes in rheumatoid arthritis[J]. Arthritis Rheum, 2003, 48(9): 2442-9. DOI: 10.1002/(ISSN)1529-0131. |
| [13] | Neidhart M, Seemayer CA, Hummel KM, et al. Functional characterization of adherent synovial fluid cells in rheumatoid arthritis: destructive potential in vitro and in vivo[J]. Arthritis Rheum, 2003, 48(7): 1873-80. DOI: 10.1002/(ISSN)1529-0131. |
| [14] | Meinecke I, Rutkauskaite E, Gay S, et al. The role of synovial fibroblasts in mediating joint destruction in rheumatoid arthritis[J]. Curr Pharm Des, 2005, 11(5): 563-8. DOI: 10.2174/1381612053381945. |
| [15] | Guiducci S, Del Rosso A, Cinelli M, et al. Rheumatoid synovial fibroblasts constitutively Express the fibrinolytic pattern of invasive tumor-like cells[J]. Clin Exp Rheumatol, 2005, 23(3): 364-72. |
| [16] | Pierer M, Brentano F, Rethage J, et al. The TNF superfamily member LIGHT contributes to survival and activation of synovial fibroblasts in rheumatoid arthritis[J]. Rheumatology (Oxford), 2007, 46(7): 1063-70. DOI: 10.1093/rheumatology/kem063. |
| [17] | Xue C, Hasunuma T, Asahara H, et al. Transcriptional regulation of the HOX4C gene by basic fibroblast growth factor on rheumatoid synovial fibroblasts[J]. Arthritis Rheum, 1997, 40(9): 1628-35. DOI: 10.1002/(ISSN)1529-0131. |
| [18] | Stanford SM, Aleman Muench GR, Bartok B, et al. TGFβ responsive tyrosine phosphatase promotes rheumatoid synovial fibroblast invasiveness[J]. Ann Rheum Dis, 2016, 75(1): 295-302. DOI: 10.1136/annrheumdis-2014-205790. |
| [19] | Xu S, Xiao Y, Zeng S, et al. Piperlongumine inhibits the proliferation, migration and invasion of fibroblast-like synoviocytes from patients with rheumatoid arthritis[J]. Inflamm Res, 2017: 8. DOI: 10.1007/s00011-017-1112-9.[Epubaheadofprint. |
| [20] | Zhen J, Yuan J, Fu YW, et al. IL-22 promotes Fas expression in oligodendrocytes and inhibits FOXP3 expression in T cells by activating the NF-kappa B pathway in multiple sclerosis[J]. Mol Immunol, 2017, 82(5): 84-93. |
| [21] | Liu GY, Bian S, Li F, et al. Effect of allogenic mesenchymal stem cells transplantation on the expression of interleukin-22 and matrix metalloproteinase-3 in rats with collagen induced arthritis[J]. Zhonghua Yi Xue Za Zhi, 2017, 97(9): 698-702. |
| [22] | Altobelli E, Angeletti PM, Piccolo D, et al. Synovial fluid and serum concentrations of inflammatory markers in rheumatoid arthritis, psoriatic arthritis and osteoarthitis: a systematic review[J]. Curr Rheumatol Rev, 2017. |
| [23] | Thalhamer T, Mcgrath MA, Harnett MM. MAPKs and their relevance to arthritis and inflammation[J]. Rheumatology, 2008, 47(4): 409-14. |
| [24] | Okamoto H, Kobayashi A. Tyrosine kinases in rheumatoid arthritis[J]. J Inflamm, 2011, 8(1): 21. DOI: 10.1186/1476-9255-8-21. |
| [25] | Krause A, Scaletta N, Ji JD, et al. Rheumatoid arthritis synoviocyte survival is dependent on Stat3[J]. J Immunol, 2002, 169(11): 6610-6. DOI: 10.4049/jimmunol.169.11.6610. |
| [26] | Cha HS, Boyle DL, Inoue T, et al. A novel spleen tyrosine kinase inhibitor blocks c-Jun N-terminal kinase-mediated gene expression in synoviocytes[J]. J Pharmacol Exp Ther, 2006, 317(2): 571-8. DOI: 10.1124/jpet.105.097436. |
| [27] | Aupperle KR, Bennett BL, Han ZN, et al. NF-kappa B regulation by Ⅰ kappa B kinase-2 in rheumatoid arthritis synoviocytes[J]. J Immunol, 2001, 166(4): 2705-11. DOI: 10.4049/jimmunol.166.4.2705. |
| [28] | Ren J, Zhou Y, Wu H, et al. Role of NK-22 cells and interleukin-22-related molecules in proliferation of fibroblast-like synoviocytes in patients with rheumatoid arthritis[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014, 34(1): 20-4. |
| [29] | Zhao M, Li Y, Xiao W. Anti-apoptotic effect of interleukin-22 on fibroblast-like synoviocytes in patients with rheumatoid arthritis is mediated via the signal transducer and activator of transcription 3 signaling pathway[J]. Int J Rheum Dis, 2017, 20(2): 214-24. DOI: 10.1111/apl.2017.20.issue-2. |
| [30] | Kim KW, Kim HR, Park JY, et al. Interleukin-22 promotes osteoclastogenesis in rheumatoid arthritis through induction of RANKL in human synovial fibroblasts[J]. Arthritis Rheum, 2012, 64(4): 1015-23. DOI: 10.1002/art.33446. |
 2017, Vol. 37
2017, Vol. 37

