2. 广州军区广州总医院药学部,广东 广州 510010
2. Department of Pharmacy, General Hospital of Guangzhou Military Command, Guangzhou 510010, China
MCM家族是生物体DNA复制过程中的必需蛋白,该家族包括7个成员:MCM2-MCM7及MCM10,其中MCM2-7是真核细胞中启动DNA复制的关键蛋白[1]。MCM3蛋白能直接与cyclin D1结合,调控细胞增殖[2-3]。在人类多种肿瘤细胞中,MCM3过度表达[4],高于正常组织。MCM家族在肿瘤细胞中的表达情况已证实是一种癌症前诊断、治疗后的可靠标记蛋白[5]。同一时间抑制多种MCM蛋白[6],在相同的肺癌细胞系中可表现出显著的协同抑制作用。在细胞周期过程中,MCM7参与并启动DNA复制,调节细胞增殖[7]。经研究表明,CDC45是DNA起始复合物的建立、复制叉染色体解旋及DNA合成的必须蛋白[8],也是G1期到S期转变过程中的关键因素,可作为解旋酶辅助因子[9]。CDC45与MCM2-7、GINS形成真核细胞中的复制解旋酶CMG [10]。CDC45参与细胞的表达调控,在多种肿瘤细胞中,CDC45的表达量比在正常细胞中高[11]。
鱼藤素(Deguelin),鱼藤酮的衍生物,来自非洲软木(Mundulea sericea,豆科)[12]。鱼藤素通过调节不同的途径,在体内、外各种类型癌症中都能表现出显著的抗肿瘤增殖活性。鱼藤素通过阻断抗凋亡途径,如PI3K-Akt、IKK-IκBα-NF-κB、AMPK-mTOR-survivin来诱导细胞凋亡,同时通过调节p27-cyclinE-pRb-E2F、HIF-1α-VEGF来抑制肿瘤细胞的增殖和恶性转变[13]。鱼藤素通过作用于VEGF,抑制肿瘤增长,且呈浓度依赖性[14]。
尽管已有大量文献报道鱼藤素的多种抗肿瘤机制作用,但鱼藤素对MCM3-CDC45的影响尚未见报道。因此,为进一步探究鱼藤素的抗肿瘤作用,本文选取MCF-7乳腺癌细胞和H1299肺癌细胞,探讨不同浓度的鱼藤素对其生长的抑制效果,并首次考察鱼藤素对MCF-7、H1299细胞中MCM3和CDC45 mRNA表达变化的影响,研究鱼藤素能否通过对MCM3-CDC45进行调控,从而来抑制癌细胞的增殖作用。
1 材料和方法 1.1 材料 1.1.1 实验细胞乳腺癌细胞MCF-7、肺癌细胞H1299均由北京大学深圳研究生院林硕教授实验室提供;
1.1.2 主要试剂DMEM培养基、1640培养基购自赛默飞世尔生物化学制品有限公司;胎牛血清、新生牛血清和accutase消化液均购自GIBCO;MTT、DMSO购自sigma;Trizol RNA提取试剂盒购自Invitrogen;PCR八联管购自BIO-RAD公司。
1.2 实验方法 1.2.1 MTT法探究鱼藤素对MCF-7、H1299两种肿瘤细胞增殖影响以104/孔的密度将MCF-7、H1299细胞接种于96孔板中。在相应培养孔内加入不同浓度(0.25、0.5、1、5、10、30、50 µmol/L)的鱼藤素100 μL,每组设4个复孔,在培养箱中分别培养48、72、96 h。到达各自时间点后,弃去培养基,每孔加入20 μL 5 mg/mL MTT溶液,37 ℃下避光孵育4 h。弃去培养液,每孔加入150 μL DMSO,振荡10 min,完全溶解结晶物,酶标仪590 nm处测吸光度A。抑制率=(A对照组-A实验组)/A对照组×100%。
1.2.2 光学显微镜下检测细胞形态以104/孔密度将MCF-7、H1299细胞接种于96孔板,每孔100 μL,在CO2培养箱中培养36 h,在相应培养孔内加入100 μL不同浓度(1、10 µmol/L)鱼藤素,每组设3个复孔。对照组加入培养液,每孔100 μL。培养72 h后,在光学显微镜下观察细胞形态。
1.2.3 荧光定量PCR法检测MCF-7、H1299在鱼藤素作用下MCM3-CDC45表达的影响 1.2.3.1 总RNA的提取取对数生长期的MCF-7及H1299细胞,接种到6孔培养板,每孔接种2 mL、密度为2×105的细胞悬液。培养24 h后,将5、10 μmol/L的鱼藤素分别加入MCF-7、H1299细胞中,每组设3个复孔,对照组细胞加入2 mL培养液。培养72 h,弃上清,PBS缓冲液洗2次。加入Trizol细胞裂解液,每孔300 μL,室温放置5 min使其充分裂解,4 ℃,12 000 r/min离心10 min。取上清,加入0.2 mL氯仿,剧烈震荡15 s后,室温静置5 min,样品自然分相。4 ℃,12 000 r/min离心15 min,小心吸取含RNA的上层水相至另一离心管中。加入等体积异丙醇,小心混匀后于室温静置10~20 min,4 ℃,12 000 r/min离心10 min。弃上清,向RNA沉淀中加入1 mL 75%乙醇,温和振荡,洗涤沉淀。4 ℃,12 000 r/min离心5 min,弃上清。室温晾干10 min,加30 μL RNase free H2O溶解。用Nanodrop仪检测RNA的纯度和浓度。
1.2.3.2 设计及合成引物序列通过NCBI GenBank数据库,获得目的基因cDNA的序列,利用Primer Premier 5.0软件设计PCR引物,以GAPDH为内参基因。引物序列见表 1。
| 表 1 Real-time PCR引物设计 Table 1 Primer for real-time PCR |
按照Prime Script® RT reagent Kit试剂盒操作说明进行RT反应,配制RT反应液:5× Prime Script TM Buffer 4 µL,Prime Script TM Enzyme Mix1 2 µL,Oligo dT Primer(50 µmol/L)1 µL,Random 6 mers(100 µmol/L)1 µL,加入RNA样品,Rnase Free dH2O加至总体积为20 µL,其中20 µL的反应体系可最大使用1 µg的Total RNA。反转录条件为:37 ℃,15 min;85 ℃,5 s。所得cDNA产物置于-20 ℃保存。
1.2.3.4 Real-Time PCR反应体系的制备:SYBR Premix Ex TaqTMII(2×)12.5 µL,PCR Forward Primer(10 μmol/L)1 µL,PCR Reverse Primer(10 μmol/L)1 µL,DNA模板2 µL,dH2O 8.5 µL。用ABI PRISM7300 Real-Time PCR System进行反应。扩增条件:预变性:95 ℃ 30 s,循环1次;PCR反应:95 ℃ 10 s,60 ℃ 30 s,循环40次;融解曲线分析:95 ℃ 15 s,60 ℃,60 s,95 ℃ 15 s,循环1次。利用2—△△Ct法对qPCR结果进行数据分析。△Ct(域循环)=Ct(目的基因)-Ct(内参基因);△△Ct=△Ct(给药组)-△Ct(对照组);差别倍数=2—△△Ct,正常对照组的数值均为1。
1.2.4 统计学分析利用SPSS 19.0软件来进行统计学分析。数据以均数±标准差表示,组间数据比较采用单因素方差分析,P < 0.05则差异具有统计学意义。
2 结果 2.1 鱼藤素抑制两种细胞(MCF-7、H1299)的增殖作用0.25、0.5、1、5、10、30、50 µmol/L的鱼藤素作用于MCF-7细胞48、72、96 h后,与对照组相比,MCF-7癌细胞存活率降低,增殖明显受到抑制,具有显著性差异。且该抑制效果呈现浓度和时间依赖性(图 1)。鱼藤素处理MCF-7细胞48、72、96 h的IC50分别是9、3和2 µmol/L。
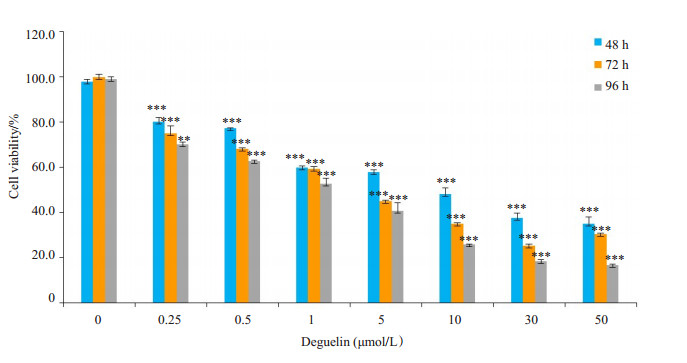
|
图 1 不同浓度的鱼藤素作用MCF-7细胞48、72 h和96 h的存活率 Figure 1 MCF-7 cell viability following treatments with different concentrations of deguelin for different time. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group. |
0.5、1、5、10、30、50及100 µmol/L的鱼藤素作用于H1299细胞48、72、96 h,其抑制率亦呈浓度-时间依赖性,鱼藤素处理96 h后,H1299细胞的IC50是2 µmol/L;鱼藤素浓度0.5~10 µmol/L,处理96 h后,H1299细胞抑制率是29.8%~59.2%(图 2)。
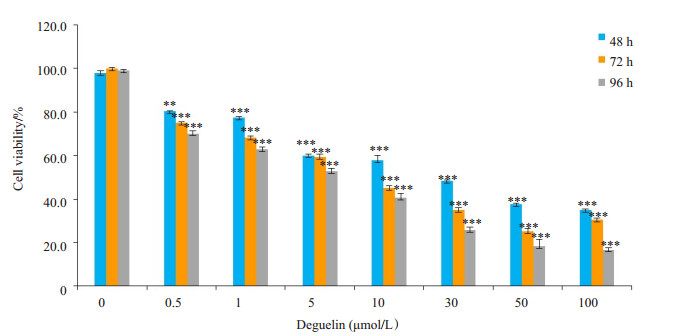
|
图 2 不同浓度的鱼藤素作用H1299细胞48、72 h和96 h的生长抑制效果 Figure 2 H1299 cell viability following treatments with different concentrations of deguelin for different time. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group. |
与对照组相比,观察鱼藤素作用72 h后MCF-7细胞的生长状态,对照组细胞生长分布密集,贴壁好,形态规则;1 µmol/L鱼藤素处理后,细胞数量减少,大部分细胞状态良好,仅少部分细胞贴壁能力减弱;10 µmol/L鱼藤素处理后,大部分细胞死亡,细胞不贴壁,细胞数量显著减少(图 3)。
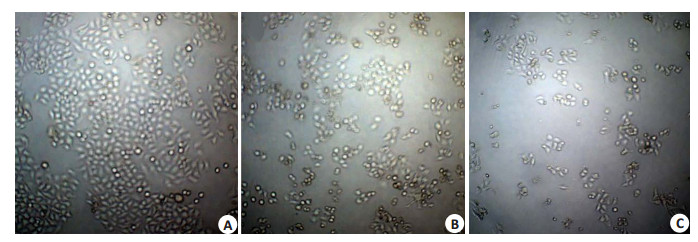
|
图 3 鱼藤素对MCF-7生长状态的影响 Figure 3 Morphological change of MCF-7 cells treated with different concentrations of deguelin. A: Control; B:1.0 µmol/L deguelin; C: 10 µmol/L deguelin. |
对照组H1299细胞生长状态良好,呈梭状,细胞形态饱满,贴壁生长;5 µmol/L鱼藤素处理后,H1299细胞形态变小皱缩,生长分散,细胞数量减少;30 µmol/L鱼藤素处理后,细胞数目明显减少,形态不规则,不贴壁,死亡细胞数量明显增多(图 4)。
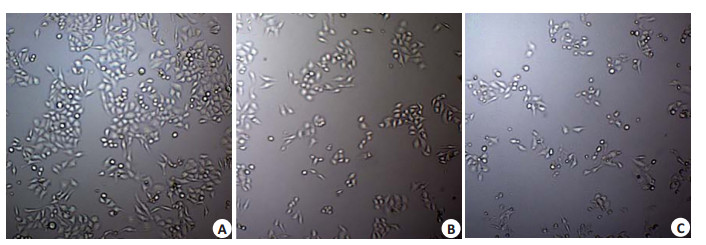
|
图 4 鱼藤素对H1299生长状态的影响 Figure 4 Morphological changes of H1299 cells treated with different concentrations of deguelin. A: Control; B: 5 µmol/L deguelin; C: 30 µmol/L deguelin. |
提取对照组与处理组细胞的总RNA,通过反转录成cDNA,设计MCM3、CDC45引物,以GAPDH为内参基因,进行RT-PCR扩增反应,扩增曲线形态平稳光滑,各平行组溶解曲线峰单一,峰度重合性良好,显示扩增的产物单一,特异性好,数据可靠,可以重复。
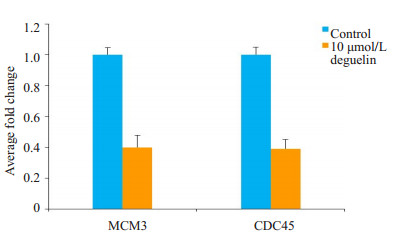
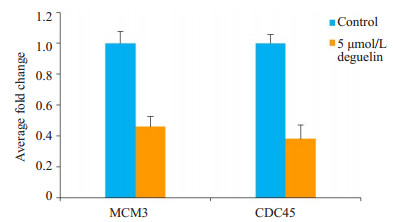
10 μmol/L鱼藤素处理MCF-7细胞72 h后,MCM3及CDC45 mRNA有明显下调。与对照组相比,鱼藤素处理组的MCM3 mRNA表达量是对照组的40%,下调了60%,CDC45 mRNA的表达量是对照组的39%(图 5)。5 μmol/L鱼藤素处理H1299细胞72 h后,鱼藤素处理组的MCM3 mRNA表达量下调了54%,CDC45 mRNA的表达量下调了62%(图 6)。
|
图 5 荧光定量PCR检测10 μmol/L鱼藤素处理MCF-7细胞 72 h MCM3、CDC45 变化情况 Figure 5 Expression change of MCM3 and CDC45 in MCF-7 cells treated with 10 μmol/L deguelin for 72 h. P < 0.001 vs control group. |
|
图 6 荧光定量PCR检测5 μmol/L鱼藤素处理H1299细 胞72 h MCM3、CDC45变化情况 Figure 6 Expression change of MCM3 and CDC45 in H1299 cells treated with 5 μmol/L deguelin for 72 h. P < 0.001 vs control group. |
研究表明,鱼藤素对人类多种癌症有很好的抑制作用,如乳腺癌、结肠癌、皮肤癌和胃癌等。体外实验发现,鱼藤素对NSCLC细胞系具有抗增殖和诱导凋亡的活性。作为一种天然异黄酮类化合物,鱼藤素通过抑制ETC(线粒体电子传递链)的泛醌氧化还原酶(复合体I)来抑制细胞的呼吸作用[15]。已报道[16],鱼藤素可消耗Hsp 90受体蛋白,其中包括Akt,survivin及Cdk4。其原因为,鱼藤素可直接与Hsp 90结合并抑制其活性,导致泛素介导的Hsp 90受体蛋白降解,Hsp 90是一种分子伴侣,许多受体蛋白在癌症发展、肿瘤血管生成和肿瘤耐药性中起到了关键作用。此外,鱼藤素可通过下调特定细胞存活蛋白诱导细胞周期阻滞和细胞凋亡,包括Akt和促分裂原活化蛋白激酶(MAPK)等[17]。最新研究发现,鱼藤素能够介导胰腺癌的自噬抑制作用,提高其他药物对癌细胞的敏感性[18]。鱼藤素可通过下调HK2介导的糖酵解抑制NSCLC细胞的增殖[19]。
本文首次研究了鱼藤素对MCM3-CDC45 mRNA表达的影响。首先运用MTT试验研究了鱼藤素抑制MCF-7、H1299细胞的增殖作用。结果显示,鱼藤素能诱导细胞凋亡并呈一定的浓度时间依赖性。根据数据分析得知,鱼藤素能明显抑制MCF-7及H1299细胞增殖。此外,在光学显微镜下,观察到MCF-7和H1299细胞处理前后的形态变化,可直观地显示鱼藤素对MCF-7及H1299细胞具有明显凋亡诱导效应,且随着鱼藤素浓度升高,死亡细胞数量也明显增多。
控制DNA复制和控制DNA复制检查点是维护基因组稳定、预防治疗人类癌症的关键。MCMs [20](包含MCM2-7)、CDC45以及GINs被称为CMG,是DNA解旋酶的关键因素。DNA复制过程紊乱将导致基因组的不稳定及细胞的恶性转化,从而促进肿瘤的发生。MCMs对复制检查点具有调节作用,因此被认为是DNA损伤反应的一个重要组成部分[21]。研究表明,MCM3在多种人类癌症细胞中过度表达,高于正常组织中的表达量,MCM蛋白水平可反应细胞的增殖情况[22]。此外,生物信息学分析发现,CDC45与细菌RecJ中DHH域有相似的N端氨基酸序列(5'-3' ssDNA核酸外切酶),可对DNA进行重组修复[23]。为了研究鱼藤素是否通过调控MCM3-CDC45的表达量发挥抑制MCF-7及H1299细胞增殖作用,采用荧光定量PCR法检测鱼藤素对MCF-7、H1299细胞中MCM3-CDC45表达量的影响,结果证实,鱼藤素下调了MCM3-CDC45 mRNA表达。已证实,MCM3的裂解最早出现于凋亡细胞内,因此可以推断其在细胞凋亡过程中具有重要的意义。鱼藤素通过下调MCM3的表达量,诱导两种癌细胞发生凋亡[24]。在真核细胞中,CDC45对DNA复制起始和延伸发挥重要作用,参与细胞的表达调控。CDC45-MCM(2-7)-GINS复合物(CMG)构成真核复制体的核心,我们发现,尽管CDC45和GINS不能单独刺激MCM的活性,但是形成完整的CMG复合物可以有效地增加MCM的基础解旋酶活性[25]。鱼藤素通过下调CDC45,从而达到诱导凋亡、抑制增殖的作用。因此,下一步的研究方向可能是:设计体内试验,建立小鼠肺癌、乳腺癌模型,用鱼藤素进行干预,观察模型小鼠的生理状态并探究鱼藤素的体内抗肿瘤效果,且进一步研究其对MCM3-CDC45蛋白表达量的影响。
| [1] | Rezvani G, Andisheh-Tadbir A, Ashraf MJ, et al. Evaluation of minichromosome maintenance-3 (MCM3) in oral squamous cell carcinoma[J]. J Dent (Shiraz), 2015, 16(2): 87-92. |
| [2] | Cosarca AS, Mocan SL, Pacurar MA, et al. The evaluation of Ki67, p53, MCM3 and PCNA immunoexpressions at the level of the dental follicle of impacted teeth, dentigerous cysts and keratocystic odontogenic tumors[J]. Rom J Morphol Embryol, 2016, 57(2): 407-12. |
| [3] | Ji W, Liu H, Liu C, et al. Up-regulation of MCM3 relates to neuronal apoptosis after traumatic brain injury in adult rats[J]. Cell Mol Neurobiol, 2017, 37(4): 683-93. DOI: 10.1007/s10571-016-0404-x. |
| [4] | Schimmack S, Lawrence B, Kenney BA, et al. Minichromosome maintenance expression defines Slow-Growing gastroenteropancreatic neuroendocrine neoplasms[J]. Transl Oncol, 2016, 9(5): 411-8. DOI: 10.1016/j.tranon.2016.07.006. |
| [5] | Shinya M, Machiki D, Henrich T, et al. Evolutionary diversification of MCM3 genes in Xenopus laevis and Danio rerio[J]. Cell Cycle, 2014, 13(20): 3271-81. DOI: 10.4161/15384101.2014.954445. |
| [6] | Kikuchi J, Kinoshita I, Shimizu Y, et al. Minichromosome maintenance (MCM) protein 4 as a marker for proliferation and its clinical and clinicopathological significance in non-small cell lung cancer[J]. Lung Cancer, 2011, 72(2): 229-37. DOI: 10.1016/j.lungcan.2010.08.020. |
| [7] | Walters AD, Chong JP. Methanococcus maripaludis: An archaeon with multiple functional MCM proteins?[J]. Biochem Soc Trans, 2009, 37(Pt 1): 1-6. |
| [8] | Speck C. Exceeding the limits-Cdc45 overexpression turns bad[J]. Cell Cycle, 2016, 15(14): 1809-10. DOI: 10.1080/15384101.2016.1184512. |
| [9] | Xu XH, Wang JT, Li M, et al. TIMELESS suppresses the accumulation of aberrant CDC45 center dot MCM2-7 center dot GINS replicative helicase complexes on human chromatin[J]. J Biol Chem, 2016, 291(43): 22544-58. DOI: 10.1074/jbc.M116.719963. |
| [10] | Koehler C, Koalick D, Fabricius A, et al. Cdc45 is limiting for replication initiation in humans[J]. Cell Cycle, 2016, 15(7): 974-85. DOI: 10.1080/15384101.2016.1152424. |
| [11] | Jing SZ. Cell division cycle 45 promotes papillary thyroid cancer progression via regulating cell cycle[J]. Tumour Biol, 2017, 39(5): 1-9. |
| [12] | Thamilselvan V, Menon M, Thamilselvan S. Anticancer efficacy of deguelin in human prostate cancer cells targeting glycogen synthase kinase-3 beta/beta-catenin pathway[J]. Intl J Cancer, 2011, 129(12): 2916-27. DOI: 10.1002/ijc.25949. |
| [13] | Wang Y, Ma W, Deguelin ZW. A novel anti-tumorigenic agent targeting apoptosis, cell cycle arrest and anti-angiogenesis for cancer chemoprevention[J]. Mol Clin Oncol, 2013, 1(2): 215-9. DOI: 10.3892/mco.2012.36. |
| [14] | Kang HW, Kim JM, Cha MY, et al. Deguelin, an Akt inhibitor, Down-Regulates NF-kappa B signaling and induces apoptosis in colon cancer cells and inhibits tumor growth in mice[J]. Dig Dis Sci, 2012, 57(11): 2873-82. DOI: 10.1007/s10620-012-2237-x. |
| [15] | Vrana JA, Boggs N, Currie HN, et al. Amelioration of an undesired action of deguelin[J]. Toxicon, 2013, 74(3): 83-91. |
| [16] | Yang YL, Ji C, Bi ZG, et al. Deguelin induces both apoptosis and autophagy in cultured head and neck squamous cell carcinoma cells[J]. PLoS One, 2013, 8(1): e54736. DOI: 10.1371/journal.pone.0054736. |
| [17] | Ji BC, Yu CC, Yang ST, et al. Induction of DNA damage by deguelin is mediated through reducing DNA repair genes in human non-small cell lung cancer NCI-H460 cells[J]. Oncol Rep, 2012, 27(4): 959-64. DOI: 10.3892/or.2012.1622. |
| [18] | Xu XD, Zhao Y, Zhang M, et al. Inhibition of autophagy by deguelin sensitizes pancreatic cancer cells to doxorubicin[J]. Int J Mol Sci, 2017, 18(2): 370. DOI: 10.3390/ijms18020370. |
| [19] | Li W, Gao F, Ma XQ, et al. Deguelin inhibits non-small cell lung cancer via down-regulating Hexokinases Ⅱ-mediated glycolysis[J]. Oncotarget, 2017, 8(20): 32586-99. |
| [20] | Han XZ, Pozo FM, Wisotsky JN, et al. Phosphorylation of minichromosome maintenance 3 (MCM3) by checkpoint kinase 1 (Chk1) negatively regulates DNA replication and checkpoint activation[J]. J Biol Chem, 2015, 290(19): 12370-8. DOI: 10.1074/jbc.M114.621532. |
| [21] | Toyokawa G, Masuda K, Daigo Y, et al. Minichromosome Maintenance Protein 7 is a potential therapeutic target in human cancer and a novel prognostic marker of non-small cell lung cancer[J]. Mol Cancer, 2011, 10(1): 65. DOI: 10.1186/1476-4598-10-65. |
| [22] | Koehler CU, Kreuter A, Rozynkowski MC, et al. Validation of different replication markers for the detection of beta-cell proliferation in human pancreatic tissue[J]. Regul Pept, 2010, 162(1/3): 115-21. |
| [23] | Gerhardt J, Guler GD, Fanning E. Human DNA helicase B interacts with the replication initiation protein Cdc45 and facilitates Cdc45 binding onto chromatin[J]. Exp Cell Res, 2015, 334(2): 283-93. DOI: 10.1016/j.yexcr.2015.04.014. |
| [24] | Cheng DD, Zhang HZ, Yuan JQ, et al. Minichromosome maintenance protein 2 and 3 promote osteosarcoma progression via DHX9 and predict poor patient prognosis[J]. Oncotarget, 2017, 8(16): 26380-93. |
| [25] | Xu YL, Gristwood T, Hodgson B, et al. Archaeal orthologs of Cdc45 and GINS form a stable complex that stimulates the helicase activity of MCM[J]. Proc Natl Acad Sci USA, 2016, 113(47): 13390-5. DOI: 10.1073/pnas.1613825113. |
 2017, Vol. 37
2017, Vol. 37

