2. 生命科学技术学院抗体工程中心,广东 广州 510632
2. Research Center of Antibody Engineering, Life Science and Technological College, Jinan University, Guangzhou 510632, China
小细胞肺癌是一种极具侵袭性的恶性肿瘤,常预后不良[1],传统的手术及放化疗在患者的治疗上一直无突破。最近几年生物靶向药物的出现在非小细胞肺癌的治疗中已经有了质的的飞跃,而在小细胞肺癌中仍然停滞不前。纵观肿瘤的复发转移与血管生长密切相关,从而使得抗血管生成的生物靶向药物与化疗药物的联合应用奠定了理论基础,相关药物的研究更是突飞猛进[2-3]。碱性成纤维细胞生长因子(bFGF)是诱导肿瘤细胞增殖的生长因子,在多种恶性肿瘤中阳性表达,有抗肿瘤血管生成的作用。bFGF单克隆抗体通过与fgfr的结合而达到显著抑制肿瘤的生长及转移,bFGF在非小细胞肺癌亦有研究[4],但在小细胞肺癌中研究较少。而且bFGF是多种肿瘤的耐药因素,主要机制是抑制化疗药物诱导的细胞凋亡使多数化疗药耐药[5-6]。伊立替康是拓扑异构酶I的抑制剂,在日本的临床研究中IP (伊立替康+顺铂)疗效优于EP (依托泊苷+顺铂) [7],因此本研究选用本实验室纯化的新型bFGF单克隆抗体联合伊立替康应用于小细胞肺癌细胞的治疗,理论上有协同作用。在国内外还未见报道。通过新型bFGF单克隆抗体抑制肿瘤血管看能否抑制小细胞肺癌的生长,缓解化疗药物的耐药性,探索两者在体内的协同抑及可能机制,为bFGF单克隆抗体靶向治疗小细胞肺癌提供实验依据。
1 材料和方法 1.1 细胞株H223小细胞肺癌珠来自暨南大学抗体工程研究中心冻存,本实验用于治疗的bFGF单克隆抗体来自中山康方生物有限公司。
1.2 主要试剂及仪器青霉素和链霉素双抗(Invitrogen);10%胎牛血清(S/N:16000-044;Gibco);96孔板中(Corning, USA);DMEM培养基和胎牛血清FBS购自Gibco公司;Akt、ERK1/2、t-/p-Akt、t-/p-ERK1/抗体(Cell Signaling Technology);Super-GL ECL超敏发光液(诺伦生物);裂解液(诺伦生物);PVDF Transfer Membrane (Millipore);转膜滤纸(bio-rad) KODAK X-Omat BT Film(Kodak);X光片显影液;X光片定影液(Kodak);HRP-cnjugated goat anti-mouse IgG (抗体使用浓度1: 1000);HRP-cnjugated goat anti-rabbit IgG (抗体使用浓度1: 1000);GADPH (Sigma,抗体使用浓度1: 5000);CCK-8试剂盒(碧云天)。伊立替康注射液(恒瑞药业)。酶标仪(Multiskan)。PowerPacTMHC电泳仪(bio-rad); VE-180垂直电泳槽(天能);Semi-Dry Transfer Cell (bio-rad);DY-B1脱色摇床(沪西仪器);Olympus-80 ℃超低温冰箱;低温超速离心机和低速离心机(Hitachi);紫外分光光度计和凝胶成像系统(Lumat LB 9507);荧光倒置相差显微镜(Olyplus);CO2培养箱(Heraeus);奥德赛条带扫描仪(S/N ODY-2792 model;9120);超净台(苏州净化设备)。
1.3 小细胞肺癌细胞增殖抑制实验取处于对数生长期的小细胞肺癌细胞,调整细胞密度至4×104/mL,每孔100 µL接种到96孔细胞培养板中,37℃培养24 h后分组加药:(1) bFGF单克隆抗体组:终质量浓度为50、100和20 µg/mL;(2)伊立替康组:将伊立替康溶于NS中,终质量浓度为5、10、20 µg/mL;(3) bFGF单克隆抗体联合伊立替康组:选用质量浓度为100 µg/mL的bFGF单克隆抗体分别与5、10、20 µg/mL的伊立替康联合作用,每孔伊立替康终质量浓度与伊立替康组终质量浓度相同;(4)空白对照组:仅加入100 µL培养液。培养72 h,加入10 µL/孔的CCK-8试剂,继续培养1.5 h,于酶标仪读取吸光度A450。每浓度设3个复孔,实验重复3次。IR= (1-药物组A)/(空白对照组A) ×100%。
1.4 小细胞肺癌细胞凋亡抑制实验H223细胞被覆盖在6孔细胞培养板中,培养24 h后分组加药,方法见1.3,一起孵化96 h。细胞凋亡的片段用FITC标记的膜联蛋白V和碘化丙啶propodium (PI)标记,在室温下孵化15 min后样本用流式细胞仪检测。
1.5 Western blotting分析bFGF-mAb联合CPT-11对AKT和ERK1/2磷酸化水平的影响H223细胞被覆盖在6孔细胞培养板中,培养24 h后,待细胞贴壁后,移液器吸掉完培,加入2 mL的DMEM基培,继续培养12 h后,分组加药,方法见1.3,一起孵化1 h。每个组细胞样本加入300 µL细胞裂解液,用枪混匀使其完全裂解,将裂解物移至新的离心管中。直接取3 µL样本加入10 µL 2 × SDS-PAGE loading buffer,混匀,100 ℃加热处理5 min,冰上冷却,12 000 g离心5 min去除不溶性沉淀。样品使用10% SDS-PAGE分离,每孔最大上样量为20 µL。电泳结束后,将PVDF膜在甲醇中浸泡1 min,再使用Transfer Buffer浸泡凝胶、滤纸和在甲醇中浸泡过的PVDF膜一起4 ℃放置10 min,然后制备转移三明治。本实验使用Semi-Dry Cell进行半干电泳转移,转移条件为30 mA 60 min。使用Blocking Buffer封闭转印膜4 ℃封闭过夜,第2天用1×TBST洗涤3次,15 min/次。加入稀释好的一抗,37 ℃温育2 h。用1×TBST洗涤4次,10 min/次。加入稀释好的二抗,37 ℃温育2 h。用1×TBST洗涤4次,10 min/次。用Super-GL ECL超敏发光液进行化学发光检测,并对X光片曝光。经显影定影处理后,晾干的胶片最后用凝胶成像分析系统拍照,本实验采用的是Gel-Pro Analyzer软件来分析处理。
1.6 统计学处理计量资料采用均数±标准差表示,运用SPSS 18.0软件对相关数据进行统计学处理,两组间计量资料比较采用t检验,率的比较采用χ2检验,以P < 0.05表示差异有统计学意义。
2 结果 2.1 bFGF单克隆抗体单用及联合CPT-11抑制小细胞肺癌细胞的增殖浓度为5、10、20 µg/mL的伊立替康与100 µg/mL的bFGF单克隆抗体联合作用于小细胞肺癌细胞,其抑制作用明显强于两者单独作用(P < 0.05,图 1)。
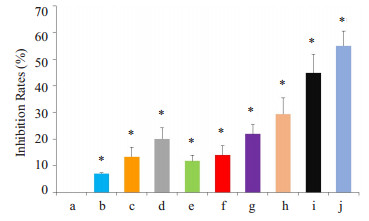
|
图 1 bFGF单克隆抗体单用及联合CPT-11对小细胞肺癌细胞增殖的影响 Figure 1 Effects of bFGF mAb and CPT-11, alone or in combination, on the proliferation of small cell lung cancer cells. *P < 0.05 vs NS. a: NS; b: bFGF-mab 50 μg/mL; c: bFGF-mab 100 μg/mL; d: bFGF-mab 200 μg/mL; e: CPT-11 5 μg/mL; f: CPT-11 10 μg/mL; g: CPT-11 20 μg/mL; h: bFGF-mab 100 μg/mL+CPT-11 5 μg/mL; i: bFGF-mab 100 μg/mL+CPT-11 10 μg/mL; j: bFGF-mab 100 μg/mL+CPT-11 20 μg/mL. |
浓度为5、10、20 µg/mL的伊立替康与100 µg/mL的bFGF单克隆抗体联合作用于小细胞肺癌细胞,其诱导作用明显强于两者单独作用(P < 0.05,图 2)。
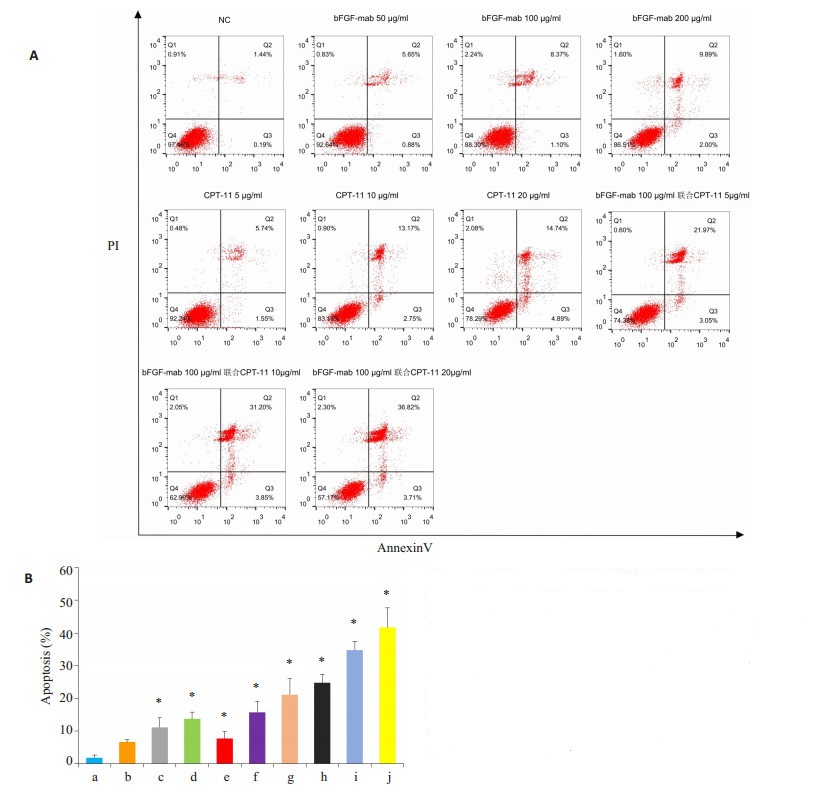
|
图 2 bFGF单克隆抗体单用及联合CPT-11对小细胞肺癌细胞凋亡的影响 Figure 2 Effect of bFGF mAb and CPT-11, alone or in combination, on apoptosis rate of H223 cells detected by FACS method. A: Flow cytometry; B: Quantitative analysis of the results. *P < 0.05 vs NS. a: NS; b: bFGF-mab 50 μg/mL; c: bFGFmab 100 μg/mL; d: bFGF-mab 200 μg/mL; e: CPT-11 5 μg/mL; f: CPT-11 10 μg/mL; g: CPT-11 20 μg/mL; h: bFGF-mab 100 μg/ mL+CPT-11 5 μg/mL; i: bFGF-mab 100 μg/mL+CPT-11 10 μg/ mL; j: bFGF-mab 100 μg/mL+CPT-11 20 μg/mL. |
bFGF单克隆抗体组、CPT-11组及bFGF单克隆抗体联合CPT-11组可明显抑制p-AKT蛋白和p-ERK1/2蛋白的水平,差异有显著性(P < 0.05),而对AKT、ERK1/ 2蛋白则影响不大(P>0.05,图 3)。
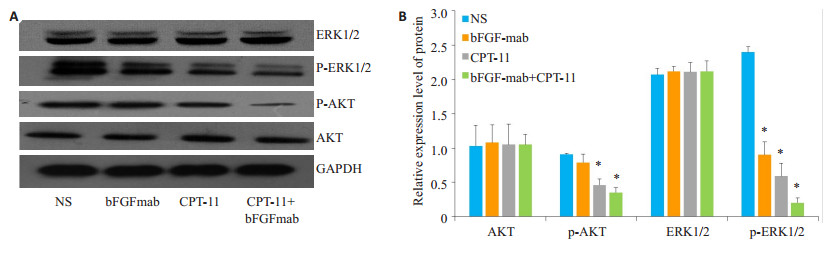
|
图 3 Western blotting检测bFGF抗体组,CPT-11组及bFGF抗体联合CPT-11组对H223中p-AKT蛋白和p-ERK1/2蛋白的影响 Figure 3 Western blotting for detecting the effect of bFGF mAb and CPT-11, alone or in combination, on p-AKT protein and p-ERK1/2 protein in H223. A: Western blotting; B: Quantitative analysis of the results. *P < 0.05 vs NS. |
恶性肿瘤的复发转移同血管的新生密不可分,而肿瘤的血管的形成主要受血管内皮生长因子(VEGF)和bFGF的调控[8],bFGF本身是一种多肽细胞生长因子,不但影响细胞的分裂增殖,而且在伤口的修复及组织的再生上发挥作用。小细胞肺癌是一种侵袭性极高的恶性肿瘤,易远处转移且预后不良[9-10]。既往研究表明[11],血清中的bFGF高表达常与小细胞肺癌患者的不良预后相关,可能通过bFGF上调抗凋亡蛋白的表达诱导细胞自我保护从而促进部分肿瘤耐药。FGFR2能通过直接与bFGF结合减少恶性细胞转移。近来有研究提示FGFR2蛋白过表达在未分化的恶性肿瘤中与分化好的恶性肿瘤有明显差异[12]。而不同恶性肿瘤的FGFR2蛋白过表达存在明显差异,且与生存率差显著相关,常提示预后不良[13-19]。作为一种细胞因子一方面通过刺激VEGF的表达影响肿瘤血管内皮细胞的增殖,另一方面通过自分泌及旁分泌直接促进肿瘤细胞增殖,进而导致新生血管形成。BFGF单克隆抗体通过与受体结合从而阻止细胞增殖抑制血管生成[20]。体内外试验证实[21-22] BFGF能促进多种因子分泌,有报道[23]BFGF/FGFR可介导恶性肿瘤的自我保护机制从而促进肿瘤生长。亦有试验报道[24-26]FGF/FGFR信号通路介导了肺癌的体内外EGFR治疗的抵抗。而治疗性的bFGF单克隆抗体与特定的bFGF受体或fgfr异构体有高度的特异性,通过依赖的抗体或补体抗肿瘤细胞毒作用增强机体的免疫作用从而达到自身的抗肿瘤活性[11]。本实验的CKK8法结果提示BFGF单克隆抗体抑制小细胞肺癌细胞的增殖,200 µg/mL的BFGF单克隆抗体抑制率为18.73%,而100 μg/mL bFGF联合伊立替康20 μg/mL组抑制率高达54.30%。既往研究显示BFGF能使较多肿瘤产生对化疗药物的抵抗,主要原因是抑制化疗药物诱导的细胞凋亡[27],伊立替康是拓扑异构酶Ⅰ的抑制剂,因抗肿瘤活性强,其活性代谢产物7-乙基-10羟基喜树碱(SN-38)在体内与拓扑异构酶Ⅰ (TopoⅠ)结合,阻止DNA链重新组装,促使DNA双链断裂,从而干扰和抑制DNA的复制以抑制细胞的有丝分裂。CPT-11在SCLC的治疗中效果显著,并且与VP-16、DDP没有交叉耐药,本研究中的AnneginV-FITC/PI法检测细胞凋亡结果提示单克隆抗体200 μg/mL的凋亡率是2.7%,而单克隆抗体100 μg/mL联合伊立替康20 μg/mL组凋亡率高达6.5%,进一步证明在单克隆抗体BFGF联合伊立替康组在抑制肿瘤方面的协同作用。既往研究[28]显示bFGF等细胞因子可能通过激活AKt/PKB通路阻断生长信号途径从而抑制细胞增殖,而CPT-11亦可抑制AKt/PKB通路,因此两者的协同作用可能与抑制AKt/ PKB通路激活有关。本实验结果提示bFGF单克隆抗体联合伊立替康通过抑制p-AKT蛋白、p-ERK1/2蛋白的水平磷酸化来抑制肿瘤细胞的增殖和转移。bFGF抗体联合伊立替康可能通过Ras-Raf-MAP激酶激活Ras启动,产生导致的多步磷酸化级联激活MAPKs,ERK1和ERK2而达到抗肿瘤的目的[29-30],同时通过抑制另一个重要目标FGFR信号是磷脂酰肌醇3-激酶(P13K)和下游蛋白丝氨酸/苏氨酸激酶AKT的表达来达到抗肿瘤目的。后一种蛋白激酶转导分子信号触发细胞生长的关键步骤。小细胞肺癌占肺癌发病率的15%~25%,肿瘤倍增时间短,侵袭能力强,绝大多数患者诊断时已存在血行和淋巴结转移[31],预后差,传统治疗模式存在的耐药及毒性严重的问题迫切需要新的治疗方法,本试验的结果提示BFGF单克隆抗体联合CPT-11在抑制小细胞肺癌中的协同作用为小细胞肺癌的治疗提供了新的思路,有关两者协同抑制肿瘤细胞增殖及血管新生的细胞因子表达及具体机制还需进一步研究探讨。
| [1] | Jett JR, Schild SE, Kesler KA, et al. Treatment of small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of chest Physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143(5 Suppl): e400S-19S. |
| [2] | Butler JM, Kobayashi H, Rafii S. Instructive role of the vascular niche in promoting tumour growth and tissue repair by angiocrine factors[J]. Nat Rev Cancer, 2010, 10(2): 138-46. DOI: 10.1038/nrc2791. |
| [3] | Murukesh N, Dive C, Jayson GC. Biomarkers of angiogenensis and their role in the development of VEGF inhibitors[J]. Br J Cancer, 2010, 102(1): 8-18. DOI: 10.1038/sj.bjc.6605483. |
| [4] | 向军俭, 李丹, 王宏, 等. bFGF单克隆抗体抑制小鼠Lewis肺癌转移及血管新生[J]. 中国癌症杂志, 2010, 20(6): 401-5. |
| [5] | Okada B, Thiery JP, Jouanneau J. Fibroblast growth factor-2[J]. Int J Biochem, 2000, 32(3): 263-7. DOI: 10.1016/S1357-2725(99)00133-8. |
| [6] | Song S, Wientjes M, Gan Y, et al. Fibroblast growth factors:an epigenetic mechanism of broad spectrum resistance to anticancer drugs[J]. Proc Natl Acad Sci USA, 2000, 97(15): 8658-63. DOI: 10.1073/pnas.140210697. |
| [7] | Nodak NM. Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer[J]. N Engl J Med, 2002, 346(2): 85-91. DOI: 10.1056/NEJMoa003034. |
| [8] | Presta M, Dell'era P, Mitola S, et al. Fibroblast growth factor/ fibroblast growth factor receptor system in angiogenesis[J]. Cytokine Growth Factor Rev, 2005, 16(2): 159-78. DOI: 10.1016/j.cytogfr.2005.01.004. |
| [9] | Van Meerbeeck JP, Fennell D, De Ruysscher DK. Small-cell lung cancer[J]. Lancet, 2011, 378(9804): 1741-55. DOI: 10.1016/S0140-6736(11)60165-7. |
| [10] | Jett JR, Schild SE, Kesler KA. Treatment of small cell lung cancer diagnosis and management of lung cancer, 3rd ed: American college of chest physicians Evidence-Based clinical practice guidelines[J]. Chest, 2013, 143(5, S): E400-19. |
| [11] | Lindorfer MA, Wiestner A, Zent CS. Monoclonal antibody (mAb)-based cancer therapy Is it time to reevaluate dosing strategies?[J]. Oncoimmunology, 2012, 1(6): 959-61. DOI: 10.4161/onci.20368. |
| [12] | Inokuchi M, Fujimori Y, Otsuki S, et al. Therapeutic targeting of fibroblast growth factorreceptors in gastric cancer[J]. Gastroenterol Res Pract, 2015, 2015: 796380. |
| [13] | Chang J, Liu X, Wang S, et al. Prognostic value of FGFR gene amplification in patients with different types of cancer: a systematic review and meta-analysis[J]. PLoS One, 2014, 9(8): e105524. DOI: 10.1371/journal.pone.0105524. |
| [14] | Nagatsuma AK, Aizawa M, Kuwata T, et al. Expression profiles of HER2, EGFR, Met and FGFR2 in a large cohort of patients with gastric adenocarcinoma[J]. Gastric Cancer, 2015, 18(2): 227-38. DOI: 10.1007/s10120-014-0360-4. |
| [15] | Jung EJ, Jung EJ, Min SY, et al. Fibroblast growth factor receptor 2 gene amplification status and its clinicopathologic significance in gastric carcinoma[J]. Hum Pathol, 2012, 43(10): 1559-66. DOI: 10.1016/j.humpath.2011.12.002. |
| [16] | Matsumoto K, Arao T, Hamaguchi T, et al. FGFR2 gene amplification and clinicopathological features in gastric cancer[J]. Br J Cancer, 2012, 106(4): 727-32. DOI: 10.1038/bjc.2011.603. |
| [17] | Betts G, Valentine H, Pritchard S, et al. FGFR2, HER2 and cMet in gastric adenocarcinoma: detection, prognostic significance and assessment of downstream pathway activation[J]. Virchows Archiv, 2014, 464(2): 145-56. DOI: 10.1007/s00428-013-1517-y. |
| [18] | Das K, Gunasegaran B, Tan IB, et al. Mutually exclusive FGFR2, HER2, and KRAS gene amplifications in gastric cancer revealed by multicolour FISH[J]. Cancer Lett, 2014, 353(2): 167-75. DOI: 10.1016/j.canlet.2014.07.021. |
| [19] | Su X, Zhan P, Gavine PR, et al. FGFR2 amplification has prognostic significance in gastric cancer: results from a large international multicentre study[J]. Br J Cancer, 2014, 110(4): 967-75. DOI: 10.1038/bjc.2013.802. |
| [20] | Rusnati M, Presta M. Fibroblast growth factor/fibroblast growth factor receptors as targets for the development of antiangiogenesis strategies[J]. Curr Pharm Des, 2007, 13(20): 2025-44. DOI: 10.2174/138161207781039689. |
| [21] | Cao R, Brakenhielm E, Pawliuk R, et al. Anjiogenic synergism, vascular stability and improvement of hind-limb ischemia by a combination of PDGF-BB and FGF-2[J]. Nat Med, 2003, 9(5): 604-13. DOI: 10.1038/nm848. |
| [22] | Zhang ZH, Liu P, WangLH, et al. Effects of bFGF expression on the angiogenesis of a leukemia cell line transplanted into nude mice[J]. Chin J Clin Oncol, 2013, 40(14): 821-3. |
| [23] | Kottakis F, Polytarchou C, Foltopoulou P, et al. FGF-2 regulates cell proliferation, migration, and angiogenesis through an NDY1/ KDM2B-miR-101-EZH2 pathway[J]. Mol Cell, 2011, 43(2): 285-98. DOI: 10.1016/j.molcel.2011.06.020. |
| [24] | Wynes DM, Hinz TK, Gao D, et al. FGFR1 mRNA and protein expression, not gene copy number, predict FGFR TKI sensitivity across all lung cancer histologies[J]. Clin Cancer Res, 2014(20): 3299-309. |
| [25] | Schultheis AM, Bos M, Schmitz K, et al. Fibroblast growth factor receptor 1 (FGFR1) amplification is a potential therapeutic target in small-cell lung cancer[J]. Mod Pathol, 2014, 27(2): 214-21. DOI: 10.1038/modpathol.2013.141. |
| [26] | Peifer M, Fernandez-Cuesta L, Sos ML, et al. Integrative genome analyses identify key somatic drive mutations of small-cell lung cancer[J]. Nat Genet, 2012, 44(10): 1104-10. DOI: 10.1038/ng.2396. |
| [27] | Debatin K. Activation of apoptosis pathways by anticancer treatment[J]. Toxicol Lett, 2000, 112/113: 41-48. DOI: 10.1016/S0378-4274(99)00252-0. |
| [28] | Rusnati M, PrestaM. Fibroblast growth factors/fibroblast growth factor receptors as targets for the development of antiangiogenesis strategies[J]. Curr Pharm Des, 2007, 13(20): 2025-44. DOI: 10.2174/138161207781039689. |
| [29] | Mendelsohon J, Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer[J]. J Clin Oncol, 2003, 21(14): 2787-99. DOI: 10.1200/JCO.2003.01.504. |
| [30] | Mccubrey JA, Abrams SL, Ligresti G, et al. Involvement of p53 and Raf/MEK/ERK pathways in hematopoietic drug resistance[J]. Leukemia, 2008, 22(11): 2080-90. DOI: 10.1038/leu.2008.207. |
| [31] | Faruk Tas Derya Duranyildiz, Hilal, Oguz, et al. Vascular endothelial growth factor interlcukin-8 levels in small cell cancer[J]. Cancerinvers, 2006, 24(5): 492-6. |
 2017, Vol. 37
2017, Vol. 37

