随着肥胖症的发病率不断增高,肥胖症常并发或导致的代谢综合征以及一些常见的代谢性疾病如高血压、冠心病、2型糖尿病等的发病率也在不断增高[1-2]。除心血管疾病等并发症外,最近,科学家开始意识到,肥胖或超重的人群表现出不孕不育的发生率正在上升,有一些表现为父系肥胖可能会对基本精子参数产生负面的影响,比如精子的数量和运动能力[3-4]。越来越多的研究表明,肥胖对男性的生殖系统有明显的负面效应[5-6]。相对于控制食欲和抑制营养吸收等传统的抗肥胖疗法[7-9],通过天然活性成分物质刺激增加机体的能量消耗很可能是一个极具前景的治疗方法。近年来已经有研究表明,一种新型的天然植物化学物-芦丁对糖尿病等相关代谢疾病具有有益效果,可以降低由高脂饮食所引起的肥胖而导致的高血脂和高血糖[10-12],并且可以通过清除细胞内的活性氧对肥胖诱导的肝脏和心肌的病变起到改善作用[13],但是这种保护作用的分子机制仍然不清楚。因此,我们在假设通过芦丁给药治疗可以减缓由高脂饮食引起的肥胖而导致的雄性生殖损伤的基础上,通过芦丁对高脂饮食诱导的肥胖雄性小鼠进行处理,研究芦丁在肥胖雄性小鼠体质量抑制以及对肥胖诱发的生殖损伤的保护效果及其机制。
1 材料和方法 1.1 主要材料和仪器芦丁(纯度≥98%,C27H30O16,百灵威科技有限公司),多聚甲醛(Sigma-Aldrich,美国),甘油三酯等检测试剂盒(南京建成生物工程研究所),SYBP Green Premix Ex Taq试剂盒(TakaRa,日本),其它化学试剂均为分析纯;高速离心机(Beckman公司,德国),荧光定量PCR仪(ABI,美国),电泳仪(Bio-Rad,美国)。
1.2 实验动物处理成年ICR小鼠24只,雄性,购自安徽医科大学实验动物中心。小鼠适应性喂养1周后随机分成3组,体质量20~23 g,每组8只,分为:正常对照组(ND)正常饮食,高脂饮食组(HFD)高脂饮食,芦丁保护组(HRU)高脂饮食+芦丁。普通饲料(脂肪20%),高脂饲料(脂肪60%),购自南京青龙山饲料厂。自由摄食、饮水,室温22± 2 ℃,相对湿度为45%~65%,昼夜明暗交替时间为12 h/ 12 h,按照每笼3~5只饲养,每日观察、称质量、记录。为尽量减少组内差异,HRU组以灌胃的方式按体质量添加10 mg/ (kg·d)芦丁,芦丁以DMSO为助溶剂用蒸馏水进行配制,每次灌胃前均采用超声处理;ND组和HFD组以灌胃的方式灌同等体积的含有DMSO的蒸馏水。28 d后,禁食1晚,麻醉,迅速剥离褐色脂肪、睾丸和附睾,部分固定于4%多聚甲醛以及制备精子悬液,其余的组织在液氮中迅速冷冻后转入-80 ℃冰箱中保存。
1.3 HE染色睾丸和附睾经4%多聚甲醛固定后,梯度酒精脱水,石蜡包埋,切片厚6 μm。常规脱蜡至水后,HE染色,中性树胶封片,置显微镜下观察。
1.4 相关指标检测制备睾丸、附睾的组织匀浆,按照试剂盒说明书检测睾丸和附睾中的甘油三酯(TG)、总胆固醇(TC)。制备精子悬液后,高倍镜观察,将精子活动度分为4级:Ⅰ级为精子活动良好;Ⅱ级为精子活动比较活泼;Ⅲ级为精子活动迟缓;Ⅳ为精子不活动。活动率(activity rate) = (Ⅰ+Ⅱ+Ⅲ)/(Ⅰ+Ⅱ+Ⅲ+Ⅳ) × 100%。按红细胞计数法计数精子浓度,计算精子畸形率。
1.5 荧光定量PCR反应体系为20 μL,扩增产物长度和引物序列如表 1所示,根据PCR扩增溶解曲线得到的阈值循环数值(Ct),用2-△△Ct方法计算相对基因表达量。
| 表 1 荧光定量PCR扩增基因引物列表 Table 1 Primers for quantitative PCRamplification |
蛋白裂解液RIPA提取蛋白,BCA法测定并调整蛋白浓度,SDS-PAGE电泳、转膜、封闭、抗体孵育。条带用ECL发光液显色,使用化学发光成像仪(天能公司,上海)进行化学发光检测,并采集蛋白条带图像,图像灰度采用Quantity One (Bio-Rad, USA)软件进行分析。
1.7 统计学方法使用SPSS 17.0对数据进行统计分析。资料采用均数±标准差表示,经正态检验后,多组间比较采用方差分析,两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 芦丁对肥胖小鼠体质量、睾丸系数、精子数量和畸形率的影响各组小鼠初始体质量差异无统计学意义(P> 0.05,表 2)。高脂饮食组(HFD组)与芦丁保护组(HRU组)相较于正常对照组(ND组),一开始均表现出体质量增长较快的趋势,而后HFD组一直保持相对较高的体质量增长。28 d后,HFD组与HRU组体质量均比ND组高,· 1530 · J South Med Univ, 2017, 37(11): 1529-1534 http://www.j-smu.com而HRU组比HFD组的平均体质量轻(P < 0.05)。HFD组和HRU组睾丸质量与ND组相比没有有显著性变化(P>0.05),但是睾丸相对体质量系数差异显著(P < 0.05)。HFD组精子数量明显减少,畸形率明显上升(P < 0.05)。
| 表 2 芦丁对肥胖小鼠体质量、睾丸系数、精子数量和畸形率的影响 Table 2 Effect of rutin on body weight, testicular coefficient, and sperm count and deformity rate in obese mice (n=8, Mean±SD) |
从各级精子活动度看,HFD组与ND组、HRU组相比有明显区别,HFD组总的精子活动率出现了明显的下降(P < 0.05,表 3)。
| 表 3 芦丁对肥胖小鼠精子活动度的影响 Table 3 Effects of rutin on sperm motility in obese mice (n=8, Mean±SD) |
如图 1所示,3组雄性小鼠睾丸的基本结构完整,曲精小管分布较为规则、排列整齐,无明显损伤。从切面图看:正常对照组和芦丁保护组的曲精小管内的生精细胞与基底膜之间结合紧密,各级生精细胞与精子排列紧密、层次分明,管腔内精子数量较多。而高脂饮食组诱导的肥胖小鼠曲精小管内的生精细胞与基底膜之间则较为松散,甚至有些部位疏松剥离(如图 1箭头所示);生精细胞层数明显减少,并且部分生精细胞结构异常,呈现不规则的细胞形态;管腔内成熟的精子数量明显较少。如图 2所示,与正常对照组和芦丁保护组相比,高脂饮食组的小鼠附睾管壁细胞排列较疏松,上皮开始出现退化变性,细胞排列不整,胞浆内有少许空泡,管腔内可见精子相对较少。
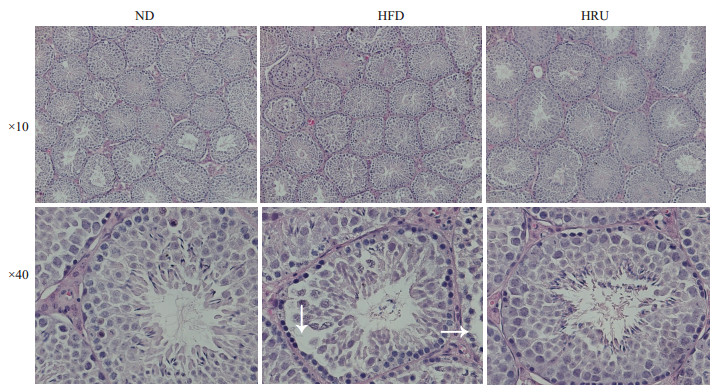
|
图 1 ND,HFD和HRU组的小鼠睾丸组织形态观察 Figure 1 Morphological observation of the testis of the mice in ND, HFD and HRU groups. |
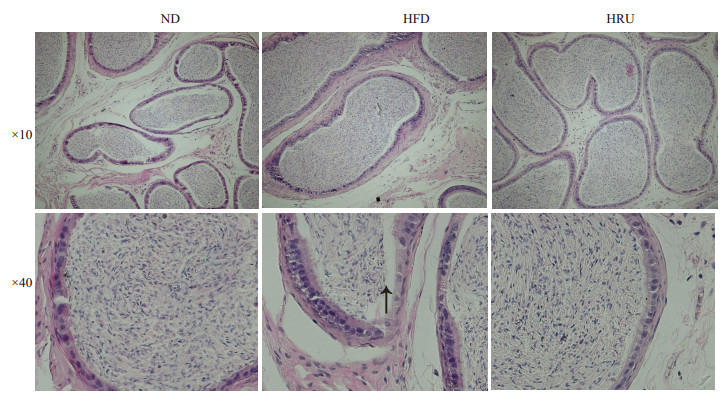
|
图 2 ND,HFD和HRU组的小鼠组附睾织形态观察 Figure 2 Morphological observation of the epididymis of the mice in ND, HFD and HRU groups. |
| 表 4 ND,HFD和HRU组睾丸和附睾中TG、TC的水平含量比较 Table 4 Comparison of levels of TG and TC in the testis and epididymis among ND, HFD and HRU groups (n=6, Mean±SD) |
在高脂饮食的影响下,高脂饮食组睾丸和附睾组织中的TG的含量以及附睾组织中的TC的含量,明显高于正常饮食组和芦丁保护组。而睾丸组织中的TC的含量,各组之间没有明显的差异。
2.5 相关基因和蛋白的表达情况由表 5和图 3可知:褐色脂肪组织中Ucp1基因在芦丁处理后的表达量显著增加(P < 0.05);与HFD组小鼠相比,HRU处理组的小鼠褐色脂肪的脂肪酸氧化的相关基因Cpt1α的表达也有所增强;同时,芦丁还可以显著降低饮食导致的肥胖小鼠睾丸中炎症因子Mcp1和Tnfα的表达(P < 0.05)。从图 4 Ucp1蛋白免疫印迹可知,芦丁上调了Ucp1蛋白的相对表达量。
| 表 5 ND,HFD,HRU组小鼠睾丸组织mRNA水平的定量分析 Table 5 Quantitativeanalysis of testicularmRNA levels of the mice in ND, HFD and HRU groups (n=5, Mean±SD) |
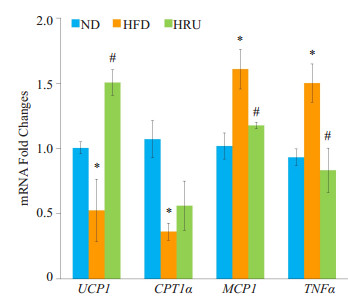
|
图 3 ND,HFD,HRU组小鼠睾丸组织mRNA水平的定量分析 Figure 3 Quantitative analysis of testicular mRNA levels of mice in ND, HFD and HRU groups. *P < 0.05 vs ND group, #P < 0.05 vs HFD group. |
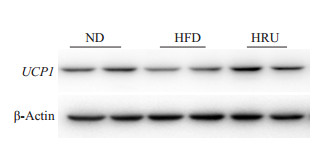
|
图 4 小鼠褐色脂肪中Ucp1蛋白的表达情况 Figure 4 Expression level of Ucp1 protein in brown fat of mice. |
肥胖的发生在全球呈爆发性流行。我国肥胖人口数量已占总人口数量的11.3%。许多研究表明脂肪异常与不育之间存在关系,但详细的机制尚不清楚[14-15]。白色脂肪组织除了储存能量之外,还具有内分泌和免疫的作用[16]。脂肪在睾丸和附睾中的过度积累会直接导致睾丸和附睾的结构异常,还可释放炎症因子和氧化自由基,影响到睾丸组织的内分泌功能,对细胞增生及精子的发生过程都有着不同程度的影响。与白色脂肪相比,唯一在褐色脂肪组织中表达的解偶联蛋白Ucp1,在其丰富的线粒体内膜上,可以消除线粒体跨膜电位,将其储存的化学势能转化为热能[17-18]。相对于控制食欲和抑制营养吸收等传统的抗肥胖疗法,通过棕色脂肪增加机体的能量消耗很可能是一个极具吸引力的治疗方法[19]。
棕色脂肪含有丰富的线粒体,直接产生热量的方式来消耗能量。已有研究表明芦丁可以降低高脂诱导大鼠的体质量[20],也有少量研究报道芦丁具有降血糖和降血脂以及保护脏器的作用[10, 13]。近期的研究发现芦丁可以上调褐色脂肪细胞相关产热基因的表达,同时能显著增加褐色脂肪细胞线粒体数量,提高棕色脂肪细胞的耗氧量从而增加棕色脂肪细胞的产热功能[21-23]。在本研究中,在芦丁的保护作用下,高脂诱导的肥胖得到抑制,睾丸、附睾中TG和附睾中TC的含量恢复到了正常水平。通过进一步的组织切片HE染色观察发现,芦丁可以减弱高脂饮食诱导的睾丸和附睾组织的病理性损伤变化,改善精子数量下降以及活动度差等问题。褐色脂肪产热标记基因Ucp1在芦丁处理后的表达量显著增加(P < 0.05),其蛋白表达量同样增强。因此在芦丁的干预下,同样行高脂饮食的小鼠可能通过增加机体能量消耗,从而在一定程度上抑制由高脂饮食诱导的肥胖。研究发现,肥胖患者体内的脂肪细胞会被许多促炎症巨噬细胞侵润,且其数量随着高脂饮食调节的诱导有增多的趋势[24],因此,我们对睾丸的促炎症因子进行了检测分析,结果表明伴随着体质量增加的减少,芦丁可以改善小鼠脂肪组织的累积,睾丸中的脂肪酸β氧化基因Cpt1α表达量在芦丁处理后有所上升,同时,小鼠睾丸中炎症因子Mcp1和Tnfα的表达在芦丁处理后显著下降(P < 0.05)。这说明芦丁可以通过促进肝脏中脂肪酸的氧化来降低组织中脂质的过高含量,以及减低睾丸组织的炎症反应。对于这些效应的最可能的解释是芦丁上调棕色脂肪细胞相关产热基因的表达,进而通过脂质代谢的调节而产生的。
综上,芦丁可以显著提高小鼠棕色脂肪产热相关基因Ucp1以及脂肪酸氧化相关基因Cpt1α的表达,从而提高机体能量消耗,抑制机体的体质量增加,减少白色脂肪累积,能够改善睾丸和附睾因肥胖而出现的结构松散,细胞结构异常,成熟的精子减少,精子数量下降和活动度差的现象。对肥胖诱发的生殖损伤有一定的保护效果。
| [1] | Caballero B. The global epidemic of obesity: an overview[J]. Epidemiol Rev, 2007, 29: 1-5. DOI: 10.1093/epirev/mxm012. |
| [2] | Cabler S, Agarwal A, Flint M, et al. Obesity: modern man's fertility nemesis[J]. Asian J Androl, 2010, 12(4): 480-9. DOI: 10.1038/aja.2010.38. |
| [3] | Palmer NO, Bakos HW, Fullston T, et al. Impact of obesity on male fertility, sperm function and molecular composition[J]. Spermatogenesis, 2012, 2(4): 253-63. DOI: 10.4161/spmg.21362. |
| [4] | Hammoud AO, Wilde N, Gibson M, et al. Male obesity and alteration in sperm parameters[J]. Fertil Steril, 2008, 90(6): 2222-5. DOI: 10.1016/j.fertnstert.2007.10.011. |
| [5] | Landry D, Cloutier F, Martin LJ. Implications of leptin in neuroendocrine regulation of male reproduction[J]. Reprod Biol, 2013, 13(1): 1-14. DOI: 10.1016/j.repbio.2012.12.001. |
| [6] | Galliano D, Bellver J. Female obesity: short-and long-term Consequences on the offspring[J]. Gynecol Endocrinol, 2013, 29(7): 626-31. DOI: 10.3109/09513590.2013.777420. |
| [7] | Sui Y, Zhao HL, Wong VC, et al. A systematic review on use of Chinese medicine and acupuncture for treatment of obesity[J]. Obes Rev, 2012, 13(5): 409-30. DOI: 10.1111/obr.2012.13.issue-5. |
| [8] | Cummings DE, Overduin J, Foster-Schubert KE. Gastric bypass for obesity:mechanisms of weight loss and diabetes resolution[J]. J Clin Endocrinol Metab, 2004, 89(6): 2608-15. DOI: 10.1210/jc.2004-0433. |
| [9] | Chapple I, Wilson N. Manifesto for a paradigm shift: periodontal health for a better Life[J]. Br Dent J, 2014, 216(4): 159-62. DOI: 10.1038/sj.bdj.2014.97. |
| [10] | Sadeghnia HR, Yousefsani BS, Ghorbani A, et al. Protective effect of rutin on hexachlorobutadiene-induced nephrotoxicity[J]. Ren Fail, 2013, 35(8): 1151-5. DOI: 10.3109/0886022X.2013.815546. |
| [11] | Yun JW. Possible anti-obesity therapeutics from Nature -A review[J]. Phytochemistry, 2010, 71(14/15): 1625-41. |
| [12] | Gao M, Ma Y, Liu D. Rutin suppresses palmitic acids-triggered inflammation inmacrophages and blocks high fat diet-induced obesity and fatty liver in mice[J]. Pharm Res, 2013, 30(11): 2940-50. DOI: 10.1007/s11095-013-1125-1. |
| [13] | Krishna KM, Annapurna A, Gopal GS, et al. Partial reversal by rutin and quercetin of impaired cardiac function in streptozotocininduced diabetic rats[J]. Can J Physiol Pharmacol, 2005, 83(4): 343-55. DOI: 10.1139/y05-009. |
| [14] | Ramírez-Torres MA, Carrera A, Zambrana M. High incidence of hyperestrogenemia and dyslipidemia in a group of infertile men[J]. Ginecol Obstet Mex, 2000, 68: 224-9. |
| [15] | Shalaby MA, El-Zorba HY, Kamel GM. Effect of alpha-tocopherol and simvastatin on male fertility in hypercholesterolemic rats[J]. Pharmacol Res, 2004, 50(2): 137-42. DOI: 10.1016/j.phrs.2003.10.013. |
| [16] | Saito M, Yoneshiro T. Capsinoids and related food ingredients activating brown fat thermogenesis and reducing body fat in humans[J]. Curr Opin Lipidol, 2013, 24(1): 71-7. DOI: 10.1097/MOL.0b013e32835a4f40. |
| [17] | Ouellet V, Labbe SM, Blondin DP, et al. Brown adipose tissue oxidative metabolism contributesto energy expenditure during acute cold exposure in humans[J]. J Clin Invest, 2012, 122(2): 545-52. DOI: 10.1172/JCI60433. |
| [18] | Bartelt A, Bruns OT, Reimer R, et al. Brown adipose tissueactivity controls triglyceride clearance[J]. Nat Med, 2011, 17(2): 200-5. DOI: 10.1038/nm.2297. |
| [19] | Altintas MM, Azad A, Nayer B, et al. Mast cells, macrophages, and crown-like structures distinguish subcutaneous from visceral fat in mice[J]. J Lipid Res, 2011, 52(3): 480-8. DOI: 10.1194/jlr.M011338. |
| [20] | Hsu CL, Wu CH, Huang SL, et al. Phenolic compounds rutin andocoumaricacidameliorate obesity induced by high-fat diet in rats[J]. J Agric Food Chem, 2009, 57(2): 425-31. DOI: 10.1021/jf802715t. |
| [21] | Yuan XX, Hu T, Zhao H, et al. Brown adipose tissue transplantation ameliorates polycystic ovary syndrome[J]. Proc Natl Acad Sci U S A, 2016, 113(10): 2708-13. DOI: 10.1073/pnas.1523236113. |
| [22] | Gunawardana SC, Piston DW. Reversal of type 1 diabetes in mice by brown adipose tissue transplant[J]. Diabetes, 2012, 61(3): 674-82. DOI: 10.2337/db11-0510. |
| [23] | Nedergaard J, Bengtsson T, Cannon B. New powers of brown fat: fighting the metabolic syndrome[J]. Cell Metab, 2011, 13(3): 238-40. DOI: 10.1016/j.cmet.2011.02.009. |
| [24] | Hagita S, Osaka M, Shimokado K, et al. Adipose inflammation initiatesrecruitment of leukocytes to mouse femoral artery: role of adipovascular axis in chronicinflammation[J]. PLoS One, 2011, 6(5): e19871. DOI: 10.1371/journal.pone.0019871. |
 2017, Vol. 11
2017, Vol. 11
